El tetrahidropirano ( THP ) es un compuesto orgánico que consiste en un anillo saturado de seis miembros que contiene cinco átomos de carbono y un átomo de oxígeno. Se nombra por referencia al pirano , que contiene dos enlaces dobles, y puede producirse a partir de él agregando cuatro hidrógenos. En 2013, su nombre IUPAC preferido se estableció como oxano . [1] El compuesto es un líquido volátil incoloro. Sin embargo, los derivados del tetrahidropirano son más comunes. Los éteres de 2-tetrahidropiranilo (THP-) derivados de la reacción de alcoholes y 3,4-dihidropirano se usan comúnmente como grupos protectores en la síntesis orgánica . [2] Además, un sistema de anillo de tetrahidropirano , es decir, cinco átomos de carbono y un oxígeno, es el núcleo de los azúcares de piranosa , como la glucosa .
En fase gaseosa, el THP existe en su conformación de silla de simetría C de energía más baja . [ 3]
Un procedimiento clásico para la síntesis orgánica de tetrahidropirano es mediante la hidrogenación del isómero 3,4 del dihidropirano con níquel Raney . [4]
Aunque el tetrahidropirano es un compuesto poco conocido, los éteres de tetrahidropiranilo se utilizan habitualmente en la síntesis orgánica . Específicamente, el grupo 2-tetrahidropiranilo (THP) es un grupo protector común para los alcoholes . [5] [6] Los alcoholes reaccionan con 3,4-dihidropirano para dar éteres de 2-tetrahidropiranilo. Estos éteres son resistentes a una variedad de reacciones. El alcohol puede restaurarse posteriormente mediante hidrólisis catalizada por ácido . Esta hidrólisis reforma el alcohol original así como el 5-hidroxipentanal. Los éteres de THP derivados de alcoholes quirales forman diastereómeros. Otra característica indeseable es que los éteres muestran espectros de RMN complejos, que interfieren con el análisis. [2]
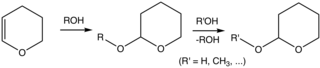
En un procedimiento típico, el alcohol se trata con 3,4-dihidropirano y ácido p -toluenosulfónico en diclorometano a temperatura ambiente. [2]

Alternativamente, el éter de THP se puede generar en condiciones similares a las de la reacción de Mitsunobu . Por lo tanto, el alcohol se trata con 2-hidroxitetrahidropiranilo, trifenilfosfina y azodicarboxilato de dietilo (DEAD) en tetrahidrofurano (THF).
Comúnmente, los éteres de THP se desprotegen utilizando ácido acético en una solución de THF/agua, ácido p -toluenosulfónico en agua o p -toluenosulfonato de piridinio (PPTS) en etanol .
Los oxanos son una clase de anillos de éter cíclicos hexílicos cuyo compuesto químico raíz es el tetrahidropirano. Los oxanos tienen uno o más átomos de carbono reemplazados por un átomo de oxígeno. [8] El nombre preferido por la IUPAC para el tetrahidropirano es ahora oxano . [9]
Oxane es también el nombre comercial de cis -2-metil-4-propil-1,3-oxatiano, una fragancia comercial. [10]