Una reacción de α-sustitución de carbonilo ocurre en la posición próxima al grupo carbonilo , la posición α, e implica la sustitución de un α-hidrógeno por un electrófilo a través de un intermedio de ion enol o enolato . [1]
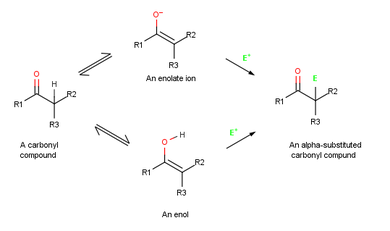
Debido a que sus enlaces dobles son ricos en electrones, los enoles se comportan como nucleófilos y reaccionan con los electrófilos de la misma manera que lo hacen los alquenos . Pero debido a la donación de electrones por resonancia de un par solitario de electrones en el oxígeno vecino , los enoles son más ricos en electrones y, en consecuencia, más reactivos que los alquenos. Observe en el siguiente mapa de potencial electrostático del etenol (H 2 C=CHOH) cómo hay una cantidad sustancial de densidad electrónica en el carbono α .
Cuando un alqueno reacciona con un electrófilo, como el HCl , la adición inicial de H + da un catión intermedio y la reacción posterior con Cl− produce un producto de adición . Sin embargo, cuando un enol reacciona con un electrófilo, solo el paso de adición inicial es el mismo. En lugar de reaccionar con Cl− para dar un producto de adición, el catión intermedio pierde el protón OH− para dar un compuesto carbonílico α-sustituido . [1] : 845
Una reacción de sustitución α particularmente común en el laboratorio es la halogenación de aldehídos y cetonas en sus posiciones α mediante la reacción de Cl 2 , Br 2 o I 2 en solución ácida. A menudo se utiliza bromo en disolvente de ácido acético .
Sorprendentemente, la halogenación de cetonas también ocurre en sistemas biológicos , particularmente en algas marinas , donde se han encontrado dibromoacetaldehído, bromoacetona , 1, l,l -tribromoacetona y otros compuestos relacionados.
La halogenación es una reacción típica de sustitución α que se produce mediante la formación catalizada por ácido de un intermedio enólico. [1] : 846
Un hidrógeno en la posición α de un compuesto carbonílico es débilmente ácido y puede eliminarse mediante una base fuerte para producir un ion enolato. Al comparar la acetona (pKa = 19,3) con el etano (pKa = 60), por ejemplo, la presencia de un grupo carbonílico vecino aumenta la acidez de la cetona con respecto al alcano en un factor de 10 40 .
La abstracción de un protón de un compuesto carbonílico ocurre cuando el enlace CH está orientado aproximadamente en paralelo a los orbitales p del grupo carbonílico. El átomo de carbono α del ion enolato tiene hibridación sp2 y tiene un orbital p que se superpone a los orbitales p del carbonilo vecino. Por lo tanto, la carga negativa es compartida por el átomo de oxígeno electronegativo y el ion enolato se estabiliza por resonancia .
Los compuestos carbonílicos son más ácidos que los alcanos por la misma razón que los ácidos carboxílicos son más ácidos que los alcoholes . En ambos casos, los aniones se estabilizan por resonancia. Sin embargo, los iones enolato se diferencian de los iones carboxilato en que sus dos formas de resonancia no son equivalentes: la forma con la carga negativa en el oxígeno tiene menor energía que la forma con la carga en el carbono. No obstante, el principio detrás de la estabilización por resonancia es el mismo en ambos casos.
Debido a que los compuestos carbonílicos son sólo débilmente ácidos, se necesita una base fuerte para la formación del ion enolato. Si se utiliza un alcóxido como el etóxido de sodio como base, la desprotonación tiene lugar sólo en un grado de aproximadamente el 0,1% porque la acetona es un ácido más débil que el etanol (pKa = 16). Sin embargo, si se utiliza una base más potente como el hidruro de sodio (NaH) o la diisopropilamida de litio ( LDA ), un compuesto carbonílico se puede convertir completamente en su ion enolato. La diisopropilamida de litio (LDA), que se prepara fácilmente por reacción de la base fuerte butillitio con diisopropilamina , se utiliza ampliamente en el laboratorio como base para preparar iones enolato a partir de compuestos carbonílicos.
Muchos tipos de compuestos carbonílicos, incluidos aldehídos , cetonas , ésteres , tioésteres , ácidos carboxílicos y amidas , pueden convertirse en iones enolato mediante la reacción con LDA. Tenga en cuenta que los nitrilos también son ácidos y pueden convertirse en aniones similares al enolato (denominados aniones nitrilo ).
Cuando un átomo de hidrógeno está flanqueado por dos grupos carbonilo, su acidez aumenta aún más. Esta acidez aumentada de los compuestos β-dicarbonílicos se debe a la estabilización de los iones enolato resultantes por deslocalización de la carga negativa sobre ambos grupos carbonilo. [1] : 850
Los iones enolato son más útiles que los enoles por dos razones. En primer lugar, los enoles puros normalmente no se pueden aislar, sino que se generan solo como intermediarios de corta duración en baja concentración . Por el contrario, las soluciones estables de iones enolato puros se preparan fácilmente a partir de la mayoría de los compuestos carbonílicos mediante la reacción con una base fuerte. En segundo lugar, los iones enolato son más reactivos que los enoles y experimentan muchas reacciones que los enoles no experimentan. Mientras que los enoles son neutros, los iones enolato tienen carga negativa, lo que los convierte en nucleófilos mucho mejores. Como resultado, los iones enolato son más comunes que los enoles tanto en el laboratorio como en la química biológica.
Debido a que son híbridos de resonancia de dos formas no equivalentes, los iones enolato pueden considerarse como alcóxidos vinílicos (C=C- O − ) o como α-cetocarbaniones ( − CC= O). Por lo tanto, los iones enolato pueden reaccionar con electrófilos tanto en oxígeno como en carbono. La reacción en oxígeno produce un derivado enólico, mientras que la reacción en carbono produce un compuesto carbonílico α-sustituido. Se conocen ambos tipos de reactividad, pero la reacción en carbono es más común. [1] : 853
Quizás la reacción más importante de los iones enolato es su alquilación mediante el tratamiento con un haluro de alquilo o tosilato , formando así un nuevo enlace CC y uniendo dos piezas más pequeñas en una molécula más grande . La alquilación ocurre cuando el ion enolato nucleófilo reacciona con el haluro de alquilo electrófilo en una reacción SN2 y desplaza al grupo saliente mediante un ataque por la parte posterior.
Las reacciones de alquilación están sujetas a las mismas restricciones que afectan a todas las reacciones SN2 . Por lo tanto, el grupo saliente X en el agente alquilante RX puede ser cloruro , bromuro , yoduro o tosilato . El grupo alquilo R debe ser primario o metilo, y preferiblemente debe ser alílico o bencílico . Los haluros secundarios reaccionan mal y los haluros terciarios no reaccionan en absoluto porque en su lugar se produce una eliminación competitiva de HX por E2. Los haluros vinílicos y arílicos también son poco reactivos porque se impide estéricamente la aproximación por el lado posterior . [1] : 855