
La resistencia a los antimicrobianos ( RAM ) se produce cuando los microbios desarrollan mecanismos que los protegen de los efectos de los antimicrobianos (medicamentos utilizados para tratar infecciones). [2] Todas las clases de microbios pueden desarrollar resistencia hasta el punto de que uno o más medicamentos utilizados para combatirlos ya no sean efectivos. Los hongos desarrollan resistencia a los antifúngicos , los virus desarrollan resistencia a los antivirales , los protozoos desarrollan resistencia a los antiprotozoarios y las bacterias desarrollan resistencia a los antibióticos . En conjunto, todos estos se incluyen bajo el paraguas de la resistencia a los antimicrobianos.
Los microbios resistentes a múltiples antimicrobianos se denominan resistentes a múltiples fármacos (MDR) y a veces se los denomina superbacterias . [3] Aunque la resistencia a los antimicrobianos es un proceso que ocurre de forma natural, a menudo es el resultado de un uso inadecuado de los medicamentos y del manejo de las infecciones. [4] [5]
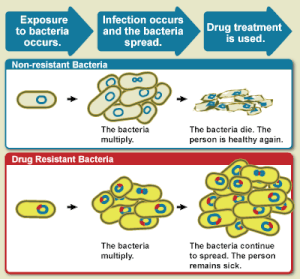
La resistencia a los antibióticos es un subconjunto importante de la RAM, que se aplica específicamente a las bacterias que se vuelven resistentes a los antibióticos . [2] La resistencia en las bacterias puede surgir de forma natural por mutación genética , o por una especie que adquiere resistencia de otra. [6] La resistencia puede aparecer espontáneamente debido a mutaciones aleatorias, pero también surge a través de la propagación de genes resistentes mediante la transferencia horizontal de genes . Sin embargo, el uso prolongado de antibióticos parece fomentar la selección de mutaciones que pueden hacer que los antibióticos sean ineficaces. [7] La resistencia a los antimicóticos es un subconjunto de la RAM, que se aplica específicamente a los hongos que se han vuelto resistentes a los antimicóticos. La resistencia a los antimicóticos puede surgir de forma natural, por ejemplo, por mutación genética o por aneuploidía . El uso prolongado de antimicóticos conduce al desarrollo de resistencia a los antimicóticos a través de varios mecanismos. [8]
Las afecciones clínicas debidas a infecciones causadas por microbios que contienen RAM causan millones de muertes cada año. [9] En 2019, hubo alrededor de 1,27 millones de muertes en todo el mundo causadas por RAM bacteriana. [10] Las infecciones causadas por microbios resistentes son más difíciles de tratar y requieren dosis más altas de medicamentos antimicrobianos, antibióticos más caros o medicamentos alternativos que pueden resultar más tóxicos . Estos enfoques también pueden costar más. [4] [5]
La prevención del uso indebido de antibióticos , que puede conducir a la resistencia a los antibióticos, incluye tomar antibióticos solo cuando se prescriben. [11] [12] Los antibióticos de espectro estrecho se prefieren a los antibióticos de amplio espectro cuando sea posible, ya que atacar de manera efectiva y precisa a organismos específicos tiene menos probabilidades de causar resistencia y efectos secundarios. [13] [14] [15] Para las personas que toman estos medicamentos en casa, la educación sobre el uso adecuado es esencial. Los proveedores de atención médica pueden minimizar la propagación de infecciones resistentes mediante el uso de saneamiento e higiene adecuados , incluido el lavado y la desinfección de manos entre pacientes, y deben alentar lo mismo de cada paciente, visitante y miembro de la familia. [16]
La creciente resistencia a los medicamentos se debe principalmente al uso de antimicrobianos en humanos y otros animales y a la propagación de cepas de resistencia a los antimicrobianos entre ambos. [11] La creciente resistencia también se ha relacionado con la liberación de efluentes inadecuadamente tratados de la industria farmacéutica, especialmente en países donde se fabrican medicamentos a granel. [17] Los antibióticos aumentan la presión selectiva en las poblaciones bacterianas, matando bacterias vulnerables; esto aumenta el porcentaje de bacterias resistentes, que siguen creciendo. Incluso niveles muy bajos de antibióticos pueden dar a las bacterias resistentes una ventaja para crecer y reproducirse más rápido que las bacterias vulnerables. [18] De manera similar, el uso de antimicóticos en la agricultura aumenta la presión selectiva en las poblaciones de hongos, lo que causa resistencia a los antimicóticos. [8] A medida que la resistencia a los antimicrobianos se vuelve más común, hay una necesidad mucho mayor de tratamientos alternativos. Se han emitido llamados a nuevas terapias antimicrobianas, pero hay muy poco desarrollo de nuevos medicamentos y, en consecuencia, poca innovación en el proceso de investigación de posibles candidatos para ellos. [19]
La resistencia a los antibióticos está aumentando a nivel mundial debido al aumento de la prescripción y dispensación de medicamentos antibióticos en los países en desarrollo . [20] Se estima que entre 700.000 y varios millones de muertes en todo el mundo resultan anualmente de la resistencia a los antibióticos, por lo que sigue representando una importante amenaza para la salud pública. [21] [22] [23] Cada año en los Estados Unidos , al menos 2,8 millones de personas se infectan con bacterias resistentes a los antibióticos, al menos 35.000 de ellas mueren y se gastan 55 mil millones de dólares en todos sus costos de atención médica y pérdida de productividad. [24] [25] Según estimaciones de la Organización Mundial de la Salud (OMS), 350 millones de muertes podrían ser causadas por RAM para 2050. [26] Para entonces, la cifra anual de muertes será de 10 millones, según un informe de las Naciones Unidas . [27]
Los llamados públicos a la acción colectiva global para abordar la amenaza incluyen propuestas de tratados internacionales sobre la resistencia a los antimicrobianos. [28] La carga de la resistencia a los antibióticos en todo el mundo no está completamente identificada, pero los países de ingresos bajos y medios con sistemas de atención de salud más débiles son los más afectados, y la mortalidad es la más alta en el África subsahariana . [10] [12] Durante la pandemia de COVID-19 , las prioridades cambiaron y la acción contra la RAM se desaceleró porque el enfoque científico y gubernamental se trasladó al problema más urgente de la investigación del SARS-CoV-2 . [29] [30] Al mismo tiempo, la amenaza de la RAM aumentó. [31]
La OMS define la resistencia a los antimicrobianos como la resistencia de un microorganismo a un fármaco antimicrobiano que en su día fue capaz de tratar una infección causada por ese microorganismo. [2] Una persona no puede volverse resistente a los antibióticos. La resistencia es una propiedad del microbio, no de una persona u otro organismo infectado por un microbio. [33] Todos los tipos de microbios pueden desarrollar resistencia a los fármacos. Así, existen resistencias a los antibióticos, a los antifúngicos, a los antivirales y a los antiparasitarios. [4] [5]
La resistencia a los antibióticos es un subconjunto de la resistencia a los antimicrobianos. Esta resistencia más específica está vinculada a las bacterias y, por lo tanto, se divide en dos subconjuntos más, microbiológica y clínica. La resistencia microbiológica es la más común y se produce a partir de genes, mutados o heredados, que permiten a las bacterias resistir el mecanismo para matar al microbio asociado con ciertos antibióticos. La resistencia clínica se manifiesta a través del fracaso de muchas técnicas terapéuticas donde las bacterias que normalmente son susceptibles a un tratamiento se vuelven resistentes después de sobrevivir al resultado del tratamiento. En ambos casos de resistencia adquirida, las bacterias pueden transmitir el catalizador genético de la resistencia a través de la transferencia horizontal de genes: conjugación, transducción o transformación. Esto permite que la resistencia se propague a través de la misma especie de patógeno o incluso patógenos bacterianos similares. [34]
En un informe de la OMS publicado en abril de 2014 se afirmaba que "esta grave amenaza ya no es una predicción para el futuro, sino que está ocurriendo ahora mismo en todas las regiones del mundo y tiene el potencial de afectar a cualquier persona, de cualquier edad, en cualquier país. La resistencia a los antibióticos (cuando las bacterias cambian de forma que los antibióticos ya no funcionan en las personas que los necesitan para tratar infecciones) es ahora una gran amenaza para la salud pública". [35]
En 2019, las muertes a nivel mundial atribuibles a la RAM ascendieron a 1,27 millones. Ese año, la RAM puede haber contribuido a 5 millones de muertes y una de cada cinco personas que murieron debido a la RAM eran niños menores de cinco años. [10]
En 2018, la OMS consideró que la resistencia a los antibióticos era una de las mayores amenazas para la salud mundial, la seguridad alimentaria y el desarrollo. [36] Las muertes atribuibles a la RAM varían según la zona:
El Centro Europeo para la Prevención y el Control de Enfermedades calculó que en 2015 hubo 671.689 infecciones en la UE y el Espacio Económico Europeo causadas por bacterias resistentes a los antibióticos, que provocaron 33.110 muertes. La mayoría se adquirieron en entornos sanitarios. [37] [38] En 2019 hubo 133.000 muertes causadas por RAM. [39]
La resistencia a los antimicrobianos se debe principalmente al uso excesivo o indebido de antimicrobianos. Esto hace que los microbios desarrollen una defensa contra los medicamentos que se utilizan para tratarlos o que ciertas cepas de microbios que tienen una resistencia natural a los antimicrobianos se vuelvan mucho más frecuentes que las que se pueden vencer fácilmente con medicamentos. [40] Si bien la resistencia a los antimicrobianos se produce de forma natural con el tiempo, el uso de agentes antimicrobianos en una variedad de entornos, tanto dentro como fuera de la industria de la salud, ha hecho que la resistencia a los antimicrobianos se vuelva cada vez más frecuente. [41]
Aunque muchos microbios desarrollan resistencia a los antibióticos con el tiempo a través de mutaciones naturales, la prescripción excesiva y la prescripción inadecuada de antibióticos han acelerado el problema. Es posible que hasta 1 de cada 3 recetas escritas para antibióticos sean innecesarias. [42] Cada año, se escriben aproximadamente 154 millones de recetas de antibióticos. De estas, hasta 46 millones son innecesarias o inadecuadas para la enfermedad que tiene el paciente. [42] Los microbios pueden desarrollar resistencia de forma natural a través de mutaciones genéticas que ocurren durante la división celular y, aunque las mutaciones aleatorias son raras, muchos microbios se reproducen con frecuencia y rapidez, lo que aumenta las posibilidades de que los miembros de la población adquieran una mutación que aumente la resistencia. [43] Muchas personas dejan de tomar antibióticos cuando comienzan a sentirse mejor. Cuando esto ocurre, es posible que los microbios que son menos susceptibles al tratamiento sigan permaneciendo en el cuerpo. Si estos microbios pueden seguir reproduciéndose, esto puede provocar una infección por bacterias que son menos susceptibles o incluso resistentes a un antibiótico. [43]

La resistencia a los antimicrobianos puede evolucionar de forma natural debido a la exposición continua a los antimicrobianos. La selección natural implica que los organismos que son capaces de adaptarse a su entorno sobreviven y siguen produciendo descendencia. [44] Como resultado, los tipos de microorganismos que son capaces de sobrevivir con el tiempo al ataque continuo de ciertos agentes antimicrobianos se volverán naturalmente más frecuentes en el entorno, y aquellos que no presenten esta resistencia se volverán obsoletos. [41]
Algunas resistencias antimicrobianas contemporáneas también han evolucionado de forma natural antes del uso de antimicrobianos de uso clínico en humanos. Por ejemplo, la resistencia a la meticilina evolucionó como un patógeno de los erizos, posiblemente como una adaptación coevolutiva del patógeno a los erizos que están infectados por un dermatofito que produce antibióticos de forma natural. [45] Además, muchos hongos y bacterias del suelo son competidores naturales y el antibiótico original penicilina descubierto por Alexander Fleming perdió rápidamente su eficacia clínica en el tratamiento de seres humanos y, además, ninguna de las otras penicilinas naturales (F, K, N, X, O, U1 o U6) se encuentra actualmente en uso clínico. [ cita requerida ]
La resistencia a los antimicrobianos puede adquirirse de otros microbios mediante el intercambio de genes en un proceso denominado transferencia horizontal de genes . Esto significa que una vez que un gen de resistencia a un antibiótico aparece en una comunidad microbiana, puede propagarse a otros microbios de la comunidad, pasando potencialmente de un microbio que no causa enfermedades a un microbio que las causa. Este proceso está fuertemente impulsado por los procesos de selección natural que ocurren durante el uso o mal uso de los antibióticos. [46]
Con el tiempo, la mayoría de las cepas bacterianas y las infecciones presentes serán del tipo resistente al agente antimicrobiano que se utiliza para tratarlas, lo que hace que este agente ya no sea eficaz para derrotar a la mayoría de los microbios. Con el aumento del uso de agentes antimicrobianos, se está acelerando este proceso natural. [47]
En el 89% de los países, los antibióticos solo pueden ser recetados por un médico y suministrados por una farmacia. [48] La automedicación por parte de los consumidores se define como "la toma de medicamentos por iniciativa propia o por sugerencia de otra persona, que no es un profesional médico certificado", y se ha identificado como una de las principales razones de la evolución de la resistencia a los antimicrobianos. [49] La automedicación con antibióticos es una forma inadecuada de usarlos, pero una práctica común en países con recursos limitados. La práctica expone a las personas al riesgo de bacterias que han desarrollado resistencia a los antimicrobianos. [50] Muchas personas recurren a esto por necesidad, cuando el acceso a un médico no está disponible debido a los cierres de los consultorios médicos de cabecera o cuando los pacientes tienen una cantidad limitada de tiempo o dinero para ver a un médico que prescribe. [51] Este mayor acceso hace que sea extremadamente fácil obtener antimicrobianos y un ejemplo es la India, donde en el estado de Punjab el 73% de la población recurrió al tratamiento de sus problemas de salud menores y enfermedades crónicas mediante la automedicación. [49]
La automedicación es mayor fuera del entorno hospitalario, y esto está relacionado con un mayor uso de antibióticos, ya que la mayoría de los antibióticos se utilizan en la comunidad en lugar de en los hospitales. La prevalencia de la automedicación en los países de ingresos bajos y medios (LMIC) varía del 8,1% a muy alta, del 93%. La accesibilidad, la asequibilidad y las condiciones de los centros de salud, así como el comportamiento de búsqueda de atención médica, son factores que influyen en la automedicación en los países de ingresos bajos y medios (LMIC). [50] Dos problemas importantes con la automedicación son la falta de conocimiento del público sobre, en primer lugar, los efectos peligrosos de ciertos antimicrobianos (por ejemplo, ciprofloxacino, que puede causar tendinitis , rotura de tendones y disección aórtica ) [52] [53] y, en segundo lugar, la amplia resistencia microbiana y cuándo buscar atención médica si la infección no desaparece. Para determinar el conocimiento y las ideas preconcebidas del público sobre la resistencia a los antibióticos, se realizó una selección de 3.537 artículos publicados en Europa, Asia y América del Norte. De las 55.225 personas encuestadas en los artículos, el 70% había oído hablar de la resistencia a los antibióticos anteriormente, pero el 88% de esas personas pensaba que se refería a algún tipo de cambio físico en el cuerpo humano. [49]
El uso inadecuado de los antibióticos por parte de los profesionales sanitarios es otro factor que contribuye al aumento de la resistencia a los antimicrobianos. Estudios realizados en Estados Unidos muestran que la indicación de tratamiento con antibióticos, la elección del agente utilizado y la duración de la terapia fueron incorrectas en hasta el 50% de los casos estudiados. [54] En 2010 y 2011, aproximadamente un tercio de las prescripciones de antibióticos en ámbitos ambulatorios en Estados Unidos no fueron necesarias. [55] Otro estudio en una unidad de cuidados intensivos de un importante hospital de Francia ha demostrado que entre el 30% y el 60% de los antibióticos prescritos fueron innecesarios. [54] Estos usos inadecuados de los agentes antimicrobianos promueven la evolución de la resistencia a los antimicrobianos al ayudar a las bacterias a desarrollar alteraciones genéticas que conducen a la resistencia. [56]
Según una investigación realizada en los EE. UU. que tuvo como objetivo evaluar las actitudes y el conocimiento de los médicos sobre la resistencia a los antimicrobianos en entornos ambulatorios, solo el 63% de los encuestados informó que la resistencia a los antibióticos era un problema en sus prácticas locales, mientras que el 23% informó que la prescripción agresiva de antibióticos era necesaria para evitar no brindar una atención adecuada. [57] Esto demuestra cómo la mayoría de los médicos subestiman el impacto que sus propios hábitos de prescripción tienen en la resistencia a los antimicrobianos en su conjunto. También confirma que algunos médicos pueden ser demasiado cautelosos y recetar antibióticos por razones médicas o legales, incluso cuando las indicaciones clínicas para el uso de estos medicamentos no siempre están confirmadas. Esto puede conducir a un uso innecesario de antimicrobianos, un patrón que puede haber empeorado durante la pandemia de COVID-19 . [58] [59]
Los estudios han demostrado que los conceptos erróneos comunes sobre la eficacia y la necesidad de los antibióticos para tratar enfermedades leves comunes contribuyen a su uso excesivo. [60] [61]
El sistema médico veterinario es un elemento importante para la discusión sobre el uso de antibióticos. La supervisión veterinaria es obligatoria por ley para todos los antibióticos de importancia médica. [62] Los veterinarios utilizan el modelo farmacocinético/farmacodinámico (PK/PD) para garantizar que se administre la dosis correcta del medicamento en el lugar correcto en el momento correcto. [63]
El aumento del uso de antibióticos durante las primeras olas de la pandemia de COVID-19 puede exacerbar este problema de salud global . [64] [65] Además, las cargas pandémicas en algunos sistemas de atención médica pueden contribuir a las infecciones resistentes a los antibióticos. [66] Por otro lado, "la mayor higiene de manos, la disminución de los viajes internacionales y la disminución de los procedimientos hospitalarios electivos pueden haber reducido la selección y propagación de patógenos RAM en el corto plazo" durante la pandemia de COVID-19. [67] El uso de desinfectantes como los desinfectantes para manos a base de alcohol y el lavado de manos antiséptico también puede tener el potencial de aumentar la resistencia a los antimicrobianos. [68] El uso extensivo de desinfectantes puede conducir a mutaciones que inducen resistencia a los antimicrobianos. [69]
En una reunión de alto nivel de las Naciones Unidas sobre la resistencia a los antimicrobianos que se celebrará en 2024 se ha comprometido a reducir las muertes causadas por bacterias resistentes a los medicamentos en un 10 % en los próximos seis años. [70] En su primera declaración importante sobre el tema desde 2016, los líderes mundiales también se comprometieron a recaudar 100 millones de dólares para actualizar e implementar los planes de acción contra la RAM. [71] Sin embargo, el borrador final de la declaración omitió un objetivo anterior de reducir el uso de antibióticos en animales en un 30 % para 2030, debido a la oposición de los países productores de carne y la industria agrícola. Los críticos sostienen que esta omisión es una debilidad importante, ya que el ganado representa alrededor del 73 % de las ventas mundiales de agentes antimicrobianos, incluidos antibióticos , antivirales y antiparasitarios .
Los efluentes no tratados de las industrias de fabricación farmacéutica, [72] hospitales y clínicas, y la eliminación inadecuada de medicamentos no utilizados o vencidos pueden exponer a los microbios del medio ambiente a los antibióticos y desencadenar la evolución de la resistencia. [ cita requerida ]

La crisis de resistencia a los antimicrobianos también se extiende a la industria alimentaria, en particular a los animales destinados a la producción de alimentos. Con una población humana en constante aumento, existe una presión constante para intensificar la productividad en muchos sectores agrícolas, incluida la producción de carne como fuente de proteínas. [73] Los antibióticos se administran al ganado para que actúen como suplementos de crecimiento y como medida preventiva para reducir la probabilidad de infecciones. [74]
Los agricultores suelen utilizar antibióticos en la alimentación animal para mejorar las tasas de crecimiento y prevenir infecciones. Sin embargo, esto es ilógico, ya que los antibióticos se utilizan para tratar infecciones y no para prevenirlas. El 80% del uso de antibióticos en los EE. UU. se destina a fines agrícolas y aproximadamente el 70% de ellos son importantes desde el punto de vista médico. [75] El uso excesivo de antibióticos da tiempo a las bacterias para adaptarse, lo que hace que sean necesarias dosis más altas o incluso antibióticos más fuertes para combatir la infección. Aunque los antibióticos para estimular el crecimiento se prohibieron en toda la UE en 2006, 40 países de todo el mundo todavía utilizan antibióticos para promover el crecimiento. [76]
Esto puede provocar la transferencia de cepas bacterianas resistentes a los alimentos que consumen los seres humanos, lo que puede provocar una transmisión de enfermedades potencialmente mortal. Si bien la práctica de utilizar antibióticos como promotores del crecimiento da como resultado mejores rendimientos y productos cárnicos , es un problema importante y debe reducirse para prevenir la resistencia a los antimicrobianos. [77] Aunque la evidencia que vincula el uso de antimicrobianos en el ganado con la resistencia a los antimicrobianos es limitada, el Grupo Asesor de la Organización Mundial de la Salud sobre Vigilancia Integrada de la Resistencia a los Antimicrobianos recomendó enfáticamente la reducción del uso de antimicrobianos de importancia médica en el ganado. Además, el Grupo Asesor declaró que dichos antimicrobianos deberían prohibirse expresamente tanto para la promoción del crecimiento como para la prevención de enfermedades en animales destinados a la producción de alimentos. [78]
Al mapear el consumo de antimicrobianos en el ganado a nivel mundial, se predijo que en 228 países habrá un aumento total del 67% en el consumo de antibióticos por parte del ganado para el año 2030. En algunos países como Brasil, Rusia, India, China y Sudáfrica se predice que ocurrirá un aumento del 99%. [47] Varios países han restringido el uso de antibióticos en el ganado, incluidos Canadá, China, Japón y los EE. UU. Estas restricciones a veces se asocian con una reducción de la prevalencia de resistencia a los antimicrobianos en humanos. [78]
En los Estados Unidos, la Directiva de Alimentos Veterinarios entró en vigor en 2017 y dictamina que todos los antibióticos de importancia médica que se utilicen en alimentos o agua para especies animales destinadas al consumo humano requieren una directiva de alimentos veterinarios (VFD) o una receta médica. [79]
La mayoría de los pesticidas protegen los cultivos contra insectos y plantas, pero en algunos casos se utilizan pesticidas antimicrobianos para proteger contra diversos microorganismos como bacterias, virus, hongos, algas y protozoos. El uso excesivo de muchos pesticidas en un esfuerzo por obtener un mayor rendimiento de los cultivos ha dado lugar a que muchos de estos microbios desarrollen una tolerancia a estos agentes antimicrobianos. Actualmente hay más de 4000 pesticidas antimicrobianos registrados en la Agencia de Protección Ambiental de los Estados Unidos (EPA) y vendidos en el mercado, lo que demuestra el uso generalizado de estos agentes. [80] Se estima que por cada comida que consume una persona, se utilizan 0,3 g de pesticidas, ya que el 90% de todo el uso de pesticidas se realiza en la agricultura. La mayoría de estos productos se utilizan para ayudar a defenderse contra la propagación de enfermedades infecciosas y, con suerte, proteger la salud pública. Pero de la gran cantidad de pesticidas utilizados, también se estima que menos del 0,1% de esos agentes antimicrobianos realmente alcanzan sus objetivos. Eso deja más del 99% de todos los pesticidas utilizados disponibles para contaminar otros recursos. [81] En el suelo, el aire y el agua, estos agentes antimicrobianos pueden propagarse, entrar en contacto con más microorganismos y hacer que estos microbios desarrollen mecanismos para tolerar y resistir aún más a los pesticidas. El uso de pesticidas azólicos antimicóticos que impulsan la resistencia ambiental a los azólicos se ha relacionado con casos de resistencia a los azólicos en el ámbito clínico. [82] Los mismos problemas enfrentan las nuevas clases de antimicóticos (por ejemplo, orotomidas ) que se están utilizando nuevamente tanto en la clínica como en la agricultura. [83]

El término permafrost se utiliza para referirse a cualquier suelo que haya permanecido congelado durante dos años o más, y los ejemplos más antiguos conocidos han permanecido congelados de forma continua durante unos 700.000 años. [85] En las últimas décadas, el permafrost se ha ido descongelando rápidamente debido al cambio climático . [86] : 1237 El frío preserva cualquier materia orgánica dentro del permafrost, y es posible que los microorganismos reanuden sus funciones vitales una vez que se descongela. Mientras que algunos patógenos comunes como la gripe , la viruela o las bacterias asociadas a la neumonía no han logrado sobrevivir a los intentos intencionales de revivirlos, [87] microorganismos más adaptados al frío como el ántrax , o varios virus antiguos de plantas y amebas , han sobrevivido con éxito a descongelaciones prolongadas. [88] [89] [90] [91] [92]
Algunos científicos han argumentado que la incapacidad de los agentes causantes conocidos de enfermedades contagiosas para sobrevivir a la congelación y descongelación hace que esta amenaza sea poco probable. En cambio, ha habido sugerencias de que cuando las bacterias patógenas modernas interactúan con las antiguas, pueden, a través de la transferencia horizontal de genes , recoger secuencias genéticas que están asociadas con la resistencia a los antimicrobianos, exacerbando un problema ya difícil. [93] Los antibióticos a los que las bacterias del permafrost han mostrado al menos cierta resistencia incluyen cloranfenicol , estreptomicina , kanamicina , gentamicina , tetraciclina , espectinomicina y neomicina . [94] Sin embargo, otros estudios muestran que los niveles de resistencia en las bacterias antiguas a los antibióticos modernos siguen siendo más bajos que en las bacterias contemporáneas de la capa activa de suelo descongelado sobre ellas, [84] lo que puede significar que este riesgo "no es mayor" que el de cualquier otro suelo. [95]

Cada vez hay más llamados públicos a la acción colectiva mundial para hacer frente a esta amenaza, incluida una propuesta de tratado internacional sobre la resistencia a los antimicrobianos. Aún se necesitan más detalles y atención para reconocer y medir las tendencias de la resistencia a nivel internacional; se ha sugerido la idea de un sistema de seguimiento mundial, pero aún no se ha implementado. Un sistema de esta naturaleza proporcionaría información sobre las áreas de alta resistencia, así como la información necesaria para evaluar programas, introducir intervenciones y otros cambios realizados para combatir o revertir la resistencia a los antibióticos. [96] [97]
Retrasar o minimizar el uso de antibióticos para ciertas afecciones puede ayudar a reducir su uso de manera segura. [98] La duración del tratamiento antimicrobiano debe basarse en la infección y otros problemas de salud que pueda tener una persona. [13] En el caso de muchas infecciones, una vez que una persona ha mejorado, hay poca evidencia de que suspender el tratamiento cause más resistencia. [13] Por lo tanto, algunos creen que suspender el tratamiento antes de tiempo puede ser razonable en algunos casos. [13] Sin embargo, otras infecciones requieren tratamientos más prolongados independientemente de si la persona se siente mejor o no. [13]
Retrasar el uso de antibióticos para afecciones como dolor de garganta y otitis media puede no tener diferencias en la tasa de complicaciones en comparación con el uso inmediato de antibióticos, por ejemplo. [98] Cuando se tratan infecciones del tracto respiratorio, se requiere un criterio clínico en cuanto al tratamiento apropiado (uso tardío o inmediato de antibióticos). [98]
El estudio, "Duraciones más cortas y más largas de los antibióticos para las infecciones respiratorias: para combatir la resistencia a los antimicrobianos: un estudio transversal retrospectivo en un entorno de atención secundaria en el Reino Unido", destaca la urgencia de reevaluar las duraciones del tratamiento con antibióticos en medio del desafío global de la resistencia a los antimicrobianos (RAM). Investiga la eficacia de los regímenes de antibióticos más cortos en comparación con los más largos para las infecciones de las vías respiratorias (ITR) en un entorno de atención secundaria del Reino Unido, y enfatiza la necesidad de prácticas de prescripción basadas en evidencia para optimizar los resultados de los pacientes y combatir la RAM. [99]
Existen múltiples programas nacionales e internacionales de monitoreo de amenazas resistentes a los medicamentos, incluyendo Staphylococcus aureus resistente a la meticilina (MRSA), S. aureus resistente a la vancomicina (VRSA), Enterobacterales productores de betalactamasas de espectro extendido (ESBL) , Enterococcus resistente a la vancomicina (VRE) y Acinetobacter baumannii resistente a múltiples fármacos (MRAB). [100]
ResistanceOpen es un mapa global en línea de la resistencia a los antimicrobianos desarrollado por HealthMap que muestra datos agregados sobre la resistencia a los antimicrobianos a partir de datos disponibles públicamente y enviados por los usuarios. [101] [102] El sitio web puede mostrar datos para un radio de 25 millas (40 km) desde una ubicación. Los usuarios pueden enviar datos de antibiogramas para hospitales o laboratorios individuales. Los datos europeos provienen de EARS-Net (Red Europea de Vigilancia de la Resistencia a los Antimicrobianos), parte del ECDC . ResistanceMap es un sitio web del Centro para la Dinámica, la Economía y la Política de Enfermedades y proporciona datos sobre la resistencia a los antimicrobianos a nivel mundial. [103]
En comparación, hay una falta de programas nacionales e internacionales de monitoreo de la resistencia a los antimicóticos. [8]
Los programas de gestión de antimicrobianos parecen ser útiles para reducir las tasas de resistencia a los antimicrobianos. [104] El programa de gestión de antimicrobianos también proporcionará a los farmacéuticos el conocimiento necesario para educar a los pacientes sobre el hecho de que los antibióticos no funcionan contra un virus, por ejemplo. [105]
El uso excesivo de antimicrobianos se ha convertido en uno de los principales factores que contribuyen a la evolución de la resistencia a los antimicrobianos. Desde el comienzo de la era de los antimicrobianos, se han utilizado para tratar una amplia gama de enfermedades infecciosas. [106] El uso excesivo de antimicrobianos se ha convertido en la causa principal de los crecientes niveles de resistencia a los antimicrobianos. El principal problema es que los médicos están dispuestos a recetar antimicrobianos a personas mal informadas que creen que los antimicrobianos pueden curar casi todas las enfermedades, incluidas las infecciones virales como el resfriado común. En un análisis de prescripciones de medicamentos, al 36% de las personas con un resfriado o una infección de las vías respiratorias superiores (ambas generalmente de origen viral) se les dieron recetas de antibióticos. [107] Estas prescripciones no lograron nada más que aumentar el riesgo de una mayor evolución de las bacterias resistentes a los antibióticos. [108] El uso de antimicrobianos sin receta es otra fuerza impulsora que conduce al uso excesivo de antibióticos para el autotratamiento de enfermedades como el resfriado común, la tos, la fiebre y la disentería, lo que resulta en una epidemia de resistencia a los antibióticos en países como Bangladesh, con el riesgo de que se propague por todo el mundo. [109] La introducción de una estricta gestión de los antibióticos en el ámbito ambulatorio para reducir la prescripción inadecuada de antibióticos puede reducir la resistencia bacteriana emergente. [110]
La guía y el libro sobre antibióticos AWaRe (Access, Watch, Reserve) de la OMS se han presentado para orientar la elección de antibióticos para las 30 infecciones más comunes en adultos y niños, con el fin de reducir la prescripción inadecuada en atención primaria y hospitales. Se prefieren los antibióticos de espectro reducido debido a su menor potencial de resistencia, y los antibióticos de amplio espectro solo se recomiendan para personas con síntomas más graves. Algunos antibióticos tienen más probabilidades de conferir resistencia, por lo que se mantienen como antibióticos de reserva en el libro AWaRe. [15]
Se han empleado diversas estrategias de diagnóstico para prevenir el uso excesivo de la terapia antimicótica en la clínica, demostrando ser una alternativa segura a la terapia antimicótica empírica y, por lo tanto, respaldando los esquemas de administración de antimicóticos. [111]
Los equipos de gestión de la eficacia de los antimicrobianos en los hospitales están fomentando el uso óptimo de los mismos. [112] Los objetivos de la gestión de la eficacia de los antimicrobianos son ayudar a los profesionales a elegir el fármaco adecuado en la dosis y la duración adecuadas del tratamiento, evitando al mismo tiempo el uso indebido y minimizando el desarrollo de resistencia. Las intervenciones de gestión de la eficacia pueden reducir la duración de la hospitalización en un promedio de poco más de un día sin aumentar el riesgo de muerte. [113]
Dado el volumen de atención que se brinda en la atención primaria (medicina general), las estrategias recientes se han centrado en reducir la prescripción innecesaria de antimicrobianos en este ámbito. Se ha demostrado que intervenciones simples, como la información escrita que explica cuándo no es necesario tomar antibióticos, por ejemplo en infecciones comunes de las vías respiratorias superiores, reducen la prescripción de antibióticos. [114] También existen varias herramientas para ayudar a los profesionales a decidir si es necesario recetar antimicrobianos.
Las expectativas de los padres, impulsadas por la preocupación por la salud de sus hijos, pueden influir en la frecuencia con la que se les prescriben antibióticos a sus hijos. Los padres a menudo confían en su médico para obtener consejos y tranquilidad. Sin embargo, la falta de información en un lenguaje sencillo y la falta de tiempo suficiente para la consulta afectan negativamente a esta relación. En efecto, los padres a menudo confían en experiencias pasadas en sus expectativas en lugar de en la tranquilidad del médico. El tiempo adecuado para la consulta y la información en un lenguaje sencillo pueden ayudar a los padres a tomar decisiones informadas y evitar el uso innecesario de antibióticos. [115]
El médico que prescribe debe respetar estrictamente los cinco principios correctos de la administración de medicamentos: el paciente correcto, el medicamento correcto, la dosis correcta, la vía correcta y el momento correcto. [116] Se deben tomar muestras microbiológicas para realizar cultivos y pruebas de sensibilidad antes del tratamiento cuando esté indicado y se debe modificar el tratamiento en función del informe de sensibilidad. [16] [117]
Los trabajadores de la salud y los farmacéuticos pueden ayudar a abordar la resistencia a los antibióticos: mejorando la prevención y el control de las infecciones; recetando y dispensando antibióticos solo cuando sean realmente necesarios; recetando y dispensando los antibióticos adecuados para tratar la enfermedad. [35]
Las personas pueden ayudar a combatir la resistencia utilizando antibióticos solo cuando están infectadas con una infección bacteriana y prescrita por un médico; completando la receta completa incluso si el usuario se siente mejor, nunca compartiendo antibióticos con otras personas o utilizando recetas sobrantes. [35] Tomar antibióticos cuando no es necesario no ayudará al usuario, sino que dará a las bacterias la opción de adaptarse y dejará al usuario con los efectos secundarios que vienen con cierto tipo de antibiótico. [118] Los CDC recomiendan que sigas estos comportamientos para evitar estos efectos secundarios negativos y mantener a la comunidad a salvo de la propagación de bacterias resistentes a los medicamentos. [118] Practicar cursos básicos de prevención de infecciones bacterianas, como la higiene, también ayuda a prevenir la propagación de bacterias resistentes a los antibióticos. [119]
El control de las enfermedades infecciosas mediante la mejora de la infraestructura de agua, saneamiento e higiene (WASH) debe incluirse en la agenda de la resistencia a los antimicrobianos (AMR). El "Grupo de coordinación interinstitucional sobre resistencia a los antimicrobianos" afirmó en 2018 que "la propagación de patógenos a través del agua insalubre da lugar a una alta carga de enfermedades gastrointestinales, lo que aumenta aún más la necesidad de tratamiento con antibióticos". [122] Esto es particularmente un problema en los países en desarrollo , donde la propagación de enfermedades infecciosas causada por estándares WASH inadecuados es un importante impulsor de la demanda de antibióticos. [123] El creciente uso de antibióticos junto con los niveles persistentes de enfermedades infecciosas han llevado a un ciclo peligroso en el que la dependencia de los antimicrobianos aumenta mientras que la eficacia de los medicamentos disminuye. [123] El uso adecuado de la infraestructura para agua, saneamiento e higiene (WASH) puede resultar en una disminución del 47 al 72 por ciento de los casos de diarrea tratados con antibióticos, dependiendo del tipo de intervención y su eficacia. [123] Una reducción de la carga de enfermedades diarreicas mediante la mejora de la infraestructura daría lugar a grandes disminuciones en el número de casos de diarrea tratados con antibióticos. Se estima que esta cifra oscilará entre 5 millones en Brasil y hasta 590 millones en la India para el año 2030. [123] El fuerte vínculo entre el aumento del consumo y la resistencia indica que esto mitigará directamente la propagación acelerada de la RAM. [123] El saneamiento y el agua para todos en 2030 es el Objetivo número 6 de los Objetivos de Desarrollo Sostenible . [124]
Un aumento en el cumplimiento del lavado de manos por parte del personal hospitalario da como resultado una disminución de las tasas de organismos resistentes. [125]
La infraestructura de abastecimiento de agua y saneamiento en los centros de salud ofrece importantes beneficios colaterales para combatir la RAM, y se debería aumentar la inversión. [122] Hay mucho margen de mejora: la OMS y el UNICEF estimaron en 2015 que a nivel mundial el 38% de los centros de salud no tenían una fuente de agua, casi el 19% no tenían retretes y el 35% no tenían agua ni jabón o desinfectante a base de alcohol para lavarse las manos. [126]
Los fabricantes de antimicrobianos necesitan mejorar el tratamiento de sus aguas residuales (mediante el uso de procesos de tratamiento de aguas residuales industriales ) para reducir la liberación de residuos al medio ambiente. [122]
Se ha comprobado que el uso de antibióticos en la cría de animales puede generar resistencias RAM en las bacterias presentes en los animales destinados al consumo a los antibióticos que se administran (mediante inyecciones o alimentos medicados). [127] Por este motivo, en estas prácticas solo se utilizan antimicrobianos que se consideran "no clínicamente relevantes".
A diferencia de la resistencia a los antibacterianos, la resistencia a los antifúngicos puede ser impulsada por la agricultura ; actualmente no existe ninguna regulación sobre el uso de clases de antifúngicos similares en la agricultura y la clínica. [8] [83]
Estudios recientes han demostrado que el uso profiláctico de antimicrobianos "no prioritarios" o "no clínicamente relevantes" en los alimentos puede potencialmente, bajo ciertas condiciones, conducir a la coselección de bacterias ambientales resistentes a los antimicrobianos con resistencia a antibióticos de importancia médica. [128] La posibilidad de coselección de resistencias a los antimicrobianos en la cadena alimentaria puede tener implicaciones de largo alcance para la salud humana. [128] [129]
En 1997, los ministros de salud de la Unión Europea votaron para prohibir la avoparcina y cuatro antibióticos adicionales utilizados para promover el crecimiento animal en 1999. [130] En 2006, entró en vigor una prohibición del uso de antibióticos en los piensos europeos, con la excepción de dos antibióticos en los piensos para aves de corral. [131] En Escandinavia, hay evidencia de que la prohibición ha llevado a una menor prevalencia de resistencia a los antibióticos en poblaciones bacterianas animales (no peligrosas). [132] A partir de 2004, varios países europeos establecieron una disminución de la resistencia a los antimicrobianos en humanos mediante la limitación del uso de antimicrobianos en la agricultura y las industrias alimentarias sin poner en peligro la salud animal o el costo económico. [133]
El Departamento de Agricultura de los Estados Unidos (USDA) y la Administración de Alimentos y Medicamentos (FDA) recopilan datos sobre el uso de antibióticos en humanos y, de manera más limitada, en animales. [134] Aproximadamente el 80% del uso de antibióticos en los EE. UU. se destina a fines agrícolas, y aproximadamente el 70% de estos son importantes desde el punto de vista médico. [75] Esto da motivos para preocuparse por la crisis de resistencia a los antibióticos en los EE. UU. y más motivos para vigilarla. La FDA determinó por primera vez en 1977 que hay evidencia de la aparición de cepas bacterianas resistentes a los antibióticos en el ganado. No obstante, la práctica establecida desde hace mucho tiempo de permitir la venta sin receta de antibióticos (incluida la penicilina y otros medicamentos) a propietarios de animales para su administración a sus propios animales continuó en todos los estados. En 2000, la FDA anunció su intención de revocar la aprobación del uso de fluoroquinolonas en la producción avícola debido a la evidencia sustancial que lo vincula con la aparición de infecciones por Campylobacter resistentes a las fluoroquinolonas en humanos. Los desafíos legales de las industrias farmacéutica y de alimentos para animales retrasaron la decisión final de hacerlo hasta 2006. [135] Las fluoroquinolonas han estado prohibidas para uso fuera de etiqueta en animales de consumo en los EE. UU. desde 2007. [136] Sin embargo, siguen utilizándose ampliamente en animales de compañía y exóticos. [137]
La creciente interconexión del mundo y el hecho de que no se hayan desarrollado ni aprobado nuevas clases de antibióticos durante más de 25 años ponen de relieve hasta qué punto la resistencia a los antimicrobianos es un problema sanitario mundial. [138] En la 68.ª Asamblea Mundial de la Salud celebrada en mayo de 2015 se aprobó un plan de acción mundial para abordar el creciente problema de la resistencia a los antibióticos y otros medicamentos antimicrobianos. [139] Uno de los objetivos clave del plan es mejorar la concienciación y la comprensión de la resistencia a los antimicrobianos mediante una comunicación, una educación y una formación eficaces. Este plan de acción mundial elaborado por la Organización Mundial de la Salud se creó para combatir el problema de la resistencia a los antimicrobianos y se guió por el asesoramiento de los países y las principales partes interesadas. El plan de acción mundial de la OMS se compone de cinco objetivos clave que pueden alcanzarse por diferentes medios y representa la unión de los países para resolver un problema importante que puede tener consecuencias sanitarias futuras. [47] Estos objetivos son los siguientes:
Pasos hacia el progreso
La Organización Mundial de la Salud ha promovido la primera Semana Mundial de Concientización sobre el Uso de los Antibióticos, que se celebrará del 16 al 22 de noviembre de 2015. El objetivo de la semana es aumentar la conciencia mundial sobre la resistencia a los antibióticos y promover el uso correcto de los antibióticos en todos los ámbitos para prevenir nuevos casos de resistencia a los antibióticos. [150]
La Semana Mundial de Concientización sobre los Antibióticos se celebra cada noviembre desde 2015. Para 2017, la Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO), la Organización Mundial de la Salud (OMS) y la Organización Mundial de Sanidad Animal (OIE) están pidiendo conjuntamente un uso responsable de los antibióticos en seres humanos y animales para reducir la aparición de resistencia a los antibióticos. [151]
Naciones Unidas
En 2016, el Secretario General de las Naciones Unidas convocó al Grupo de Coordinación Interinstitucional sobre Resistencia a los Antimicrobianos. [152] El Grupo trabajó con organizaciones internacionales y expertos en salud humana, animal y vegetal para crear un plan para combatir la resistencia a los antimicrobianos. [152] Su informe publicado en abril de 2019 destaca la gravedad de la resistencia a los antimicrobianos y la amenaza que representa para la salud mundial. Sugiere cinco recomendaciones que los Estados miembros deben seguir para enfrentar esta creciente amenaza. Las recomendaciones del Grupo son las siguientes: [153]

Los cinco mecanismos principales por los cuales las bacterias muestran resistencia a los antibióticos son:

Hay varios tipos diferentes de gérmenes que han desarrollado resistencia con el tiempo.
Los seis patógenos que causan la mayoría de las muertes asociadas con la resistencia son Escherichia coli , Staphylococcus aureus, Klebsiella pneumoniae, Streptococcus pneumoniae, Acinetobacter baumannii y Pseudomonas aeruginosa . Fueron responsables de 929.000 muertes atribuibles a la resistencia y 3,57 millones de muertes asociadas con la resistencia en 2019. [10]
La Neisseria gonorrhoeae productora de penicilinasa desarrolló resistencia a la penicilina en 1976. Otro ejemplo es la Neisseria gonorrhoeae resistente a la azitromicina , que desarrolló resistencia a la azitromicina en 2011. [162]
En las bacterias gramnegativas , los genes de resistencia mediados por plásmidos producen proteínas que pueden unirse a la ADN girasa , protegiéndola de la acción de las quinolonas. Finalmente, las mutaciones en sitios clave en la ADN girasa o la topoisomerasa IV pueden disminuir su afinidad de unión a las quinolonas, disminuyendo así la eficacia del fármaco. [163]
Algunas bacterias son naturalmente resistentes a ciertos antibióticos; por ejemplo, las bacterias gramnegativas son resistentes a la mayoría de los antibióticos β-lactámicos debido a la presencia de β-lactamasa . La resistencia a los antibióticos también puede adquirirse como resultado de una mutación genética o de una transferencia horizontal de genes . [164] Aunque las mutaciones son raras, y las mutaciones espontáneas en el genoma del patógeno ocurren a una tasa de aproximadamente 1 en 10 5 a 1 en 10 8 por replicación cromosómica, [165] el hecho de que las bacterias se reproduzcan a una tasa alta permite que el efecto sea significativo. Dado que la esperanza de vida y la producción de nuevas generaciones pueden estar en una escala de tiempo de meras horas, una nueva mutación (de novo) en una célula madre puede convertirse rápidamente en una mutación hereditaria de prevalencia generalizada, lo que resulta en la microevolución de una colonia completamente resistente. Sin embargo, las mutaciones cromosómicas también confieren un costo de aptitud. Por ejemplo, una mutación ribosomal puede proteger una célula bacteriana al cambiar el sitio de unión de un antibiótico, pero puede resultar en una tasa de crecimiento más lenta. [166] Además, algunas mutaciones adaptativas pueden propagarse no solo a través de la herencia sino también a través de la transferencia horizontal de genes . El mecanismo más común de transferencia horizontal de genes es la transferencia de plásmidos que llevan genes de resistencia a antibióticos entre bacterias de la misma especie o de especies diferentes a través de la conjugación . Sin embargo, las bacterias también pueden adquirir resistencia a través de la transformación , como en la captación de fragmentos desnudos de ADN extracelular que contienen genes de resistencia a antibióticos por parte de Streptococcus pneumoniae a la estreptomicina, [167] a través de la transducción , como en la transferencia mediada por bacteriófagos de genes de resistencia a la tetraciclina entre cepas de S. pyogenes , [168] o a través de agentes de transferencia genética , que son partículas producidas por la célula huésped que se asemejan a las estructuras de los bacteriófagos y son capaces de transferir ADN. [169]
La resistencia a los antibióticos se puede introducir artificialmente en un microorganismo a través de protocolos de laboratorio, a veces se utiliza como un marcador seleccionable para examinar los mecanismos de transferencia genética o para identificar individuos que absorbieron un fragmento de ADN que incluía el gen de resistencia y otro gen de interés. [170]
Los últimos hallazgos muestran que no es necesario que existan grandes poblaciones de bacterias para que aparezca la resistencia a los antibióticos. Poblaciones pequeñas de Escherichia coli en un gradiente de antibióticos pueden volverse resistentes. Cualquier entorno heterogéneo con respecto a los gradientes de nutrientes y antibióticos puede facilitar la resistencia a los antibióticos en poblaciones bacterianas pequeñas. Los investigadores plantean la hipótesis de que el mecanismo de evolución de la resistencia se basa en cuatro mutaciones de SNP en el genoma de E. coli producidas por el gradiente de antibióticos. [171]
En un estudio, que tiene implicaciones para la microbiología espacial, una cepa no patógena E. coli MG1655 fue expuesta a niveles traza del antibiótico de amplio espectro cloranfenicol , bajo microgravedad simulada (LSMMG, o Microgravedad Modelada de Bajo Cizallamiento) durante 1000 generaciones. La cepa adaptada adquirió resistencia no solo al cloranfenicol, sino también resistencia cruzada a otros antibióticos; [172] esto contrastaba con la observación en la misma cepa, que se adaptó a más de 1000 generaciones bajo LSMMG, pero sin ninguna exposición a antibióticos; la cepa en este caso no adquirió tal resistencia. [173] Por lo tanto, independientemente de dónde se utilicen, el uso de un antibiótico probablemente daría como resultado una resistencia persistente a ese antibiótico, así como una resistencia cruzada a otros antimicrobianos.
En los últimos años, la aparición y propagación de β-lactamasas llamadas carbapenemasas se ha convertido en una importante crisis de salud. [174] [175] Una de estas carbapenemasas es la metalo-beta-lactamasa 1 de Nueva Delhi (NDM-1), [176] una enzima que hace que las bacterias sean resistentes a una amplia gama de antibióticos betalactámicos . Las bacterias más comunes que producen esta enzima son gramnegativas como E. coli y Klebsiella pneumoniae , pero el gen de NDM-1 puede propagarse de una cepa de bacterias a otra mediante transferencia horizontal de genes . [177]
Se utilizan medicamentos antivirales específicos para tratar algunas infecciones virales. Estos medicamentos impiden que los virus se reproduzcan al inhibir etapas esenciales del ciclo de replicación del virus en las células infectadas. Los antivirales se utilizan para tratar el VIH , la hepatitis B , la hepatitis C , la gripe , los virus del herpes , incluido el virus de la varicela zóster , el citomegalovirus y el virus de Epstein-Barr . Con cada virus, algunas cepas se han vuelto resistentes a los medicamentos administrados. [178]
Los fármacos antivirales suelen actuar sobre componentes clave de la reproducción viral; por ejemplo, el oseltamivir actúa sobre la neuraminidasa de la gripe , mientras que los análogos de la guanosina inhiben la ADN polimerasa viral. La resistencia a los antivirales se adquiere, por tanto, a través de mutaciones en los genes que codifican las proteínas diana de los fármacos.
La resistencia a los antivirales del VIH es problemática, e incluso han evolucionado cepas resistentes a múltiples fármacos. [179] Una fuente de resistencia es que muchos de los fármacos actuales contra el VIH, incluidos los NRTI y los NNRTI, tienen como objetivo la transcriptasa inversa ; sin embargo, la transcriptasa inversa del VIH-1 es muy propensa a errores y, por lo tanto, surgen rápidamente mutaciones que confieren resistencia. [180] Las cepas resistentes del virus del VIH surgen rápidamente si solo se utiliza un fármaco antiviral. [181] El uso de tres o más fármacos juntos, denominado terapia combinada , ha ayudado a controlar este problema, pero se necesitan nuevos fármacos debido a la continua aparición de cepas del VIH resistentes a los fármacos. [182]
Las infecciones por hongos son causa de alta morbilidad y mortalidad en personas inmunodeprimidas , como aquellas con VIH/SIDA, tuberculosis o que reciben quimioterapia . [183] Los hongos Candida , Cryptococcus neoformans y Aspergillus fumigatus causan la mayoría de estas infecciones y la resistencia a los antimicóticos ocurre en todos ellos. [184] La resistencia a múltiples fármacos en hongos está aumentando debido al uso generalizado de medicamentos antimicóticos para tratar infecciones en individuos inmunodeprimidos y el uso de algunos antimicóticos agrícolas. [8] [185] La enfermedad resistente a los antimicóticos se asocia con un aumento de la mortalidad.
Algunos hongos (por ejemplo, Candida krusei y fluconazol ) presentan resistencia intrínseca a ciertos fármacos o clases de antimicóticos, mientras que algunas especies desarrollan resistencia a los antimicóticos a presiones externas. La resistencia a los antimicóticos es un problema de Una Salud , impulsado por múltiples factores extrínsecos, incluido el uso extensivo de fungicidas, el uso excesivo de antimicóticos clínicos, el cambio ambiental y los factores del huésped. [8]
En los EE.UU., las especies de Candida resistentes al fluconazol y la resistencia a los azoles en Aspergillus fumigatus se han destacado como una amenaza creciente. [100]
Más de 20 especies de Candida pueden causar infección por candidiasis , siendo la más común la Candida albicans . Las levaduras Candida normalmente habitan en la piel y las membranas mucosas sin causar infección. Sin embargo, el crecimiento excesivo de Candida puede provocar candidiasis. Algunas especies de Candida (p. ej., Candida glabrata ) se están volviendo resistentes a los agentes antimicóticos de primera y segunda línea , como las equinocandinas y los azoles . [100]
La aparición de Candida auris como un posible patógeno humano que a veces muestra resistencia a múltiples fármacos antimicóticos es preocupante y se ha asociado con varios brotes a nivel mundial. La OMS ha publicado una lista prioritaria de patógenos fúngicos, que incluye patógenos con resistencia a los antimicóticos. [186]
La identificación de la resistencia a los antimicóticos se ve socavada por el limitado diagnóstico clásico de la infección, en el que no se dispone de un cultivo, lo que impide realizar pruebas de susceptibilidad. [8] Los esquemas nacionales e internacionales de vigilancia de las enfermedades fúngicas y la resistencia a los antimicóticos son limitados, lo que dificulta la comprensión de la carga de la enfermedad y la resistencia asociada. [8] La aplicación de pruebas moleculares para identificar marcadores genéticos asociados con la resistencia puede mejorar la identificación de la resistencia a los antimicóticos, pero la diversidad de mutaciones asociadas con la resistencia está aumentando en todas las especies de hongos que causan la infección. Además, varios mecanismos de resistencia dependen de la regulación positiva de genes seleccionados (por ejemplo, bombas de reflujo) en lugar de mutaciones definidas que sean susceptibles de detección molecular.
Debido al número limitado de antimicóticos en uso clínico y a la creciente incidencia mundial de resistencia a los antimicóticos, el uso de los antimicóticos existentes en combinación podría ser beneficioso en algunos casos, pero se necesita más investigación. De manera similar, otros enfoques que podrían ayudar a combatir la aparición de resistencia a los antimicóticos podrían depender del desarrollo de terapias dirigidas al huésped, como la inmunoterapia o las vacunas. [8]
Los parásitos protozoarios que causan enfermedades como la malaria , la tripanosomiasis , la toxoplasmosis , la criptosporidiosis y la leishmaniasis son patógenos humanos importantes. [187]
Los parásitos de la malaria que son resistentes a los medicamentos que están disponibles actualmente contra las infecciones son comunes y esto ha llevado a un aumento de los esfuerzos para desarrollar nuevos medicamentos. [188] También se ha informado de resistencia a medicamentos desarrollados recientemente, como la artemisinina . El problema de la resistencia a los medicamentos en la malaria ha impulsado los esfuerzos para desarrollar vacunas. [189]
Los tripanosomas son protozoos parásitos que causan la tripanosomiasis africana y la enfermedad de Chagas (tripanosomiasis americana). [190] [191] No existen vacunas para prevenir estas infecciones, por lo que se utilizan medicamentos como la pentamidina y la suramina , el benznidazol y el nifurtimox para tratar las infecciones. Estos medicamentos son eficaces, pero se han reportado infecciones causadas por parásitos resistentes. [187]
La leishmaniasis es una enfermedad causada por protozoos y constituye un importante problema de salud pública en todo el mundo, especialmente en los países tropicales y subtropicales. La resistencia a los medicamentos se ha convertido en una preocupación importante. [192]


En 2022, los epidemiólogos genómicos informaron los resultados de una encuesta mundial sobre la resistencia a los antimicrobianos a través de la epidemiología genómica basada en aguas residuales , encontrando grandes variaciones regionales, proporcionando mapas y sugiriendo que los genes de resistencia también se transmiten entre especies microbianas que no están estrechamente relacionadas. [194] [193] La OMS proporciona los informes del Sistema mundial de vigilancia de la resistencia y el uso de antimicrobianos (GLASS) que resumen los datos anuales (por ejemplo, de 2020) sobre la RAM internacional, incluyendo también un panel interactivo. [195] [196]
Public Health England informó que el número total de infecciones resistentes a los antibióticos en Inglaterra aumentó un 9%, de 55.812 en 2017 a 60.788 en 2018, pero el consumo de antibióticos había disminuido un 9%, de 20,0 a 18,2 dosis diarias definidas por cada 1.000 habitantes por día entre 2014 y 2018. [197]
Los Centros para el Control y la Prevención de Enfermedades informaron que se han notificado más de 2,8 millones de casos de resistencia a los antibióticos. Sin embargo, en 2019, las muertes generales por infecciones resistentes a los antibióticos disminuyeron un 18% y las muertes en hospitales disminuyeron un 30%. [198]
La pandemia de COVID provocó una reversión de gran parte del progreso logrado en la atenuación de los efectos de la resistencia a los antibióticos, lo que dio como resultado un mayor uso de antibióticos, infecciones más resistentes y menos datos sobre acciones preventivas. [199] Las infecciones y muertes de inicio hospitalario aumentaron un 15% en 2020, y se informaron tasas significativamente más altas de infecciones para 4 de los 6 tipos de infecciones asociadas a la atención médica. [200]
Los años 1950 a 1970 representaron la edad de oro del descubrimiento de antibióticos, donde se descubrieron innumerables nuevas clases de antibióticos para tratar enfermedades previamente incurables como la tuberculosis y la sífilis. [201] Sin embargo, desde entonces el descubrimiento de nuevas clases de antibióticos ha sido casi inexistente, y representa una situación que es especialmente problemática considerando la resiliencia de las bacterias [202] demostrada a lo largo del tiempo y el continuo mal uso y uso excesivo de antibióticos en el tratamiento. [203]
El fenómeno de la resistencia antimicrobiana causado por el uso excesivo de antibióticos fue predicho ya en 1945 por Alexander Fleming, quien dijo: "Puede llegar el día en que cualquiera pueda comprar penicilina en las tiendas. Entonces existe el peligro de que el hombre ignorante pueda fácilmente ingerir una dosis menor y, al exponer a sus microbios a cantidades no letales del fármaco, se vuelvan resistentes". [204] [205] Sin la creación de antibióticos nuevos y más fuertes, es muy posible que lleguemos a una era en la que las infecciones comunes y las lesiones menores puedan ser mortales y en la que procedimientos complejos como la cirugía y la quimioterapia se vuelvan demasiado arriesgados. [206] La resistencia antimicrobiana puede conducir a epidemias de enormes proporciones si no se toman medidas preventivas. En la actualidad, la resistencia antimicrobiana actual conduce a estancias hospitalarias más prolongadas, mayores costes médicos y mayor mortalidad. [203]
Desde mediados de los años 1980, las compañías farmacéuticas han invertido en medicamentos contra el cáncer o enfermedades crónicas que tienen un mayor potencial de generar ganancias y han "reducido el énfasis o abandonado el desarrollo de antibióticos". [207] El 20 de enero de 2016, en el Foro Económico Mundial de Davos , Suiza , más de "80 compañías farmacéuticas y de diagnóstico" de todo el mundo pidieron "modelos comerciales transformadores" a nivel mundial para estimular la investigación y el desarrollo de antibióticos y el "uso mejorado de pruebas de diagnóstico que puedan identificar rápidamente el organismo infectante". [207] Varios países están considerando o implementando modelos de pago desvinculados para nuevos antimicrobianos mediante los cuales el pago se basa en el valor en lugar del volumen de ventas de medicamentos. Esto ofrece la oportunidad de pagar por nuevos medicamentos valiosos incluso si están reservados para su uso en infecciones resistentes a medicamentos relativamente raras. [208]
Algunos expertos en salud global han sostenido que se necesita un marco legal global para prevenir y controlar la resistencia a los antimicrobianos. [209] [210] [28] [211] Por ejemplo, se podrían utilizar políticas globales vinculantes para crear estándares de uso de antimicrobianos, regular la comercialización de antibióticos y fortalecer los sistemas de vigilancia global. [28] [209] Garantizar el cumplimiento de las partes involucradas es un desafío. [28] Las políticas globales de resistencia a los antimicrobianos podrían aprender lecciones del sector ambiental al adoptar estrategias que han hecho que los acuerdos ambientales internacionales sean exitosos en el pasado, como: sanciones por incumplimiento, asistencia para la implementación, reglas de toma de decisiones por mayoría de votos, un panel científico independiente y compromisos específicos. [212]
Para el presupuesto de los Estados Unidos de 2016 , el presidente estadounidense Barack Obama propuso casi duplicar la cantidad de fondos federales para "combatir y prevenir" la resistencia a los antibióticos a más de 1.200 millones de dólares. [213] Muchas agencias de financiación internacionales como USAID, DFID, SIDA y la Fundación Bill y Melinda Gates han prometido dinero para desarrollar estrategias para contrarrestar la resistencia a los antimicrobianos. [ cita requerida ]
El 27 de marzo de 2015, la Casa Blanca publicó un plan integral para abordar la creciente necesidad de que las agencias combatan el aumento de las bacterias resistentes a los antibióticos. El Grupo de Trabajo para Combatir las Bacterias Resistentes a los Antibióticos desarrolló el Plan de Acción Nacional para Combatir las Bacterias Resistentes a los Antibióticos con la intención de proporcionar una hoja de ruta para guiar a los EE. UU. en el desafío de la resistencia a los antibióticos y con la esperanza de salvar muchas vidas. Este plan describe las medidas que adoptará el gobierno federal durante los próximos cinco años necesarias para prevenir y contener los brotes de infecciones resistentes a los antibióticos; mantener la eficacia de los antibióticos que ya están en el mercado; y ayudar a desarrollar futuros diagnósticos, antibióticos y vacunas. [214]
El Plan de Acción se desarrolló en torno a cinco objetivos que se centran en el fortalecimiento de la atención sanitaria, la medicina veterinaria de salud pública, la agricultura, la seguridad alimentaria y la investigación, y la industria. Estos objetivos, según los enumeró la Casa Blanca, son los siguientes:
Los siguientes son los objetivos que se han fijado para el año 2020: [214]
Según la Organización Mundial de la Salud , los responsables de las políticas pueden ayudar a combatir la resistencia fortaleciendo el seguimiento de la resistencia y la capacidad de laboratorio y regulando y promoviendo el uso apropiado de los medicamentos. [35] Los responsables de las políticas y la industria pueden ayudar a combatir la resistencia fomentando la innovación y la investigación y el desarrollo de nuevas herramientas; y promoviendo la cooperación y el intercambio de información entre todas las partes interesadas. [35]
Medir los costos y beneficios de las estrategias para combatir la resistencia a los antimicrobianos es difícil y las políticas pueden tener efectos sólo en un futuro lejano. En otras enfermedades infecciosas, este problema se ha abordado mediante el uso de modelos matemáticos. Se necesita más investigación para entender cómo se desarrolla y se propaga la resistencia a los antimicrobianos, de modo que se puedan utilizar modelos matemáticos para anticipar los efectos probables de diferentes políticas. [215]

Distinguir las infecciones que requieren antibióticos de las que se curan por sí solas es un desafío clínico. Para orientar el uso adecuado de los antibióticos y prevenir la evolución y propagación de la resistencia a los antimicrobianos, se necesitan pruebas diagnósticas que proporcionen a los médicos resultados oportunos y prácticos.
La enfermedad febril aguda es un motivo frecuente de búsqueda de atención médica en todo el mundo y una de las principales causas de morbilidad y mortalidad. En las zonas donde la incidencia de la malaria está disminuyendo, muchos pacientes febriles reciben un tratamiento inadecuado para la malaria y, en ausencia de una prueba diagnóstica sencilla para identificar causas alternativas de la fiebre, los médicos suponen que una enfermedad febril no palúdica es muy probablemente una infección bacteriana, lo que conduce al uso inadecuado de antibióticos. Múltiples estudios han demostrado que el uso de pruebas de diagnóstico rápido de la malaria sin herramientas fiables para distinguir otras causas de la fiebre ha dado lugar a un aumento del uso de antibióticos. [216]
Las pruebas de susceptibilidad a los antimicrobianos (AST) pueden facilitar un enfoque de medicina de precisión para el tratamiento al ayudar a los médicos a prescribir una terapia antimicrobiana más efectiva y dirigida. [217] Al mismo tiempo, con las AST fenotípicas tradicionales, puede llevar de 12 a 48 horas obtener un resultado debido al tiempo que tardan los organismos en crecer en/sobre los medios de cultivo. [218] Las pruebas rápidas, posibles gracias a las innovaciones en diagnóstico molecular , se definen como "que sean factibles dentro de un turno de trabajo de 8 horas". [218] Hay varios ensayos comerciales aprobados por la Administración de Alimentos y Medicamentos disponibles que pueden detectar genes de RAM a partir de una variedad de tipos de muestras. El progreso ha sido lento debido a una variedad de razones, incluido el costo y la regulación. [219] Sin embargo, los métodos de caracterización genotípica de RAM se utilizan cada vez más en combinación con algoritmos de aprendizaje automático en la investigación para ayudar a predecir mejor la RAM fenotípica a partir del genotipo del organismo. [220] [221]
Optical techniques such as phase contrast microscopy in combination with single-cell analysis are another powerful method to monitor bacterial growth. In 2017, scientists from Uppsala University in Sweden published a method[222] that applies principles of microfluidics and cell tracking, to monitor bacterial response to antibiotics in less than 30 minutes overall manipulation time. This invention was awarded the 8M£ Longitude Prize on AMR in 2024. Recently, this platform has been advanced by coupling microfluidic chip with optical tweezing[223] in order to isolate bacteria with altered phenotype directly from the analytical matrix.
Rapid diagnostic methods have also been trialled as antimicrobial stewardship interventions to influence the healthcare drivers of AMR. Serum procalcitonin measurement has been shown to reduce mortality rate, antimicrobial consumption and antimicrobial-related side-effects in patients with respiratory infections, but impact on AMR has not yet been demonstrated.[224] Similarly, point of care serum testing of the inflammatory biomarker C-reactive protein has been shown to influence antimicrobial prescribing rates in this patient cohort, but further research is required to demonstrate an effect on rates of AMR.[225] Clinical investigation to rule out bacterial infections are often done for patients with pediatric acute respiratory infections. Currently it is unclear if rapid viral testing affects antibiotic use in children.[226]
Microorganisms usually do not develop resistance to vaccines because vaccines reduce the spread of the infection and target the pathogen in multiple ways in the same host and possibly in different ways between different hosts. Furthermore, if the use of vaccines increases, there is evidence that antibiotic resistant strains of pathogens will decrease; the need for antibiotics will naturally decrease as vaccines prevent infection before it occurs.[227] However, there are well documented cases of vaccine resistance, although these are usually much less of a problem than antimicrobial resistance.[228][229]
While theoretically promising, antistaphylococcal vaccines have shown limited efficacy, because of immunological variation between Staphylococcus species, and the limited duration of effectiveness of the antibodies produced. Development and testing of more effective vaccines is underway.[230]
Two registrational trials have evaluated vaccine candidates in active immunization strategies against S. aureus infection. In a phase II trial, a bivalent vaccine of capsular proteins 5 & 8 was tested in 1804 hemodialysis patients with a primary fistula or synthetic graft vascular access. After 40 weeks following vaccination a protective effect was seen against S. aureus bacteremia, but not at 54 weeks following vaccination.[231] Based on these results, a second trial was conducted which failed to show efficacy.[232]
Merck tested V710, a vaccine targeting IsdB, in a blinded randomized trial in patients undergoing median sternotomy. The trial was terminated after a higher rate of multiorgan system failure–related deaths was found in the V710 recipients. Vaccine recipients who developed S. aureus infection were five times more likely to die than control recipients who developed S. aureus infection.[233]
Numerous investigators have suggested that a multiple-antigen vaccine would be more effective, but a lack of biomarkers defining human protective immunity keep these proposals in the logical, but strictly hypothetical arena.[232]
Antibodies are promising against antimicrobial resistance. Monoclonal antibodies (mAbs) target bacterial virulence factors, aiding in bacterial destruction through various mechanisms. Three FDA-approved antibodies target B. anthracis and C. difficile toxins.[234][235] Innovative strategies include DSTA4637S, an antibody-antibiotic conjugate, and MEDI13902, a bispecific antibody targeting Pseudomonas aeruginosa components.[235]
Alternating therapy is a proposed method in which two or three antibiotics are taken in a rotation versus taking just one antibiotic such that bacteria resistant to one antibiotic are killed when the next antibiotic is taken. Studies have found that this method reduces the rate at which antibiotic resistant bacteria emerge in vitro relative to a single drug for the entire duration.[236]
Studies have found that bacteria that evolve antibiotic resistance towards one group of antibiotic may become more sensitive to others.[237] This phenomenon can be used to select against resistant bacteria using an approach termed collateral sensitivity cycling, which has recently been found to be relevant in developing treatment strategies for chronic infections caused by Pseudomonas aeruginosa.[238] Despite its promise, large-scale clinical and experimental studies revealed limited evidence of susceptibility to antibiotic cycling across various pathogens.[239][240]
Since the discovery of antibiotics, research and development (R&D) efforts have provided new drugs in time to treat bacteria that became resistant to older antibiotics, but in the 2000s there has been concern that development has slowed enough that seriously ill people may run out of treatment options.[241][242] Another concern is that practitioners may become reluctant to perform routine surgeries because of the increased risk of harmful infection.[243] Backup treatments can have serious side-effects; for example, antibiotics like aminoglycosides (such as amikacin, gentamicin, kanamycin, streptomycin, etc.) used for the treatment of drug-resistant tuberculosis and cystic fibrosis can cause respiratory disorders, deafness and kidney failure.[244][245]
The potential crisis at hand is the result of a marked decrease in industry research and development.[246][247] Poor financial investment in antibiotic research has exacerbated the situation.[248][246] The pharmaceutical industry has little incentive to invest in antibiotics because of the high risk and because the potential financial returns are less likely to cover the cost of development than for other pharmaceuticals.[249] In 2011, Pfizer, one of the last major pharmaceutical companies developing new antibiotics, shut down its primary research effort, citing poor shareholder returns relative to drugs for chronic illnesses.[250] However, small and medium-sized pharmaceutical companies are still active in antibiotic drug research. In particular, apart from classical synthetic chemistry methodologies, researchers have developed a combinatorial synthetic biology platform on single cell level in a high-throughput screening manner to diversify novel lanthipeptides.[251]
In the 5–10 years since 2010, there has been a significant change in the ways new antimicrobial agents are discovered and developed – principally via the formation of public-private funding initiatives. These include CARB-X,[252] which focuses on nonclinical and early phase development of novel antibiotics, vaccines, rapid diagnostics; Novel Gram Negative Antibiotic (GNA-NOW),[253] which is part of the EU's Innovative Medicines Initiative; and Replenishing and Enabling the Pipeline for Anti-infective Resistance Impact Fund (REPAIR).[254] Later stage clinical development is supported by the AMR Action Fund, which in turn is supported by multiple investors with the aim of developing 2–4 new antimicrobial agents by 2030. The delivery of these trials is facilitated by national and international networks supported by the Clinical Research Network of the National Institute for Health and Care Research (NIHR), European Clinical Research Alliance in Infectious Diseases (ECRAID) and the recently formed ADVANCE-ID, which is a clinical research network based in Asia.[255] The Global Antimicrobial Research and Development Partnership (GARDP) is generating new evidence for global AMR threats such as neonatal sepsis, treatment of serious bacterial infections and sexually transmitted infections as well as addressing global access to new and strategically important antibacterial drugs.[256]
The discovery and development of new antimicrobial agents has been facilitated by regulatory advances, which have been principally led by the European Medicines Agency (EMA) and the Food and Drug Administration (FDA). These processes are increasingly aligned although important differences remain and drug developers must prepare separate documents. New development pathways have been developed to help with the approval of new antimicrobial agents that address unmet needs such as the Limited Population Pathway for Antibacterial and Antifungal Drugs (LPAD). These new pathways are required because of difficulties in conducting large definitive phase III clinical trials in a timely way.
Some of the economic impediments to the development of new antimicrobial agents have been addressed by innovative reimbursement schemes that delink payment of antimicrobials from volume-based sales. In the UK, a market entry reward scheme has been pioneered by the National Institute for Clinical Excellence (NICE) whereby an annual subscription fee is paid for use of strategically valuable antimicrobial agents – cefiderocol and ceftazidime-aviabactam are the first agents to be used in this manner and the scheme is potential blueprint for comparable programs in other countries.
The available classes of antifungal drugs are still limited but as of 2021 novel classes of antifungals are being developed and are undergoing various stages of clinical trials to assess performance.[257]
Scientists have started using advanced computational approaches with supercomputers for the development of new antibiotic derivatives to deal with antimicrobial resistance.[247][258][259]
Using antibiotic-free alternatives in bone infection treatment may help decrease the use of antibiotics and thus antimicrobial resistance.[54] The bone regeneration material bioactive glass S53P4 has shown to effectively inhibit the bacterial growth of up to 50 clinically relevant bacteria including MRSA and MRSE.[260][261][262]
During the last decades, copper and silver nanomaterials have demonstrated appealing features for the development of a new family of antimicrobial agents.[263] Nanoparticles (1-100 nm) show unique properties and promise as antimicrobial agents against resistant bacteria. Silver (AgNPs) and gold nanoparticles (AuNPs) are extensively studied, disrupting bacterial cell membranes and interfering with protein synthesis. Zinc oxide (ZnO NPs), copper (CuNPs), and silica (SiNPs) nanoparticles also exhibit antimicrobial properties. However, high synthesis costs, potential toxicity, and instability pose challenges. To overcome these, biological synthesis methods and combination therapies with other antimicrobials are explored. Enhanced biocompatibility and targeting are also under investigation to improve efficacy.[235]
Similar to the situation in malaria therapy, where successful treatments based on ancient recipes have been found,[264] there has already been some success in finding and testing ancient drugs and other treatments that are effective against AMR bacteria.[265]
One of the key tools identified by the WHO and others for the fight against rising antimicrobial resistance is improved surveillance of the spread and movement of AMR genes through different communities and regions. Recent advances in high-throughput DNA sequencing as a result of the Human Genome Project have resulted in the ability to determine the individual microbial genes in a sample.[266] Along with the availability of databases of known antimicrobial resistance genes, such as the Comprehensive Antimicrobial Resistance Database (CARD)[267][268] and ResFinder,[269][270] this allows the identification of all the antimicrobial resistance genes within the sample – the so-called "resistome". In doing so, a profile of these genes within a community or environment can be determined, providing insights into how antimicrobial resistance is spreading through a population and allowing for the identification of resistance that is of concern.[266]
Phage therapy is the therapeutic use of bacteriophages to treat pathogenic bacterial infections.[271] Phage therapy has many potential applications in human medicine as well as dentistry, veterinary science, and agriculture.[272]
Phage therapy relies on the use of naturally occurring bacteriophages to infect and lyse bacteria at the site of infection in a host. Due to current advances in genetics and biotechnology these bacteriophages can possibly be manufactured to treat specific infections.[273] Phages can be bioengineered to target multidrug-resistant bacterial infections, and their use involves the added benefit of preventing the elimination of beneficial bacteria in the human body.[49] Phages destroy bacterial cell walls and membrane through the use of lytic proteins which kill bacteria by making many holes from the inside out.[274] Bacteriophages can even possess the ability to digest the biofilm that many bacteria develop that protect them from antibiotics in order to effectively infect and kill bacteria. Bioengineering can play a role in creating successful bacteriophages.[274]
Understanding the mutual interactions and evolutions of bacterial and phage populations in the environment of a human or animal body is essential for rational phage therapy.[275]
Bacteriophagics are used against antibiotic resistant bacteria in Georgia (George Eliava Institute) and in one institute in Wrocław, Poland.[276][277] Bacteriophage cocktails are common drugs sold over the counter in pharmacies in eastern countries.[278][279] In Belgium, four patients with severe musculoskeletal infections received bacteriophage therapy with concomitant antibiotics. After a single course of phage therapy, no recurrence of infection occurred and no severe side-effects related to the therapy were detected.[280]
{{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link){{cite journal}}: CS1 maint: overridden setting (link)