
Una reacción química es un proceso que conduce a la transformación química de un conjunto de sustancias químicas en otro. [1] Cuando ocurren reacciones químicas, los átomos se reorganizan y la reacción va acompañada de un cambio de energía a medida que se generan nuevos productos. Clásicamente, las reacciones químicas abarcan cambios que solo involucran las posiciones de los electrones en la formación y ruptura de enlaces químicos entre átomos , sin cambios en los núcleos (ningún cambio en los elementos presentes), y a menudo se pueden describir mediante una ecuación química . La química nuclear es una subdisciplina de la química que involucra las reacciones químicas de elementos inestables y radiactivos donde pueden ocurrir cambios tanto electrónicos como nucleares.
Las sustancias que intervienen inicialmente en una reacción química se denominan reactivos . Las reacciones químicas suelen caracterizarse por un cambio químico y dan lugar a uno o más productos , que suelen tener propiedades diferentes a las de los reactivos. Las reacciones suelen constar de una secuencia de subpasos individuales, las denominadas reacciones elementales , y la información sobre el curso preciso de la acción forma parte del mecanismo de reacción . Las reacciones químicas se describen con ecuaciones químicas , que presentan simbólicamente los materiales de partida, los productos finales y, a veces, los productos intermedios y las condiciones de reacción.
Las reacciones químicas ocurren a una velocidad de reacción característica a una temperatura y concentración química determinadas. Algunas reacciones producen calor y se denominan reacciones exotérmicas , mientras que otras pueden requerir calor para que se produzca la reacción, que se denominan reacciones endotérmicas . Normalmente, las velocidades de reacción aumentan con el aumento de la temperatura porque hay más energía térmica disponible para alcanzar la energía de activación necesaria para romper los enlaces entre los átomos.
Una reacción puede clasificarse como redox, en la que se produce oxidación y reducción , o no redox, en la que no se produce oxidación ni reducción. La mayoría de las reacciones redox simples pueden clasificarse como una combinación, una descomposición o una reacción de desplazamiento simple.
Durante la síntesis química se utilizan diferentes reacciones químicas para obtener el producto deseado. En bioquímica , una serie consecutiva de reacciones químicas (en las que el producto de una reacción es el reactivo de la siguiente) forman vías metabólicas . Estas reacciones suelen estar catalizadas por enzimas proteicas . Las enzimas aumentan la velocidad de las reacciones bioquímicas, de modo que pueden producirse síntesis y descomposiciones metabólicas imposibles en condiciones normales a la temperatura y las concentraciones presentes en una célula .
El concepto general de reacción química se ha extendido a reacciones entre entidades más pequeñas que los átomos, incluidas las reacciones nucleares , las desintegraciones radiactivas y las reacciones entre partículas elementales , como lo describe la teoría cuántica de campos .
.jpg/440px-David_-_Portrait_of_Monsieur_Lavoisier_(cropped).jpg)
Las reacciones químicas como la combustión en el fuego, la fermentación y la reducción de minerales a metales se conocían desde la antigüedad. Las teorías iniciales de transformación de materiales fueron desarrolladas por filósofos griegos, como la teoría de los cuatro elementos de Empédocles que afirmaba que cualquier sustancia está compuesta por los cuatro elementos básicos: fuego, agua, aire y tierra. En la Edad Media , las transformaciones químicas fueron estudiadas por los alquimistas . Intentaron, en particular, convertir el plomo en oro , para lo cual utilizaron reacciones de plomo y aleaciones de plomo y cobre con azufre . [2]
La producción artificial de sustancias químicas ya era un objetivo central para los alquimistas medievales. [3] Los ejemplos incluyen la síntesis de cloruro de amonio a partir de sustancias orgánicas como se describe en las obras (c. 850-950) atribuidas a Jābir ibn Ḥayyān , [4] o la producción de ácidos minerales como los ácidos sulfúrico y nítrico por alquimistas posteriores, a partir de c. 1300. [5] La producción de ácidos minerales implicaba el calentamiento de minerales de sulfato y nitrato como el sulfato de cobre , el alumbre y el salitre . En el siglo XVII, Johann Rudolph Glauber produjo ácido clorhídrico y sulfato de sodio haciendo reaccionar ácido sulfúrico y cloruro de sodio . Con el desarrollo del proceso de cámara de plomo en 1746 y el proceso Leblanc , que permitieron la producción a gran escala de ácido sulfúrico y carbonato de sodio , respectivamente, las reacciones químicas se implementaron en la industria. Una mayor optimización de la tecnología del ácido sulfúrico dio como resultado el proceso de contacto en la década de 1880, [6] y el proceso Haber se desarrolló entre 1909 y 1910 para la síntesis de amoníaco . [7]
A partir del siglo XVI, investigadores como Jan Baptist van Helmont , Robert Boyle e Isaac Newton intentaron establecer teorías de transformaciones químicas observadas experimentalmente. La teoría del flogisto fue propuesta en 1667 por Johann Joachim Becher . Postuló la existencia de un elemento parecido al fuego llamado "flogisto", que estaba contenido en los cuerpos combustibles y se liberaba durante la combustión . Esto resultó ser falso en 1785 por Antoine Lavoisier, quien encontró la explicación correcta de la combustión como una reacción con el oxígeno del aire. [8]
Joseph Louis Gay-Lussac reconoció en 1808 que los gases siempre reaccionan entre sí en una determinada relación. Basándose en esta idea y en la teoría atómica de John Dalton , Joseph Proust había desarrollado la ley de proporciones definidas , que posteriormente dio lugar a los conceptos de estequiometría y ecuaciones químicas . [9]
En cuanto a la química orgánica , durante mucho tiempo se creyó que los compuestos obtenidos a partir de organismos vivos eran demasiado complejos para ser obtenidos sintéticamente . Según el concepto de vitalismo , la materia orgánica estaba dotada de una "fuerza vital" y se distinguía de los materiales inorgánicos. Esta separación fue sin embargo terminada por la síntesis de urea a partir de precursores inorgánicos por Friedrich Wöhler en 1828. Otros químicos que aportaron importantes contribuciones a la química orgánica incluyen a Alexander William Williamson con su síntesis de éteres y Christopher Kelk Ingold , quien, entre muchos descubrimientos, estableció los mecanismos de las reacciones de sustitución .
Las características generales de las reacciones químicas son:

Las ecuaciones químicas se utilizan para ilustrar gráficamente las reacciones químicas. Consisten en fórmulas químicas o estructurales de los reactivos a la izquierda y las de los productos a la derecha. Están separadas por una flecha (→) que indica la dirección y el tipo de reacción; la flecha se lee como la palabra "rendimiento". [10] La punta de la flecha apunta en la dirección en la que procede la reacción. Una flecha doble (⇌) que apunta en direcciones opuestas se utiliza para las reacciones de equilibrio . Las ecuaciones deben estar balanceadas de acuerdo con la estequiometría , el número de átomos de cada especie debe ser el mismo en ambos lados de la ecuación. Esto se logra escalando el número de moléculas involucradas (A, B, C y D en un ejemplo esquemático a continuación) por los números enteros apropiados a, b, c y d . [11]
Las reacciones más elaboradas se representan mediante esquemas de reacción, que además de los materiales de partida y los productos muestran intermediarios importantes o estados de transición . Además, algunas adiciones relativamente menores a la reacción se pueden indicar encima de la flecha de reacción; ejemplos de tales adiciones son agua, calor, iluminación, un catalizador , etc. De manera similar, algunos productos menores se pueden colocar debajo de la flecha, a menudo con un signo menos.
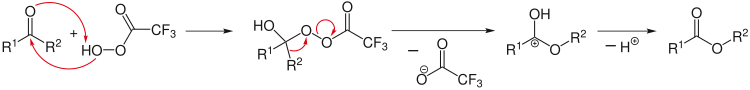
El análisis retrosintético se puede aplicar para diseñar una reacción de síntesis compleja. En este caso, el análisis comienza a partir de los productos, por ejemplo, mediante la división de enlaces químicos seleccionados, para llegar a reactivos iniciales plausibles. En las reacciones retroactivas se utiliza una flecha especial (⇒). [12]
La reacción elemental es la división más pequeña en la que se puede descomponer una reacción química, no tiene productos intermedios. [13] La mayoría de las reacciones observadas experimentalmente se construyen a partir de muchas reacciones elementales que ocurren en paralelo o secuencialmente. La secuencia real de las reacciones elementales individuales se conoce como mecanismo de reacción . Una reacción elemental involucra unas pocas moléculas, generalmente una o dos, debido a la baja probabilidad de que varias moléculas se encuentren en un momento determinado. [14]

Las reacciones elementales más importantes son las reacciones unimoleculares y bimoleculares. En una reacción unimolecular sólo interviene una molécula, que se transforma por isomerización o disociación en una o más moléculas. Estas reacciones requieren la adición de energía en forma de calor o luz. Un ejemplo típico de una reacción unimolecular es la isomerización cis-trans , en la que la forma cis de un compuesto se convierte en la forma trans o viceversa. [15]
En una reacción de disociación típica , un enlace en una molécula se divide ( se rompe ) dando como resultado dos fragmentos moleculares. La división puede ser homolítica o heterolítica . En el primer caso, el enlace se divide de modo que cada producto retiene un electrón y se convierte en un radical neutro . En el segundo caso, ambos electrones del enlace químico permanecen con uno de los productos, lo que da como resultado iones cargados . La disociación juega un papel importante en el desencadenamiento de reacciones en cadena , como las reacciones de hidrógeno-oxígeno o de polimerización .
En las reacciones bimoleculares , dos moléculas chocan y reaccionan entre sí. Su fusión se denomina síntesis química o reacción de adición .
Otra posibilidad es que sólo una parte de una molécula se transfiera a la otra molécula. Este tipo de reacción ocurre, por ejemplo, en las reacciones redox y ácido-base. En las reacciones redox, la partícula transferida es un electrón, mientras que en las reacciones ácido-base es un protón. Este tipo de reacción también se denomina metátesis .
Por ejemplo
La mayoría de las reacciones químicas son reversibles, es decir, pueden y de hecho se desarrollan en ambas direcciones. Las reacciones directa e inversa compiten entre sí y difieren en sus velocidades de reacción . Estas velocidades dependen de la concentración y, por lo tanto, cambian con el tiempo de la reacción: la velocidad inversa aumenta gradualmente y se vuelve igual a la velocidad de la reacción directa, estableciendo el llamado equilibrio químico. El tiempo para alcanzar el equilibrio depende de parámetros como la temperatura, la presión y los materiales involucrados, y está determinado por la energía libre mínima . En equilibrio, la energía libre de Gibbs de la reacción debe ser cero. La dependencia de la presión se puede explicar con el principio de Le Chatelier . Por ejemplo, un aumento de la presión debido a la disminución del volumen hace que la reacción se desplace hacia el lado con menos moles de gas. [16]
El rendimiento de la reacción se estabiliza en el equilibrio, pero se puede aumentar eliminando el producto de la mezcla de reacción o modificar aumentando la temperatura o la presión. Un cambio en las concentraciones de los reactivos no afecta la constante de equilibrio, pero sí la posición de equilibrio.
Las reacciones químicas están determinadas por las leyes de la termodinámica . Las reacciones pueden proceder por sí mismas si son exergónicas , es decir, si liberan energía libre. El cambio de energía libre asociado a la reacción se compone de los cambios de dos magnitudes termodinámicas diferentes, la entalpía y la entropía : [17]
Las reacciones pueden ser exotérmicas , donde Δ H es negativo y se libera energía. Ejemplos típicos de reacciones exotérmicas son la combustión , la precipitación y la cristalización , en las que se forman sólidos ordenados a partir de fases gaseosas o líquidas desordenadas. Por el contrario, en las reacciones endotérmicas , se consume calor del entorno. Esto puede ocurrir al aumentar la entropía del sistema, a menudo a través de la formación de productos de reacción gaseosos o disueltos, que tienen una entropía más alta. Dado que el término de entropía en el cambio de energía libre aumenta con la temperatura, muchas reacciones endotérmicas tienen lugar preferiblemente a altas temperaturas. Por el contrario, muchas reacciones exotérmicas como la cristalización ocurren preferiblemente a temperaturas más bajas. Un cambio de temperatura a veces puede invertir el signo de la entalpía de una reacción, como en el caso de la reducción del dióxido de molibdeno con monóxido de carbono :
Esta reacción para formar dióxido de carbono y molibdeno es endotérmica a bajas temperaturas y se vuelve menos endotérmica a medida que aumenta la temperatura. [18] Δ H ° es cero a1855 K , y la reacción se vuelve exotérmica por encima de esa temperatura.
Los cambios de temperatura también pueden invertir la tendencia direccional de una reacción. Por ejemplo, la reacción de desplazamiento del gas de agua
es favorecida por las bajas temperaturas, pero su inversa es favorecida por las altas temperaturas. La tendencia al cambio de dirección de la reacción ocurre en1100 K . [18]
Las reacciones también pueden caracterizarse por su variación de energía interna , que tiene en cuenta los cambios en la entropía, el volumen y los potenciales químicos . Estos últimos dependen, entre otras cosas, de las actividades de las sustancias involucradas. [19]
La velocidad a la que se producen las reacciones se estudia mediante la cinética de reacciones . La velocidad depende de varios parámetros, como:
Existen varias teorías que permiten calcular las velocidades de reacción a nivel molecular. Este campo se denomina dinámica de reacciones. La velocidad v de una reacción de primer orden , que podría ser la desintegración de una sustancia A, viene dada por:
Su integración da como resultado:
Aquí k es la constante de velocidad de primer orden, con dimensión 1/tiempo, [A]( t ) es la concentración en un tiempo t y [A] 0 es la concentración inicial. La velocidad de una reacción de primer orden depende únicamente de la concentración y de las propiedades de la sustancia involucrada, y la reacción en sí misma puede describirse con una vida media característica . Se necesita más de una constante de tiempo para describir reacciones de orden superior. La dependencia de la temperatura de la constante de velocidad generalmente sigue la ecuación de Arrhenius :
donde E a es la energía de activación y k B es la constante de Boltzmann . Uno de los modelos más simples de velocidad de reacción es la teoría de colisiones . Los modelos más realistas se adaptan a un problema específico e incluyen la teoría del estado de transición , el cálculo de la superficie de energía potencial , la teoría de Marcus y la teoría de Rice–Ramsperger–Kassel–Marcus (RRKM) . [20]
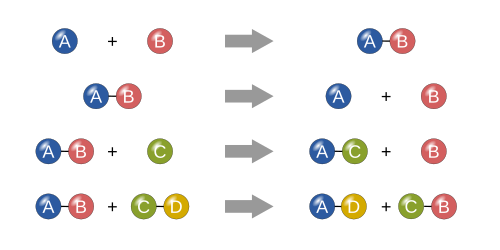
En una reacción de síntesis, dos o más sustancias simples se combinan para formar una sustancia más compleja. Estas reacciones tienen la forma general:
Otra forma de identificar una reacción de síntesis es la presencia de dos o más reactivos que dan lugar a un producto. Un ejemplo de reacción de síntesis es la combinación de hierro y azufre para formar sulfuro de hierro (II) :
Otro ejemplo es el simple gas hidrógeno combinado con simple gas oxígeno para producir una sustancia más compleja, como el agua. [21]
Una reacción de descomposición es cuando una sustancia más compleja se descompone en sus partes más simples. Por lo tanto, es lo opuesto a una reacción de síntesis y se puede escribir como [21]
Un ejemplo de una reacción de descomposición es la electrólisis del agua para producir gas oxígeno e hidrógeno :
En una reacción de desplazamiento simple , un solo elemento no combinado reemplaza a otro en un compuesto; en otras palabras, un elemento intercambia lugares con otro elemento en un compuesto [21]. Estas reacciones vienen en la forma general de:
Un ejemplo de una reacción de desplazamiento simple es cuando el magnesio reemplaza al hidrógeno en el agua para producir hidróxido de magnesio sólido y gas hidrógeno:
En una reacción de doble desplazamiento , los aniones y cationes de dos compuestos intercambian sus posiciones y forman dos compuestos completamente diferentes. Estas reacciones tienen la forma general: [21]
Por ejemplo, cuando el cloruro de bario (BaCl 2 ) y el sulfato de magnesio (MgSO 4 ) reaccionan, el anión SO 4 2− cambia de lugar con el anión 2Cl − , dando los compuestos BaSO 4 y MgCl 2 .
Otro ejemplo de una reacción de doble desplazamiento es la reacción del nitrato de plomo (II) con yoduro de potasio para formar yoduro de plomo (II) y nitrato de potasio :
Según el Principio de Le Chatelier , las reacciones pueden proceder en dirección directa o inversa hasta que finalicen o alcancen el equilibrio . [22]
Las reacciones que se desarrollan en dirección directa (de izquierda a derecha) para acercarse al equilibrio se denominan a menudo reacciones espontáneas , es decir, son negativas, lo que significa que si ocurren a temperatura y presión constantes, disminuyen la energía libre de Gibbs de la reacción. Requieren menos energía para desarrollarse en la dirección directa. [23] Las reacciones suelen escribirse como reacciones directas en la dirección en la que son espontáneas. Ejemplos:
Las reacciones que se desarrollan en dirección inversa para acercarse al equilibrio se denominan a menudo reacciones no espontáneas , es decir, son positivas, lo que significa que si ocurren a temperatura y presión constantes, aumentan la energía libre de Gibbs de la reacción. Requieren un aporte de energía para continuar en dirección directa. [23] [24] Algunos ejemplos incluyen:
En una reacción de combustión , un elemento o compuesto reacciona con un oxidante, generalmente oxígeno , y a menudo produce energía en forma de calor o luz . Las reacciones de combustión con frecuencia involucran un hidrocarburo . Por ejemplo, la combustión de 1 mol (114 g) de octano en oxígeno
libera 5500 kJ. Una reacción de combustión también puede resultar de la reacción del carbono , magnesio o azufre con el oxígeno. [27]


Las reacciones redox pueden entenderse en términos de la transferencia de electrones de una especie involucrada ( agente reductor ) a otra ( agente oxidante ). En este proceso, la primera especie se oxida y la segunda se reduce . Aunque son suficientes para muchos propósitos, estas descripciones no son precisamente correctas. La oxidación se define mejor como un aumento en el estado de oxidación de los átomos y la reducción como una disminución del estado de oxidación. En la práctica, la transferencia de electrones siempre cambiará el estado de oxidación, pero hay muchas reacciones que se clasifican como "redox" aunque no ocurra transferencia de electrones (como las que involucran enlaces covalentes ). [28] [29]
En la siguiente reacción redox, el peligroso metal sodio reacciona con gas cloro tóxico para formar el compuesto iónico cloruro de sodio o sal de mesa común:
En la reacción, el sodio metálico pasa de un estado de oxidación de 0 (elemento puro) a +1: es decir, el sodio pierde un electrón y se dice que se ha oxidado. Por otro lado, el cloro gaseoso pasa de una oxidación de 0 (también elemento puro) a −1: el cloro gana un electrón y se dice que se ha reducido. Como el cloro es el que se reduce, se considera que es el aceptor de electrones, o en otras palabras, induce la oxidación en el sodio; por lo tanto, el cloro gaseoso se considera el agente oxidante. Por el contrario, el sodio se oxida o es el donante de electrones, y por lo tanto induce una reducción en las otras especies y se considera el agente reductor .
Se puede predecir cuál de los reactivos involucrados sería un agente reductor u oxidante a partir de la electronegatividad de sus elementos. Los elementos con electronegatividades bajas, como la mayoría de los metales, donan electrones fácilmente y se oxidan: son agentes reductores. Por el contrario, muchos óxidos o iones con altos números de oxidación de sus átomos no oxigenados, como el H
2Oh
2, MnO−
4, Cromo
3, Cr
2Oh2−
7, o OsO4, pueden ganar uno o dos electrones extra y son agentes oxidantes fuertes.
En el caso de algunos elementos del grupo principal, el número de electrones donados o aceptados en una reacción redox se puede predecir a partir de la configuración electrónica del elemento reactivo. Los elementos intentan alcanzar la configuración de gas noble de baja energía y, por lo tanto, los metales alcalinos y los halógenos donarán y aceptarán un electrón, respectivamente. Los gases nobles en sí mismos son químicamente inactivos. [30]
La reacción redox general se puede equilibrar combinando las semireacciones de oxidación y reducción multiplicadas por coeficientes tales que el número de electrones perdidos en la oxidación sea igual al número de electrones ganados en la reducción.
Una clase importante de reacciones redox son las reacciones electroquímicas electrolíticas , en las que los electrones de la fuente de alimentación en el electrodo negativo se utilizan como agente reductor y la extracción de electrones en el electrodo positivo como agente oxidante. Estas reacciones son particularmente importantes para la producción de elementos químicos, como el cloro [31] o el aluminio . El proceso inverso, en el que los electrones se liberan en reacciones redox y la energía química se convierte en energía eléctrica, es posible y se utiliza en baterías .
En las reacciones de complexación, varios ligandos reaccionan con un átomo de metal para formar un complejo de coordinación . Esto se logra proporcionando pares solitarios del ligando en orbitales vacíos del átomo de metal y formando enlaces dipolares . Los ligandos son bases de Lewis , pueden ser tanto iones como moléculas neutras, como monóxido de carbono, amoniaco o agua. El número de ligandos que reaccionan con un átomo central de metal se puede encontrar utilizando la regla de los 18 electrones , diciendo que las capas de valencia de un metal de transición acomodarán colectivamente 18 electrones , mientras que la simetría del complejo resultante se puede predecir con la teoría del campo cristalino y la teoría del campo de ligandos . Las reacciones de complexación también incluyen el intercambio de ligandos , en el que uno o más ligandos son reemplazados por otro, y los procesos redox que cambian el estado de oxidación del átomo central de metal. [32]
En la teoría ácido-base de Brønsted-Lowry , una reacción ácido-base implica una transferencia de protones (H + ) de una especie (el ácido ) a otra (la base ). Cuando se elimina un protón de un ácido, la especie resultante se denomina base conjugada de ese ácido . Cuando una base acepta el protón, la especie resultante se denomina ácido conjugado de esa base . [33] En otras palabras, los ácidos actúan como donadores de protones y las bases actúan como aceptores de protones de acuerdo con la siguiente ecuación:
La reacción inversa es posible y, por lo tanto, el ácido/base y la base/ácido conjugado siempre están en equilibrio. El equilibrio está determinado por las constantes de disociación de ácido y base ( K a y K b ) de las sustancias involucradas. Un caso especial de la reacción ácido-base es la neutralización , en la que un ácido y una base, tomados en cantidades exactamente iguales, forman una sal neutra .
Las reacciones ácido-base pueden tener distintas definiciones según el concepto ácido-base empleado. Algunas de las más comunes son:

La precipitación es la formación de un sólido en una solución o dentro de otro sólido durante una reacción química. Generalmente ocurre cuando la concentración de iones disueltos excede el límite de solubilidad [34] y forma una sal insoluble. Este proceso puede ser asistido por la adición de un agente precipitante o por la eliminación del solvente. La precipitación rápida da como resultado un residuo amorfo o microcristalino y un proceso lento puede producir monocristales . Estos últimos también pueden obtenerse por recristalización a partir de sales microcristalinas. [35]
Las reacciones pueden tener lugar entre dos sólidos. Sin embargo, debido a las velocidades de difusión relativamente pequeñas en los sólidos, las reacciones químicas correspondientes son muy lentas en comparación con las reacciones en fase líquida y gaseosa. Se aceleran aumentando la temperatura de reacción y dividiendo finamente el reactivo para aumentar el área de superficie de contacto. [36]
La reacción puede tener lugar en la interfaz sólido-gas, superficies a muy baja presión como el ultra alto vacío . Mediante microscopía de efecto túnel de barrido , es posible observar reacciones en la interfaz sólido-gas en el espacio real, si la escala de tiempo de la reacción está en el rango correcto. [37] [38] Las reacciones en la interfaz sólido-gas están relacionadas en algunos casos con la catálisis.
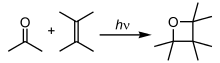
En las reacciones fotoquímicas , los átomos y las moléculas absorben energía ( fotones ) de la luz de iluminación y la convierten en un estado excitado . Luego pueden liberar esta energía rompiendo enlaces químicos, produciendo así radicales. Las reacciones fotoquímicas incluyen reacciones de hidrógeno-oxígeno, polimerización radical , reacciones en cadena y reacciones de reordenamiento . [39]
Muchos procesos importantes involucran la fotoquímica. El principal ejemplo es la fotosíntesis , en la que la mayoría de las plantas utilizan la energía solar para convertir el dióxido de carbono y el agua en glucosa , eliminando el oxígeno como subproducto. Los humanos dependen de la fotoquímica para la formación de vitamina D, y la visión se inicia mediante una reacción fotoquímica de la rodopsina . [15] En las luciérnagas , una enzima en el abdomen cataliza una reacción que da como resultado la bioluminiscencia . [40] Muchas reacciones fotoquímicas significativas, como la formación de ozono, ocurren en la atmósfera de la Tierra y constituyen la química atmosférica .


En la catálisis , la reacción no se produce directamente, sino a través de una reacción con una tercera sustancia conocida como catalizador . Aunque el catalizador participa en la reacción, formando enlaces débiles con reactivos o intermediarios, vuelve a su estado original al final de la reacción y, por lo tanto, no se consume. Sin embargo, puede inhibirse, desactivarse o destruirse mediante procesos secundarios. Los catalizadores se pueden utilizar en una fase diferente ( heterogéneos ) o en la misma fase ( homogéneos ) que los reactivos. En la catálisis heterogénea, los procesos secundarios típicos incluyen la coquización , donde el catalizador queda cubierto por productos secundarios poliméricos . Además, los catalizadores heterogéneos pueden disolverse en la solución en un sistema sólido-líquido o evaporarse en un sistema sólido-gas. Los catalizadores solo pueden acelerar la reacción: los productos químicos que la ralentizan se denominan inhibidores. [41] [42] Las sustancias que aumentan la actividad de los catalizadores se denominan promotores y las sustancias que desactivan los catalizadores se denominan venenos catalíticos. Con un catalizador se puede llevar a cabo una reacción cinéticamente inhibida por una energía de activación elevada, evitando esta energía de activación.
Los catalizadores heterogéneos suelen ser sólidos, en polvo para maximizar su área superficial. De particular importancia en la catálisis heterogénea son los metales del grupo del platino y otros metales de transición, que se utilizan en hidrogenaciones , reformado catalítico y en la síntesis de productos químicos básicos como el ácido nítrico y el amoníaco . Los ácidos son un ejemplo de catalizador homogéneo, aumentan la nucleofilia de los carbonilos , lo que permite una reacción que de otro modo no se produciría con electrófilos. La ventaja de los catalizadores homogéneos es la facilidad de mezclarlos con los reactivos, pero también pueden ser difíciles de separar de los productos. Por lo tanto, los catalizadores heterogéneos son los preferidos en muchos procesos industriales. [43]
En química orgánica , además de las reacciones de oxidación, reducción o ácido-base, pueden tener lugar otras reacciones que implican enlaces covalentes entre átomos de carbono o carbono y heteroátomos (como oxígeno, nitrógeno, halógenos , etc.). Muchas reacciones específicas en química orgánica son reacciones con nombre designado en honor a sus descubridores.
Una de las reacciones más importantes a nivel industrial es el craqueo de hidrocarburos pesados en las refinerías de petróleo para crear moléculas más pequeñas y simples. Este proceso se utiliza para fabricar gasolina . Los tipos específicos de reacciones orgánicas pueden agruparse por sus mecanismos de reacción (en particular, sustitución, adición y eliminación) o por los tipos de productos que producen (por ejemplo, metilación , polimerización y halogenación ).
En una reacción de sustitución , un grupo funcional en un compuesto químico particular es reemplazado por otro grupo. [44] Estas reacciones se pueden distinguir por el tipo de especie sustitutiva en una sustitución nucleofílica , electrófila o radical .
En el primer tipo, un nucleófilo , un átomo o molécula con un exceso de electrones y, por lo tanto, una carga negativa o carga parcial , reemplaza a otro átomo o parte de la molécula "sustrato". El par de electrones del nucleófilo ataca al sustrato formando un nuevo enlace, mientras que el grupo saliente se va con un par de electrones. El nucleófilo puede ser eléctricamente neutro o tener carga negativa, mientras que el sustrato suele ser neutro o tener carga positiva. Ejemplos de nucleófilos son el ion hidróxido , los alcóxidos , las aminas y los haluros . Este tipo de reacción se encuentra principalmente en hidrocarburos alifáticos y rara vez en hidrocarburos aromáticos . Estos últimos tienen una alta densidad electrónica y entran en sustitución aromática nucleofílica solo con grupos atractores de electrones muy fuertes . La sustitución nucleofílica puede tener lugar mediante dos mecanismos diferentes, SN 1 y SN 2 . En sus nombres, S significa sustitución, N nucleofílica y el número representa el orden cinético de la reacción, unimolecular o bimolecular. [45]
La reacción S N 1 se desarrolla en dos pasos. En primer lugar, se elimina el grupo saliente creando un carbocatión . A esto le sigue una reacción rápida con el nucleófilo. [46]
En los mecanismos S N 2 , el nucleófilo forma un estado de transición con la molécula atacada, y sólo entonces se escinde el grupo saliente. Estos dos mecanismos difieren en la estereoquímica de los productos. S N 1 conduce a la adición no estereoespecífica y no da como resultado un centro quiral, sino más bien un conjunto de isómeros geométricos ( cis/trans ). Por el contrario, en el mecanismo S N 2 se observa una inversión ( inversión de Walden ) de la estereoquímica previamente existente . [47]
La sustitución electrofílica es la contraparte de la sustitución nucleofílica en la que el átomo o molécula atacante, un electrófilo , tiene baja densidad electrónica y, por lo tanto, una carga positiva. Los electrófilos típicos son el átomo de carbono de los grupos carbonilo , los carbocationes o los cationes de azufre o nitronio . Esta reacción tiene lugar casi exclusivamente en hidrocarburos aromáticos, donde se denomina sustitución aromática electrofílica . El ataque electrófilo da como resultado el llamado complejo σ, un estado de transición en el que se elimina el sistema aromático. Luego, el grupo saliente, generalmente un protón, se separa y se restaura la aromaticidad. Una alternativa a la sustitución aromática es la sustitución alifática electrofílica. Es similar a la sustitución alifática nucleofílica y también tiene dos tipos principales, SE 1 y SE 2 [ 48]

En el tercer tipo de reacción de sustitución, la sustitución radical, la partícula atacante es un radical . [44] Este proceso suele adoptar la forma de una reacción en cadena , por ejemplo en la reacción de alcanos con halógenos. En el primer paso, la luz o el calor desintegran las moléculas que contienen halógeno produciendo radicales. Luego, la reacción se desarrolla como una avalancha hasta que dos radicales se encuentran y se recombinan. [49]
La adición y su contraparte, la eliminación , son reacciones que cambian el número de sustituyentes en el átomo de carbono y forman o escinden enlaces múltiples . Los enlaces dobles y triples se pueden producir eliminando un grupo saliente adecuado. De manera similar a la sustitución nucleofílica, existen varios mecanismos de reacción posibles que reciben su nombre según el orden de reacción respectivo. En el mecanismo E1, el grupo saliente se expulsa primero, formando un carbocatión. El siguiente paso, la formación del doble enlace, tiene lugar con la eliminación de un protón ( desprotonación ). El orden de salida se invierte en el mecanismo E1cb, es decir, el protón se escinde primero. Este mecanismo requiere la participación de una base. [50] Debido a las condiciones similares, ambas reacciones en la eliminación E1 o E1cb siempre compiten con la sustitución S N 1. [51]

El mecanismo E2 también requiere una base, pero en este caso el ataque de la base y la eliminación del grupo saliente se producen simultáneamente y no producen ningún intermediario iónico. A diferencia de las eliminaciones E1, en el mecanismo E2 son posibles diferentes configuraciones estereoquímicas para el producto de reacción, porque el ataque de la base se produce preferentemente en la posición anti con respecto al grupo saliente. Debido a las condiciones y reactivos similares, la eliminación E2 siempre compite con la sustitución S N 2. [52]

La contraparte de la eliminación es una adición donde los enlaces dobles o triples se convierten en enlaces simples. De manera similar a las reacciones de sustitución, existen varios tipos de adiciones que se distinguen por el tipo de partícula atacante. Por ejemplo, en la adición electrofílica de bromuro de hidrógeno , un electrófilo (protón) ataca el doble enlace formando un carbocatión , que luego reacciona con el nucleófilo (bromo). El carbocatión se puede formar en cualquier lado del doble enlace dependiendo de los grupos unidos a sus extremos, y la configuración preferida se puede predecir con la regla de Markovnikov . [53] Esta regla establece que "En la adición heterolítica de una molécula polar a un alqueno o alquino, el átomo (o parte) más electronegativo (nucleófilo) de la molécula polar se une al átomo de carbono que tiene el menor número de átomos de hidrógeno". [54]
Si la adición de un grupo funcional tiene lugar en el átomo de carbono menos sustituido del doble enlace, entonces la sustitución electrofílica con ácidos no es posible. En este caso, se debe utilizar la reacción de hidroboración-oxidación , en la que en el primer paso, el átomo de boro actúa como electrófilo y se añade al átomo de carbono menos sustituido. En el segundo paso, el hidroperóxido nucleofílico o el anión halógeno atacan al átomo de boro. [55]
Mientras que la adición a los alquenos y alquinos ricos en electrones es principalmente electrofílica, la adición nucleofílica juega un papel importante en los enlaces múltiples carbono-heteroátomo, y especialmente en su representante más importante, el grupo carbonilo. Este proceso a menudo se asocia con la eliminación, de modo que después de la reacción el grupo carbonilo está presente nuevamente. Por lo tanto, se denomina reacción de adición-eliminación y puede ocurrir en derivados de ácidos carboxílicos como cloruros, ésteres o anhídridos. Esta reacción a menudo es catalizada por ácidos o bases, donde los ácidos aumentan la electrofilicidad del grupo carbonilo al unirse al átomo de oxígeno, mientras que las bases mejoran la nucleofilicidad del nucleófilo atacante. [56]
La adición nucleofílica de un carbanión u otro nucleófilo al doble enlace de un compuesto carbonílico alfa, beta-insaturado puede realizarse mediante la reacción de Michael , que pertenece a la clase más amplia de adiciones conjugadas . Este es uno de los métodos más útiles para la formación suave de enlaces C–C. [57] [58] [59]
Algunas adiciones que no se pueden realizar con nucleófilos y electrófilos se pueden realizar con radicales libres. Al igual que con la sustitución por radicales libres, la adición de radicales se produce como una reacción en cadena, y estas reacciones son la base de la polimerización por radicales libres . [60]

En una reacción de reordenamiento , el esqueleto carbonado de una molécula se reordena para dar un isómero estructural de la molécula original. Estas incluyen reacciones de desplazamiento de hidruro como el reordenamiento de Wagner-Meerwein , donde un grupo hidrógeno , alquilo o arilo migra de un carbono a un carbono vecino. La mayoría de los reordenamientos están asociados con la ruptura y formación de nuevos enlaces carbono-carbono. Otros ejemplos son las reacciones sigmatrópicas como el reordenamiento de Cope . [61]
Los reordenamientos cíclicos incluyen cicloadiciones y, de manera más general, reacciones pericíclicas , en las que dos o más moléculas que contienen un doble enlace forman una molécula cíclica. Un ejemplo importante de reacción de cicloadición es la reacción de Diels-Alder (la llamada cicloadición [4+2]) entre un dieno conjugado y un alqueno sustituido para formar un sistema de ciclohexeno sustituido. [62]
El que se produzca una determinada cicloadición depende de los orbitales electrónicos de las especies participantes, ya que solo los orbitales con el mismo signo de función de onda se superpondrán e interactuarán de forma constructiva para formar nuevos enlaces. La cicloadición suele estar asistida por luz o calor. Estas perturbaciones dan como resultado una disposición diferente de los electrones en el estado excitado de las moléculas involucradas y, por lo tanto, diferentes efectos. Por ejemplo, las reacciones [4+2] de Diels-Alder pueden ser asistidas por calor, mientras que la cicloadición [2+2] es inducida selectivamente por la luz. [63] Debido al carácter orbital, el potencial para desarrollar productos estereoisoméricos tras la cicloadición es limitado, como se describe en las reglas de Woodward-Hoffmann . [64]
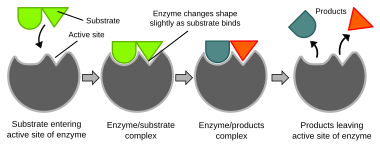
Las reacciones bioquímicas están controladas principalmente por proteínas complejas llamadas enzimas , que suelen estar especializadas para catalizar una única reacción específica. La reacción tiene lugar en el sitio activo , una pequeña parte de la enzima que normalmente se encuentra en una hendidura o bolsillo revestido por residuos de aminoácidos , y el resto de la enzima se utiliza principalmente para la estabilización. La acción catalítica de las enzimas depende de varios mecanismos, entre ellos la forma molecular ("ajuste inducido"), la tensión de enlace, la proximidad y orientación de las moléculas en relación con la enzima, la donación o retirada de protones (catálisis ácido/base), las interacciones electrostáticas y muchos otros. [65]
Las reacciones bioquímicas que ocurren en los organismos vivos se conocen colectivamente como metabolismo . Entre sus mecanismos más importantes se encuentra el anabolismo , en el que diferentes procesos controlados por ADN y enzimas dan como resultado la producción de moléculas grandes como proteínas y carbohidratos a partir de unidades más pequeñas. [66] La bioenergética estudia las fuentes de energía para tales reacciones. Las fuentes de energía importantes son la glucosa y el oxígeno , que pueden ser producidos por las plantas a través de la fotosíntesis o asimilados de los alimentos y el aire, respectivamente. Todos los organismos utilizan esta energía para producir trifosfato de adenosina (ATP), que luego puede usarse para energizar otras reacciones. La descomposición de material orgánico por hongos , bacterias y otros microorganismos también está dentro del alcance de la bioquímica .

Las reacciones químicas son fundamentales para la ingeniería química , donde se utilizan para la síntesis de nuevos compuestos a partir de materias primas naturales como el petróleo , los minerales y el oxígeno del aire. Es esencial hacer que la reacción sea lo más eficiente posible, maximizando el rendimiento y minimizando el número de reactivos, los insumos de energía y los desechos. Los catalizadores son especialmente útiles para reducir la energía requerida para la reacción y aumentar su velocidad de reacción . [67] [68]
Algunas reacciones específicas tienen aplicaciones específicas. Por ejemplo, la reacción de la termita se utiliza para generar luz y calor en pirotecnia y soldadura . Aunque es menos controlable que la soldadura con oxicombustible más convencional , la soldadura por arco y la soldadura por chispa , requiere mucho menos equipo y todavía se utiliza para reparar rieles, especialmente en áreas remotas. [69]
Los mecanismos de control de las reacciones químicas dependen en gran medida de la velocidad de reacción. Los procesos relativamente lentos se pueden analizar in situ para determinar las concentraciones e identidades de los componentes individuales. Las herramientas importantes del análisis en tiempo real son la medición del pH y el análisis de los espectros de absorción óptica (color) y emisión. Un método menos accesible pero bastante eficiente es la introducción de un isótopo radiactivo en la reacción y el control de cómo cambia con el tiempo y hacia dónde se mueve; este método se utiliza a menudo para analizar la redistribución de sustancias en el cuerpo humano. Las reacciones más rápidas se estudian habitualmente con espectroscopia láser ultrarrápida , donde la utilización de láseres de femtosegundos permite controlar estados de transición de corta duración en un tiempo reducido a unos pocos femtosegundos. [70]
{{cite book}}: CS1 maint: multiple names: authors list (link)