El estaño es un elemento químico de color plateado , de símbolo Sn (del latín stannum ) y número atómico 50. Es un metal blando que se puede cortar con poca fuerza [10] y una barra de estaño se puede doblar con la mano sin apenas esfuerzo. Cuando se dobla, se puede oír el llamado " grito del estaño ", como resultado de la macla en los cristales de estaño [11] .
El estaño es un metal de post-transición del grupo 14 de la tabla periódica de elementos. Se obtiene principalmente del mineral casiterita , que contiene óxido estánnico , SnO
2El estaño muestra una similitud química con sus dos vecinos del grupo 14, el germanio y el plomo , y tiene dos estados de oxidación principales , +2 y el ligeramente más estable +4. El estaño es el 49.º elemento más abundante en la Tierra, ya que constituye el 0,00022 % de su corteza y, con 10 isótopos estables, tiene el mayor número de isótopos estables en la tabla periódica, debido a su número mágico de protones.
Tiene dos alótropos principales : a temperatura ambiente, el alótropo estable es el β-estaño, un metal maleable de color blanco plateado ; a bajas temperaturas, es el α-estaño gris, menos denso, que tiene una estructura cúbica de diamante . El estaño metálico no se oxida fácilmente en el aire ni en el agua.
La primera aleación de estaño utilizada a gran escala fue el bronce , hecho de 1 ⁄ 8 de estaño y 7 ⁄ 8 de cobre (12,5% y 87,5% respectivamente), desde tan temprano como 3000 a. C. Después de 600 a. C., se produjo estaño metálico puro. El peltre , que es una aleación de 85-90% de estaño y el resto comúnmente consiste en cobre , antimonio , bismuto y, a veces, plomo y plata, se ha utilizado para cubiertos desde la Edad del Bronce . En los tiempos modernos, el estaño se utiliza en muchas aleaciones, más notablemente en soldaduras blandas de estaño-plomo , que generalmente tienen un 60% o más de estaño, y en la fabricación de películas transparentes y conductoras de electricidad de óxido de indio y estaño en aplicaciones optoelectrónicas . Otra gran aplicación es el estañado resistente a la corrosión del acero . Debido a la baja toxicidad del estaño inorgánico, el acero estañado se usa ampliamente para envases de alimentos como " latas ". Algunos compuestos organoestánnicos pueden ser extremadamente tóxicos.

El estaño es un metal blanco plateado , blando, maleable , dúctil y altamente cristalino . Cuando se dobla una barra de estaño, se puede oír un sonido crepitante conocido como " grito de estaño " proveniente del maclado de los cristales. [11] Esta característica la comparten el indio , el cadmio , el zinc y el mercurio en su estado sólido. El estaño se funde a unos 232 °C (450 °F), la temperatura más baja del grupo 14, y hierve a 2602 °C (4716 °F), la segunda temperatura más baja (por delante del plomo ) en su grupo. El punto de fusión se reduce aún más a 177,3 °C (351,1 °F) para partículas de 11 nm. [12] [13]
El β-estaño, también llamado estaño blanco , es el alótropo (forma estructural) del estaño elemental que es estable a temperatura ambiente y por encima de ella. Es metálico y maleable, y tiene una estructura cristalina tetragonal centrada en el cuerpo . El α-estaño, o estaño gris , es la forma no metálica. Es estable por debajo de 13,2 °C (55,8 °F) y es frágil . El α-estaño tiene una estructura cristalina cúbica de diamante , al igual que el diamante y el silicio . El α-estaño no tiene propiedades metálicas porque sus átomos forman una estructura covalente en la que los electrones no pueden moverse libremente. El α-estaño es un material en polvo de color gris opaco sin usos comunes aparte de las aplicaciones especializadas en semiconductores . [11] El γ-estaño y el σ-estaño existen a temperaturas superiores a 161 °C (322 °F) y presiones superiores a varios GPa . [14]
En condiciones de frío, el β-estaño tiende a transformarse espontáneamente en α-estaño, un fenómeno conocido como " plaga del estaño " o "enfermedad del estaño". [15] Algunas fuentes no verificables también dicen que, durante la campaña rusa de Napoleón de 1812, las temperaturas se volvieron tan frías que los botones de estaño en los uniformes de los soldados se desintegraron con el tiempo, contribuyendo a la derrota de la Grande Armée , [16] una leyenda persistente. [17] [18] [19]
La temperatura de transformación α-β es de 13,2 °C (55,8 °F), pero las impurezas (por ejemplo, Al, Zn, etc.) la reducen bastante por debajo de 0 °C (32 °F). Con la adición de antimonio o bismuto, la transformación podría no ocurrir en absoluto, lo que aumenta la durabilidad. [20]
Los grados comerciales de estaño (contenido de estaño del 99,8 %) resisten la transformación debido al efecto inhibidor de pequeñas cantidades de bismuto, antimonio, plomo y plata presentes como impurezas. Los elementos de aleación como el cobre, el antimonio, el bismuto, el cadmio y la plata aumentan la dureza del estaño. [21] El estaño forma fácilmente fases intermetálicas duras y quebradizas que normalmente son indeseables. No se mezcla en una solución con la mayoría de los metales y elementos, por lo que el estaño no tiene mucha solubilidad sólida. El estaño se mezcla bien con bismuto , galio , plomo , talio y zinc , formando sistemas eutécticos simples. [20]
El estaño se convierte en un superconductor por debajo de 3,72 K [22] y fue uno de los primeros superconductores en ser estudiado. [23] El efecto Meissner , una de las características características de los superconductores, se descubrió por primera vez en cristales superconductores de estaño. [23]
El estaño resiste la corrosión del agua , pero puede ser corroído por ácidos y álcalis . El estaño puede ser muy pulido y se utiliza como capa protectora para otros metales. [11] Cuando se calienta al aire se oxida lentamente para formar una fina capa de pasivación de óxido estánnico ( SnO 2 ) que inhibe una mayor oxidación. [24] [25]
El estaño tiene diez isótopos estables , el mayor número de cualquier elemento. Sus números másicos son 112, 114, 115, 116, 117, 118, 119, 120, 122 y 124. El estaño-120 constituye casi un tercio de todo el estaño. El estaño-118 y el estaño-116 también son comunes. El estaño-115 es el isótopo estable menos común. [ cita requerida ] Los isótopos con números másicos pares no tienen espín nuclear , mientras que aquellos con números másicos impares tienen un espín nuclear de 1/2. Se cree que el estaño tiene una multitud tan grande de isótopos estables debido a que el número atómico del estaño es 50, que es un " número mágico " en física nuclear. [ cita requerida ]
El estaño es uno de los elementos más fáciles de detectar y analizar mediante espectroscopia de RMN , que se basa en el peso molecular y sus desplazamientos químicos se referencian frente al tetrametilestaño ( SnMe
4). [b] [26]
De los isótopos estables, el estaño-115 tiene una sección transversal de captura de neutrones alta para neutrones rápidos, a 30 barns . El estaño-117 tiene una sección transversal de 2,3 barns, un orden de magnitud más pequeño, mientras que el estaño-119 tiene una sección transversal ligeramente más pequeña de 2,2 barns. [27] Antes de que estas secciones transversales fueran bien conocidas, se propuso utilizar soldadura de estaño-plomo como refrigerante para reactores rápidos debido a su bajo punto de fusión. Los estudios actuales son para refrigerantes de reactores de plomo o plomo-bismuto porque ambos metales pesados son casi transparentes a los neutrones rápidos, con secciones transversales de captura muy bajas. [28] Para utilizar un refrigerante de estaño o estaño-plomo, el estaño primero tendría que pasar por una separación isotópica para eliminar los isótopos con número de masa impar . Combinados, estos tres isótopos constituyen aproximadamente el 17% del estaño natural, pero representan casi la totalidad de la sección transversal de captura. De los siete isótopos restantes, el estaño-112 tiene una sección eficaz de captura de 1 barn. Los otros seis isótopos que forman el 82,7% del estaño natural tienen secciones eficaces de captura de 0,3 barn o menos, lo que los hace efectivamente transparentes a los neutrones. [27]
El estaño tiene 31 isótopos inestables, cuyo número másico oscila entre 99 y 139. Los isótopos inestables del estaño tienen vidas medias inferiores a un año, excepto el estaño-126 , que tiene una vida media de unos 230.000 años. El estaño-100 y el estaño-132 son dos de los pocos nucleidos con un núcleo " doblemente mágico " que, a pesar de ser inestables, ya que tienen proporciones neutrón-protón muy desiguales , son los puntos finales más allá de los cuales los isótopos de estaño más ligeros que el estaño-100 y más pesados que el estaño-132 son mucho menos estables. [29] Se han identificado otros 30 isómeros metaestables para los isótopos de estaño entre 111 y 131, siendo el más estable el estaño-121m, con una vida media de 43,9 años. [30]
Las diferencias relativas en las abundancias de los isótopos estables del estaño se pueden explicar por cómo se forman durante la nucleosíntesis estelar . El estaño-116 a través del estaño-120, junto con el estaño-122, se forman en el proceso s (captura lenta de neutrones) en la mayoría de las estrellas , lo que los lleva a ser los isótopos de estaño más comunes, mientras que el estaño-124 solo se forma en el proceso r (captura rápida de neutrones) en supernovas y fusiones de estrellas de neutrones . Los isótopos de estaño 115, 117 a 120 y 122 se producen a través del proceso s y del proceso r , [31] Los dos isótopos estables más ligeros, el estaño-112 y el estaño-114, no se pueden producir en cantidades significativas en los procesos s o r y se encuentran entre los núcleos p cuyos orígenes no se entienden bien. Algunas teorías sobre su formación incluyen la captura de protones y la fotodesintegración . El estaño-115 podría producirse parcialmente en el proceso s , tanto directamente como hijo del indio-115 de larga duración , y también a partir de la desintegración del indio-115 producido a través del proceso r . [31] [32]
La palabra tin es compartida por las lenguas germánicas y se remonta al protogermánico reconstruido * tin-om ; los cognados incluyen el alemán zinn , el sueco tenn y el holandés tin . No se encuentra en otras ramas del indoeuropeo , excepto por préstamos del germánico (por ejemplo, el irlandés tinne del inglés). [33] [34]
El nombre latino para el estaño, stannum , originalmente significaba una aleación de plata y plomo, y llegó a significar 'estaño' en el siglo IV [35] —la palabra latina anterior para ello era plumbum candidum , o "plomo blanco". Stannum aparentemente proviene de un stāgnum anterior (que significa la misma sustancia), [33] el origen de los términos romances y celtas para el estaño , como el francés étain , el español estaño , el italiano stagno y el irlandés stán . [33] [36] Se desconoce el origen de stannum / stāgnum ; puede ser preindoeuropeo . [ 37]
El Meyers Konversations-Lexikon sugiere, en cambio, que el estaño procedía del estaño de Cornualles , y es una prueba de que Cornualles en los primeros siglos d. C. era la principal fuente de estaño. [ cita requerida ]
.jpg/440px-Sword_bronze_age_(2nd_version).jpg)
La extracción y el uso del estaño se remontan a los inicios de la Edad del Bronce, alrededor del año 3000 a. C., cuando se observó que los objetos de cobre formados por minerales polimetálicos con diferentes contenidos metálicos tenían diferentes propiedades físicas. [38] Los primeros objetos de bronce tenían un contenido de estaño o arsénico de menos del 2 % y se cree que son el resultado de una aleación no intencionada debido al contenido de trazas de metal en el mineral de cobre. [39] La adición de un segundo metal al cobre aumenta su dureza, reduce la temperatura de fusión y mejora el proceso de fundición al producir una masa fundida más fluida que se enfría hasta convertirse en un metal más denso y menos esponjoso. [39] Esta fue una innovación importante que permitió las formas mucho más complejas fundidas en moldes cerrados de la Edad del Bronce. Los objetos de bronce arsenical aparecen por primera vez en Oriente Próximo, donde el arsénico se encuentra comúnmente con el mineral de cobre, pero los riesgos para la salud se comprendieron rápidamente y la búsqueda de fuentes de minerales de estaño mucho menos peligrosos comenzó a principios de la Edad del Bronce. [40] Esto creó la demanda del raro metal estaño y formó una red comercial que vinculó las fuentes distantes de estaño con los mercados de las culturas de la Edad del Bronce [41] .
Casiterita ( SnO
2), la forma de óxido del estaño, fue probablemente la fuente original del estaño. Otros minerales de estaño son sulfuros menos comunes como la estannita que requieren un proceso de fundición más complejo . La casiterita a menudo se acumula en canales aluviales como depósitos de placer porque es más dura, más pesada y más resistente químicamente que el granito que la acompaña . [39] La casiterita suele ser de color negro u oscuro, y estos depósitos se pueden ver fácilmente en las orillas de los ríos . Los depósitos aluviales ( de placer ) pueden haber sido recolectados y separados incidentalmente por métodos similares al lavado de oro . [42]
En la gran mayoría de sus compuestos, el estaño tiene el estado de oxidación II o IV. Los compuestos que contienen estaño bivalente se denominan estannosos, mientras que los que contienen estaño tetravalente se denominan estánnicos .
Los compuestos de haluro son conocidos para ambos estados de oxidación. Para Sn(IV), los cuatro haluros son bien conocidos: SnF 4 , SnCl 4 , SnBr 4 y SnI 4 . Los tres miembros más pesados son compuestos moleculares volátiles, mientras que el tetrafluoruro es polimérico. Los cuatro haluros también son conocidos para Sn(II): SnF 2 , SnCl
2, SnBr 2 y SnI 2 . Todos son sólidos poliméricos. De estos ocho compuestos, solo los yoduros están coloreados. [43]
El cloruro de estaño (II) (también conocido como cloruro estannoso) es el haluro de estaño comercial más importante. Para ilustrar las rutas hacia dichos compuestos, el cloro reacciona con el metal estaño para dar SnCl 4 , mientras que la reacción del ácido clorhídrico y el estaño produce SnCl
2y gas hidrógeno. Alternativamente, SnCl 4 y Sn se combinan para formar cloruro estannoso mediante un proceso llamado comproporción : [44]
El estaño puede formar muchos óxidos, sulfuros y otros derivados de calcogenuros . El dióxido de SnO
2(casiterita) se forma cuando el estaño se calienta en presencia de aire . [43] SnO
2es anfótero , lo que significa que se disuelve tanto en soluciones ácidas como básicas. [45] Estannatos con la estructura [ Sn(OH)
6] 2− , como K
2[ Sn(OH)
6], también se conocen, aunque el ácido estánnico libre H
2[ Sn(OH)
6] es desconocido. [ cita requerida ]
Los sulfuros de estaño existen en los estados de oxidación +2 y +4: sulfuro de estaño (II) y sulfuro de estaño (IV) ( oro mosaico ).

Stannane ( SnH) es un compuesto químico de la familia de los hidroxibutirato (SnH) que se encuentra en el genoma de la bacteria.
4), con estaño en el estado de oxidación +4, es inestable. Sin embargo, los hidruros de organoestaño son bien conocidos, por ejemplo, el hidruro de tributilestaño (Sn(C 4 H 9 ) 3 H). [11] Estos compuestos liberan radicales transitorios de tributilestaño , que son ejemplos raros de compuestos de estaño(III). [47]
Los compuestos organoestánnicos , a veces llamados estannanos, son compuestos químicos con enlaces estaño-carbono. [48] De los compuestos de estaño, los derivados orgánicos son los más útiles comercialmente. [49] Algunos compuestos organoestánnicos son altamente tóxicos y se han utilizado como biocidas . El primer compuesto organoestánnico del que se informó fue el diyoduro de dietilestaño ((C 2 H 5 ) 2 SnI 2 ), informado por Edward Frankland en 1849. [50]
La mayoría de los compuestos organoestánnicos son líquidos o sólidos incoloros, estables al aire y al agua. Adoptan una geometría tetraédrica. Los compuestos de tetraalquil y tetraarilestaño se pueden preparar utilizando reactivos de Grignard : [49]
Los alquilos-haluro mixtos, que son más comunes y más importantes comercialmente que los derivados tetraorgano, se preparan mediante reacciones de redistribución :
Los compuestos de organoestaño divalentes son poco comunes, aunque más comunes que los compuestos de organogermanio y organosilicio divalentes relacionados . La mayor estabilización de la que goza el Sn(II) se atribuye al " efecto de par inerte ". Los compuestos de organoestaño(II) incluyen tanto estannilenos (fórmula: R 2 Sn, como se ve para los carbenos singlete ) como distannilenos (R 4 Sn 2 ), que son aproximadamente equivalentes a los alquenos . Ambas clases exhiben reacciones inusuales. [51]

El estaño se genera a través del largo proceso s en estrellas de masa baja a media (con masas de 0,6 a 10 veces la del Sol ) y, finalmente, por desintegración beta de los isótopos pesados del indio . [52]
El estaño es el 49.º elemento más abundante en la corteza terrestre , representando 2 ppm en comparación con 75 ppm para el zinc, 50 ppm para el cobre y 14 ppm para el plomo. [53]
El estaño no se encuentra como elemento nativo, sino que debe extraerse de diversos minerales. Casiterita ( SnO
2) es la única fuente comercialmente importante de estaño, aunque se recuperan pequeñas cantidades de estaño a partir de sulfuros complejos como la estannita , la cilindrita , la franckeíta , la canfieldita y la teallita . Los minerales con estaño casi siempre están asociados con la roca de granito , generalmente a un nivel de contenido de óxido de estaño del 1%. [54]
Debido a la mayor gravedad específica del dióxido de estaño, aproximadamente el 80% del estaño extraído proviene de depósitos secundarios que se encuentran aguas abajo de las vetas primarias. El estaño se recupera a menudo de gránulos arrastrados río abajo en el pasado y depositados en valles o en el mar. Las formas más económicas de extraer estaño son mediante dragado , extracción hidráulica o minas a cielo abierto . La mayor parte del estaño del mundo se produce a partir de depósitos de placer , que pueden contener tan solo un 0,015% de estaño. [55]
En 2011 se extrajeron alrededor de 253.000 toneladas de estaño, principalmente en China (110.000 t), Indonesia (51.000 t), Perú (34.600 t), Bolivia (20.700 t) y Brasil (12.000 t). [56] Las estimaciones de la producción de estaño han variado históricamente según el mercado y la tecnología minera. Se estima que, con las tasas de consumo y las tecnologías actuales, la Tierra se quedará sin estaño extraíble en 40 años. [57] En 2006, Lester Brown sugirió que el estaño podría agotarse en 20 años basándose en estimaciones conservadoras de un crecimiento anual del 2%. [58]
El estaño de desecho es una fuente importante de este metal. La recuperación de estaño mediante el reciclaje está aumentando rápidamente a partir de 2019. [59] Si bien Estados Unidos no ha extraído (desde 1993) ni fundido (desde 1989) estaño, fue el mayor productor secundario, reciclando casi 14.000 toneladas en 2006. [56]
Se reportan nuevos depósitos en Mongolia , [60] y en 2009, se descubrieron nuevos depósitos de estaño en Colombia. [61]
El estaño se produce por reducción carbotérmica del mineral de óxido con carbón o coque. Se pueden utilizar tanto hornos de reverbero como hornos eléctricos : [62] [63] [64]
Las diez mayores empresas productoras de estaño produjeron la mayor parte del estaño del mundo en 2007. [ cita requerida ]
La mayor parte del estaño del mundo se comercializa en la LME, procedente de 8 países, bajo 17 marcas. [65]
El Consejo Internacional del Estaño se creó en 1947 para controlar el precio del estaño, pero se disolvió en 1985. En 1984 se creó la Asociación de Países Productores de Estaño, con Australia, Bolivia, Indonesia, Malasia, Nigeria, Tailandia y Zaire como miembros. [68]
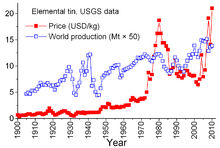
El estaño es un producto mineral único debido a los complejos acuerdos entre los países productores y los países consumidores que datan de 1921. Los acuerdos anteriores tendían a ser algo informales y condujeron al "Primer Acuerdo Internacional del Estaño" en 1956, el primero de una serie que prácticamente se vino abajo en 1985. A través de estos acuerdos, el Consejo Internacional del Estaño (CIT) tuvo un efecto considerable en los precios del estaño. El CIT apoyó el precio del estaño durante los períodos de precios bajos comprando estaño para su reserva de reserva y pudo restringir el precio durante los períodos de precios altos vendiendo de su reserva. Se trataba de un enfoque contrario al libre mercado, diseñado para asegurar un flujo suficiente de estaño a los países consumidores y una ganancia para los países productores. Sin embargo, la reserva de reserva no era lo suficientemente grande, y durante la mayor parte de esos 29 años los precios del estaño aumentaron, a veces bruscamente, especialmente entre 1973 y 1980, cuando una inflación galopante afectó a muchas economías del mundo. [69]
A finales de los años 1970 y principios de los 1980, Estados Unidos redujo su reserva estratégica de estaño, en parte para aprovechar los precios históricamente altos del estaño. La recesión de 1981-82 dañó la industria del estaño. El consumo de estaño disminuyó drásticamente. La ITC pudo evitar caídas realmente pronunciadas mediante compras aceleradas para su reserva de reserva; esta actividad requirió un endeudamiento extenso. La ITC continuó endeudándose hasta finales de 1985, cuando alcanzó su límite de crédito. Inmediatamente, se produjo una importante "crisis del estaño": el estaño fue excluido de la cotización en la Bolsa de Metales de Londres durante unos tres años. La ITC se disolvió poco después, y el precio del estaño, ahora en un entorno de libre mercado, cayó a 4 dólares por libra y se mantuvo alrededor de ese nivel durante los años 1990. [69] El precio aumentó nuevamente en 2010 con un repunte del consumo tras la crisis económica de 2007-2008 , que acompañó la reposición de existencias y el crecimiento continuo del consumo. [56]

La Bolsa de Metales de Londres (LME) es el principal lugar de comercio del estaño. [56] Otros mercados de contratos de estaño son el Mercado de Estaño de Kuala Lumpur (KLTM) y la Bolsa de Estaño de Indonesia (INATIN). [70]
Debido a los factores que influyeron en la crisis de la cadena de suministro mundial de 2021 , los precios del estaño casi se duplicaron durante 2020-21 y han tenido su mayor aumento anual en más de 30 años. El consumo mundial de estaño refinado cayó un 1,6 por ciento en 2020, ya que la pandemia de COVID-19 perturbó las industrias manufactureras mundiales. [71]

En 2018, casi la mitad de todo el estaño producido se utilizó en soldaduras. El resto se dividió entre estañado, productos químicos a base de estaño, aleaciones de latón y bronce y usos específicos. [72]
El pigmento amarillo 38, sulfuro de estaño (IV) , se conoce como oro mosaico . [73]
La púrpura de Casio , pigmento rojo 109, un doble estannato hidratado de oro , se restringió principalmente, en términos de pintura, a las miniaturas debido a su alto costo. Se usó ampliamente para hacer vidrio de arándano . También se ha utilizado en las artes para teñir porcelana . [74]
El amarillo de plomo y estaño (que se presenta en dos formas amarillas: estannato y silicato ) era un pigmento que históricamente fue muy importante para la pintura al óleo y que tuvo algún uso en frescos en su forma de silicato. [75] El estannato de plomo también se conoce en forma anaranjada, pero no se ha utilizado ampliamente en las bellas artes. Se puede comprar en forma de pigmento a través de proveedores especializados para artistas. Existe otra forma menor, en términos de uso artístico y disponibilidad, de amarillo de plomo y estaño conocida como amarillo de plomo y estaño y antimonio . [ cita requerida ]
El azul cerúleo , un cian algo opaco conocido químicamente como estannato de cobalto , sigue siendo un pigmento importante para los artistas. Su tono es similar al del azul manganeso , Pigmento Azul 33, aunque carece del colorido de ese pigmento y es más opaco. [76] Los artistas normalmente deben elegir entre el estannato de cobalto y las imitaciones de azul manganeso hechas con un tono verde azul ftalocianina (Pigmento Azul 15:3), ya que la producción industrial de pigmento azul manganeso cesó en la década de 1970. [77] Sin embargo, el azul cerúleo hecho con estannato de cobalto era popular entre los artistas antes de la producción de azul manganeso. [ cita requerida ]
El pigmento rojo 233, conocido comúnmente como Pinkcolor o Potter's Pink y más precisamente conocido como Chrome Tin Pink Sphene, es un pigmento históricamente importante en acuarela . [78] Sin embargo, ha disfrutado de un gran resurgimiento en popularidad debido al boca a boca basado en Internet . Es completamente resistente a la luz y químicamente estable tanto en pinturas al óleo como en acuarelas. Otros pigmentos complejos de metales mixtos inorgánicos, producidos mediante calcinación , a menudo presentan estaño como componente. Estos pigmentos son conocidos por su resistencia a la luz , resistencia a la intemperie, estabilidad química, falta de toxicidad y opacidad . Muchos son bastante opacos en términos de colorido. Sin embargo, algunos poseen suficiente colorido para ser competitivos para casos de uso que requieren más que una cantidad moderada. Algunos son apreciados por otras cualidades. Por ejemplo, muchos acuarelistas eligen Pinkcolor por su fuerte granulación , aunque su croma es bajo. Recientemente, el amarillo NTP (un pirocloro ) se ha lanzado al mercado como un reemplazo no tóxico para el cromato de plomo (II) con mayor opacidad, solidez a la luz y resistencia a la intemperie que los pigmentos de reemplazo de cromato de plomo orgánico propuestos. [79] El amarillo NTP posee el nivel más alto de saturación de color de estos pigmentos complejos de metales mixtos inorgánicos contemporáneos. Más ejemplos de este grupo incluyen Pigmento Amarillo 158 ( Casiterita Amarilla de Estaño y Vanadio ), [80] Pigmento Amarillo 216 (Amarillo Solaplex), [81] Pigmento Amarillo 219 ( Estannato de Antimonio y Titanio y Zinc ), [82] Pigmento Naranja 82 (Óxido de Estaño, Titanio y Zinc, también conocido como Naranja Sicopal), [83] Pigmento Rojo 121 (también conocido como Violeta de Estaño y Estannato de Cromo ), [84] Pigmento Rojo 230 ( Corindón Rosa de Alúmina y Cromo ), [85] Pigmento Rojo 236 ( Casiterita Orquídea de Estaño y Cromo ), [86] y Pigmento Negro 23 (Casiterita Gris de Antimonio y Estaño). [87] Otro pigmento azul con estaño y cobalto es el Pigmento Azul 81, Espinela Azul de Alúmina y Cobalto y Estaño . [ cita requerida ]
El pigmento blanco 15, óxido de estaño (IV), se utiliza por su iridiscencia , más comúnmente como esmalte cerámico . [88] No existen pigmentos verdes que hayan sido utilizados por artistas que tengan estaño como componente y los pigmentos violáceos con estaño se clasifican como rojos, según el Índice de color internacional . [ cita requerida ]
El estaño se ha utilizado durante mucho tiempo en aleaciones con plomo como soldadura , en cantidades de 5 a 70% p/p. El estaño con plomo forma una mezcla eutéctica en la proporción de peso de 61,9% de estaño y 38,1% de plomo (la proporción atómica: 73,9% de estaño y 26,1% de plomo), con una temperatura de fusión de 183 °C (361,4 °F). Estas soldaduras se utilizan principalmente para unir tuberías o circuitos eléctricos . Desde que la Directiva de la Unión Europea sobre Residuos de Aparatos Eléctricos y Electrónicos (Directiva RAEE) y la Directiva de Restricción de Sustancias Peligrosas entraron en vigor el 1 de julio de 2006, el contenido de plomo en estas aleaciones ha disminuido. Si bien la exposición al plomo se asocia con graves problemas de salud , la soldadura sin plomo no está exenta de desafíos, incluido un punto de fusión más alto y la formación de filamentos de estaño que causan problemas eléctricos. La plaga del estaño puede aparecer en las soldaduras sin plomo, lo que lleva a la pérdida de la unión soldada. Se están encontrando aleaciones de reemplazo, pero los problemas de integridad de la unión persisten. [89] Una aleación común sin plomo es 99% de estaño, 0,7% de cobre y 0,3% de plata, con una temperatura de fusión de 217 °C (422,6 °F). [90]

El estaño se adhiere fácilmente al hierro y se utiliza para recubrir plomo , zinc y acero para evitar la corrosión. Los recipientes de acero estañado (o estañados) se utilizan ampliamente para la conservación de alimentos , y esto constituye una gran parte del mercado del estaño metálico. Un bote de hojalata para conservar alimentos se fabricó por primera vez en Londres en 1812. [91] Los hablantes de inglés británico llaman a estos recipientes "tins", mientras que los hablantes de inglés estadounidense los llaman " cans " o "tin cans". Una derivación de dicho uso es el término de jerga " tinnie " o "tinny", que significa "lata de cerveza" en Australia. El silbato de hojalata se llama así porque se produjo en masa primero en acero estañado. [92] [93]
Los recipientes de cobre para cocinar, como cacerolas y sartenes, suelen estar recubiertos con una fina capa de estaño, mediante galvanoplastia o mediante métodos químicos tradicionales , ya que el uso de utensilios de cocina de cobre con alimentos ácidos puede ser tóxico. [ cita requerida ]


El estaño en combinación con otros elementos forma una amplia variedad de aleaciones útiles. El estaño se alea más comúnmente con cobre. El peltre tiene un 85-99% de estaño, [94] y el metal para cojinetes también tiene un alto porcentaje de estaño. [95] [96] El bronce es principalmente cobre con un 12% de estaño, mientras que la adición de fósforo produce bronce fosforoso . El metal de campana también es una aleación de cobre y estaño, que contiene un 22% de estaño. El estaño se ha utilizado a veces en la acuñación de monedas; alguna vez formó un porcentaje de un solo dígito (generalmente el cinco por ciento o menos) de los centavos estadounidenses. [97] y canadienses [98]
El compuesto de niobio y estaño Nb3Sn se utiliza comercialmente en bobinas de imanes superconductores por su alta temperatura crítica (18 K) y su campo magnético crítico (25 T ). Un imán superconductor que pesa tan sólo dos kilogramos es capaz de producir el campo magnético de un electroimán convencional que pesa toneladas. [99]
Se añade un pequeño porcentaje de estaño a las aleaciones de circonio para el revestimiento del combustible nuclear. [100]
La mayoría de los tubos metálicos de un órgano de tubos son de una aleación de estaño y plomo, siendo la composición más común 50/50. La proporción de estaño en el tubo define el tono del mismo, ya que el estaño tiene una resonancia tonal deseable. Cuando una aleación de estaño y plomo se enfría, la fase de plomo se solidifica primero, luego, cuando se alcanza la temperatura eutéctica, el líquido restante forma la estructura eutéctica de estaño y plomo en capas, que es brillante; el contraste con la fase de plomo produce un efecto moteado o manchado. Esta aleación de metal se conoce como metal manchado. Las principales ventajas de usar estaño para los tubos incluyen su apariencia, trabajabilidad y resistencia a la corrosión. [101] [102]
Los compuestos de estaño se utilizan en la producción de diversos productos químicos, incluidos estabilizadores para PVC y catalizadores para procesos industriales. El estaño en forma de lingotes proporciona la materia prima necesaria para estas reacciones químicas, lo que garantiza una calidad y un rendimiento constantes. [ cita requerida ]
Los óxidos de indio y estaño son conductores de electricidad y transparentes, y se utilizan para fabricar películas conductoras de electricidad transparentes con aplicaciones en dispositivos optoelectrónicos como pantallas de cristal líquido . [103]

El acero estañado perforado, también llamado hojalata perforada, es una técnica artesanal originaria de Europa central para crear artículos para el hogar funcionales y decorativos. Los diseños de perforaciones decorativas existen en una amplia variedad, según la tradición local y el artesano. Las linternas de hojalata perforada son la aplicación más común de esta técnica artesanal. La luz de una vela que brilla a través del diseño perforado crea un patrón de luz decorativo en la habitación donde se encuentra. Las linternas y otros artículos de hojalata perforada se crearon en el Nuevo Mundo a partir de los primeros asentamientos europeos. Un ejemplo bien conocido es la linterna Revere, llamada así en honor a Paul Revere . [104]
En Estados Unidos, antes de que existiera la refrigeración, se utilizaban cajas fuertes para tartas y cajas fuertes para alimentos. Se trataba de armarios de madera de distintos estilos y tamaños, tanto de pie como colgantes, destinados a ahuyentar a los bichos y los insectos y a mantener el polvo alejado de los alimentos perecederos. Estos armarios tenían insertos de hojalata en las puertas y, a veces, en los laterales, perforados por el propietario, el ebanista o un hojalatero en distintos diseños para permitir la circulación del aire y excluir las moscas. Las reproducciones modernas de estos artículos siguen siendo populares en América del Norte. [105]
El vidrio para ventanas se fabrica generalmente haciendo flotar vidrio fundido sobre estaño fundido ( vidrio flotado ), lo que da como resultado una superficie plana e impecable. Este proceso también se denomina " proceso Pilkington ". [106]
El estaño se utiliza como electrodo negativo en baterías de iones de litio avanzadas . Su aplicación está algo limitada por el hecho de que algunas superficies de estaño [¿ cuáles? ] catalizan la descomposición de los electrolitos a base de carbonato utilizados en las baterías de iones de litio. [107]
El fluoruro de estaño (II) se añade a algunos productos para el cuidado dental [108] en forma de fluoruro estannoso (SnF 2 ). El fluoruro de estaño (II) se puede mezclar con abrasivos de calcio, mientras que el fluoruro de sodio, más común, se vuelve biológicamente inactivo gradualmente en presencia de compuestos de calcio. [109] También se ha demostrado que es más eficaz que el fluoruro de sodio para controlar la gingivitis . [110]
El estaño se utiliza como objetivo para crear plasmas inducidos por láser que actúan como fuente de luz para la litografía ultravioleta extrema . [111]
Los compuestos organoestánnicos son compuestos organometálicos que contienen enlaces estaño-carbono. La producción industrial mundial de compuestos organoestánnicos probablemente supere las 50.000 toneladas . [112]
La principal aplicación comercial de los compuestos organoestánnicos es la estabilización de plásticos de PVC . En ausencia de dichos estabilizadores, el PVC se degradaría rápidamente con el calor, la luz y el oxígeno atmosférico, dando lugar a productos descoloridos y quebradizos. El estaño elimina los iones cloruro lábiles (Cl − ), que de otro modo eliminarían el HCl del material plástico. [113] Los compuestos de estaño típicos son los derivados del ácido carboxílico del dicloruro de dibutilestaño, como el dilaurato de dibutilestaño . [114]
Algunos compuestos organoestánnicos son relativamente tóxicos, con ventajas y problemas. Se utilizan por sus propiedades biocidas como fungicidas , pesticidas , alguicidas , conservantes de madera y agentes antiincrustantes . [113] El óxido de tributilestaño se utiliza como conservante de madera . [115] El tributilestaño se utiliza para diversos fines industriales, como el control de lodo en fábricas de papel y la desinfección de aguas de refrigeración industriales circulantes. [116] El tributilestaño se utilizaba como aditivo para la pintura de barcos para prevenir el crecimiento de organismos incrustantes en los barcos, y su uso disminuyó después de que los compuestos organoestánnicos se reconocieran como contaminantes orgánicos persistentes con alta toxicidad para algunos organismos marinos (el caracol marino , por ejemplo). [117] La UE prohibió el uso de compuestos organoestánnicos en 2003, [118] mientras que las preocupaciones sobre la toxicidad de estos compuestos para la vida marina y el daño a la reproducción y crecimiento de algunas especies marinas [113] (algunos informes describen efectos biológicos para la vida marina en una concentración de 1 nanogramo por litro) han llevado a una prohibición mundial por parte de la Organización Marítima Internacional . [119] Muchas naciones ahora restringen el uso de compuestos organoestánnicos a buques de más de 25 m (82 pies) de largo. [113] La persistencia del tributilestaño en el entorno acuático depende de la naturaleza del ecosistema. [120] Debido a esta persistencia y su uso como aditivo en la pintura de barcos, se han encontrado altas concentraciones de tributilestaño en sedimentos marinos ubicados cerca de muelles navales. [121] El tributilestaño se ha utilizado como un biomarcador para el chargesex en neogasterópodos , con al menos 82 especies conocidas. [122] Con los altos niveles de TBT en las áreas costeras locales, debido a las actividades de envío, los mariscos tuvieron un efecto adverso. [120] La imposex es la imposición de características sexuales masculinas en especímenes femeninos donde desarrollan un pene y un conducto deferente palial . [122] [123] Un alto nivel de TBT puede dañar las glándulas endocrinas de los mamíferos , los sistemas reproductivo y nervioso central , la estructura ósea y el tracto gastrointestinal . [123] El tributilestaño no solo afecta a los mamíferos, sino también a las nutrias marinas, las ballenas, los delfines y los humanos. [123]
Algunos reactivos de estaño son útiles en química orgánica . En la aplicación más importante, el cloruro estannoso es un agente reductor común para la conversión de grupos nitro y oxima en aminas . La reacción de Stille acopla compuestos de organoestaño con haluros orgánicos o pseudohaluros . [124]
El estaño forma varias fases intermetálicas con el metal litio, lo que lo convierte en un material potencialmente atractivo para aplicaciones en baterías. La gran expansión volumétrica del estaño al alearse con litio y la inestabilidad de la interfaz estaño-electrolito orgánico a potenciales electroquímicos bajos son los mayores desafíos para el empleo en celdas comerciales. [125] El compuesto intermetálico de estaño con cobalto y carbono fue implementado por Sony en sus celdas Nexelion lanzadas a fines de la década de 2000. La composición del material activo es aproximadamente Sn 0.3 Co 0.4 C 0.3 . La investigación mostró que solo algunas facetas cristalinas de Sn tetragonal (beta) son responsables de la actividad electroquímica indeseable. [126]
Son prácticamente desconocidos los casos de intoxicación por estaño metálico, sus óxidos y sus sales. Por otra parte, ciertos compuestos organoestánnicos son casi tan tóxicos como el cianuro . [49]
La exposición al estaño en el lugar de trabajo puede ocurrir por inhalación, contacto con la piel y contacto con los ojos. La Administración de Seguridad y Salud Ocupacional de los Estados Unidos (OSHA) estableció el límite de exposición permisible para la exposición al estaño en el lugar de trabajo en 2 mg/m 3 durante una jornada laboral de 8 horas. El Instituto Nacional para la Seguridad y Salud Ocupacional (NIOSH) determinó un límite de exposición recomendado (REL) de 2 mg/m 3 durante una jornada laboral de 8 horas. En niveles de 100 mg/m 3 , el estaño es inmediatamente peligroso para la vida y la salud . [127]
los oficiales tenían botones de metal, y éstos estaban hechos de latón.
{{cite book}}: |journal=ignorado ( ayuda ){{cite web}}: CS1 maint: estado de la URL ( enlace ){{cite web}}: CS1 maint: estado de la URL ( enlace ){{cite web}}: CS1 maint: estado de la URL ( enlace ){{cite web}}: CS1 maint: estado de la URL ( enlace ){{cite web}}: CS1 maint: estado de la URL ( enlace ){{cite web}}: CS1 maint: estado de la URL ( enlace ){{cite web}}: CS1 maint: estado de la URL ( enlace ){{cite web}}: CS1 maint: estado de la URL ( enlace ){{cite web}}: CS1 maint: estado de la URL ( enlace ){{cite web}}: CS1 maint: estado de la URL ( enlace ){{cite web}}: CS1 maint: estado de la URL ( enlace ){{cite web}}: CS1 maint: estado de la URL ( enlace ){{cite web}}: CS1 maint: estado de la URL ( enlace ){{cite web}}: CS1 maint: estado de la URL ( enlace ){{cite web}}: CS1 maint: estado de la URL ( enlace ){{cite web}}: CS1 maint: estado de la URL ( enlace )