
Un potencial de acción ocurre cuando el potencial de membrana de una célula específica aumenta y disminuye rápidamente. [1] Esta despolarización hace que las ubicaciones adyacentes se despolaricen de manera similar. Los potenciales de acción ocurren en varios tipos de células animales , llamadas células excitables , que incluyen neuronas , células musculares y algunas células vegetales . Ciertas células endocrinas como las células beta pancreáticas y ciertas células de la glándula pituitaria anterior también son células excitables. [2]
En las neuronas, los potenciales de acción desempeñan un papel central en la comunicación entre células al proporcionar (o, con respecto a la conducción saltatoria , ayudar) a la propagación de señales a lo largo del axón de la neurona hacia los botones sinápticos situados en los extremos de un axón; Estas señales luego pueden conectarse con otras neuronas en las sinapsis o con células o glándulas motoras. En otro tipo de células, su función principal es activar procesos intracelulares. En las células musculares, por ejemplo, un potencial de acción es el primer paso en la cadena de acontecimientos que conducen a la contracción. En las células beta del páncreas provocan la liberación de insulina . [a] Los potenciales de acción en las neuronas también se conocen como " impulsos nerviosos " o " picos ", y la secuencia temporal de potenciales de acción generados por una neurona se denomina " tren de picos ". A menudo se dice que una neurona que emite un potencial de acción, o impulso nervioso, "se dispara".
Los potenciales de acción son generados por tipos especiales de canales iónicos dependientes de voltaje incrustados en la membrana plasmática de una célula . [b] Estos canales se cierran cuando el potencial de membrana está cerca del potencial de reposo (negativo) de la célula, pero rápidamente comienzan a abrirse si el potencial de membrana aumenta a un voltaje umbral definido con precisión, despolarizando el potencial transmembrana. [b] Cuando los canales se abren, permiten un flujo hacia adentro de iones de sodio , lo que cambia el gradiente electroquímico, lo que a su vez produce un aumento adicional en el potencial de membrana hacia cero. Esto hace que se abran más canales, lo que produce una mayor corriente eléctrica a través de la membrana celular y así sucesivamente. El proceso avanza de manera explosiva hasta que todos los canales iónicos disponibles están abiertos, lo que resulta en un gran aumento en el potencial de membrana. La rápida entrada de iones de sodio hace que se invierta la polaridad de la membrana plasmática y los canales iónicos se inactivan rápidamente. A medida que los canales de sodio se cierran, los iones de sodio ya no pueden ingresar a la neurona y luego son transportados activamente fuera de la membrana plasmática. Luego se activan los canales de potasio y hay una corriente de salida de iones de potasio, lo que devuelve el gradiente electroquímico al estado de reposo. Después de que se ha producido un potencial de acción, hay un desplazamiento negativo transitorio, llamado poshiperpolarización .
En las células animales, existen dos tipos principales de potenciales de acción. Un tipo es generado por canales de sodio dependientes de voltaje , el otro por canales de calcio dependientes de voltaje . Los potenciales de acción basados en sodio suelen durar menos de un milisegundo, pero los potenciales de acción basados en calcio pueden durar 100 milisegundos o más. [ cita necesaria ] En algunos tipos de neuronas, los picos lentos de calcio proporcionan la fuerza impulsora para una larga ráfaga de picos de sodio emitidos rápidamente. En las células del músculo cardíaco , por otro lado, un pico inicial rápido de sodio proporciona un "cebador" para provocar la rápida aparición de un pico de calcio, que luego produce la contracción muscular. [3]

Casi todas las membranas celulares de animales, plantas y hongos mantienen una diferencia de voltaje entre el exterior y el interior de la célula, llamada potencial de membrana . Un voltaje típico a través de la membrana de una célula animal es de -70 mV. Esto significa que el interior de la celda tiene un voltaje negativo con respecto al exterior. En la mayoría de los tipos de células, el potencial de membrana suele permanecer bastante constante. Sin embargo, algunos tipos de celdas son eléctricamente activas en el sentido de que sus voltajes fluctúan con el tiempo. En algunos tipos de células eléctricamente activas, incluidas las neuronas y las células musculares, las fluctuaciones de voltaje frecuentemente toman la forma de un rápido pico ascendente (positivo) seguido de una rápida caída. Estos ciclos de altibajos se conocen como potenciales de acción . En algunos tipos de neuronas, todo el ciclo de subida y bajada tiene lugar en unas pocas milésimas de segundo. En las células musculares, un potencial de acción típico dura aproximadamente una quinta parte de segundo. En las células vegetales , un potencial de acción puede durar tres segundos o más. [4]
Las propiedades eléctricas de una célula están determinadas por la estructura de su membrana. Una membrana celular consta de una bicapa lipídica de moléculas en la que están incrustadas moléculas de proteínas más grandes. La bicapa lipídica es muy resistente al movimiento de iones cargados eléctricamente, por lo que funciona como aislante. Por el contrario, las proteínas grandes incrustadas en la membrana proporcionan canales a través de los cuales los iones pueden atravesar la membrana. Los potenciales de acción son impulsados por proteínas de canal cuya configuración cambia entre estados cerrados y abiertos en función de la diferencia de voltaje entre el interior y el exterior de la célula. Estas proteínas sensibles al voltaje se conocen como canales iónicos dependientes de voltaje .

Todas las células de los tejidos del cuerpo animal están polarizadas eléctricamente ; en otras palabras, mantienen una diferencia de voltaje a través de la membrana plasmática de la célula , conocida como potencial de membrana . Esta polarización eléctrica resulta de una interacción compleja entre estructuras proteicas incrustadas en la membrana llamadas bombas iónicas y canales iónicos . En las neuronas, los tipos de canales iónicos en la membrana generalmente varían en las diferentes partes de la célula, lo que confiere a las dendritas , el axón y el cuerpo celular diferentes propiedades eléctricas. Como resultado, algunas partes de la membrana de una neurona pueden ser excitables (capaces de generar potenciales de acción), mientras que otras no. Estudios recientes han demostrado que la parte más excitable de una neurona es la parte posterior al montículo del axón (el punto donde el axón abandona el cuerpo celular), que se denomina segmento inicial axonal , pero el axón y el cuerpo celular también son excitables en la mayoría de los casos. casos. [5]
Cada parche excitable de membrana tiene dos niveles importantes de potencial de membrana: el potencial de reposo , que es el valor que mantiene el potencial de membrana mientras nada perturbe a la célula, y un valor más alto llamado potencial umbral . En el montículo axónico de una neurona típica, el potencial de reposo es de alrededor de –70 milivoltios (mV) y el potencial umbral es de alrededor de –55 mV. Las entradas sinápticas a una neurona hacen que la membrana se despolarice o hiperpolarice ; es decir, hacen que el potencial de membrana aumente o disminuya. Los potenciales de acción se activan cuando se acumula suficiente despolarización para llevar el potencial de membrana hasta el umbral. Cuando se activa un potencial de acción, el potencial de membrana se dispara abruptamente hacia arriba y luego de manera igualmente abrupta hacia abajo, terminando a menudo por debajo del nivel de reposo, donde permanece durante algún período de tiempo. La forma del potencial de acción está estereotipada; esto significa que el ascenso y la caída suelen tener aproximadamente la misma amplitud y evolución temporal para todos los potenciales de acción en una celda determinada. (Las excepciones se analizan más adelante en el artículo). En la mayoría de las neuronas, todo el proceso tiene lugar en aproximadamente una milésima de segundo. Muchos tipos de neuronas emiten potenciales de acción constantemente a velocidades de hasta 10 a 100 por segundo. Sin embargo, algunos tipos son mucho más silenciosos y pueden pasar minutos o más sin emitir ningún potencial de acción.
Los potenciales de acción resultan de la presencia en la membrana celular de tipos especiales de canales iónicos dependientes de voltaje . [6] Un canal iónico dependiente de voltaje es una proteína transmembrana que tiene tres propiedades clave:
Por tanto, un canal iónico dependiente de voltaje tiende a estar abierto para algunos valores del potencial de membrana y cerrado para otros. Sin embargo, en la mayoría de los casos, la relación entre el potencial de membrana y el estado del canal es probabilística e implica un retraso en el tiempo. Los canales iónicos cambian entre conformaciones en momentos impredecibles: el potencial de membrana determina la velocidad de las transiciones y la probabilidad por unidad de tiempo de cada tipo de transición.

Los canales iónicos dependientes de voltaje son capaces de producir potenciales de acción porque pueden dar lugar a bucles de retroalimentación positiva : el potencial de membrana controla el estado de los canales iónicos, pero el estado de los canales iónicos controla el potencial de membrana. Por tanto, en algunas situaciones, un aumento del potencial de membrana puede hacer que se abran canales iónicos, provocando así un aumento adicional del potencial de membrana. Un potencial de acción ocurre cuando este ciclo de retroalimentación positiva ( ciclo de Hodgkin ) avanza de manera explosiva. La trayectoria temporal y de amplitud del potencial de acción están determinadas por las propiedades biofísicas de los canales iónicos dependientes de voltaje que lo producen. Existen varios tipos de canales capaces de producir la retroalimentación positiva necesaria para generar un potencial de acción. Los canales de sodio dependientes de voltaje son responsables de los potenciales de acción rápida implicados en la conducción nerviosa. Los potenciales de acción más lentos en las células musculares y algunos tipos de neuronas son generados por canales de calcio dependientes de voltaje. Cada uno de estos tipos viene en múltiples variantes, con diferente sensibilidad al voltaje y diferente dinámica temporal.
El tipo de canales iónicos dependientes de voltaje más estudiado son los canales de sodio implicados en la conducción nerviosa rápida. A veces se les conoce como canales de sodio de Hodgkin-Huxley porque fueron caracterizados por primera vez por Alan Hodgkin y Andrew Huxley en sus estudios sobre la biofísica del potencial de acción, ganadores del Premio Nobel, pero es más conveniente denominarlos canales de Na V. (La "V" significa "voltaje".) Un canal Na V tiene tres estados posibles, conocidos como desactivado , activado e inactivado . El canal es permeable sólo a los iones de sodio cuando está en estado activado . Cuando el potencial de membrana es bajo, el canal pasa la mayor parte del tiempo en estado desactivado (cerrado). Si el potencial de membrana se eleva por encima de cierto nivel, el canal muestra una mayor probabilidad de pasar al estado activado (abierto). Cuanto mayor sea el potencial de membrana mayor será la probabilidad de activación. Una vez que un canal se ha activado, eventualmente pasará al estado inactivado (cerrado). Luego tiende a permanecer inactivado durante algún tiempo, pero, si el potencial de membrana vuelve a bajar, el canal eventualmente volverá al estado desactivado . Durante un potencial de acción, la mayoría de canales de este tipo pasan por un ciclo desactivado → activado → inactivado → desactivado . Sin embargo, este es sólo el comportamiento promedio de la población: un canal individual puede, en principio, realizar cualquier transición en cualquier momento. Sin embargo, la probabilidad de que un canal pase directamente del estado inactivado al estado activado es muy baja: un canal en el estado inactivado es refractario hasta que haya regresado al estado desactivado .
El resultado de todo esto es que la cinética de los canales Na V está gobernada por una matriz de transición cuyas velocidades dependen del voltaje de una manera complicada. Dado que estos canales desempeñan un papel importante en la determinación del voltaje, la dinámica global del sistema puede ser bastante difícil de determinar. Hodgkin y Huxley abordaron el problema desarrollando un conjunto de ecuaciones diferenciales para los parámetros que gobiernan los estados de los canales iónicos, conocidas como ecuaciones de Hodgkin-Huxley . Estas ecuaciones han sido modificadas ampliamente por investigaciones posteriores, pero forman el punto de partida para la mayoría de los estudios teóricos de la biofísica del potencial de acción.
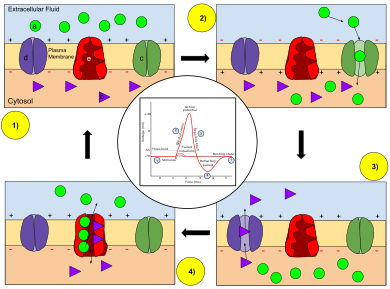
A medida que aumenta el potencial de membrana, los canales iónicos de sodio se abren, permitiendo la entrada de iones de sodio al interior de la célula. A esto le sigue la apertura de los canales de iones de potasio que permiten la salida de los iones de potasio de la célula. El flujo entrante de iones de sodio aumenta la concentración de cationes cargados positivamente en la célula y provoca la despolarización, donde el potencial de la célula es mayor que el potencial de reposo de la célula . Los canales de sodio se cierran en el pico del potencial de acción, mientras que el potasio continúa saliendo de la célula. La salida de iones potasio disminuye el potencial de membrana o hiperpolariza la célula. Para pequeños aumentos de voltaje desde el reposo, la corriente de potasio excede la corriente de sodio y el voltaje vuelve a su valor normal en reposo, típicamente −70 mV. [7] [8] [9] Sin embargo, si el voltaje aumenta más allá de un umbral crítico, generalmente 15 mV más que el valor en reposo, domina la corriente de sodio. Esto da como resultado una condición descontrolada en la que la retroalimentación positiva de la corriente de sodio activa aún más canales de sodio. Así, la célula se dispara , produciendo un potencial de acción. [7] [10] [11] [nota 1] La frecuencia a la que una neurona provoca potenciales de acción a menudo se denomina tasa de activación o tasa de activación neuronal .
Las corrientes producidas por la apertura de canales dependientes de voltaje en el curso de un potencial de acción suelen ser significativamente mayores que la corriente de estimulación inicial. Por tanto, la amplitud, duración y forma del potencial de acción están determinadas en gran medida por las propiedades de la membrana excitable y no por la amplitud o duración del estímulo. Esta propiedad de todo o nada del potencial de acción lo distingue de los potenciales graduados , como los potenciales de receptor , los potenciales electrotónicos , las oscilaciones del potencial de membrana subumbral y los potenciales sinápticos , que escalan con la magnitud del estímulo. Existe una variedad de tipos de potenciales de acción en muchos tipos de células y compartimentos celulares según lo determinado por los tipos de canales dependientes de voltaje, canales de fuga , distribuciones de canales, concentraciones iónicas, capacitancia de membrana, temperatura y otros factores.
Los principales iones implicados en un potencial de acción son los cationes de sodio y potasio; Los iones de sodio entran en la célula y los iones de potasio salen, restableciendo el equilibrio. Se necesitan relativamente pocos iones para cruzar la membrana para que el voltaje de la misma cambie drásticamente. Por lo tanto, los iones intercambiados durante un potencial de acción producen un cambio insignificante en las concentraciones iónicas interiores y exteriores. Los pocos iones que cruzan son bombeados nuevamente mediante la acción continua de la bomba de sodio-potasio , que, con otros transportadores de iones , mantiene la proporción normal de concentraciones de iones a través de la membrana. Los cationes de calcio y los aniones cloruro están involucrados en algunos tipos de potenciales de acción, como el potencial de acción cardíaco y el potencial de acción en el alga unicelular Acetabularia , respectivamente.
Aunque los potenciales de acción se generan localmente en parches de membrana excitable, las corrientes resultantes pueden desencadenar potenciales de acción en tramos vecinos de membrana, precipitando una propagación tipo dominó. A diferencia de la propagación pasiva de potenciales eléctricos ( potencial electrotónico ), los potenciales de acción se generan de nuevo a lo largo de tramos excitables de la membrana y se propagan sin desintegrarse. [12] Las secciones mielinizadas de los axones no son excitables y no producen potenciales de acción y la señal se propaga pasivamente como potencial electrotónico . Los parches amielínicos regularmente espaciados, llamados nódulos de Ranvier , generan potenciales de acción para aumentar la señal. Conocida como conducción saltatoria , este tipo de propagación de señal proporciona un equilibrio favorable entre la velocidad de la señal y el diámetro del axón. La despolarización de las terminales de los axones , en general, desencadena la liberación de neurotransmisores hacia la hendidura sináptica . Además, se han registrado potenciales de acción de retropropagación en las dendritas de las neuronas piramidales , que se encuentran en todas partes en la neocorteza. [c] Se cree que estos tienen un papel en la plasticidad dependiente del momento del pico .
En el modelo de capacitancia de membrana de Hodgkin-Huxley , la velocidad de transmisión de un potencial de acción no estaba definida y se suponía que las áreas adyacentes se despolarizaban debido a la interferencia de iones liberados con los canales vecinos. Desde entonces, las mediciones de la difusión de iones y los radios han demostrado que esto no es posible. [ cita necesaria ] Además, las mediciones contradictorias de los cambios de entropía y el tiempo cuestionaron que el modelo de capacitancia actuara solo. [ cita necesaria ] Alternativamente, la hipótesis de adsorción de Gilbert Ling postula que el potencial de membrana y el potencial de acción de una célula viva se debe a la adsorción de iones móviles en los sitios de adsorción de las células. [13]
La capacidad de una neurona para generar y propagar un potencial de acción cambia durante el desarrollo . Cuánto cambia el potencial de membrana de una neurona como resultado de un impulso de corriente es función de la resistencia de entrada de la membrana . A medida que una célula crece, se agregan más canales a la membrana, lo que provoca una disminución en la resistencia de entrada. Una neurona madura también sufre cambios más cortos en el potencial de membrana en respuesta a las corrientes sinápticas. Las neuronas del núcleo geniculado lateral de un hurón tienen una constante de tiempo más larga y una desviación de voltaje mayor en P0 que en P30. [14] Una consecuencia de la disminución de la duración del potencial de acción es que la fidelidad de la señal puede preservarse en respuesta a la estimulación de alta frecuencia. Las neuronas inmaduras son más propensas a la depresión sináptica que a la potenciación después de una estimulación de alta frecuencia. [14]
En el desarrollo temprano de muchos organismos, el potencial de acción es transportado inicialmente por una corriente de calcio en lugar de una corriente de sodio . La cinética de apertura y cierre de los canales de calcio durante el desarrollo es más lenta que la de los canales de sodio dependientes de voltaje que transportarán el potencial de acción en las neuronas maduras. Los tiempos de apertura más prolongados de los canales de calcio pueden provocar potenciales de acción considerablemente más lentos que los de las neuronas maduras. [14] Las neuronas de Xenopus inicialmente tienen potenciales de acción que tardan entre 60 y 90 ms. Durante el desarrollo, este tiempo disminuye a 1 ms. Hay dos razones para esta drástica disminución. Primero, la corriente entrante es transportada principalmente por canales de sodio. [15] En segundo lugar, el rectificador retardado , una corriente de canal de potasio , aumenta a 3,5 veces su fuerza inicial. [14]
Para que se produzca la transición de un potencial de acción dependiente de calcio a un potencial de acción dependiente de sodio, se deben agregar nuevos canales a la membrana. Si las neuronas de Xenopus se cultivan en un entorno con inhibidores de la síntesis de ARN o de la síntesis de proteínas , se evita esa transición. [16] Incluso la actividad eléctrica de la propia célula puede desempeñar un papel en la expresión del canal. Si se bloquean los potenciales de acción en los miocitos de Xenopus, se previene o retrasa el aumento típico de la densidad de corriente de sodio y potasio. [17]
Esta maduración de las propiedades eléctricas se observa en todas las especies. Las corrientes de sodio y potasio de Xenopus aumentan drásticamente después de que una neurona pasa por su fase final de mitosis . La densidad de corriente de sodio de las neuronas corticales de rata aumenta en un 600% dentro de las dos primeras semanas posnatales. [14]
Varios tipos de células apoyan un potencial de acción, como las células vegetales, las células musculares y las células especializadas del corazón (en las que se produce el potencial de acción cardíaco ). Sin embargo, la principal célula excitable es la neurona , que también tiene el mecanismo más simple para el potencial de acción.
Las neuronas son células eléctricamente excitables compuestas, por lo general, por una o más dendritas, un solo soma , un solo axón y una o más terminales axónicas . Las dendritas son proyecciones celulares cuya función principal es recibir señales sinápticas. Sus protuberancias, conocidas como espinas dendríticas , están diseñadas para capturar los neurotransmisores liberados por la neurona presináptica. Tienen una alta concentración de canales iónicos activados por ligando . Estas espinas tienen un cuello delgado que conecta una protuberancia bulbosa con la dendrita. Esto asegura que es menos probable que los cambios que ocurren dentro de la columna afecten a las espinas vecinas. La columna dendrítica puede, con raras excepciones (ver LTP ), actuar como una unidad independiente. Las dendritas se extienden desde el soma, que alberga el núcleo , y muchos de los orgánulos eucarióticos "normales" . A diferencia de las espinas, la superficie del soma está poblada por canales iónicos activados por voltaje. Estos canales ayudan a transmitir las señales generadas por las dendritas. Del soma emerge el montículo del axón . Esta región se caracteriza por tener una concentración muy alta de canales de sodio activados por voltaje. En general, se considera la zona de inicio de picos para los potenciales de acción, [18] es decir, la zona de activación . Aquí convergen múltiples señales generadas en las espinas y transmitidas por el soma. Inmediatamente después del montículo del axón está el axón. Se trata de una protuberancia tubular delgada que se aleja del soma. El axón está aislado por una vaina de mielina . La mielina está compuesta de células de Schwann (en el sistema nervioso periférico) u oligodendrocitos (en el sistema nervioso central), los cuales son tipos de células gliales . Aunque las células gliales no participan en la transmisión de señales eléctricas, se comunican y brindan un importante apoyo bioquímico a las neuronas. [19] Para ser específicos, la mielina se envuelve varias veces alrededor del segmento axonal, formando una capa grasa gruesa que evita que los iones entren o escapen del axón. Este aislamiento evita una caída significativa de la señal y garantiza una velocidad de señal más rápida. Este aislamiento, sin embargo, tiene la restricción de que no puede haber canales en la superficie del axón. Por lo tanto, hay parches de membrana regularmente espaciados, que no tienen aislamiento. Estos nodos de Ranvier pueden considerarse "minimontones de axones", ya que su propósito es aumentar la señal para evitar una caída significativa de la misma. En el extremo más alejado, el axón pierde su aislamiento y comienza a ramificarse en varias terminales del axón.. Estas terminales presinápticas, o botones sinápticos, son un área especializada dentro del axón de la célula presináptica que contiene neurotransmisores encerrados en pequeñas esferas unidas a membranas llamadas vesículas sinápticas .
Antes de considerar la propagación de los potenciales de acción a lo largo de los axones y su terminación en los nudos sinápticos, es útil considerar los métodos mediante los cuales se pueden iniciar los potenciales de acción en el montículo del axón . El requisito básico es que la tensión de la membrana en el montículo se eleve por encima del umbral de disparo. [7] [8] [20] [21] Hay varias formas en que puede ocurrir esta despolarización.

Los potenciales de acción suelen iniciarse mediante potenciales postsinápticos excitadores de una neurona presináptica. [22] Normalmente, las moléculas de neurotransmisores son liberadas por la neurona presináptica . Estos neurotransmisores luego se unen a receptores de la célula postsináptica. Esta unión abre varios tipos de canales iónicos . Esta apertura tiene además el efecto de cambiar la permeabilidad local de la membrana celular y, por tanto, el potencial de membrana. Si la unión aumenta el voltaje (despolariza la membrana), la sinapsis es excitatoria. Sin embargo, si la unión disminuye el voltaje (hiperpolariza la membrana), es inhibidora. Ya sea que el voltaje aumente o disminuya, el cambio se propaga pasivamente a las regiones cercanas de la membrana (como se describe en la ecuación del cable y sus refinamientos). Normalmente, el estímulo de voltaje decae exponencialmente con la distancia desde la sinapsis y con el tiempo desde la unión del neurotransmisor. Una fracción de un voltaje excitador puede alcanzar el montículo del axón y (en casos raros) despolarizar la membrana lo suficiente como para provocar un nuevo potencial de acción. Lo más habitual es que los potenciales excitadores de varias sinapsis deban trabajar juntos casi al mismo tiempo para provocar un nuevo potencial de acción. Sin embargo, sus esfuerzos conjuntos pueden verse frustrados por los potenciales postsinápticos inhibidores que se contrarrestan .
La neurotransmisión también puede ocurrir a través de sinapsis eléctricas . [23] Debido a la conexión directa entre células excitables en forma de uniones en hendidura , un potencial de acción puede transmitirse directamente de una célula a la siguiente en cualquier dirección. El libre flujo de iones entre las células permite una transmisión rápida no mediada por productos químicos. Los canales rectificadores aseguran que los potenciales de acción se muevan solo en una dirección a través de una sinapsis eléctrica. [ cita necesaria ] Las sinapsis eléctricas se encuentran en todos los sistemas nerviosos, incluido el cerebro humano, aunque son una clara minoría. [24]
A menudo se piensa que la amplitud de un potencial de acción es independiente de la cantidad de corriente que lo produjo. En otras palabras, las corrientes más grandes no crean potenciales de acción más grandes. Por lo tanto, se dice que los potenciales de acción son señales de todo o nada , ya que o ocurren completamente o no ocurren en absoluto. [d] [e] [f] Esto contrasta con los potenciales del receptor , cuyas amplitudes dependen de la intensidad de un estímulo. [25] En ambos casos, la frecuencia de los potenciales de acción se correlaciona con la intensidad de un estímulo.
A pesar de que la visión clásica del potencial de acción como una señal estereotipada y uniforme ha dominado el campo de la neurociencia durante muchas décadas, evidencia más reciente sugiere que los potenciales de acción son eventos más complejos, de hecho capaces de transmitir información no sólo a través de su amplitud, sino también de su duración y duración. fase también, a veces incluso hasta distancias que originalmente no se creían posibles. [26] [27] [28] [29]
En las neuronas sensoriales , una señal externa como presión, temperatura, luz o sonido se combina con la apertura y cierre de canales iónicos , que a su vez alteran las permeabilidades iónicas de la membrana y su voltaje. [30] Estos cambios de voltaje pueden ser nuevamente excitadores (despolarizantes) o inhibidores (hiperpolarizantes) y, en algunas neuronas sensoriales, sus efectos combinados pueden despolarizar el montículo del axón lo suficiente como para provocar potenciales de acción. Algunos ejemplos en humanos incluyen la neurona receptora olfativa y el corpúsculo de Meissner , que son fundamentales para el sentido del olfato y el tacto , respectivamente. Sin embargo, no todas las neuronas sensoriales convierten sus señales externas en potenciales de acción; algunos ni siquiera tienen axón. [31] En cambio, pueden convertir la señal en la liberación de un neurotransmisor , o en potenciales graduados continuos , cualquiera de los cuales puede estimular las neuronas posteriores para que activen un potencial de acción. Por ejemplo, en el oído humano , las células ciliadas convierten el sonido entrante en la apertura y cierre de canales iónicos activados mecánicamente , lo que puede provocar la liberación de moléculas de neurotransmisores . De manera similar, en la retina humana, las células fotorreceptoras iniciales y la siguiente capa de células (que comprende células bipolares y células horizontales ) no producen potenciales de acción; sólo algunas células amacrinas y la tercera capa, las células ganglionares , producen potenciales de acción, que luego viajan hacia el nervio óptico .
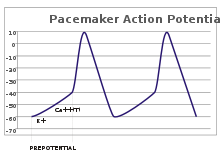
En las neuronas sensoriales, los potenciales de acción resultan de un estímulo externo. Sin embargo, algunas células excitables no requieren tal estímulo para activarse: despolarizan espontáneamente su cono de axón y disparan potenciales de acción a un ritmo regular, como un reloj interno. [32] Las trazas de voltaje de tales células se conocen como potenciales de marcapasos . [33] Las células marcapasos del nódulo sinoauricular del corazón son un buen ejemplo. [g] Aunque tales potenciales de marcapasos tienen un ritmo natural , pueden ajustarse mediante estímulos externos; por ejemplo, la frecuencia cardíaca puede verse alterada por productos farmacéuticos, así como por señales de los nervios simpáticos y parasimpáticos . [34] Los estímulos externos no provocan la activación repetitiva de la célula, sino que simplemente alteran su sincronización. [33] En algunos casos, la regulación de la frecuencia puede ser más compleja, lo que lleva a patrones de potenciales de acción, como el estallido .
El curso del potencial de acción se puede dividir en cinco partes: la fase ascendente, la fase máxima, la fase descendente, la fase insuficiente y el período refractario. Durante la fase ascendente, el potencial de membrana se despolariza (se vuelve más positivo). El punto en el que se detiene la despolarización se llama fase máxima. En esta etapa, el potencial de membrana alcanza un máximo. Después de esto, hay una fase de caída. Durante esta etapa el potencial de membrana se vuelve más negativo, volviendo al potencial de reposo. La fase insuficiente, o posthiperpolarización , es el período durante el cual el potencial de membrana se carga temporalmente más negativamente que cuando está en reposo (hiperpolarizado). Finalmente, se denomina período refractario al tiempo durante el cual es imposible o difícil disparar un potencial de acción posterior , que puede superponerse con las demás fases. [35]
El curso del potencial de acción está determinado por dos efectos acoplados. [36] Primero, los canales iónicos sensibles al voltaje se abren y cierran en respuesta a cambios en el voltaje de la membrana V m . Esto cambia la permeabilidad de la membrana a esos iones. [37] En segundo lugar , según la ecuación de Goldman , este cambio en la permeabilidad cambia el potencial de equilibrio Em y, por tanto, el voltaje de membrana V m . [h] Por lo tanto, el potencial de membrana afecta la permeabilidad, que luego afecta aún más el potencial de membrana. Esto crea la posibilidad de retroalimentación positiva , que es una parte clave de la fase ascendente del potencial de acción. [7] [10] Un factor que complica la situación es que un solo canal iónico puede tener múltiples "puertas" internas que responden a los cambios en V m de maneras opuestas o a diferentes velocidades. [38] [i] Por ejemplo, aunque aumentar V m abre la mayoría de las puertas en el canal de sodio sensible al voltaje, también cierra la "puerta de inactivación" del canal, aunque más lentamente. [39] Por lo tanto, cuando V m aumenta repentinamente, los canales de sodio se abren inicialmente, pero luego se cierran debido a la inactivación más lenta.
Los voltajes y corrientes del potencial de acción en todas sus fases fueron modelados con precisión por Alan Lloyd Hodgkin y Andrew Huxley en 1952, [i] por lo que recibieron el Premio Nobel de Fisiología o Medicina en 1963. [griego inferior 2] Sin embargo, su modelo considera sólo dos tipos de canales iónicos sensibles al voltaje y hace varias suposiciones sobre ellos, por ejemplo, que sus puertas internas se abren y cierran independientemente una de otra. En realidad, existen muchos tipos de canales iónicos [40] y no siempre se abren y cierran de forma independiente. [j]
Un potencial de acción típico comienza en el montículo del axón [41] con una despolarización suficientemente fuerte, por ejemplo, un estímulo que aumenta V m . Esta despolarización suele ser causada por la inyección de cationes de sodio adicionales en la célula; estos cationes pueden provenir de una amplia variedad de fuentes, como sinapsis químicas , neuronas sensoriales o potenciales marcapasos .
Para una neurona en reposo, hay una alta concentración de iones sodio y cloruro en el líquido extracelular en comparación con el líquido intracelular , mientras que hay una alta concentración de iones potasio en el líquido intracelular en comparación con el líquido extracelular. La diferencia de concentraciones, que hace que los iones se muevan de una concentración alta a una baja , y los efectos electrostáticos (atracción de cargas opuestas) son responsables del movimiento de los iones dentro y fuera de la neurona. El interior de una neurona tiene una carga negativa, en relación con el exterior de la célula, debido al movimiento de K + fuera de la célula. La membrana neuronal es más permeable al K + que a otros iones, lo que permite que este ion salga selectivamente de la célula, a favor de su gradiente de concentración. Este gradiente de concentración junto con los canales de fuga de potasio presentes en la membrana de la neurona provocan una salida de iones de potasio que hacen que el potencial de reposo se acerque a E K ≈ –75 mV. [42] Dado que los iones Na + se encuentran en concentraciones más altas fuera de la célula, las diferencias de concentración y voltaje los impulsan hacia el interior de la célula cuando se abren los canales de Na + . La despolarización abre los canales de sodio y potasio en la membrana, permitiendo que los iones fluyan hacia adentro y hacia afuera del axón, respectivamente. Si la despolarización es pequeña (por ejemplo, aumentando V m de −70 mV a −60 mV), la corriente de salida de potasio supera a la corriente de entrada de sodio y la membrana se repolariza nuevamente a su potencial de reposo normal alrededor de −70 mV. [7] [8] [9] Sin embargo, si la despolarización es lo suficientemente grande, la corriente de entrada de sodio aumenta más que la corriente de salida de potasio y se produce una condición descontrolada ( retroalimentación positiva ): cuanto más corriente de entrada hay, más V m aumenta, lo que a su vez aumenta aún más la corriente entrante. [7] [10] Una despolarización suficientemente fuerte (aumento de V m ) provoca la apertura de los canales de sodio sensibles al voltaje; la creciente permeabilidad al sodio acerca a V m al voltaje de equilibrio del sodio E Na ≈ +55 mV. El aumento de voltaje, a su vez, hace que se abran aún más canales de sodio, lo que empuja a V m aún más hacia E Na . Esta retroalimentación positiva continúa hasta que los canales de sodio están completamente abiertos y V m está cerca de E Na . [7] [8] [20][21] El fuerte aumento en V m y la permeabilidad del sodio corresponden a la fase ascendente del potencial de acción. [7] [8] [20] [21]
El voltaje umbral crítico para esta condición desbocada suele ser de alrededor de -45 mV, pero depende de la actividad reciente del axón. Una célula que acaba de disparar un potencial de acción no puede disparar otro inmediatamente, ya que los canales de Na + no se han recuperado del estado inactivado. El período durante el cual no se puede disparar ningún potencial de acción nuevo se llama período refractario absoluto . [43] [44] [45] En tiempos más largos, después de que algunos pero no todos los canales iónicos se hayan recuperado, el axón puede ser estimulado para producir otro potencial de acción, pero con un umbral más alto, lo que requiere una despolarización mucho más fuerte, por ejemplo, a −30 mV. El período durante el cual los potenciales de acción son inusualmente difíciles de evocar se llama período refractario relativo . [43] [44] [45]
La retroalimentación positiva de la fase ascendente se ralentiza y se detiene a medida que los canales iónicos de sodio se abren al máximo. En el pico del potencial de acción, la permeabilidad del sodio se maximiza y el voltaje de membrana Vm es casi igual al voltaje de equilibrio del sodio ENa . Sin embargo, el mismo voltaje elevado que inicialmente abrió los canales de sodio también los cierra lentamente, al cerrar sus poros; Los canales de sodio se inactivan . [39] Esto reduce la permeabilidad de la membrana al sodio en relación con el potasio, lo que hace que el voltaje de la membrana vuelva al valor de reposo. Al mismo tiempo, el voltaje elevado abre canales de potasio sensibles al voltaje; el aumento de la permeabilidad al potasio de la membrana impulsa a V m hacia E K . [39] Combinados, estos cambios en la permeabilidad del sodio y el potasio hacen que V m caiga rápidamente, repolarizando la membrana y produciendo la "fase descendente" del potencial de acción. [43] [46] [21] [47]
El voltaje despolarizado abre canales de potasio adicionales dependientes del voltaje, y algunos de ellos no se cierran inmediatamente cuando la membrana vuelve a su voltaje normal en reposo. Además, se abren más canales de potasio en respuesta a la entrada de iones de calcio durante el potencial de acción. La concentración intracelular de iones potasio es transitoriamente inusualmente baja, lo que hace que el voltaje de membrana V m se acerque aún más al voltaje de equilibrio del potasio E K . El potencial de membrana desciende por debajo del potencial de membrana en reposo. Por lo tanto, hay una hipopolarización o hiperpolarización , denominada poshiperpolarización , que persiste hasta que la permeabilidad del potasio de la membrana vuelve a su valor habitual, restaurando el potencial de membrana al estado de reposo. [48] [46]
A cada potencial de acción le sigue un período refractario , que se puede dividir en un período refractario absoluto , durante el cual es imposible evocar otro potencial de acción, y luego un período refractario relativo , durante el cual se requiere un estímulo más fuerte de lo habitual. [43] [44] [45] Estos dos períodos refractarios son causados por cambios en el estado de las moléculas de los canales de sodio y potasio. Cuando se cierran después de un potencial de acción, los canales de sodio entran en un estado "inactivado" , en el que no se puede hacer que se abran independientemente del potencial de membrana; esto da lugar al período refractario absoluto. Incluso después de que un número suficiente de canales de sodio hayan vuelto a su estado de reposo, sucede con frecuencia que una fracción de los canales de potasio permanece abierta, lo que dificulta la despolarización del potencial de membrana y, por lo tanto, da lugar al período refractario relativo. Debido a que la densidad y los subtipos de canales de potasio pueden diferir mucho entre los diferentes tipos de neuronas, la duración del período refractario relativo es muy variable.
El período refractario absoluto es en gran medida responsable de la propagación unidireccional de los potenciales de acción a lo largo de los axones. [49] En cualquier momento dado, el parche del axón detrás de la parte que se activa activamente es refractario, pero el parche en frente, al no haber sido activado recientemente, es capaz de ser estimulado por la despolarización del potencial de acción.
El potencial de acción generado en el cono del axón se propaga como una onda a lo largo del axón. [50] Las corrientes que fluyen hacia el interior en un punto del axón durante un potencial de acción se extienden a lo largo del axón y despolarizan las secciones adyacentes de su membrana. Si es lo suficientemente fuerte, esta despolarización provoca un potencial de acción similar en las zonas de membrana vecinas. Este mecanismo básico fue demostrado por Alan Lloyd Hodgkin en 1937. Después de aplastar o enfriar segmentos nerviosos y bloquear así los potenciales de acción, demostró que un potencial de acción que llegaba a un lado del bloqueo podía provocar otro potencial de acción en el otro, siempre que el El segmento bloqueado era suficientemente corto. [k]
Una vez que se ha producido un potencial de acción en un parche de membrana, el parche de membrana necesita tiempo para recuperarse antes de poder dispararse nuevamente. A nivel molecular, este período refractario absoluto corresponde al tiempo necesario para que los canales de sodio activados por voltaje se recuperen de la inactivación, es decir, vuelvan a su estado cerrado. [44] Hay muchos tipos de canales de potasio activados por voltaje en las neuronas. Algunas de ellas se inactivan rápidamente (corrientes tipo A) y otras se inactivan lentamente o no se inactivan en absoluto; esta variabilidad garantiza que siempre habrá una fuente de corriente disponible para la repolarización, incluso si algunos de los canales de potasio están inactivados debido a una despolarización anterior. Por otro lado, todos los canales de sodio neuronales activados por voltaje se inactivan en varios milisegundos durante una despolarización fuerte, lo que hace imposible la siguiente despolarización hasta que una fracción sustancial de los canales de sodio haya regresado a su estado cerrado. Aunque limita la frecuencia de disparo, [51] el período refractario absoluto garantiza que el potencial de acción se mueva en una sola dirección a lo largo de un axón. [49] Las corrientes que fluyen debido a un potencial de acción se extienden en ambas direcciones a lo largo del axón. [52] Sin embargo, sólo la parte no disparada del axón puede responder con un potencial de acción; la parte que acaba de disparar no responde hasta que el potencial de acción está fuera de alcance de manera segura y no puede reestimular esa parte. En la conducción ortodrómica habitual , el potencial de acción se propaga desde el montículo del axón hacia los botones sinápticos (los extremos axonales); la propagación en la dirección opuesta, conocida como conducción antidrómica , es muy rara. [53] Sin embargo, si un axón de laboratorio se estimula en su centro, ambas mitades del axón están "frescas", es decir, sin disparar; luego se generarán dos potenciales de acción, uno que viaja hacia el cono del axón y el otro que viaja hacia las perillas sinápticas.

Para permitir una transducción rápida y eficiente de señales eléctricas en el sistema nervioso, ciertos axones neuronales están cubiertos con vainas de mielina . La mielina es una membrana multilamelar que envuelve el axón en segmentos separados por intervalos conocidos como nódulos de Ranvier . Es producido por células especializadas: células de Schwann exclusivamente en el sistema nervioso periférico , y oligodendrocitos exclusivamente en el sistema nervioso central . La vaina de mielina reduce la capacitancia de la membrana y aumenta la resistencia de la membrana en los intervalos entre nodos, permitiendo así un movimiento rápido y saltador de los potenciales de acción de un nodo a otro. [l] [m] [n] La mielinización se encuentra principalmente en los vertebrados , pero se ha descubierto un sistema análogo en algunos invertebrados, como algunas especies de camarones . [o] No todas las neuronas de los vertebrados están mielinizadas; por ejemplo, los axones de las neuronas que componen el sistema nervioso autónomo no están, en general, mielinizados.
La mielina impide que los iones entren o salgan del axón a lo largo de segmentos mielinizados. Como regla general, la mielinización aumenta la velocidad de conducción de los potenciales de acción y los hace más eficientes energéticamente. Ya sea saltatorio o no, la velocidad media de conducción de un potencial de acción oscila entre 1 metro por segundo (m/s) y más de 100 m/s y, en general, aumenta con el diámetro axonal. [pag]
Los potenciales de acción no pueden propagarse a través de la membrana en los segmentos mielinizados del axón. Sin embargo, la corriente es transportada por el citoplasma, que es suficiente para despolarizar el primer o segundo nódulo de Ranvier posterior . En cambio, la corriente iónica de un potencial de acción en un nodo de Ranvier provoca otro potencial de acción en el siguiente nodo; este aparente "salto" del potencial de acción de un nodo a otro se conoce como conducción saltatoria . Aunque el mecanismo de la conducción saltatoria fue sugerido en 1925 por Ralph Lillie, [q] la primera evidencia experimental de la conducción saltatoria provino de Ichiji Tasaki [r] y Taiji Takeuchi [s] [54] y de Andrew Huxley y Robert Stämpfli. [t] Por el contrario, en los axones amielínicos, el potencial de acción provoca otro en la membrana inmediatamente adyacente y se mueve continuamente hacia abajo por el axón como una onda.

La mielina tiene dos ventajas importantes: velocidad de conducción rápida y eficiencia energética. Para axones mayores que un diámetro mínimo (aproximadamente 1 micrómetro ), la mielinización aumenta la velocidad de conducción de un potencial de acción, típicamente diez veces. [v] Por el contrario, para una velocidad de conducción determinada, las fibras mielinizadas son más pequeñas que sus contrapartes no mielinizadas. Por ejemplo, los potenciales de acción se mueven aproximadamente a la misma velocidad (25 m/s) en el axón de una rana mielinizada y en el axón de un calamar gigante no mielinizado , pero el axón de la rana tiene un diámetro aproximadamente 30 veces menor y un área de sección transversal 1000 veces menor. . Además, dado que las corrientes iónicas están confinadas a los nodos de Ranvier, muchos menos iones "se escapan" a través de la membrana, lo que ahorra energía metabólica. Este ahorro supone una importante ventaja selectiva , ya que el sistema nervioso humano utiliza aproximadamente el 20% de la energía metabólica del cuerpo. [v]
La longitud de los segmentos mielinizados de los axones es importante para el éxito de la conducción saltatoria. Deben ser lo más largos posible para maximizar la velocidad de conducción, pero no tan largos como para que la señal entrante sea demasiado débil para provocar un potencial de acción en el siguiente nodo de Ranvier. En la naturaleza, los segmentos mielinizados generalmente son lo suficientemente largos para que la señal propagada pasivamente viaje por al menos dos nodos mientras conserva suficiente amplitud para disparar un potencial de acción en el segundo o tercer nodo. Por lo tanto, el factor de seguridad de la conducción saltatoria es alto, lo que permite que la transmisión evite los nodos en caso de lesión. Sin embargo, los potenciales de acción pueden terminar prematuramente en ciertos lugares donde el factor de seguridad es bajo, incluso en neuronas amielínicas; un ejemplo común es el punto de ramificación de un axón, donde se divide en dos axones. [56]
Algunas enfermedades degradan la mielina y alteran la conducción saltatoria, lo que reduce la velocidad de conducción de los potenciales de acción. [w] El más conocido de ellos es la esclerosis múltiple , en la que la degradación de la mielina altera el movimiento coordinado. [57]

El flujo de corrientes dentro de un axón puede describirse cuantitativamente mediante la teoría del cable [58] y sus elaboraciones, como el modelo compartimental. [59] La teoría del cable fue desarrollada en 1855 por Lord Kelvin para modelar el cable telegráfico transatlántico [x] y Hodgkin y Rushton demostraron que era relevante para las neuronas en 1946. [y] En la teoría del cable simple, la neurona se trata como una cable de transmisión eléctricamente pasivo, perfectamente cilíndrico, que puede describirse mediante una ecuación diferencial parcial [58]
donde V ( x , t ) es el voltaje a través de la membrana en un momento t y una posición x a lo largo de la neurona, y donde λ y τ son las escalas características de longitud y tiempo en las que esos voltajes decaen en respuesta a un estímulo . Con referencia al diagrama de circuito de la derecha, estas escalas se pueden determinar a partir de las resistencias y capacitancias por unidad de longitud. [60]
Estas escalas de tiempo y longitud se pueden utilizar para comprender la dependencia de la velocidad de conducción del diámetro de la neurona en fibras amielínicas. Por ejemplo, la escala de tiempo τ aumenta tanto con la resistencia de la membrana r m como con la capacitancia cm . A medida que aumenta la capacitancia, se debe transferir más carga para producir un voltaje transmembrana determinado (según la ecuación Q = CV ); A medida que aumenta la resistencia, se transfiere menos carga por unidad de tiempo, lo que hace que el equilibrio sea más lento. De manera similar, si la resistencia interna por unidad de longitud r i es menor en un axón que en otro (por ejemplo, porque el radio del primero es mayor), la longitud de desintegración espacial λ se vuelve más larga y la velocidad de conducción de un potencial de acción debería aumentar. Si se aumenta la resistencia transmembrana r m , se reduce la corriente de "fuga" promedio a través de la membrana, lo que también hace que λ se alargue, aumentando la velocidad de conducción.
En general, los potenciales de acción que alcanzan los botones sinápticos provocan la liberación de un neurotransmisor en la hendidura sináptica. [z] Los neurotransmisores son moléculas pequeñas que pueden abrir canales iónicos en la célula postsináptica; la mayoría de los axones tienen el mismo neurotransmisor en todos sus extremos. La llegada del potencial de acción abre canales de calcio sensibles al voltaje en la membrana presináptica; la entrada de calcio hace que las vesículas llenas de neurotransmisor migren a la superficie de la célula y liberen su contenido en la hendidura sináptica . [aa] Este complejo proceso es inhibido por las neurotoxinas tetanospasmina y toxina botulínica , que son responsables del tétanos y el botulismo , respectivamente. [ab]

Algunas sinapsis prescinden del "intermediario" del neurotransmisor y conectan las células presinápticas y postsinápticas. [ac] Cuando un potencial de acción alcanza dicha sinapsis, las corrientes iónicas que fluyen hacia la célula presináptica pueden cruzar la barrera de las dos membranas celulares y entrar en la célula postsináptica a través de poros conocidos como conexiones . [ad] Por lo tanto, las corrientes iónicas del potencial de acción presináptico pueden estimular directamente la célula postsináptica. Las sinapsis eléctricas permiten una transmisión más rápida porque no requieren la difusión lenta de neurotransmisores a través de la hendidura sináptica. Por lo tanto, las sinapsis eléctricas se utilizan siempre que la respuesta rápida y la coordinación del tiempo son cruciales, como en los reflejos de escape , la retina de los vertebrados y el corazón .
Un caso especial de sinapsis química es la unión neuromuscular , en la que el axón de una neurona motora termina en una fibra muscular . [ae] En tales casos, el neurotransmisor liberado es acetilcolina , que se une al receptor de acetilcolina, una proteína de membrana integral en la membrana (el sarcolema ) de la fibra muscular. [af] Sin embargo, la acetilcolina no permanece unida; más bien, se disocia y es hidrolizado por la enzima acetilcolinesterasa , ubicada en la sinapsis. Esta enzima reduce rápidamente el estímulo al músculo, lo que permite regular delicadamente el grado y el momento de la contracción muscular. Algunos venenos inactivan la acetilcolinesterasa para impedir este control, como los agentes nerviosos sarín y tabún , [ag] y los insecticidas diazinón y malatión . [ah]

El potencial de acción cardíaco se diferencia del potencial de acción neuronal por tener una meseta extendida, en la que la membrana se mantiene a un alto voltaje durante unos cientos de milisegundos antes de ser repolarizada por la corriente de potasio como de costumbre. [ai] Esta meseta se debe a la acción de canales de calcio más lentos que abren y mantienen el voltaje de la membrana cerca de su potencial de equilibrio incluso después de que los canales de sodio se hayan inactivado.
El potencial de acción cardíaco juega un papel importante en la coordinación de la contracción del corazón. [ai] Las células cardíacas del nódulo sinoauricular proporcionan el potencial de marcapasos que sincroniza el corazón. Los potenciales de acción de esas células se propagan hacia y a través del nódulo auriculoventricular (nódulo AV), que normalmente es la única vía de conducción entre las aurículas y los ventrículos . Los potenciales de acción del nódulo AV viajan a través del haz de His y de allí a las fibras de Purkinje . [nota 2] Por el contrario, las anomalías en el potencial de acción cardíaco, ya sea debido a una mutación congénita o a una lesión, pueden provocar patologías humanas, especialmente arritmias . [ai] Varios fármacos antiarritmia actúan sobre el potencial de acción cardíaco, como la quinidina , la lidocaína , los betabloqueantes y el verapamilo . [aj]
El potencial de acción en una célula del músculo esquelético normal es similar al potencial de acción en las neuronas. [61] Los potenciales de acción resultan de la despolarización de la membrana celular (el sarcolema ), que abre canales de sodio sensibles al voltaje; estos se inactivan y la membrana se repolariza mediante la corriente de salida de iones potasio. El potencial de reposo antes del potencial de acción suele ser de -90 mV, algo más negativo que el de las neuronas típicas. El potencial de acción muscular dura aproximadamente 2 a 4 ms, el período refractario absoluto es aproximadamente 1 a 3 ms y la velocidad de conducción a lo largo del músculo es aproximadamente 5 m/s. El potencial de acción libera iones de calcio que liberan tropomiosina y permiten que el músculo se contraiga. Los potenciales de acción muscular son provocados por la llegada de un potencial de acción neuronal presináptico a la unión neuromuscular , que es un objetivo común de las neurotoxinas . [ag]
Las células vegetales y fúngicas [ak] también son excitables eléctricamente. La diferencia fundamental con los potenciales de acción animales es que la despolarización en las células vegetales no se logra mediante la absorción de iones sodio positivos, sino mediante la liberación de iones cloruro negativos . [al] [am] [an] En 1906, JC Bose publicó las primeras mediciones de potenciales de acción en plantas, que habían sido descubiertos previamente por Burdon-Sanderson y Darwin. [62] Un aumento en los iones de calcio citoplasmáticos puede ser la causa de la liberación de aniones en la célula. Esto convierte al calcio en un precursor de los movimientos iónicos, como la entrada de iones de cloruro negativos y la salida de iones de potasio positivos, como se observa en las hojas de cebada. [63]
La entrada inicial de iones de calcio también plantea una pequeña despolarización celular, lo que hace que los canales iónicos dependientes de voltaje se abran y permite que los iones de cloruro propaguen la despolarización completa.
Algunas plantas (por ejemplo, Dionaea muscipula ) utilizan canales regulados por sodio para realizar movimientos y esencialmente "contar". Dionaea muscipula , también conocida como Venus atrapamoscas, se encuentra en humedales subtropicales de Carolina del Norte y del Sur. [64] Cuando hay pocos nutrientes en el suelo, la trampa para moscas depende de una dieta de insectos y animales. [65] A pesar de la investigación sobre la planta, falta una comprensión detrás de las bases moleculares de las Venus atrapamoscas y de las plantas carnívoras en general. [66]
Sin embargo, se han realizado muchas investigaciones sobre los potenciales de acción y cómo afectan el movimiento y el mecanismo de relojería dentro de la Venus atrapamoscas. Para empezar, el potencial de membrana en reposo de la Venus atrapamoscas (-120 mV) es menor que el de las células animales (normalmente -90 mV a -40 mV). [66] [67] El potencial de reposo más bajo hace que sea más fácil activar un potencial de acción. Así, cuando un insecto aterriza en la trampa de la planta, activa un mecanorreceptor parecido a un pelo. [66] Este receptor activa entonces un potencial de acción que dura alrededor de 1,5 ms. [68] En última instancia, esto provoca un aumento de iones de calcio positivos en la célula, despolarizándola ligeramente.
Sin embargo, la trampa para moscas no se cierra después de un disparo. En cambio, requiere la activación de 2 o más pelos. [65] [66] Si solo se activa un cabello, arroja la activación como un falso positivo. Además, el segundo cabello debe activarse dentro de un cierto intervalo de tiempo (0,75 s - 40 s) para que se registre con la primera activación. [66] Por lo tanto, comienza una acumulación de calcio que disminuye lentamente desde el primer desencadenante. Cuando el segundo potencial de acción se activa dentro del intervalo de tiempo, alcanza el umbral de calcio para despolarizar la célula, cerrando la trampa sobre la presa en una fracción de segundo. [66]
Junto con la posterior liberación de iones potasio positivos, el potencial de acción en las plantas implica una pérdida osmótica de sal (KCl). Mientras que el potencial de acción animal es osmóticamente neutro porque cantidades iguales de sodio que entra y potasio que sale se cancelan osmóticamente entre sí. La interacción de las relaciones eléctricas y osmóticas en las células vegetales [ao] parece haber surgido de una función osmótica de la excitabilidad eléctrica en ancestros unicelulares comunes de plantas y animales bajo condiciones de salinidad cambiantes. Además, la función actual de transmisión rápida de señales se considera un logro más reciente de las células metazoarias en un entorno osmótico más estable. [69] Es probable que la función de señalización familiar de los potenciales de acción en algunas plantas vasculares (por ejemplo, Mimosa pudica ) surgiera independientemente de la de las células excitables de los metazoos.
A diferencia de la fase ascendente y el pico, la fase descendente y la poshiperpolarización parecen depender principalmente de cationes que no son calcio. Para iniciar la repolarización, la célula requiere el movimiento de potasio fuera de la célula mediante transporte pasivo a través de la membrana. Esta se diferencia de las neuronas porque el movimiento del potasio no domina la disminución del potencial de membrana; De hecho, para repolarizarse completamente, una célula vegetal necesita energía en forma de ATP para ayudar a liberar hidrógeno de la célula, utilizando un transportador comúnmente conocido como H+-ATPasa. [70] [66]
Los potenciales de acción se encuentran en todos los organismos multicelulares , incluidas las plantas , los invertebrados como los insectos y los vertebrados como los reptiles y los mamíferos . [ap] Las esponjas parecen ser el principal filo de eucariotas multicelulares que no transmiten potenciales de acción, aunque algunos estudios han sugerido que estos organismos también tienen una forma de señalización eléctrica. [aq] El potencial de reposo, así como el tamaño y la duración del potencial de acción, no han variado mucho con la evolución, aunque la velocidad de conducción sí varía dramáticamente con el diámetro axonal y la mielinización.
Dada su conservación a lo largo de la evolución, el potencial de acción parece conferir ventajas evolutivas. Una función de los potenciales de acción es la señalización rápida y de largo alcance dentro del organismo; la velocidad de conducción puede exceder los 110 m/s, que es un tercio de la velocidad del sonido . En comparación, una molécula hormonal transportada por el torrente sanguíneo se mueve a aproximadamente 8 m/s en las arterias grandes. Parte de esta función es la estrecha coordinación de eventos mecánicos, como la contracción del corazón. Una segunda función es el cálculo asociado a su generación. Al ser una señal de todo o nada que no decae con la distancia de transmisión, el potencial de acción tiene ventajas similares a las de la electrónica digital . La integración de varias señales dendríticas en el montículo del axón y su umbral para formar un tren complejo de potenciales de acción es otra forma de computación, que se ha explotado biológicamente para formar generadores de patrones centrales y se ha imitado en redes neuronales artificiales .
Se cree que el ancestro común procariótico/eucariota, que vivió hace quizás cuatro mil millones de años, tenía canales dependientes de voltaje. Es probable que esta funcionalidad, en algún momento posterior, tuviera propósitos cruzados para proporcionar un mecanismo de comunicación. Incluso las bacterias unicelulares modernas pueden utilizar potenciales de acción para comunicarse con otras bacterias en la misma biopelícula . [72]

El estudio de los potenciales de acción ha requerido el desarrollo de nuevos métodos experimentales. El trabajo inicial, anterior a 1955, fue realizado principalmente por Alan Lloyd Hodgkin y Andrew Fielding Huxley , quienes, junto con John Carew Eccles , recibieron el Premio Nobel de Fisiología o Medicina en 1963 por su contribución a la descripción de la base iónica de los nervios. conducción. Se centró en tres objetivos: aislar señales de neuronas o axones individuales, desarrollar componentes electrónicos rápidos y sensibles y reducir los electrodos lo suficiente como para poder registrar el voltaje dentro de una sola célula.
El primer problema se resolvió estudiando los axones gigantes que se encuentran en las neuronas del calamar ( Loligo forbesii y Doryteuthis pealeii , en su momento clasificados como Loligo pealeii ). [ar] Estos axones tienen un diámetro tan grande (aproximadamente 1 mm, o 100 veces más grande que una neurona típica) que pueden verse a simple vista, lo que los hace fáciles de extraer y manipular. [i] [as] Sin embargo, no son representativos de todas las células excitables y se han estudiado muchos otros sistemas con potenciales de acción.
El segundo problema se abordó con el desarrollo crucial de la pinza de voltaje , [en] que permitió a los experimentadores estudiar las corrientes iónicas subyacentes a un potencial de acción de forma aislada y eliminó una fuente clave de ruido electrónico , la corriente I C asociada con la capacitancia C. de la membrana. [74] Dado que la corriente es igual a C multiplicado por la tasa de cambio del voltaje transmembrana V m , la solución fue diseñar un circuito que mantuviera V m fijo (tasa de cambio cero) independientemente de las corrientes que fluyeran a través de la membrana. Por tanto, la corriente necesaria para mantener V m en un valor fijo es un reflejo directo de la corriente que fluye a través de la membrana. Otros avances electrónicos incluyeron el uso de jaulas de Faraday y electrónica con alta impedancia de entrada , de modo que la medición en sí no afectaba el voltaje que se estaba midiendo. [75]
El tercer problema, el de obtener electrodos lo suficientemente pequeños como para registrar voltajes dentro de un solo axón sin perturbarlo, se resolvió en 1949 con la invención del electrodo de micropipeta de vidrio, [au] que fue rápidamente adoptado por otros investigadores. [av] [aw] Los refinamientos de este método pueden producir puntas de electrodos que son tan finas como 100 Å (10 nm ), lo que también confiere una alta impedancia de entrada. [76] Los potenciales de acción también se pueden registrar con pequeños electrodos metálicos colocados justo al lado de una neurona, con neurochips que contienen EOSFET u ópticamente con tintes que son sensibles al Ca 2+ o al voltaje. [hacha]

Mientras que los electrodos de micropipeta de vidrio miden la suma de las corrientes que pasan a través de muchos canales iónicos, el estudio de las propiedades eléctricas de un solo canal iónico se hizo posible en la década de 1970 con el desarrollo de la pinza de parche por parte de Erwin Neher y Bert Sakmann . Por este descubrimiento, recibieron el Premio Nobel de Fisiología o Medicina en 1991. [griego inferior 3] La fijación mediante parche comprobó que los canales iónicos tienen estados discretos de conductancia, como abiertos, cerrados e inactivados.
En los últimos años se han desarrollado tecnologías de imágenes ópticas para medir los potenciales de acción, ya sea mediante grabaciones simultáneas en múltiples sitios o con resolución ultraespacial. Utilizando colorantes sensibles al voltaje , se han registrado ópticamente potenciales de acción a partir de una pequeña porción de membrana de cardiomiocitos . [sí]

Varias neurotoxinas , tanto naturales como sintéticas, están diseñadas para bloquear el potencial de acción. La tetrodotoxina del pez globo y la saxitoxina del Gonyaulax (el género de dinoflagelados responsable de las " mareas rojas ") bloquean los potenciales de acción inhibiendo el canal de sodio sensible al voltaje; [az] de manera similar, la dendrotoxina de la serpiente mamba negra inhibe el canal de potasio sensible al voltaje. Estos inhibidores de canales iónicos cumplen un importante propósito de investigación, al permitir a los científicos "desactivar" canales específicos a voluntad, aislando así las contribuciones de los otros canales; también pueden ser útiles para purificar canales iónicos mediante cromatografía de afinidad o para analizar su concentración. Sin embargo, estos inhibidores también producen neurotoxinas eficaces y se ha considerado su uso como armas químicas . Las neurotoxinas dirigidas a los canales iónicos de los insectos han sido insecticidas eficaces ; un ejemplo es la permetrina sintética , que prolonga la activación de los canales de sodio implicados en los potenciales de acción. Los canales iónicos de los insectos son lo suficientemente diferentes de los de sus homólogos humanos como para que existan pocos efectos secundarios en los humanos.

El papel de la electricidad en el sistema nervioso de los animales fue observado por primera vez en ranas disecadas por Luigi Galvani , quien la estudió entre 1791 y 1797. [ba] Los resultados de Galvani inspiraron a Alessandro Volta a desarrollar la pila voltaica , la batería eléctrica más antigua conocida , con en el que estudió la electricidad animal (como las anguilas eléctricas ) y las respuestas fisiológicas a los voltajes de corriente continua aplicados . [cama y desayuno]
En el siglo XIX, los científicos estudiaron la propagación de señales eléctricas en nervios completos (es decir, haces de neuronas ) y demostraron que el tejido nervioso estaba formado por células , en lugar de una red interconectada de tubos (un retículo ). [77] Carlo Matteucci siguió los estudios de Galvani y demostró que los nervios y músculos lesionados de las ranas podían producir corriente continua . El trabajo de Matteucci inspiró al fisiólogo alemán Emil du Bois-Reymond , quien descubrió en 1843 que la estimulación de estas preparaciones musculares y nerviosas producía una notable disminución de sus corrientes en reposo, lo que lo convirtió en el primer investigador en identificar la naturaleza eléctrica del potencial de acción. [78] La velocidad de conducción de los potenciales de acción fue medida en 1850 por el amigo de du Bois-Reymond, Hermann von Helmholtz . [79] El progreso en electrofisiología se estancó posteriormente debido a las limitaciones de la teoría química y la práctica experimental. Para establecer que el tejido nervioso está formado por células discretas, el médico español Santiago Ramón y Cajal y sus alumnos utilizaron una tinción desarrollada por Camillo Golgi para revelar las innumerables formas de las neuronas, que representaron minuciosamente. Por sus descubrimientos, Golgi y Ramón y Cajal recibieron el Premio Nobel de Fisiología en 1906 . [griego inferior 4] Su trabajo resolvió una controversia de larga data en la neuroanatomía del siglo XIX; El propio Golgi había defendido el modelo de red del sistema nervioso.

El siglo XX vio importantes avances en electrofisiología. En 1902 y nuevamente en 1912, Julius Bernstein propuso la hipótesis de que el potencial de acción resultaba de un cambio en la permeabilidad de la membrana axonal a los iones. [bc] [80] La hipótesis de Bernstein fue confirmada por Ken Cole y Howard Curtis, quienes demostraron que la conductancia de la membrana aumenta durante un potencial de acción. [bd] En 1907, Louis Lapicque sugirió que el potencial de acción se generaba cuando se cruzaba un umbral, [siendo] lo que más tarde se mostraría como un producto de los sistemas dinámicos de conductancias iónicas. En 1949, Alan Hodgkin y Bernard Katz refinaron la hipótesis de Bernstein al considerar que la membrana axonal podría tener diferentes permeabilidades a diferentes iones; en particular, demostraron el papel crucial de la permeabilidad del sodio para el potencial de acción. [bf] Hicieron el primer registro real de los cambios eléctricos a través de la membrana neuronal que median el potencial de acción. [griego inferior 5] Esta línea de investigación culminó en los cinco artículos de 1952 de Hodgkin, Katz y Andrew Huxley , en los que aplicaron la técnica de fijación de voltaje para determinar la dependencia de las permeabilidades de la membrana axonal a los iones de sodio y potasio del voltaje y el tiempo. , a partir del cual pudieron reconstruir cuantitativamente el potencial de acción. [i] Hodgkin y Huxley correlacionaron las propiedades de su modelo matemático con canales iónicos discretos que podrían existir en varios estados diferentes, incluidos "abierto", "cerrado" e "inactivado". Sus hipótesis fueron confirmadas a mediados de los años 1970 y 1980 por Erwin Neher y Bert Sakmann , quienes desarrollaron la técnica de sujeción con parche para examinar los estados de conductancia de canales iónicos individuales. [bg] En el siglo XXI, los investigadores están comenzando a comprender la base estructural de estos estados de conductancia y de la selectividad de los canales para sus especies de iones, [bh] a través de las estructuras cristalinas de resolución atómica , [bi] mediciones de distancia de fluorescencia [ bj] y estudios de microscopía crioelectrónica . [bk]
Julius Bernstein también fue el primero en introducir la ecuación de Nernst para el potencial de reposo a través de la membrana; esto fue generalizado por David E. Goldman a la ecuación homónima de Goldman en 1943. [h] La bomba de sodio-potasio fue identificada en 1957 [bl] [griego inferior 6] y sus propiedades se dilucidaron gradualmente, [bm] [bn] [ bo] culminando en la determinación de su estructura de resolución atómica mediante cristalografía de rayos X. [pb] También se han resuelto las estructuras cristalinas de bombas iónicas relacionadas, lo que proporciona una visión más amplia de cómo funcionan estas máquinas moleculares . [bq]

Los modelos matemáticos y computacionales son esenciales para comprender el potencial de acción y ofrecen predicciones que pueden contrastarse con datos experimentales, proporcionando una prueba rigurosa de una teoría. El más importante y preciso de los primeros modelos neuronales es el modelo de Hodgkin-Huxley , que describe el potencial de acción mediante un conjunto acoplado de cuatro ecuaciones diferenciales ordinarias (EDO). [i] Aunque el modelo de Hodgkin-Huxley puede ser una simplificación con pocas limitaciones [81] en comparación con la membrana nerviosa realista tal como existe en la naturaleza, su complejidad ha inspirado varios modelos aún más simplificados, [82] [br] tales como el modelo de Morris-Lecar [bs] y el modelo de FitzHugh-Nagumo , [bt] , los cuales tienen sólo dos EDO acopladas. Las propiedades de los modelos Hodgkin-Huxley y FitzHugh-Nagumo y sus parientes, como el modelo Bonhoeffer-Van der Pol, [bu] han sido bien estudiadas en matemáticas, [83] [bv] computación [84] y electrónica. [bw] Sin embargo, los modelos simples de potencial generador y potencial de acción no logran reproducir con precisión la tasa de pico neural cercana al umbral y la forma de pico, específicamente para los mecanorreceptores como el corpúsculo de Pacini . [85] La investigación más moderna se ha centrado en sistemas más grandes e integrados; al unir modelos de potencial de acción con modelos de otras partes del sistema nervioso (como dendritas y sinapsis), los investigadores pueden estudiar la computación neuronal [86] y reflejos simples , como los reflejos de escape y otros controlados por generadores de patrones centrales . [87] [bx]
{{cite book}}: Mantenimiento CS1: falta el editor de la ubicación ( enlace ){{cite book}}: |journal=ignorado ( ayuda ){{cite book}}: |journal=ignorado ( ayuda )