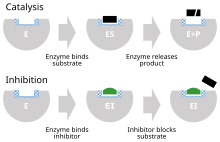
Un inhibidor de enzima es una molécula que se une a una enzima y bloquea su actividad . Las enzimas son proteínas que aceleran las reacciones químicas necesarias para la vida , en las que las moléculas de sustrato se convierten en productos . [1] Una enzima facilita una reacción química específica al unir el sustrato a su sitio activo , un área especializada en la enzima que acelera el paso más difícil de la reacción .
Un inhibidor enzimático detiene ("inhibe") este proceso, ya sea uniéndose al sitio activo de la enzima (evitando así que el sustrato se una) o uniéndose a otro sitio de la enzima de modo que se bloquea la catálisis de la reacción por parte de la enzima. Los inhibidores enzimáticos pueden unirse de forma reversible o irreversible. Los inhibidores irreversibles forman un enlace químico con la enzima de modo que la enzima queda inhibida hasta que se rompe el enlace químico. Por el contrario, los inhibidores reversibles se unen de forma no covalente y pueden abandonar la enzima de forma espontánea, lo que permite que la enzima reanude su función. Los inhibidores reversibles producen diferentes tipos de inhibición según se unan a la enzima, al complejo enzima-sustrato o a ambos.
Los inhibidores enzimáticos desempeñan un papel importante en todas las células, ya que generalmente son específicos de una enzima cada uno y sirven para controlar la actividad de esa enzima. Por ejemplo, las enzimas en una vía metabólica pueden ser inhibidas por moléculas producidas más tarde en la vía, lo que reduce la producción de moléculas que ya no son necesarias. Este tipo de retroalimentación negativa es una forma importante de mantener el equilibrio en una célula . [2] Los inhibidores enzimáticos también controlan enzimas esenciales como las proteasas o nucleasas que, si no se controlan, pueden dañar una célula. Muchos venenos producidos por animales o plantas son inhibidores enzimáticos que bloquean la actividad de enzimas cruciales en presas o depredadores .
Muchas moléculas de fármacos son inhibidores enzimáticos que inhiben una enzima humana aberrante o una enzima crítica para la supervivencia de un patógeno como un virus , bacteria o parásito . Algunos ejemplos incluyen el metotrexato (usado en quimioterapia y en el tratamiento de la artritis reumática ) y los inhibidores de la proteasa utilizados para tratar el VIH/SIDA . Dado que los inhibidores antipatógenos generalmente se dirigen solo a una enzima, estos fármacos son altamente específicos y generalmente producen pocos efectos secundarios en humanos, siempre que no se encuentre una enzima análoga en humanos. (Este es a menudo el caso, ya que estos patógenos y los humanos son genéticamente distantes ). Los inhibidores enzimáticos medicinales a menudo tienen constantes de disociación bajas , lo que significa que solo se requiere una cantidad mínima del inhibidor para inhibir la enzima. Una baja concentración del inhibidor enzimático reduce el riesgo de daño hepático y renal y otras reacciones adversas a los medicamentos en humanos. Por lo tanto, el descubrimiento y el refinamiento de los inhibidores enzimáticos es un área activa de investigación en bioquímica y farmacología .
Los inhibidores de enzimas son un conjunto químicamente diverso de sustancias que varían en tamaño desde pequeñas moléculas orgánicas hasta proteínas macromoleculares .
Los inhibidores de moléculas pequeñas incluyen metabolitos primarios esenciales que inhiben las enzimas que producen esos metabolitos. Esto proporciona un ciclo de retroalimentación negativa que evita la sobreproducción de metabolitos y, por lo tanto, mantiene la homeostasis celular (condiciones internas estables). [3] [2] Los inhibidores de enzimas de moléculas pequeñas también incluyen metabolitos secundarios , que no son esenciales para el organismo que los produce, pero le brindan al organismo una ventaja evolutiva, ya que pueden usarse para repeler depredadores u organismos competidores o inmovilizar presas. [4] Además, muchos medicamentos son inhibidores de enzimas de moléculas pequeñas que se dirigen a enzimas modificadoras de la enfermedad en el paciente [1] : 5 o enzimas en patógenos que son necesarias para el crecimiento y la reproducción del patógeno. [5]
Además de las moléculas pequeñas, algunas proteínas actúan como inhibidores de enzimas. El ejemplo más destacado son las serpinas ( inhibidores de la serina proteasa ) que son producidas por animales para protegerse contra la activación enzimática inapropiada y por plantas para prevenir la depredación. [6] Otra clase de proteínas inhibidoras son los inhibidores de ribonucleasa , que se unen a las ribonucleasas en una de las interacciones proteína-proteína más estrechas conocidas . [7] Un caso especial de inhibidores de enzimas proteicas son los zimógenos que contienen un péptido N-terminal autoinhibitorio que se une al sitio activo de la enzima que bloquea intramolecularmente su actividad como un mecanismo de protección contra la catálisis descontrolada. El péptido N-terminal se escinde (separa) del precursor de la enzima zimógeno por otra enzima para liberar una enzima activa. [8]
El sitio de unión de los inhibidores en las enzimas es más comúnmente el mismo sitio que se une al sustrato de la enzima. Estos inhibidores del sitio activo se conocen como inhibidores ortostéricos (orientación "regular"). [9] El mecanismo de inhibición ortostérica es simplemente evitar la unión del sustrato a la enzima a través de la competencia directa, lo que a su vez evita que la enzima catalice la conversión de sustratos en productos. Alternativamente, el inhibidor puede unirse a un sitio alejado del sitio activo de la enzima. Estos se conocen como inhibidores alostéricos (orientación "alternativa"). [9] Los mecanismos de inhibición alostérica son variados e incluyen cambiar la conformación (forma) de la enzima de modo que ya no pueda unirse al sustrato ( cinéticamente indistinguible de la inhibición ortostérica competitiva) [10] o, alternativamente, estabilizar la unión del sustrato a la enzima pero bloquear la enzima en una conformación que ya no es catalíticamente activa. [11]
Los inhibidores reversibles se unen a las enzimas con interacciones no covalentes, como enlaces de hidrógeno , interacciones hidrofóbicas y enlaces iónicos . [12] Múltiples enlaces débiles entre el inhibidor y el sitio activo de la enzima se combinan para producir una unión fuerte y específica.
A diferencia de los inhibidores irreversibles, los inhibidores reversibles generalmente no experimentan reacciones químicas cuando se unen a la enzima y se pueden eliminar fácilmente por dilución o diálisis . Un caso especial son los inhibidores reversibles covalentes que forman un enlace químico con la enzima, pero el enlace se puede romper, por lo que la inhibición es completamente reversible. [13]
Los inhibidores reversibles generalmente se clasifican en cuatro tipos, según los introdujo Cleland en 1963. [14] Se clasifican según el efecto del inhibidor en la Vmax ( velocidad máxima de reacción catalizada por la enzima) y Km ( la concentración de sustrato que resulta en la mitad de la actividad máxima de la enzima) a medida que varía la concentración del sustrato de la enzima. [15] [16]
En la inhibición competitiva, el sustrato y el inhibidor no pueden unirse a la enzima al mismo tiempo. [17] : 134 Esto suele deberse a que el inhibidor tiene afinidad por el sitio activo de una enzima al que también se une el sustrato; el sustrato y el inhibidor compiten por el acceso al sitio activo de la enzima. Este tipo de inhibición se puede superar con concentraciones suficientemente altas de sustrato ( la Vmax permanece constante), es decir, compitiendo con el inhibidor. [17] : 134–135 Sin embargo, la Km aparente aumentará , ya que se necesita una mayor concentración del sustrato para alcanzar el punto Km , o la mitad de la Vmax . Los inhibidores competitivos suelen ser similares en estructura al sustrato real (véase, por ejemplo, la figura "metotrexato versus folato" en la sección "Medicamentos"). [17] : 134
En la inhibición no competitiva, el inhibidor se une únicamente al complejo enzima-sustrato. [17] : 139 Este tipo de inhibición hace que Vmax disminuya (la velocidad máxima disminuye como resultado de la eliminación del complejo activado) y que Km disminuya (debido a una mejor eficiencia de unión como resultado del principio de Le Chatelier y la eliminación efectiva del complejo ES, disminuyendo así la Km , lo que indica una mayor afinidad de unión). [18] La inhibición no competitiva es rara. [17] : 139 [19]
En la inhibición no competitiva, la unión del inhibidor a la enzima reduce su actividad pero no afecta la unión del sustrato. [16] Este tipo de inhibidor se une con igual afinidad a la enzima libre que al complejo enzima-sustrato. Se puede pensar que tiene la capacidad de los inhibidores competitivos y no competitivos, pero sin preferencia por ninguno de los dos tipos. Como resultado, el grado de inhibición depende únicamente de la concentración del inhibidor. Vmax disminuirá debido a la incapacidad de que la reacción se lleve a cabo de manera tan eficiente, pero Km permanecerá igual ya que la unión real del sustrato, por definición, seguirá funcionando correctamente. [20]
En la inhibición mixta, el inhibidor puede unirse a la enzima independientemente de si el sustrato ya se ha unido o no. Por lo tanto, la inhibición mixta es una combinación de inhibición competitiva y no competitiva. [16] Además, la afinidad del inhibidor por la enzima libre y el complejo enzima-sustrato puede diferir. [17] : 136–139 Al aumentar las concentraciones de sustrato [S], este tipo de inhibición se puede reducir (debido a la contribución competitiva), pero no superar por completo (debido al componente no competitivo). [21] : 381–382 Aunque es posible que los inhibidores de tipo mixto se unan en el sitio activo, este tipo de inhibición generalmente resulta de un efecto alostérico donde el inhibidor se une a un sitio diferente en una enzima. La unión del inhibidor a este sitio alostérico cambia la conformación (es decir, la estructura terciaria o forma tridimensional) de la enzima de modo que se reduce la afinidad del sustrato por el sitio activo. [22]
Estos cuatro tipos de inhibición también se pueden distinguir por el efecto del aumento de la concentración de sustrato [S] sobre el grado de inhibición causado por una cantidad dada de inhibidor. En el caso de la inhibición competitiva, el grado de inhibición se reduce al aumentar [S], en el caso de la inhibición no competitiva, el grado de inhibición no varía y en el caso de la inhibición no competitiva (también llamada anticompetitiva), el grado de inhibición aumenta con [S]. [23]
La inhibición reversible se puede describir cuantitativamente en términos de la unión del inhibidor a la enzima y al complejo enzima-sustrato, y sus efectos sobre las constantes cinéticas de la enzima. [24] : 6 En el esquema clásico de Michaelis-Menten (mostrado en el diagrama "esquemático del mecanismo de inhibición"), una enzima (E) se une a su sustrato (S) para formar el complejo enzima-sustrato ES. Tras la catálisis, este complejo se descompone para liberar el producto P y la enzima libre. [24] : 55 El inhibidor (I) puede unirse a E o ES con las constantes de disociación K i o K i ', respectivamente. [24] : 87
Cuando una enzima tiene múltiples sustratos, los inhibidores pueden mostrar diferentes tipos de inhibición según el sustrato que se considere. Esto se debe a que el sitio activo contiene dos sitios de unión diferentes dentro del sitio activo, uno para cada sustrato. Por ejemplo, un inhibidor puede competir con el sustrato A por el primer sitio de unión, pero ser un inhibidor no competitivo con respecto al sustrato B en el segundo sitio de unión. [26]
Tradicionalmente, los inhibidores enzimáticos reversibles se han clasificado como competitivos, no competitivos o no competitivos, según sus efectos sobre K m y V max . [14] Estos tres tipos de inhibición resultan respectivamente de la unión del inhibidor solo a la enzima E en ausencia de sustrato S, al complejo enzima-sustrato ES, o a ambos. La división de estas clases surge de un problema en su derivación y da como resultado la necesidad de utilizar dos constantes de unión diferentes para un evento de unión. [27] Además, se supone que la unión del inhibidor a la enzima da como resultado una inhibición del 100% y no considera la posibilidad de inhibición parcial. [27] La forma común del término inhibidor también oscurece la relación entre la unión del inhibidor a la enzima y su relación con cualquier otro término de unión, ya sea la ecuación de Michaelis-Menten o una curva de respuesta a la dosis asociada con la unión del receptor del ligando. Para demostrar la relación se puede realizar la siguiente reorganización: [28]
Este reordenamiento demuestra que, de manera similar a la ecuación de Michaelis-Menten, la velocidad máxima de reacción depende de la proporción de la población de enzimas que interactúa con su sustrato.
fracción de la población enzimática unida al sustrato
fracción de la población enzimática unida por el inhibidor
El efecto del inhibidor es el resultado del porcentaje de la población de enzimas que interactúa con el inhibidor. El único problema con esta ecuación en su forma actual es que supone una inhibición absoluta de la enzima con la unión del inhibidor, cuando en realidad puede haber una amplia gama de efectos que van desde una inhibición del 100% del recambio de sustrato hasta ninguna inhibición. Para tener esto en cuenta, la ecuación se puede modificar fácilmente para permitir diferentes grados de inhibición incluyendo un término delta Vmax . [ 29] : 361
o
Este término puede definir la actividad enzimática residual presente cuando el inhibidor interactúa con enzimas individuales en la población. Sin embargo, la inclusión de este término tiene el valor agregado de permitir la posibilidad de activación si el término Vmax secundario resulta ser mayor que el término inicial. Para tener en cuenta también la posibilidad de activación, la notación puede reescribirse reemplazando el inhibidor "I" con un término modificador (estimulador o inhibidor) denotado aquí como "X". [28] : ecuación 13
Si bien esta terminología simplifica el tratamiento de los efectos cinéticos relacionados con la velocidad máxima de la ecuación de Michaelis-Menten, pone de relieve los posibles problemas que puede presentar el término utilizado para describir los efectos relacionados con la K m . La K m relacionada con la afinidad de la enzima por el sustrato debería relacionarse en la mayoría de los casos con los posibles cambios en el sitio de unión de la enzima que resultarían directamente de las interacciones con el inhibidor de la enzima. Por lo tanto, un término similar al término delta V max propuesto anteriormente para modular la V max debería ser adecuado en la mayoría de las situaciones: [28] : ecuación 14
![Gráficos 2D de la concentración de 1/[S] (eje x) y 1/V (eje y) que demuestran que a medida que cambia la concentración del inhibidor, las líneas de inhibidores competitivos se intersecan en un único punto del eje y, los inhibidores no competitivos se intersecan en el eje x y los inhibidores mixtos se intersecan en un punto que no está en ninguno de los ejes.](http://upload.wikimedia.org/wikipedia/commons/thumb/b/ba/Inhibition_diagrams-1-.png/220px-Inhibition_diagrams-1-.png)
Un inhibidor de enzima se caracteriza por su constante de disociación K i , la concentración a la que la mitad del inhibidor ocupa la enzima. En la inhibición no competitiva, el inhibidor también puede unirse al complejo enzima-sustrato, y la presencia de sustrato unido puede cambiar la afinidad del inhibidor por la enzima, lo que resulta en una segunda constante de disociación K i '. Por lo tanto, K i y K i ' son las constantes de disociación del inhibidor para la enzima y para el complejo enzima-sustrato, respectivamente. [30] : Glosario La constante enzima-inhibidor K i se puede medir directamente por varios métodos; un método especialmente preciso es la calorimetría de titulación isotérmica , en la que el inhibidor se titula en una solución de enzima y se mide el calor liberado o absorbido. [31] Sin embargo, la otra constante de disociación K i ' es difícil de medir directamente, ya que el complejo enzima-sustrato tiene una vida corta y experimenta una reacción química para formar el producto. Por lo tanto, K i ' se mide generalmente de forma indirecta, observando la actividad enzimática bajo diversas concentraciones de sustrato e inhibidor, y ajustando los datos mediante regresión no lineal [32] a una ecuación de Michaelis-Menten modificada . [21]
donde los factores modificadores α y α' están definidos por la concentración del inhibidor y sus dos constantes de disociación
Por lo tanto, en presencia del inhibidor, la K m y la V max efectivas de la enzima se convierten en (α/α') K m y (1/α') V max , respectivamente. Sin embargo, la ecuación de Michaelis-Menten modificada supone que la unión del inhibidor a la enzima ha alcanzado el equilibrio, lo que puede ser un proceso muy lento para inhibidores con constantes de disociación subnanomolares. En estos casos, la inhibición se vuelve efectivamente irreversible, por lo que es más práctico tratar a estos inhibidores de unión fuerte como irreversibles (ver a continuación).
Los efectos de diferentes tipos de inhibidores enzimáticos reversibles sobre la actividad enzimática se pueden visualizar utilizando representaciones gráficas de la ecuación de Michaelis-Menten, como los gráficos de Lineweaver-Burk , Eadie-Hofstee o Hanes-Woolf . [17] : 140–144 Los tres gráficos de Lineweaver-Burk representados en la figura Diagramas de Lineweaver-Burk proporcionan una ilustración . En el diagrama superior, las líneas de inhibición competitiva se cruzan en el eje y , lo que ilustra que dichos inhibidores no afectan a V max . En el diagrama inferior, las líneas de inhibición no competitiva se cruzan en el eje x , lo que muestra que estos inhibidores no afectan a K m . Sin embargo, dado que puede ser difícil estimar Ki y Ki ' con precisión a partir de dichos gráficos, [33] es aconsejable estimar estas constantes utilizando métodos de regresión no lineal más confiables. [33]
El mecanismo de inhibición parcialmente competitiva es similar al de la no competitiva, excepto que el complejo EIS tiene una actividad catalítica, que puede ser menor o incluso mayor (activación parcialmente competitiva) que la del complejo enzima-sustrato (ES). Esta inhibición normalmente muestra un valor de Vmax menor , pero un valor de Km inalterado . [18]
La inhibición del sustrato o del producto es cuando el sustrato o el producto de una enzima también actúan como inhibidores. Esta inhibición puede seguir patrones competitivos, no competitivos o mixtos. En la inhibición del sustrato hay una disminución progresiva de la actividad a altas concentraciones de sustrato, posiblemente debido a que una enzima tiene dos sitios de unión al sustrato en competencia. A bajas concentraciones de sustrato, el sitio de alta afinidad está ocupado y se siguen las cinéticas normales . Sin embargo, a concentraciones más altas, el segundo sitio inhibidor se ocupa, inhibiendo la enzima. [34] La inhibición del producto (ya sea el propio producto de la enzima o un producto de una enzima aguas abajo en su vía metabólica) es a menudo una característica reguladora del metabolismo y puede ser una forma de retroalimentación negativa . [2]
La inhibición lenta y apretada ocurre cuando el complejo enzima-inhibidor inicial EI sufre isomería conformacional (un cambio de forma) a un segundo complejo más apretadamente unido, EI*, pero el proceso de inhibición general es reversible. Esto se manifiesta como una inhibición enzimática que aumenta lentamente. En estas condiciones, la cinética tradicional de Michaelis-Menten da un valor falso para K i , que depende del tiempo. El valor verdadero de K i se puede obtener a través de un análisis más complejo de las constantes de velocidad de encendido ( k on ) y apagado ( k off ) para la asociación del inhibidor con una cinética similar a la inhibición irreversible . [17] : 168
Los inhibidores análogos de múltiples sustratos son inhibidores selectivos de alta afinidad que se pueden preparar para enzimas que catalizan reacciones con más de un sustrato capturando la energía de enlace de cada uno de esos sustratos en una molécula. [35] [36] Por ejemplo, en las reacciones de transferencia de formilo de la biosíntesis de purina , se preparó sintéticamente un potente inhibidor de aductos de múltiples sustratos (MAI) para la TFasa del ribonucleótido de glicinamida (GAR) uniendo análogos del sustrato GAR y el cofactor tetrahidrofolato N-10-formilo para producir dideazafolato de ribonucleótido de tioglicinamida (TGDDF), [37] o enzimáticamente a partir del sustrato GAR natural para producir GDDF. [38] Aquí la constante de disociación subnanomolar (KD) del TGDDF fue mayor que la predicha, presumiblemente debido a las ventajas entrópicas obtenidas y/o interacciones positivas adquiridas a través de los átomos que unen los componentes. También se ha observado que los MAI se producen en las células mediante reacciones de profármacos como la isoniazida [39] o ligandos inhibidores de enzimas (por ejemplo, PTC124 ) [40] con cofactores celulares como el dinucleótido de nicotinamida y adenina (NADH) y el trifosfato de adenosina (ATP), respectivamente. [41]
Como las enzimas han evolucionado para unirse fuertemente a sus sustratos, y la mayoría de los inhibidores reversibles se unen en el sitio activo de las enzimas, no es sorprendente que algunos de estos inhibidores sean sorprendentemente similares en estructura a los sustratos de sus objetivos. Los inhibidores de la dihidrofolato reductasa (DHFR) son ejemplos destacados. [42] Otros ejemplos de estos imitadores de sustrato son los inhibidores de proteasa , una clase terapéuticamente eficaz de medicamentos antirretrovirales utilizados para tratar el VIH/SIDA . [43] [44] La estructura de ritonavir , un inhibidor de proteasa peptidomimético (imitador de péptidos) que contiene tres enlaces peptídicos , como se muestra en la figura de "inhibición competitiva" anterior. Como este medicamento se asemeja al péptido que es el sustrato de la proteasa del VIH, compite con el sustrato en el sitio activo de la enzima. [45]
Los inhibidores de enzimas suelen estar diseñados para imitar el estado de transición o el intermedio de una reacción catalizada por enzimas. [46] Esto garantiza que el inhibidor aproveche el efecto estabilizador del estado de transición de la enzima, lo que da como resultado una mejor afinidad de unión (menor Ki ) que los diseños basados en sustratos. Un ejemplo de un inhibidor de estado de transición de este tipo es el fármaco antiviral oseltamivir ; este fármaco imita la naturaleza planar del ion oxonio del anillo en la reacción de la enzima viral neuraminidasa . [47]
Sin embargo, no todos los inhibidores se basan en las estructuras de los sustratos. Por ejemplo, la estructura de otro inhibidor de la proteasa del VIH, el tipranavir, no se basa en un péptido y no tiene una similitud estructural obvia con un sustrato proteico. Estos inhibidores no peptídicos pueden ser más estables que los inhibidores que contienen enlaces peptídicos, porque no serán sustratos para las peptidasas y es menos probable que se degraden. [48]
En el diseño de fármacos es importante tener en cuenta las concentraciones de sustratos a las que se exponen las enzimas diana. Por ejemplo, algunos inhibidores de las proteínas quinasas tienen estructuras químicas similares al ATP, uno de los sustratos de estas enzimas. [49] Sin embargo, los fármacos que son inhibidores competitivos simples tendrán que competir con las altas concentraciones de ATP en la célula. Las proteínas quinasas también pueden inhibirse por competencia en los sitios de unión donde las quinasas interactúan con sus proteínas sustrato, y la mayoría de las proteínas están presentes dentro de las células en concentraciones mucho más bajas que la concentración de ATP. Como consecuencia, si dos inhibidores de las proteínas quinasas se unen en el sitio activo con afinidad similar, pero solo uno tiene que competir con el ATP, entonces el inhibidor competitivo en el sitio de unión de la proteína inhibirá la enzima de manera más efectiva. [50]
Los inhibidores irreversibles se unen covalentemente a una enzima, y por lo tanto este tipo de inhibición no se puede revertir fácilmente. [51] Los inhibidores irreversibles a menudo contienen grupos funcionales reactivos como mostazas nitrogenadas , aldehídos , haloalcanos , alquenos , aceptores de Michael , fenilsulfonatos o fluorofosfonatos . [52] Estos grupos electrofílicos reaccionan con las cadenas laterales de los aminoácidos para formar aductos covalentes . [51] Los residuos modificados son aquellos con cadenas laterales que contienen nucleófilos como grupos hidroxilo o sulfhidrilo ; estos incluyen los aminoácidos serina (que reacciona con DFP , consulte el diagrama de la "reacción DFP"), y también cisteína , treonina o tirosina . [53]
La inhibición irreversible es diferente de la inactivación irreversible de una enzima. [54] Los inhibidores irreversibles son generalmente específicos para una clase de enzima y no inactivan todas las proteínas; no funcionan destruyendo la estructura de la proteína sino alterando específicamente el sitio activo de su objetivo. Por ejemplo, los extremos de pH o temperatura suelen causar la desnaturalización de toda la estructura de la proteína, pero este es un efecto no específico. De manera similar, algunos tratamientos químicos no específicos destruyen la estructura de la proteína: por ejemplo, el calentamiento en ácido clorhídrico concentrado hidrolizará los enlaces peptídicos que mantienen unidas a las proteínas, liberando aminoácidos libres. [55]
Los inhibidores irreversibles muestran una inhibición dependiente del tiempo y, por lo tanto, su potencia no se puede caracterizar por un valor de CI50 . Esto se debe a que la cantidad de enzima activa a una concentración dada de inhibidor irreversible será diferente dependiendo de cuánto tiempo se preincuba el inhibidor con la enzima. En su lugar, se utilizan valores de k obs /[ I ], [56] donde k obs es la tasa de inactivación de pseudo-primer orden observada (obtenida al trazar el logaritmo del % de actividad versus tiempo) y [ I ] es la concentración de inhibidor. El parámetro k obs /[ I ] es válido siempre que el inhibidor no sature la unión con la enzima (en cuyo caso k obs = k inact ) donde k inact es la tasa de inactivación.
Los inhibidores irreversibles forman primero un complejo no covalente reversible con la enzima (EI o ESI). Posteriormente, se produce una reacción química entre la enzima y el inhibidor para producir el "complejo sin salida" modificado covalentemente EI* (un complejo covalente irreversible). La velocidad a la que se forma EI* se denomina velocidad de inactivación o k inact . [13] Dado que la formación de EI puede competir con ES, la unión de inhibidores irreversibles se puede prevenir mediante la competencia ya sea con el sustrato o con un segundo inhibidor reversible. Este efecto de protección es una buena evidencia de una reacción específica del inhibidor irreversible con el sitio activo.
Los pasos de unión e inactivación de esta reacción se investigan incubando la enzima con inhibidor y ensayando la cantidad de actividad restante con el tiempo. La actividad disminuirá de manera dependiente del tiempo, generalmente después de una disminución exponencial . Al ajustar estos datos a una ecuación de velocidad se obtiene la velocidad de inactivación a esta concentración de inhibidor. Esto se hace a varias concentraciones diferentes de inhibidor. Si está involucrado un complejo EI reversible, la velocidad de inactivación será saturable y al ajustar esta curva se obtendrá k inact y K i . [57]
Otro método que se utiliza ampliamente en estos análisis es la espectrometría de masas . Aquí, la medición precisa de la masa de la enzima nativa no modificada y la enzima inactivada proporciona el aumento de masa causado por la reacción con el inhibidor y muestra la estequiometría de la reacción. [58] Esto generalmente se hace utilizando un espectrómetro de masas MALDI-TOF . [59] En una técnica complementaria, la huella de masa de péptidos implica la digestión de la proteína nativa y modificada con una proteasa como la tripsina . Esto producirá un conjunto de péptidos que se pueden analizar utilizando un espectrómetro de masas. El péptido que cambia de masa después de la reacción con el inhibidor será el que contiene el sitio de modificación. [60]
No todos los inhibidores irreversibles forman aductos covalentes con sus enzimas diana. Algunos inhibidores reversibles se unen tan fuertemente a su enzima diana que son esencialmente irreversibles. Estos inhibidores de unión fuerte pueden mostrar una cinética similar a la de los inhibidores irreversibles covalentes. En estos casos, algunos de estos inhibidores se unen rápidamente a la enzima en un complejo EI de baja afinidad y este luego experimenta un reordenamiento más lento a un complejo EI* muy fuertemente unido (ver el diagrama del "mecanismo de inhibición irreversible"). Este comportamiento cinético se denomina unión lenta. [62] Este reordenamiento lento después de la unión a menudo implica un cambio conformacional a medida que la enzima "se cierra" alrededor de la molécula inhibidora. Algunos ejemplos de inhibidores de unión lenta incluyen algunos fármacos importantes, como el metotrexato [63] , el alopurinol [64] y la forma activada del aciclovir [65] .
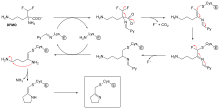
El diisopropilfluorofosfato (DFP) es un ejemplo de un inhibidor irreversible de la proteasa (véase el diagrama de la "reacción del DFP"). La enzima hidroliza el enlace fósforo-flúor, pero el residuo de fosfato permanece unido a la serina en el sitio activo , desactivándola. [67] De manera similar, el DFP también reacciona con el sitio activo de la acetilcolinesterasa en las sinapsis de las neuronas y, en consecuencia, es una potente neurotoxina, con una dosis letal de menos de 100 mg. [68]
La inhibición suicida es un tipo inusual de inhibición irreversible en la que la enzima convierte el inhibidor en una forma reactiva en su sitio activo. [69] Un ejemplo es el inhibidor de la biosíntesis de poliaminas , α-difluorometilornitina (DFMO), que es un análogo del aminoácido ornitina y se utiliza para tratar la tripanosomiasis africana (enfermedad del sueño). La ornitina descarboxilasa puede catalizar la descarboxilación de DFMO en lugar de ornitina (véase el diagrama del "mecanismo inhibidor de DFMO"). Sin embargo, esta reacción de descarboxilación es seguida por la eliminación de un átomo de flúor, que convierte este intermediario catalítico en una imina conjugada , una especie altamente electrofílica. Esta forma reactiva de DFMO reacciona luego con un residuo de cisteína o lisina en el sitio activo para inactivar irreversiblemente la enzima. [61]
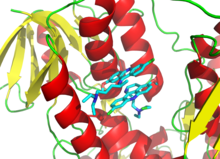
Dado que la inhibición irreversible a menudo implica la formación inicial de un complejo inhibidor de enzimas (IE) no covalente, [13] a veces es posible que un inhibidor se una a una enzima de más de una manera. Por ejemplo, en la figura que muestra la tripanotiona reductasa del parásito protozoario humano Trypanosoma cruzi , dos moléculas de un inhibidor llamado mostaza quinacrina están unidas en su sitio activo. La molécula superior está unida de forma reversible, pero la inferior está unida de forma covalente, ya que ha reaccionado con un residuo de aminoácido a través de su grupo mostaza nitrogenada . [70]
Los inhibidores enzimáticos se encuentran en la naturaleza [71] y también se producen artificialmente en el laboratorio. [72] Los inhibidores enzimáticos naturales regulan muchos procesos metabólicos y son esenciales para la vida. [3] [1] Además, los venenos producidos naturalmente son a menudo inhibidores enzimáticos que han evolucionado para su uso como agentes tóxicos contra depredadores, presas y organismos competidores. [4] Estas toxinas naturales incluyen algunas de las sustancias más venenosas conocidas. [73] Los inhibidores artificiales se utilizan a menudo como fármacos, pero también pueden ser insecticidas como el malatión , herbicidas como el glifosato , [74] o desinfectantes como el triclosán . Otros inhibidores enzimáticos artificiales bloquean la acetilcolinesterasa , una enzima que descompone la acetilcolina , y se utilizan como agentes nerviosos en la guerra química . [75]
La inhibición enzimática es una característica común del control de las vías metabólicas en las células. [3] El flujo metabólico a través de una vía a menudo está regulado por los metabolitos de la vía que actúan como inhibidores y potenciadores de las enzimas en esa misma vía. La vía glucolítica es un ejemplo clásico. [76] Esta vía catabólica consume glucosa y produce ATP , NADH y piruvato . Un paso clave para la regulación de la glucólisis es una reacción temprana en la vía catalizada por la fosfofructoquinasa-1 (PFK1). Cuando los niveles de ATP aumentan, el ATP se une a un sitio alostérico en PFK1 para disminuir la velocidad de la reacción enzimática; la glucólisis se inhibe y la producción de ATP cae. Este control de retroalimentación negativa ayuda a mantener una concentración constante de ATP en la célula. Sin embargo, las vías metabólicas no solo se regulan a través de la inhibición, ya que la activación enzimática es igualmente importante. Con respecto a PFK1, la fructosa 2,6-bisfosfato y el ADP son ejemplos de metabolitos que son activadores alostéricos. [77]
La inhibición enzimática fisiológica también puede producirse por inhibidores proteicos específicos. Este mecanismo ocurre en el páncreas , que sintetiza muchas enzimas precursoras digestivas conocidas como zimógenos . Muchas de estas son activadas por la proteasa tripsina , por lo que es importante inhibir la actividad de la tripsina en el páncreas para evitar que el órgano se digiera a sí mismo. Una forma en que se controla la actividad de la tripsina es la producción de una proteína inhibidora de tripsina específica y potente en el páncreas. Este inhibidor se une fuertemente a la tripsina, evitando la actividad de la tripsina que de otro modo sería perjudicial para el órgano. [78] Aunque el inhibidor de tripsina es una proteína, evita ser hidrolizado como sustrato por la proteasa al excluir agua del sitio activo de la tripsina y desestabilizar el estado de transición. [79] Otros ejemplos de proteínas inhibidoras de enzimas fisiológicas incluyen el inhibidor barstar de la ribonucleasa bacteriana barnasa . [80]

Los animales y las plantas han evolucionado para sintetizar una amplia gama de productos venenosos, incluidos metabolitos secundarios , [81] péptidos y proteínas [82] que pueden actuar como inhibidores. Las toxinas naturales suelen ser pequeñas moléculas orgánicas y son tan diversas que probablemente existan inhibidores naturales para la mayoría de los procesos metabólicos. [83] Los procesos metabólicos a los que se dirigen los venenos naturales abarcan más que las enzimas en las vías metabólicas y también pueden incluir la inhibición de las funciones de los receptores, canales y proteínas estructurales en una célula. Por ejemplo, el paclitaxel (taxol), una molécula orgánica que se encuentra en el tejo del Pacífico , se une firmemente a los dímeros de tubulina e inhibe su ensamblaje en microtúbulos en el citoesqueleto . [84]
Muchos venenos naturales actúan como neurotoxinas que pueden causar parálisis que conduce a la muerte y funcionan para la defensa contra los depredadores o en la caza y captura de presas. Algunos de estos inhibidores naturales, [85] a pesar de sus atributos tóxicos, son valiosos para usos terapéuticos en dosis más bajas. [86] Un ejemplo de una neurotoxina son los glicoalcaloides , de las especies de plantas de la familia Solanaceae (incluye la papa , el tomate y la berenjena ), que son inhibidores de la acetilcolinesterasa . La inhibición de esta enzima causa un aumento descontrolado en el neurotransmisor acetilcolina, parálisis muscular y luego la muerte. La neurotoxicidad también puede resultar de la inhibición de los receptores; por ejemplo, la atropina de la belladona ( Atropa belladonna ) que funciona como un antagonista competitivo de los receptores muscarínicos de acetilcolina . [87]
Aunque muchas toxinas naturales son metabolitos secundarios, estos venenos también incluyen péptidos y proteínas. Un ejemplo de un péptido tóxico es la alfa-amanitina , que se encuentra en parientes del hongo de la muerte . Este es un potente inhibidor enzimático, que en este caso impide que la enzima ARN polimerasa II transcriba el ADN. [88] La toxina de algas microcistina también es un péptido y es un inhibidor de las fosfatasas proteicas . [89] Esta toxina puede contaminar los suministros de agua después de las floraciones de algas y es un carcinógeno conocido que también puede causar hemorragia hepática aguda y muerte en dosis más altas. [90]
Las proteínas también pueden ser venenos naturales o antinutrientes , como los inhibidores de tripsina (discutidos en la sección "regulación metabólica" anterior) que se encuentran en algunas legumbres . [91] Una clase menos común de toxinas son las enzimas tóxicas: éstas actúan como inhibidores irreversibles de sus enzimas objetivo y funcionan modificando químicamente sus enzimas sustrato. Un ejemplo es la ricina , una toxina proteica extremadamente potente que se encuentra en las semillas de aceite de ricino . [92] Esta enzima es una glicosidasa que inactiva los ribosomas. [93] Dado que la ricina es un inhibidor catalítico irreversible, esto permite que una sola molécula de ricina mate una célula. [94]


Los inhibidores de enzimas se utilizan con mayor frecuencia como fármacos para tratar enfermedades. Muchos de estos inhibidores actúan sobre una enzima humana y su objetivo es corregir una afección patológica. Por ejemplo, la aspirina es un fármaco muy utilizado que actúa como inhibidor suicida de la enzima ciclooxigenasa . [95] Esta inhibición, a su vez, suprime la producción de prostaglandinas proinflamatorias y, por lo tanto, la aspirina puede utilizarse para reducir el dolor, la fiebre y la inflamación. [95]
A partir de 2017, [update]se estima que el 29% de los medicamentos aprobados son inhibidores de enzimas [96] de los cuales aproximadamente una quinta parte son inhibidores de quinasas . [96] Una clase notable de objetivos de fármacos quinasas son las tirosina quinasas receptoras que son enzimas esenciales que regulan el crecimiento celular ; su sobreactivación puede resultar en cáncer. Por lo tanto, los inhibidores de quinasas como el imatinib se utilizan con frecuencia para tratar neoplasias malignas. [97] Las quinasas Janus son otro ejemplo notable de objetivos enzimáticos de fármacos. Los inhibidores de las quinasas Janus bloquean la producción de citocinas inflamatorias y, por lo tanto, estos inhibidores se utilizan para tratar una variedad de enfermedades inflamatorias , incluidas la artritis , el asma y la enfermedad de Crohn . [98]
Un ejemplo de la similitud estructural de algunos inhibidores con los sustratos de las enzimas a las que se dirigen se ve en la figura que compara el fármaco metotrexato con el ácido fólico . El ácido fólico es la forma oxidada del sustrato de la dihidrofolato reductasa , una enzima que es inhibida potentemente por el metotrexato. El metotrexato bloquea la acción de la dihidrofolato reductasa y, por lo tanto, detiene la biosíntesis de timidina . [42] Este bloqueo de la biosíntesis de nucleótidos es selectivamente tóxico para las células de crecimiento rápido, por lo tanto, el metotrexato se usa a menudo en la quimioterapia contra el cáncer. [99]
Un tratamiento común para la disfunción eréctil es el sildenafil (Viagra). [100] Este compuesto es un potente inhibidor de la fosfodiesterasa tipo 5 específica de cGMP , la enzima que degrada la molécula de señalización guanosina monofosfato cíclico . [101] Esta molécula de señalización desencadena la relajación del músculo liso y permite el flujo de sangre hacia el cuerpo cavernoso , lo que provoca una erección. Dado que el fármaco disminuye la actividad de la enzima que detiene la señal, hace que esta dure más tiempo.
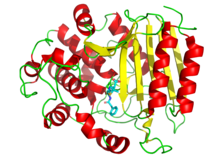
También se utilizan fármacos para inhibir las enzimas necesarias para la supervivencia de los patógenos. Por ejemplo, las bacterias están rodeadas por una pared celular gruesa formada por un polímero en forma de red llamado peptidoglicano . Muchos antibióticos, como la penicilina y la vancomicina, inhiben las enzimas que producen y luego reticulan las hebras de este polímero. [102] [103] Esto hace que la pared celular pierda fuerza y las bacterias exploten. En la figura, se muestra una molécula de penicilina (mostrada en forma de bola y barra) unida a su objetivo, la transpeptidasa de la bacteria Streptomyces R61 (la proteína se muestra como un diagrama de cinta ).
El diseño de fármacos antibióticos se ve facilitado cuando una enzima que es esencial para la supervivencia del patógeno está ausente o es muy diferente en los seres humanos. [104] Los seres humanos no producen peptidoglicano, por lo tanto, los antibióticos que inhiben este proceso son selectivamente tóxicos para las bacterias. [105] La toxicidad selectiva también se produce en los antibióticos al explotar las diferencias en la estructura de los ribosomas en las bacterias, [106] o cómo producen ácidos grasos . [107]
Los medicamentos que inhiben las enzimas necesarias para la replicación de los virus son eficaces en el tratamiento de las infecciones virales. [108] Los medicamentos antivirales incluyen inhibidores de la proteasa utilizados para tratar el VIH/SIDA [109] y la hepatitis C , [110] inhibidores de la transcriptasa inversa dirigidos contra el VIH/SIDA, [111] inhibidores de la neuraminidasa dirigidos contra la gripe , [112] e inhibidores de la terminasa dirigidos contra el citomegalovirus humano . [113]
Muchos pesticidas son inhibidores de enzimas. [114] La acetilcolinesterasa (AChE) es una enzima que se encuentra en animales, desde insectos hasta humanos. Es esencial para el funcionamiento de las células nerviosas a través de su mecanismo de descomposición del neurotransmisor acetilcolina en sus constituyentes, acetato y colina . [115] Esto es algo inusual entre los neurotransmisores, ya que la mayoría, incluida la serotonina , la dopamina y la noradrenalina , se absorben desde la hendidura sináptica en lugar de escindirse. Una gran cantidad de inhibidores de AChE se utilizan tanto en medicina como en agricultura. [116] Los inhibidores competitivos reversibles, como el edrofonio , la fisostigmina y la neostigmina , se utilizan en el tratamiento de la miastenia gravis [117] y en la anestesia para revertir el bloqueo muscular. [118] Los pesticidas carbamatos también son ejemplos de inhibidores reversibles de AChE. Los pesticidas organofosforados como el malatión , el paratión y el clorpirifos inhiben irreversiblemente la acetilcolinesterasa. [119]
El herbicida glifosato es un inhibidor de la 3-fosfoshikimato 1-carboxiviniltransferasa , [120] otros herbicidas, como las sulfonilureas , inhiben la enzima acetolactato sintasa . [121] Ambas enzimas son necesarias para que las plantas produzcan aminoácidos de cadena ramificada . Muchos otros enzimas son inhibidos por los herbicidas, incluidas las enzimas necesarias para la biosíntesis de lípidos y carotenoides y los procesos de fotosíntesis y fosforilación oxidativa . [122]

Los nuevos fármacos son el producto de un largo proceso de desarrollo de fármacos , cuyo primer paso es a menudo el descubrimiento de un nuevo inhibidor enzimático. [123] Hay dos enfoques principales para descubrir estos inhibidores. [124]
El primer método general es el diseño racional de fármacos basado en imitar el estado de transición de la reacción química catalizada por la enzima. [125] El inhibidor diseñado a menudo se parece mucho al sustrato, excepto que la porción del sustrato que experimenta la reacción química se reemplaza por un grupo funcional químicamente estable que se asemeja al estado de transición. Dado que la enzima ha evolucionado para estabilizar el estado de transición, los análogos del estado de transición generalmente poseen una mayor afinidad por la enzima en comparación con el sustrato y, por lo tanto, son inhibidores efectivos. [46]
La segunda forma de descubrir nuevos inhibidores de enzimas es el cribado de alto rendimiento de grandes bibliotecas de compuestos estructuralmente diversos para identificar moléculas que se unan a la enzima. Este método se ha ampliado para incluir el cribado virtual de bases de datos de diversas moléculas mediante computadoras, [126] [127] que luego son seguidas por la confirmación experimental de la unión de los compuestos que se unen a la enzima. [128] Los enfoques complementarios que pueden proporcionar nuevos puntos de partida para los inhibidores incluyen el descubrimiento de compuestos clave basado en fragmentos [129] y las bibliotecas químicas codificadas por ADN (DEL). [130]
Los impactos de cualquiera de los enfoques anteriores se pueden optimizar para aglutinantes de alta afinidad que inhiben eficazmente la enzima. [131] Se pueden utilizar métodos informáticos para predecir la orientación de la unión y la afinidad de un inhibidor para una enzima, como el acoplamiento molecular [132] y la mecánica molecular, para ayudar en el proceso de optimización. [133] Se utilizan nuevos inhibidores para obtener estructuras cristalográficas de la enzima en un complejo inhibidor/enzima para mostrar cómo se une la molécula al sitio activo, lo que permite realizar cambios en el inhibidor para optimizar la unión en un proceso conocido como diseño de fármacos basado en la estructura . [1] : 66 Este ciclo de prueba y mejora se repite hasta que se produce un inhibidor suficientemente potente.
En algunos casos, el inhibidor puede unirse a un sitio distinto en la enzima que está en comunicación alostérica con el bolsillo de unión del sustrato. En muchos casos, los compuestos alostéricos competitivos con el sustrato dan como resultado cambios conformacionales en la enzima que cambian la capacidad de la enzima para unirse al sustrato.
se explica generalmente como un proceso químico que involucra varios fenómenos como agregación, disociación en subunidades o desnaturalización (cambios conformacionales), que ocurren simultáneamente durante la inactivación de una enzima específica.
Figura 1C: Éxito clínico de las clases de familias de proteínas privilegiadas (porcentaje de fármacos aprobados dirigidos a cada clase diana): reductasa 7,62, quinasa 5,94, proteasa 3,35, hidrolasa 2,76, NPTasa 2,09, transferasa 1,92, liasa 1,59, isomerasa 1,51, fosfodiesterasa 1,50, citocromo p450 0,84, borrador epigenético 0,33, objetivos enzimáticos totales de los fármacos aprobados = 29,45 %
Capítulo 10.2.1: Inhibidores de la acetolactato sintasa de sulfonilurea