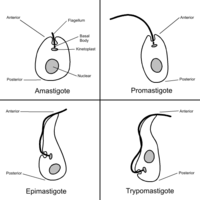
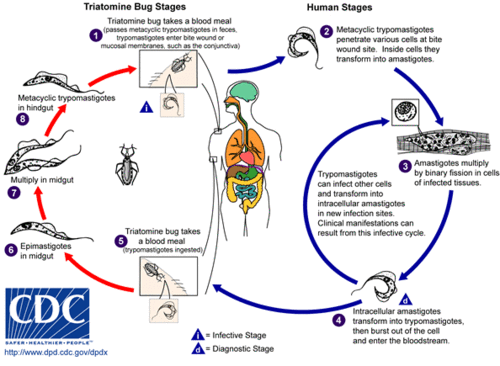
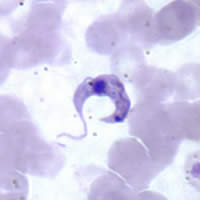
Trypanosoma cruzi
Es un parásito intracelular con un ciclo de vida que involucra vertebrados e invertebrados.
[1][2] La mayoría de las especies son encontradas en viviendas y áreas peridomésticas humanos principalmente selváticas.
Este último a su vez se divide en cinco grupos menores: T. cruzi IIa, IIb, IIc, IId y IIe.
La diseminación del T. cruzi se da por el contacto con las heces de insectos del tipo hemípteros, del género Triatoma, entrando los parásitos por la herida causada por su picadura; llegan al torrente sanguíneo (forma tripomastigota metacíclico) viajando hacia los diferentes órganos y tejidos, replicándose principalmente en tejidos musculares y nervioso (forma amastigota).
Se presupone que el daño principal ocasionado en la enfermedad de Chagas se debe a la lesión directa que produce el parásito al invadir a las células del ser vivo, y también al consiguiente proceso inflamatorio localizado.