La enfermedad de Huntington ( HD ), también conocida como corea de Huntington , es una enfermedad neurodegenerativa incurable [7] que en su mayoría es hereditaria . [8] Los primeros síntomas suelen ser problemas sutiles con el estado de ánimo o las capacidades mentales/psiquiátricas. [9] [1] A menudo siguen una falta general de coordinación y una marcha inestable . [2] También es una enfermedad de los ganglios basales que causa un trastorno del movimiento hipercinético conocido como corea . [10] [11] A medida que avanza la enfermedad, los movimientos corporales involuntarios y descoordinados de la corea se vuelven más evidentes. [1] Las capacidades físicas empeoran gradualmente hasta que el movimiento coordinado se vuelve difícil y la persona no puede hablar. [1] [2] Las capacidades mentales generalmente disminuyen hasta convertirse en demencia , depresión, apatía e impulsividad a veces. [9] [12] [3] Los síntomas específicos varían un poco entre las personas. [1] Los síntomas suelen comenzar entre los 30 y 50 años de edad, y pueden comenzar a cualquier edad, pero generalmente se observan alrededor de los 40 años. [12] [9] [3] [4] La enfermedad puede desarrollarse antes en cada generación sucesiva . [1] Alrededor del ocho por ciento de los casos comienzan antes de los 20 años y se conocen como EH juvenil , que generalmente se presenta con los síntomas de movimiento lento de la enfermedad de Parkinson en lugar de los de la corea. [3]
La EH se hereda típicamente de un progenitor afectado , que porta una mutación en el gen huntingtina ( HTT ). [4] Sin embargo, hasta el 10% de los casos se deben a una nueva mutación. [1] El gen huntingtina proporciona la información genética para la proteína huntingtina (Htt). [1] La expansión de las repeticiones CAG de citosina - adenina - guanina (conocida como expansión de repetición de trinucleótidos ) en el gen que codifica la proteína huntingtina da como resultado una proteína mutante anormal (mHtt), que daña gradualmente las células cerebrales a través de varios mecanismos posibles. [8] [13] La proteína mutante es dominante , por lo que tener un progenitor portador del rasgo es suficiente para desencadenar la enfermedad en sus hijos. El diagnóstico se realiza mediante pruebas genéticas , que se pueden realizar en cualquier momento, independientemente de si hay síntomas o no. [5] Este hecho plantea varios debates éticos: la edad a la que se considera que un individuo es lo suficientemente maduro para elegir las pruebas; si los padres tienen derecho a que sus hijos se sometan a pruebas; y la gestión de la confidencialidad y la divulgación de los resultados de las pruebas. [2]
No se conoce cura para la EH, y se requiere atención a tiempo completo en las etapas posteriores. [2] Los tratamientos pueden aliviar algunos síntomas y, en algunos, mejorar la calidad de vida . [3] La mejor evidencia para el tratamiento de los problemas de movimiento es con tetrabenazina . [3] La EH afecta a aproximadamente 4 a 15 de cada 100.000 personas de ascendencia europea. [1] [3] Es poco común entre los finlandeses y japoneses, mientras que la tasa de aparición en África es desconocida. [3] La enfermedad afecta a hombres y mujeres por igual. [3] Las complicaciones como la neumonía , la enfermedad cardíaca y las lesiones físicas por caídas reducen la esperanza de vida; aunque la neumonía por aspiración fatal se cita comúnmente como la causa última de muerte para quienes padecen la afección. [14] [12] [3] El suicidio es la causa de muerte en aproximadamente el 9% de los casos. [3] La muerte generalmente ocurre entre 15 y 20 años después de que se detectó la enfermedad por primera vez. [4]
La primera descripción conocida de la enfermedad fue en 1841 por el médico estadounidense Charles Oscar Waters. [15] La condición fue descrita con más detalle en 1872 por el médico estadounidense George Huntington . [15] La base genética fue descubierta en 1993 por un esfuerzo colaborativo internacional dirigido por la Fundación de Enfermedades Hereditarias . [16] [17] Las organizaciones de investigación y apoyo comenzaron a formarse a fines de la década de 1960 para aumentar la conciencia pública, brindar apoyo a las personas y sus familias y promover la investigación. [17] [18] Las direcciones de investigación incluyen determinar el mecanismo exacto de la enfermedad, mejorar los modelos animales para ayudar con la investigación, probar medicamentos y su administración para tratar los síntomas o retrasar la progresión de la enfermedad, y estudiar procedimientos como la terapia con células madre con el objetivo de reemplazar neuronas dañadas o perdidas. [16]
Los signos y síntomas de la enfermedad de Huntington se hacen más evidentes entre los 30 y 50 años, pero pueden comenzar a cualquier edad [4] y presentarse como una tríada de síntomas motores, cognitivos y psiquiátricos. [19] Cuando se desarrolla en una etapa temprana, se conoce como enfermedad de Huntington juvenil. [20] En el 50% de los casos, los síntomas psiquiátricos aparecen primero. [19] Su progresión se describe a menudo en etapas tempranas, etapas intermedias y etapas tardías con una fase prodrómica más temprana. [2] En las primeras etapas, ocurren cambios sutiles de personalidad, problemas en la cognición y habilidades físicas, irritabilidad y cambios de humor, todos los cuales pueden pasar desapercibidos, [21] [22] y estos generalmente preceden a los síntomas motores. [23] Casi todas las personas con EH eventualmente exhiben síntomas físicos similares, pero el inicio, la progresión y la extensión de los síntomas cognitivos y conductuales varían significativamente entre individuos. [24] [25]
Los síntomas físicos iniciales más característicos son movimientos espasmódicos, aleatorios e incontrolables llamados corea . [10] Muchas personas no son conscientes de sus movimientos involuntarios o se ven obstaculizados por ellos. [1] La corea puede manifestarse inicialmente como inquietud general, pequeños movimientos iniciados o incompletos de forma involuntaria, falta de coordinación o movimientos sacádicos oculares lentos . [26] Estas anomalías motoras menores suelen preceder a los signos más obvios de disfunción motora al menos tres años. [27] La aparición clara de síntomas como rigidez, movimientos retorcidos o posturas anormales aparece a medida que progresa el trastorno. [26] Estos son signos de que el sistema del cerebro responsable del movimiento se ha visto afectado. [28] Las funciones psicomotoras se deterioran cada vez más, de modo que cualquier acción que requiera control muscular se ve afectada. Cuando el control muscular se ve afectado, como rigidez o contractura muscular, esto se conoce como distonía . La distonía es un trastorno del movimiento hipercinético neurológico que produce movimientos de torsión o repetitivos, que pueden parecerse a un temblor. Las consecuencias comunes son inestabilidad física, expresión facial anormal y dificultades para masticar, tragar y hablar . [26] Los trastornos del sueño y la pérdida de peso también son síntomas asociados. [29] Las dificultades para comer comúnmente causan pérdida de peso y pueden llevar a desnutrición. [30] [31] La pérdida de peso es común en personas con enfermedad de Huntington y progresa con la enfermedad. La EH juvenil generalmente progresa a un ritmo más rápido con un mayor deterioro cognitivo y la corea se presenta brevemente, si es que se presenta; la variante de Westphal de lentitud de movimiento , rigidez y temblores es más típica en la EH juvenil, al igual que las convulsiones . [26] [29]
Las capacidades cognitivas se deterioran progresivamente y tienden a declinar generalmente hasta llegar a la demencia . [3] Especialmente afectadas son las funciones ejecutivas , que incluyen la planificación, la flexibilidad cognitiva, el pensamiento abstracto , la adquisición de reglas, el inicio de acciones apropiadas y la inhibición de acciones inapropiadas. Diferentes deterioros cognitivos incluyen dificultad para concentrarse en las tareas, falta de flexibilidad, falta de impulso, falta de conciencia de las propias conductas y habilidades y dificultad para aprender o procesar nueva información. A medida que la enfermedad progresa, tienden a aparecer déficits de memoria . Los deterioros reportados varían desde déficits de memoria a corto plazo hasta dificultades de memoria a largo plazo , incluyendo déficits en la memoria episódica (memoria de la propia vida), procedimental (memoria del cuerpo de cómo realizar una actividad) y de trabajo . [28]
Los signos neuropsiquiátricos notificados son ansiedad , depresión , una reducción de la manifestación de las emociones , egocentrismo , agresión y comportamiento compulsivo , así como alucinaciones y delirios . [32] Otros trastornos psiquiátricos comunes podrían incluir el trastorno obsesivo-compulsivo , la manía , el insomnio y el trastorno bipolar . También se han observado dificultades para reconocer las expresiones negativas de otras personas. [28] La prevalencia de estos síntomas es muy variable entre los estudios, con tasas estimadas de prevalencia de por vida de los trastornos psiquiátricos entre el 33 y el 76 %. [32] Para muchas personas con la enfermedad y sus familias, estos síntomas se encuentran entre los aspectos más angustiantes de la enfermedad, que a menudo afectan el funcionamiento diario y constituyen un motivo de institucionalización . [32] Los cambios conductuales tempranos en la EH dan lugar a un mayor riesgo de suicidio. [10] A menudo, las personas tienen una menor conciencia de la corea y de los deterioros cognitivos y emocionales. [33]
La huntingtina mutante se expresa en todo el cuerpo y se asocia con anomalías en los tejidos periféricos que son causadas directamente por dicha expresión fuera del cerebro. Estas anomalías incluyen atrofia muscular , insuficiencia cardíaca , intolerancia a la glucosa , pérdida de peso , osteoporosis y atrofia testicular . [34]
Todos tenemos dos copias del gen huntingtina ( HTT ), que codifica la proteína huntingtina (Htt). HTT también se llama gen HD y gen IT15 ( transcripción interesante 15). Parte de este gen es una sección repetida llamada expansión de repetición de trinucleótidos , una repetición corta , que varía en longitud entre individuos y puede cambiar de longitud entre generaciones. Si la repetición está presente en un gen sano, una mutación dinámica puede aumentar el recuento de repeticiones y dar como resultado un gen defectuoso. Cuando la longitud de esta sección repetida alcanza un cierto umbral, produce una forma alterada de la proteína, llamada proteína huntingtina mutante (mHtt). Las diferentes funciones de estas proteínas son la causa de los cambios patológicos, que a su vez causan los síntomas de la enfermedad. La mutación de la enfermedad de Huntington es genéticamente dominante y casi completamente penetrante ; la mutación de cualquiera de los alelos HTT de una persona causa la enfermedad. No se hereda según el sexo, sino por la longitud de la sección repetida del gen; por lo tanto, su gravedad puede verse influenciada por el sexo del padre afectado. [26]
La HD es uno de varios trastornos de repetición de trinucleótidos que son causados por la longitud de una sección repetida de un gen que excede un rango normal. [26] El gen HTT está ubicado en el brazo corto del cromosoma 4 [26] en 4p16.3. HTT contiene una secuencia de tres bases de ADN —citosina-adenina-guanina (CAG)— repetidas varias veces (es decir, ... CAGCAGCAG ...), conocida como repetición de trinucleótido. [26] CAG es el código genético de tres letras ( codón ) para el aminoácido glutamina , por lo que una serie de ellas da como resultado la producción de una cadena de glutamina conocida como tracto de poliglutamina (o tracto poliQ), y la parte repetida del gen, la región poliQ . [35]
.jpg/440px-Huntington's_disease_(5880985560).jpg)
En general, las personas tienen menos de 36 glutaminas repetidas en la región polyQ, lo que resulta en la producción de la proteína citoplasmática huntingtina. [26] Sin embargo, una secuencia de 36 o más glutaminas resulta en la producción de una proteína con características diferentes. [26] Esta forma alterada, llamada huntingtina mutante (mHtt), aumenta la tasa de descomposición de ciertos tipos de neuronas . Las regiones del cerebro tienen diferentes cantidades y dependencia de estos tipos de neuronas y se ven afectadas en consecuencia. [26] En general, el número de repeticiones de CAG está relacionado con cuánto se ve afectado este proceso y representa aproximadamente el 60% de la variación de la edad de aparición de los síntomas. La variación restante se atribuye al medio ambiente y otros genes que modifican el mecanismo de la EH. [26] Aproximadamente entre 36 y 39 repeticiones dan como resultado una forma de penetrancia reducida de la enfermedad, con un inicio mucho más tardío y una progresión más lenta de los síntomas. En algunos casos, el inicio puede ser tan tardío que los síntomas nunca se notan. [26] Con recuentos de repeticiones muy grandes (más de 60), la EH puede aparecer antes de los 20 años, lo que se conoce como EH juvenil. La EH juvenil es típicamente de la variante de Westphal que se caracteriza por lentitud de movimiento, rigidez y temblores. Esto representa alrededor del 7% de los portadores de la EH. [36] [37]
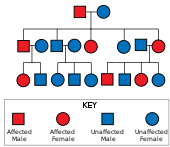
La enfermedad de Huntington tiene una herencia autosómica dominante , lo que significa que un individuo afectado generalmente hereda una copia del gen con una repetición de trinucleótidos expandida (el alelo mutante ) de un progenitor afectado. [26] Dado que la penetración de la mutación es muy alta, aquellos que tienen una copia mutada del gen tendrán la enfermedad. En este tipo de patrón de herencia, cada descendiente de un individuo afectado tiene un riesgo del 50% de heredar el alelo mutante, por lo que se ve afectado por el trastorno (véase la figura). Esta probabilidad es independiente del sexo. [38] Los genes dependientes del sexo o ligados al sexo son rasgos que se encuentran en los cromosomas X o Y. [39]
Las repeticiones de trinucleótidos CAG superiores a 28 son inestables durante la replicación , y esta inestabilidad aumenta con el número de repeticiones presentes. [26] Esto suele conducir a nuevas expansiones a medida que pasan las generaciones ( mutaciones dinámicas ) en lugar de reproducir una copia exacta de la repetición de trinucleótidos. [26] Esto hace que el número de repeticiones cambie en generaciones sucesivas, de modo que un progenitor no afectado con un número "intermedio" de repeticiones (28-35), o "penetrancia reducida" (36-40), puede transmitir una copia del gen con un aumento en el número de repeticiones que produce HD completamente penetrante. [26] La edad de aparición más temprana y la mayor gravedad de la enfermedad en generaciones sucesivas debido al aumento del número de repeticiones se conoce como anticipación genética . [1] La inestabilidad es mayor en la espermatogénesis que en la ovogénesis ; [26] Los alelos heredados por vía materna suelen tener una longitud de repetición similar, mientras que los heredados por vía paterna tienen una mayor probabilidad de aumentar en longitud. [26] [40] En raras ocasiones, la enfermedad de Huntington es causada por una nueva mutación , donde ninguno de los padres tiene más de 36 repeticiones CAG. [41]
En las raras situaciones en las que ambos padres tienen un gen de HD expandido, el riesgo aumenta al 75%, y cuando uno de los padres tiene dos copias expandidas, el riesgo es del 100% (todos los niños se verán afectados). Los individuos con ambos genes afectados son raros. Durante algún tiempo, se pensó que la HD era la única enfermedad en la que la posesión de un segundo gen mutado no afectaba los síntomas ni la progresión, [42] pero desde entonces se ha descubierto que puede afectar el fenotipo y la velocidad de progresión. [26] [43]
La proteína huntingtina interactúa con más de 100 proteínas diferentes y parece tener múltiples funciones. [44] El comportamiento de la proteína mutada (mHtt) no se entiende completamente, pero es tóxica para ciertos tipos de células, particularmente las células cerebrales . El daño temprano es más evidente en los ganglios basales subcorticales , inicialmente en el cuerpo estriado , pero a medida que la enfermedad progresa, también se ven afectadas otras áreas del cerebro, incluidas las regiones de la corteza cerebral . Los síntomas tempranos son atribuibles a las funciones del cuerpo estriado y sus conexiones corticales, es decir, el control sobre el movimiento, el estado de ánimo y la función cognitiva superior. [26] La metilación del ADN también parece estar alterada en la EH. [45]
La Htt se expresa en todas las células, con las concentraciones más altas encontradas en el cerebro y los testículos , y cantidades moderadas en el hígado , el corazón y los pulmones . Sus funciones no están claras, pero interactúa con proteínas involucradas en la transcripción , la señalización celular y el transporte intracelular . [46] En animales modificados genéticamente para presentar HD, se han identificado varias funciones de Htt. [47] En estos animales, Htt es importante para el desarrollo embrionario, ya que su ausencia está relacionada con la muerte embrionaria. Se cree que la caspasa , una enzima que desempeña un papel en la catálisis de la apoptosis , es activada por el gen mutado al dañar el sistema ubiquitina-proteasa. También actúa como un agente antiapoptótico que previene la muerte celular programada y controla la producción del factor neurotrófico derivado del cerebro , una proteína que protege a las neuronas y regula su creación durante la neurogénesis . Htt también facilita el transporte vesicular sináptico y la transmisión sináptica , y controla la transcripción de genes neuronales. [47] Si aumenta la expresión de Htt, mejora la supervivencia de las células cerebrales y se reducen los efectos de mHtt, mientras que cuando se reduce la expresión de Htt, las características resultantes son más parecidas a las observadas en presencia de mHtt. [47] En consecuencia, se piensa que la enfermedad no es causada por una producción inadecuada de Htt, sino por una ganancia tóxica de función de mHtt en el cuerpo. [26]

La acción tóxica de mHtt puede manifestarse y producir la patología HD a través de múltiples cambios celulares. [48] [49] En su forma mutante (poliglutamina expandida), la proteína es más propensa a la escisión que crea fragmentos más cortos que contienen la expansión de poliglutamina. [48] Estos fragmentos de proteína tienen una propensión a sufrir un plegamiento incorrecto y agregación, produciendo agregados fibrilares en los que las cadenas β de poliglutamina no nativas de múltiples proteínas se unen entre sí por enlaces de hidrógeno. [13] Estos agregados comparten la misma arquitectura amiloide cruzada beta fundamental observada en otras enfermedades por depósito de proteínas . [50] Con el tiempo, los agregados se acumulan para formar cuerpos de inclusión dentro de las células, lo que en última instancia interfiere con la función neuronal. [13] [48] Se han encontrado cuerpos de inclusión tanto en el núcleo celular como en el citoplasma . [48] Los cuerpos de inclusión en las células del cerebro son uno de los primeros cambios patológicos, y algunos experimentos han descubierto que pueden ser tóxicos para la célula, pero otros experimentos han demostrado que pueden formarse como parte del mecanismo de defensa del cuerpo y ayudar a proteger las células. [48]
Se han identificado varias vías por las cuales la mHtt puede causar la muerte celular. Estas incluyen efectos sobre las proteínas chaperonas , que ayudan a plegar las proteínas y eliminar las mal plegadas; interacciones con caspasas , que desempeñan un papel en el proceso de eliminación de células ; los efectos tóxicos de la glutamina sobre las células nerviosas ; deterioro de la producción de energía dentro de las células; y efectos sobre la expresión de genes. [13] [51]
Se ha descubierto que la proteína huntingtina mutante desempeña un papel clave en la disfunción mitocondrial . [46] El deterioro del transporte de electrones mitocondriales puede dar lugar a niveles más elevados de estrés oxidativo y liberación de especies reactivas de oxígeno . [52]
Se sabe que la glutamina es excitotóxica cuando está presente en grandes cantidades, lo que puede causar daños a numerosas estructuras celulares. En la EH no se encuentra un exceso de glutamina, pero las interacciones de la proteína huntingtina alterada con numerosas proteínas en las neuronas conducen a una mayor vulnerabilidad a la glutamina. Se cree que esta mayor vulnerabilidad produce efectos excitotóxicos a partir de niveles normales de glutamina. [13]

Inicialmente, el daño al cerebro es regionalmente específico, siendo el estriado dorsal en los ganglios basales subcorticales el que se ve afectado principalmente, seguido más tarde por la afectación cortical en todas las áreas. [53] [54] Otras áreas de los ganglios basales afectadas incluyen la sustancia negra ; la afectación cortical incluye las capas corticales 3, 5 y 6 ; también es evidente la afectación del hipocampo , las células de Purkinje en el cerebelo , los núcleos tuberosos laterales del hipotálamo y partes del tálamo . [26] Estas áreas se ven afectadas según su estructura y los tipos de neuronas que contienen, reduciéndose de tamaño a medida que pierden células. [26] Las neuronas espinosas medias del estriado son las más vulnerables, en particular las que tienen proyecciones hacia el globo pálido externo , siendo las interneuronas y las células espinosas que se proyectan hacia el globo pálido interno las menos afectadas. [26] [55] La EH también provoca un aumento anormal de los astrocitos y la activación de las células inmunes del cerebro, la microglia . [56]
Los ganglios basales desempeñan un papel clave en el control del movimiento y la conducta. Sus funciones no se comprenden por completo, pero las teorías proponen que forman parte del sistema ejecutivo cognitivo [28] y del circuito motor. [57] Los ganglios basales inhiben habitualmente una gran cantidad de circuitos que generan movimientos específicos. Para iniciar un movimiento en particular, la corteza cerebral envía una señal a los ganglios basales que hace que se libere la inhibición. El daño a los ganglios basales puede provocar que la liberación o el restablecimiento de las inhibiciones sea errático e incontrolado, lo que da como resultado un inicio torpe del movimiento o que los movimientos se inicien de forma involuntaria o que un movimiento se detenga antes o después de su finalización prevista. El daño acumulado en esta área causa los movimientos erráticos característicos asociados con la EH, conocidos como corea, una discinesia . [57] Debido a la incapacidad de los ganglios basales para inhibir los movimientos, las personas afectadas por ella inevitablemente experimentan una capacidad reducida para producir el habla y tragar alimentos y líquidos (disfagia). [58]
La proteína de unión a CREB (CBP), un corregulador transcripcional, es esencial para la función celular porque, como coactivador en un número significativo de promotores, activa la transcripción de genes para vías de supervivencia. [51] La CBP contiene un dominio de acetiltransferasa al que se une la HTT a través de su dominio que contiene poliglutamina. [59] También se ha descubierto que los cerebros de autopsias de personas que tenían la enfermedad de Huntington tenían cantidades increíblemente reducidas de CBP. [60] Además, cuando se sobreexpresa la CBP, se reduce la muerte inducida por poliglutamina, lo que demuestra aún más que la CBP desempeña un papel importante en la enfermedad de Huntington y en las neuronas en general. [51]
El diagnóstico de la EH se puede realizar tras la aparición de síntomas físicos específicos de la enfermedad. [26] Se pueden utilizar pruebas genéticas para confirmar un diagnóstico físico si no existen antecedentes familiares de EH. Incluso antes de la aparición de los síntomas, las pruebas genéticas pueden confirmar si un individuo o embrión es portador de una copia expandida de la repetición de trinucleótidos (CAG) en el gen HTT que causa la enfermedad. Se dispone de asesoramiento genético para proporcionar asesoramiento y orientación durante todo el procedimiento de prueba y sobre las implicaciones de un diagnóstico confirmado. Estas implicaciones incluyen el impacto en la psicología de un individuo, su carrera, las decisiones de planificación familiar, los parientes y las relaciones. A pesar de la disponibilidad de pruebas presintomáticas, solo el 5% de las personas con riesgo de heredar la EH optan por realizarlas. [26]

Un examen físico , a veces combinado con un examen psicológico , puede determinar si el inicio de la enfermedad ha comenzado. [26] Los movimientos involuntarios excesivos de cualquier parte del cuerpo son a menudo la razón para buscar una consulta médica. Si estos son abruptos y tienen un tiempo y distribución aleatorios, sugieren un diagnóstico de EH. Los síntomas cognitivos o conductuales rara vez son los primeros síntomas diagnosticados; generalmente solo se reconocen en retrospectiva o cuando se desarrollan más. Cuánto ha progresado la enfermedad se puede medir utilizando la escala de calificación unificada de la enfermedad de Huntington, que proporciona un sistema de calificación general basado en evaluaciones motoras, conductuales, cognitivas y funcionales. [62] [63] Las imágenes médicas , como una tomografía computarizada o una resonancia magnética , pueden mostrar atrofia de los núcleos caudados al principio de la enfermedad, como se ve en la ilustración de la derecha, pero estos cambios no son, por sí mismos, diagnósticos de EH. La atrofia cerebral se puede ver en las etapas avanzadas de la enfermedad. Las técnicas de neuroimagen funcional , como la resonancia magnética funcional (fMRI) y la tomografía por emisión de positrones (PET), pueden mostrar cambios en la actividad cerebral antes de la aparición de los síntomas físicos, pero son herramientas experimentales y no se utilizan clínicamente. [26]
Dado que la HD sigue un patrón de herencia autosómico dominante, existe una fuerte motivación para que las personas que corren el riesgo de heredarla busquen un diagnóstico. La prueba genética para la HD consiste en un análisis de sangre, que cuenta la cantidad de repeticiones de CAG en cada uno de los alelos HTT . [64] Los puntos de corte se dan de la siguiente manera:
Realizarse la prueba antes de la aparición de los síntomas es un acontecimiento que cambia la vida y una decisión muy personal. [26] La razón principal que se da para elegir hacerse la prueba de la EH es ayudar en las decisiones profesionales y familiares. [26] Las pruebas predictivas para la enfermedad de Huntington han estado disponibles mediante análisis de ligamiento (que requiere realizar pruebas a varios miembros de la familia) desde 1986 y mediante análisis de mutación directa desde 1993. [66] En ese momento, las encuestas indicaban que entre el 50 y el 70 % de las personas en riesgo habrían estado interesadas en recibir la prueba, pero desde que se ha ofrecido la prueba predictiva, muchas menos eligen hacérsela. [67] Más del 95 % de las personas en riesgo de heredar la EH no se hacen la prueba, principalmente porque no tiene tratamiento. [26] Una cuestión clave es la ansiedad que experimenta una persona por no saber si finalmente desarrollará la EH, en comparación con el impacto de un resultado positivo. [26] Independientemente del resultado, los niveles de estrés son menores dos años después de hacerse la prueba, pero el riesgo de suicidio aumenta después de un resultado positivo. [26] Las personas que no han heredado el trastorno pueden experimentar culpa por haber sobrevivido a la enfermedad en relación con sus familiares. [26] Otros factores que se tienen en cuenta al considerar la realización de la prueba incluyen la posibilidad de discriminación y las implicaciones de un resultado positivo, que generalmente significa que uno de los padres tiene un gen afectado y que los hermanos del individuo correrán el riesgo de heredar el gen. [26] En un estudio, se encontró discriminación genética en el 46% de las personas con riesgo de padecer la enfermedad de Huntington. Ocurrió en tasas más altas en las relaciones personales que en las relaciones laborales o de seguro médico. [68] El asesoramiento genético en la EH puede proporcionar información, asesoramiento y apoyo para la toma de decisiones inicial y, luego, si se elige, durante todas las etapas del proceso de prueba. [69] Debido a las implicaciones de esta prueba, los pacientes que desean someterse a la prueba deben completar tres sesiones de asesoramiento que brindan información sobre la enfermedad de Huntington. [70]
El asesoramiento y las directrices sobre el uso de pruebas genéticas para la EH se han convertido en modelos para otros trastornos genéticos, como la ataxia cerebelosa autosómica dominante . [26] [71] [72] Las pruebas presintomáticas para la EH también han influido en las pruebas para otras enfermedades con variantes genéticas, como la enfermedad renal poliquística , la enfermedad de Alzheimer familiar y el cáncer de mama . [71] La Red Europea de Calidad de Genética Molecular ha publicado un esquema anual de evaluación de calidad externa para las pruebas genéticas moleculares para esta enfermedad y ha desarrollado directrices de mejores prácticas para las pruebas genéticas para la EH para ayudar en las pruebas y la notificación de los resultados. [73]
Los embriones producidos mediante fertilización in vitro pueden ser sometidos a pruebas genéticas para detectar la EH mediante el diagnóstico genético preimplantacional . Esta técnica, en la que se extraen una o dos células de un embrión de entre 4 y 8 células y luego se analizan para detectar la anomalía genética, puede utilizarse para garantizar que los embriones afectados por genes de la EH no se implanten, de modo que ningún descendiente herede la enfermedad. Algunas formas de diagnóstico genético preimplantacional (pruebas de no divulgación o de exclusión) permiten que las personas en riesgo tengan descendencia sin EH sin revelar su propio genotipo parental, sin dar información sobre si ellos mismos están destinados a desarrollar la EH. En las pruebas de exclusión, el ADN del embrión se compara con el de los padres y abuelos para evitar la herencia de la región cromosómica que contiene el gen de la EH del abuelo afectado. En las pruebas de no divulgación, solo los embriones libres de la enfermedad se reemplazan en el útero, mientras que el genotipo parental y, por lo tanto, el riesgo parental de EH nunca se revelan. [74] [75]
También es posible obtener un diagnóstico prenatal de un embrión o feto en el útero, utilizando material genético fetal adquirido a través de una muestra de vellosidades coriónicas . Se puede realizar una amniocentesis si el embarazo está más avanzado, dentro de las 14 a 18 semanas. Este procedimiento examina el líquido amniótico que rodea al bebé en busca de indicadores de la mutación HD. [76] Esto también se puede combinar con pruebas de exclusión para evitar la divulgación del genotipo parental. Las pruebas prenatales se pueden realizar cuando a los padres se les ha diagnosticado HD, cuando se han realizado pruebas genéticas que muestran la expansión del gen HTT o cuando tienen una probabilidad del 50% de heredar la enfermedad. Se puede asesorar a los padres sobre sus opciones, que incluyen la interrupción del embarazo , y sobre las dificultades de un niño con el gen identificado. [77] [78]
Además, en embarazos de riesgo debido a una pareja masculina afectada, se puede realizar un diagnóstico prenatal no invasivo mediante el análisis del ADN fetal libre de células en una muestra de sangre tomada de la madre (mediante venopunción ) entre las seis y las 12 semanas de embarazo. [65] No tiene ningún riesgo de aborto relacionado con el procedimiento. [65]
Alrededor del 99% de los diagnósticos de HD basados en los síntomas típicos y antecedentes familiares de la enfermedad se confirman mediante pruebas genéticas para tener la repetición de trinucleótidos expandida que causa HD. La mayoría de los restantes se denominan síndromes similares a HD (HDL) . [26] [79] La causa de la mayoría de las enfermedades HDL es desconocida, pero aquellas con causas conocidas se deben a mutaciones en el gen de la proteína priónica (HDL1), el gen de la junctofilina 3 (HDL2), un gen desconocido heredado de forma recesiva (HDL3, que solo se encuentra en dos familias y es poco comprendido) y el gen que codifica la proteína de unión a la caja TATA ( SCA17, a veces llamada HDL4 ). Otras enfermedades autosómicas dominantes que pueden diagnosticarse erróneamente como HD son la atrofia dentatorubral-pallidoluysiana y la neuroferritinopatía . Además, algunos trastornos autosómicos recesivos se parecen a casos esporádicos de HD. Estos incluyen la acantocitosis coreica y la neurodegeneración asociada a la pantotenato quinasa . Un trastorno de este tipo ligado al cromosoma X es el síndrome de McLeod . [79]
.pdf/page1-440px-Report_(IA_report00comm_6).pdf.jpg)
Existen tratamientos disponibles para reducir la gravedad de algunos síntomas de la EH. [80] Para muchos de estos tratamientos, la evidencia para confirmar su efectividad en el tratamiento de los síntomas de la EH específicamente es incompleta. [26] [81] A medida que la enfermedad progresa, la capacidad de cuidarse a uno mismo disminuye, y la atención multidisciplinaria cuidadosamente administrada se vuelve cada vez más necesaria. [26] Aunque relativamente pocos estudios de ejercicios y terapias han demostrado ser útiles para rehabilitar los síntomas cognitivos de la EH, alguna evidencia muestra la utilidad de la fisioterapia , la terapia ocupacional y la terapia del habla . [26]
La pérdida de peso y los problemas para comer debido a la disfagia y otras descoordinaciones musculares son comunes, lo que hace que el manejo nutricional sea cada vez más importante a medida que avanza la enfermedad. [26] Se pueden agregar agentes espesantes a los líquidos, ya que los líquidos más espesos son más fáciles y seguros de tragar. [26] También puede ser útil recordarle a la persona afectada que coma lentamente y que se lleve trozos más pequeños de comida a la boca para evitar el atragantamiento. [26] Si comer se vuelve demasiado peligroso o incómodo, existe la opción de usar una gastrostomía endoscópica percutánea . Este tubo de alimentación, conectado permanentemente a través del abdomen hasta el estómago , reduce el riesgo de aspiración de alimentos y proporciona un mejor manejo nutricional. [82] Se recomienda la evaluación y el manejo por parte de patólogos del lenguaje y el habla con experiencia en la enfermedad de Huntington. [26]
Las personas con enfermedad de Huntington pueden acudir a un fisioterapeuta para que les recete métodos no invasivos y sin medicación para controlar los síntomas físicos. Los fisioterapeutas pueden implementar la evaluación y prevención del riesgo de caídas, así como ejercicios de fortalecimiento, estiramiento y cardiovasculares. Se pueden prescribir ayudas para caminar según sea necesario. Los fisioterapeutas también prescriben ejercicios de respiración y técnicas de despeje de las vías respiratorias cuando aparecen problemas respiratorios. [83] La Red Europea de EH ha elaborado directrices de consenso sobre fisioterapia en la enfermedad de Huntington. [83] Los objetivos de las intervenciones de rehabilitación temprana son la prevención de la pérdida de función. La participación en programas de rehabilitación durante la etapa temprana a media de la enfermedad puede ser beneficiosa, ya que se traduce en el mantenimiento a largo plazo del rendimiento motor y funcional. La rehabilitación durante la etapa tardía tiene como objetivo compensar las pérdidas motoras y funcionales. [84] Para el tratamiento independiente a largo plazo, el terapeuta puede desarrollar programas de ejercicios en el hogar para las personas adecuadas. [85]
Además, un número cada vez mayor de personas con EH están recurriendo a cuidados paliativos , cuyo objetivo es mejorar la calidad de vida mediante el tratamiento de los síntomas y el estrés de la enfermedad grave, además de sus otros tratamientos. [86]

La tetrabenazina fue aprobada en 2000 para el tratamiento de la corea en la enfermedad de Huntington en la UE, y en 2008 en los EE. UU. [87] Aunque se habían utilizado otros medicamentos " fuera de etiqueta ", la tetrabenazina fue el primer tratamiento aprobado para la enfermedad de Huntington en los EE. UU. El compuesto se conoce desde la década de 1950. Una alternativa a la tetrabenazina es la amantadina, pero hay evidencia limitada de su seguridad y eficacia. [88]
Otros medicamentos que ayudan a reducir la corea incluyen antipsicóticos y benzodiazepinas . [22] La hipocinesia y la rigidez, especialmente en casos juveniles, se pueden tratar con medicamentos antiparkinsonianos , y la hipercinesia mioclónica se puede tratar con ácido valproico . [22] La evidencia tentativa ha encontrado que el ácido eicosapentaenoico etílico mejora los síntomas motores al año. [89] En 2017, la FDA aprobó la deutetrabenazina , una forma más pesada del medicamento tetrabenazina para el tratamiento de la corea en la EH. [90] Este se comercializa como Austedo.
Los síntomas psiquiátricos pueden tratarse con medicamentos similares a los que se utilizan en la población general. [26] [81] Se han recomendado inhibidores selectivos de la recaptación de serotonina y mirtazapina para la depresión, mientras que los antipsicóticos atípicos se recomiendan para la psicosis y los problemas de conducta. [81] Se recomienda la intervención de un neuropsiquiatra especializado, ya que las personas pueden requerir un tratamiento a largo plazo con múltiples medicamentos en combinación. [26]
Se han experimentado varias terapias alternativas en la medicina ayurvédica con productos de origen vegetal, aunque ninguna ha aportado pruebas fehacientes de su eficacia. Un estudio reciente demostró que la peptidasa de procesamiento estromal (SPP), una enzima sintética que se encuentra en los cloroplastos de las plantas , impedía la agregación de proteínas asociadas a la enfermedad de Huntington. [91] Sin embargo, se necesitan estudios repetidos y validación clínica para confirmar su verdadero potencial terapéutico.
Las familias de las personas que han heredado o corren el riesgo de heredar la enfermedad de Huntington, y la sociedad en general, tienen generaciones de experiencia con la enfermedad, pero pueden desconocer los recientes avances en la comprensión de la enfermedad y la disponibilidad de pruebas genéticas. El asesoramiento genético beneficia a estas personas al actualizar sus conocimientos, tratar de disipar cualquier creencia infundada que puedan tener y ayudarlos a considerar sus opciones y planes futuros. El Programa de Educación para Pacientes con Enfermedad de Huntington se ha creado para ayudar a educar a los miembros de la familia, los cuidadores y las personas diagnosticadas con la enfermedad de Huntington. [92] También se incluye información sobre las opciones de planificación familiar, la gestión de la atención y otras consideraciones. [26] [93]
La longitud de la repetición de trinucleótidos explica el 60% de la variación de la edad de aparición de los síntomas y su tasa de progresión. Una repetición más larga da como resultado una edad de aparición más temprana y una progresión más rápida de los síntomas. [26] [94] Las personas con más de sesenta repeticiones a menudo desarrollan la enfermedad antes de los 20 años, mientras que aquellas con menos de 40 repeticiones pueden permanecer asintomáticas. [95] La variación restante se debe a factores ambientales y otros genes que influyen en el mecanismo de la enfermedad. [26]
La esperanza de vida en la EH es generalmente de alrededor de 10 a 30 años después del inicio de los síntomas visibles. [26] La enfermedad de Huntington juvenil tiene una tasa de esperanza de vida de 10 años después del inicio de los síntomas visibles. La mayoría de las complicaciones potencialmente mortales son resultado de la coordinación muscular y, en menor medida, de cambios de comportamiento inducidos por el deterioro de la función cognitiva. El mayor riesgo es la neumonía , que causa la muerte en un tercio de las personas con EH. A medida que la capacidad de sincronizar los movimientos se deteriora, la dificultad para limpiar los pulmones y un mayor riesgo de aspirar comida o bebida aumentan el riesgo de contraer neumonía . El segundo mayor riesgo es la enfermedad cardíaca , que causa casi una cuarta parte de las muertes de las personas con EH. [96] El suicidio es la tercera causa más importante de muertes, con un 7,3% de las personas con EH que se quitan la vida y hasta un 27% que intentan hacerlo. No está claro hasta qué punto los pensamientos suicidas están influenciados por los síntomas conductuales, ya que significan un deseo de evitar las etapas posteriores de la enfermedad. [97] [98] [99] El suicidio es el mayor riesgo de esta enfermedad antes de que se haga el diagnóstico y en las etapas intermedias del desarrollo durante toda la enfermedad. Otros riesgos asociados incluyen la asfixia; debido a la incapacidad de tragar, lesiones físicas por caídas y desnutrición. [96] [20]
La aparición tardía de la enfermedad de Huntington significa que generalmente no afecta la reproducción. [26] La prevalencia mundial de HD es de 5 a 10 casos por 100,000 personas, [100] [101] pero varía mucho geográficamente como resultado de la etnia, la migración local y los patrones de inmigración pasados. [26] La prevalencia es similar para hombres y mujeres. La tasa de aparición es más alta en personas de ascendencia europea occidental, con un promedio de alrededor de siete por 100,000 personas, y es más baja en el resto del mundo; por ejemplo, uno por millón de personas de ascendencia asiática y africana. Un estudio epidemiológico de 2013 de la prevalencia de la enfermedad de Huntington en el Reino Unido entre 1990 y 2010 encontró que la prevalencia promedio para el Reino Unido fue de 12.3 por 100,000. [26] [102] Además, algunas áreas localizadas tienen una prevalencia mucho más alta que su promedio regional. [26] Una de las incidencias más altas se encuentra en las poblaciones aisladas de la región del Lago de Maracaibo en Venezuela , donde la EH afecta hasta 700 por cada 100.000 personas. [26] [103] Se han encontrado otras áreas de alta localización en Tasmania y regiones específicas de Escocia , Gales y Suecia . [99] La mayor prevalencia en algunos casos ocurre debido a un efecto fundador local , una migración histórica de portadores a un área de aislamiento geográfico . [99] [104] Algunos de estos portadores han sido rastreados cientos de años atrás usando estudios genealógicos . [99] Los haplotipos genéticos también pueden dar pistas sobre las variaciones geográficas de la prevalencia. [99] [105] Islandia , por el contrario, tiene una prevalencia bastante baja de 1 por cada 100.000, a pesar del hecho de que los islandeses como pueblo descienden de las primeras tribus germánicas de Escandinavia que también dieron origen a los suecos ; todos los casos, con excepción de uno que se remonta a casi dos siglos y que se originó en la descendencia de una pareja que vivió a principios del siglo XIX. [106] Finlandia también tiene una incidencia baja de sólo 2,2 por cada 100.000 personas. [107]
Hasta el descubrimiento de una prueba genética, las estadísticas sólo podían incluir el diagnóstico clínico basado en síntomas físicos y antecedentes familiares de EH, excluyendo a aquellos que murieron por otras causas antes del diagnóstico. Estos casos ahora pueden incluirse en las estadísticas y, a medida que la prueba se haga más accesible, es probable que aumenten las estimaciones de la prevalencia e incidencia del trastorno. [99] [108]

En siglos pasados, varios tipos de corea eran a veces llamados con nombres como danza de San Vito , con poca o ninguna comprensión de su causa o tipo en cada caso.
La primera mención definitiva de HD fue en una carta de Charles Oscar Waters (1816-1892), publicada en la primera edición de Practice of Medicine de Robley Dunglison en 1842. [110] Waters describió "una forma de corea, vulgarmente llamada magrums", incluyendo descripciones precisas de la corea, su progresión y la fuerte herencia de la enfermedad. [111] En 1846, Charles Rollin Gorman (1817-1879) observó cómo parecía ocurrir una mayor prevalencia en regiones localizadas. [112] [111] Independientemente de Gorman y Waters, ambos estudiantes de Dunglison en el Jefferson Medical College de Filadelfia, [113] Johan Christian Lund (1830-1906) también produjo una descripción temprana en 1860. [111] Señaló específicamente que en Setesdalen , un valle montañoso aislado en Noruega , la alta prevalencia de demencia estaba asociada con un patrón de trastornos del movimiento espasmódico que se presentaba en familias. [114]
La primera descripción completa de la enfermedad la realizó George Huntington en 1872. Al examinar la historia clínica combinada de varias generaciones de una familia que presentaban síntomas similares, se dio cuenta de que sus afecciones debían estar relacionadas; presentó su definición detallada y precisa de la enfermedad como su primer artículo. Huntington describió el patrón exacto de herencia de la enfermedad autosómica dominante años antes de que los científicos redescubrieran la herencia mendeliana .
De su naturaleza hereditaria. Cuando uno o ambos padres han mostrado manifestaciones de la enfermedad... uno o más de los hijos casi invariablemente padecen la enfermedad... Pero si por casualidad estos hijos pasan por la vida sin ella, el hilo se rompe y los nietos y bisnietos de los agitadores originales pueden estar seguros de que están libres de la enfermedad. [109] [115]
Sir William Osler estaba interesado en el trastorno y la corea en general, y quedó impresionado con el artículo de Huntington, que afirmaba: "En la historia de la medicina, hay pocos casos en los que una enfermedad haya sido descrita con mayor precisión, de manera más gráfica o más brevemente". [116] [111] [117] El continuo interés de Osler en la EH, combinado con su influencia en el campo de la medicina, ayudó a difundir rápidamente la conciencia y el conocimiento del trastorno en toda la comunidad médica. [111] Los científicos de Europa mostraron un gran interés, incluidos Louis Théophile Joseph Landouzy , Désiré-Magloire Bourneville , Camillo Golgi y Joseph Jules Dejerine , y hasta finales de siglo, gran parte de la investigación sobre la EH era de origen europeo. [111] A finales del siglo XIX, se habían publicado investigaciones e informes sobre la EH en muchos países y la enfermedad se reconoció como una afección mundial. [111]
Durante el redescubrimiento de la herencia mendeliana a principios del siglo XX, la EH se utilizó de forma tentativa como ejemplo de herencia autosómica dominante. [111] El biólogo inglés William Bateson utilizó los pedigríes de las familias afectadas para establecer que la EH tenía un patrón de herencia autosómico dominante. [118] [113] El fuerte patrón de herencia impulsó a varios investigadores, incluido Smith Ely Jelliffe , a intentar rastrear y conectar a los miembros de la familia de estudios anteriores. [111] Jelliffe recopiló información de todo Nueva York y publicó varios artículos sobre la genealogía de la EH en Nueva Inglaterra . [119] La investigación de Jelliffe despertó el interés de su amigo de la universidad, Charles Davenport , quien encargó a Elizabeth Muncey que produjera el primer estudio de campo en la costa este de los Estados Unidos de familias con EH y que construyera sus pedigríes. [120] Davenport utilizó esta información para documentar la edad variable de aparición y el rango de síntomas de la EH; Afirmó que la mayoría de los casos de EH en los EE. UU. se podían rastrear hasta un puñado de individuos. [120] Esta investigación fue embellecida aún más en 1932 por PR Vessie, quien popularizó la idea de que tres hermanos que abandonaron Inglaterra en 1630 con destino a Boston fueron los progenitores de la EH en los EE. UU. [121] La afirmación de que se habían establecido los primeros progenitores y el sesgo eugenésico del trabajo de Muncey, Davenport y Vessie contribuyeron a los malentendidos y prejuicios sobre la EH. [113] Muncey y Davenport también popularizaron la idea de que en el pasado, se podía pensar que algunas personas con EH estaban poseídas por espíritus o eran víctimas de brujería , y que a veces eran rechazadas o exiliadas por la sociedad. [122] [123] Esta idea no ha sido probada. Los investigadores han encontrado evidencia contraria; por ejemplo, la comunidad de la familia estudiada por George Huntington acogió abiertamente a quienes mostraban síntomas de EH. [113] [122]
La búsqueda de la causa de esta condición se intensificó considerablemente en 1968, cuando la Fundación de Enfermedades Hereditarias (HDF) fue creada por Milton Wexler , un psicoanalista con sede en Los Ángeles , California , cuya esposa Leonore Sabin había sido diagnosticada a principios de ese año con la enfermedad de Huntington. [124] Los tres hermanos de la esposa de Wexler también tenían esta enfermedad.
La fundación participó en el reclutamiento de más de 100 científicos en el Proyecto Colaborativo de la Enfermedad de Huntington entre Estados Unidos y Venezuela, que durante un período de 10 años a partir de 1979, trabajó para localizar la causa genética. [125] Esto se logró en 1983 cuando se localizó aproximadamente un gen causal, [104] y en 1993, el gen se localizó con precisión en el cromosoma 4 (4p16.3). [126] El estudio se había centrado en las poblaciones de dos aldeas venezolanas aisladas , Barranquitas y Lagunetas, donde había una prevalencia inusualmente alta de EH, e involucró a más de 18.000 personas, en su mayoría de una sola familia extendida, y resultó en hacer de la EH el primer locus de enfermedad autosómica encontrado utilizando el análisis de ligamiento genético . [126] [127] Entre otras innovaciones, el proyecto desarrolló métodos de marcado de ADN que fueron un paso importante para hacer posible el Proyecto Genoma Humano . [125]
Al mismo tiempo, se estaban realizando descubrimientos clave sobre los mecanismos del trastorno, incluidos los hallazgos del grupo de investigación de Anita Harding sobre los efectos de la longitud del gen. [128]
La modelización de la enfermedad en diversos tipos de animales, como el ratón transgénico desarrollado en 1996, permitió realizar experimentos a mayor escala. Como estos animales tienen metabolismos más rápidos y una esperanza de vida mucho más corta que los humanos, los resultados de los experimentos se reciben antes, lo que acelera la investigación. El descubrimiento en 1997 de que los fragmentos mHtt se pliegan incorrectamente condujo al descubrimiento de las inclusiones nucleares que causan. Estos avances han dado lugar a una investigación cada vez más extensa sobre las proteínas implicadas en la enfermedad, los posibles tratamientos farmacológicos, los métodos de atención y el gen en sí. [111] [129]
Las redes de atención y apoyo que se habían desarrollado en Venezuela y Colombia durante los proyectos de investigación que se llevaron a cabo allí entre los años 1970 y 2000 fueron erosionadas con el tiempo por diversas fuerzas, como la crisis actual en Venezuela y la muerte de un investigador principal en Colombia (Jorge Daza Barriga). [130] Los médicos están trabajando para reavivar estas redes porque las personas que han contribuido a la ciencia de la enfermedad de Huntington participando en estos estudios merecen una atención de seguimiento adecuada; las sociedades en otras partes del mundo que se benefician de los avances científicos así logrados deben al menos eso a quienes participaron en la investigación. [130]
La afección antes se denominaba corea de Huntington, pero este término ha sido reemplazado por enfermedad de Huntington porque no todos los pacientes desarrollan corea y debido a la importancia de los problemas cognitivos y conductuales. [131]
Las pruebas genéticas para la enfermedad de Huntington han planteado varios problemas éticos. Entre ellos, se encuentran la definición de la madurez que debe tener un individuo antes de ser considerado apto para la prueba, la garantía de la confidencialidad de los resultados y la posibilidad de que las empresas utilicen los resultados de las pruebas para tomar decisiones sobre empleo, seguros de vida u otros asuntos financieros. Hubo controversia cuando Charles Davenport propuso en 1910 que se utilizara la esterilización obligatoria y el control de la inmigración para las personas con ciertas enfermedades, incluida la EH, como parte del movimiento eugenésico . [132] La fertilización in vitro tiene algunos problemas con respecto al uso de embriones. Algunas investigaciones sobre la EH tienen problemas éticos debido al uso de pruebas con animales y células madre embrionarias . [133] [134]
El desarrollo de una prueba diagnóstica precisa para la enfermedad de Huntington ha causado preocupaciones sociales, legales y éticas sobre el acceso y uso de los resultados de una persona. [135] [136] Muchas pautas y procedimientos de prueba tienen procedimientos estrictos de divulgación y confidencialidad para permitir que las personas decidan cuándo y cómo recibir sus resultados y también a quién se ponen a disposición de los resultados. [26] Las compañías de seguros y las empresas se enfrentan a la cuestión de si utilizar los resultados de las pruebas genéticas al evaluar a una persona, como para un seguro de vida o un empleo. Las compañías de seguros del Reino Unido acordaron con el Departamento de Salud y Asistencia Social que hasta 2017 los clientes no necesitarían revelarles las pruebas genéticas predictivas, pero este acuerdo excluyó explícitamente la prueba aprobada por el gobierno para Huntington al suscribir pólizas con un valor superior a £ 500,000 . [137] [138] Al igual que con otras condiciones genéticas intratables con un inicio más tardío, es éticamente cuestionable realizar pruebas presintomáticas en un niño o adolescente, ya que no habría ningún beneficio médico para esa persona. Existe consenso en que sólo se deben realizar pruebas a personas que se consideran cognitivamente maduras, aunque existe un contraargumento que sostiene que los padres tienen derecho a tomar la decisión en nombre de su hijo. Ante la falta de un tratamiento eficaz, realizar pruebas a una persona menor de edad que no se considera competente se considera poco ético en la mayoría de los casos. [49] [139] [140]
Existen preocupaciones éticas relacionadas con las pruebas genéticas prenatales o el diagnóstico genético preimplantacional para garantizar que un niño no nazca con una enfermedad determinada. [141] Por ejemplo, las pruebas prenatales plantean la cuestión del aborto selectivo, una opción que algunos consideran inaceptable. [141] Como se trata de una enfermedad dominante, existen dificultades en situaciones en las que un padre no quiere conocer su propio diagnóstico. Esto requeriría que partes del proceso se mantuvieran en secreto para el padre. [141]

En 1968, después de experimentar la enfermedad de Huntington en la familia de su esposa, el Dr. Milton Wexler se inspiró para iniciar la Fundación de Enfermedades Hereditarias (HDF), con el objetivo de curar enfermedades genéticas mediante la coordinación y el apoyo a la investigación. [17] La fundación y la hija de Wexler, Nancy Wexler , fueron partes clave del equipo de investigación en Venezuela que descubrió el gen de la EH. [17]
Casi al mismo tiempo que se formó la HDF, Marjorie Guthrie ayudó a fundar el comité para combatir la enfermedad de Huntington (ahora la Sociedad de la Enfermedad de Huntington de Estados Unidos ), después de que su esposo, el cantautor folk Woody Guthrie , muriera por complicaciones de la EH. [18]
Desde entonces, se han formado organizaciones de apoyo e investigación en muchos países del mundo que han ayudado a aumentar la conciencia pública sobre la EH. Varias de ellas colaboran en organizaciones paraguas, como la Asociación Internacional de Huntington y la red europea de la EH. [142] Muchas organizaciones de apoyo celebran un evento anual de concienciación sobre la EH, algunos de los cuales han sido respaldados por sus respectivos gobiernos. Por ejemplo, el 6 de junio ha sido designado "Día Nacional de Concientización sobre la Enfermedad de Huntington" por el Senado de los EE. UU . [143] Existen muchas organizaciones para apoyar e informar a las personas afectadas por la EH, incluida la Asociación de la Enfermedad de Huntington en el Reino Unido. El mayor financiador de la investigación lo proporciona la Fundación Cure Huntington's Disease Initiative (CHDI). [144]
La investigación sobre el mecanismo de la EH se centra en identificar el funcionamiento de Htt, cómo mHtt difiere o interfiere con él y la patología cerebral que produce la enfermedad. [145] La investigación se lleva a cabo utilizando métodos in vitro , animales modificados genéticamente (también llamados modelos animales transgénicos ) y voluntarios humanos. Los modelos animales son fundamentales para comprender los mecanismos fundamentales que causan la enfermedad y para respaldar las primeras etapas del desarrollo de fármacos . [129] La identificación del gen causante ha permitido el desarrollo de muchos organismos modificados genéticamente , incluidos nematodos (gusanos redondos), moscas de la fruta Drosophila y mamíferos modificados genéticamente, incluidos ratones, ratas, ovejas, cerdos y monos que expresan huntingtina mutante y desarrollan neurodegeneración progresiva y síntomas similares a la EH. [129]
Se están realizando investigaciones utilizando muchos enfoques para prevenir la enfermedad de Huntington o retrasar su progresión. [145] Las estrategias de modificación de la enfermedad se pueden agrupar ampliamente en tres categorías: reducción del nivel de la proteína huntingtina mutante (incluido el empalme y silenciamiento de genes ); enfoques destinados a mejorar la supervivencia neuronal reduciendo el daño causado por la proteína a vías y mecanismos celulares específicos (incluida la homeostasis de proteínas y la inhibición de la histona desacetilasa ); y estrategias para reemplazar las neuronas perdidas. Además, se están desarrollando nuevas terapias para mejorar el funcionamiento cerebral; estas buscan producir terapias sintomáticas en lugar de modificadoras de la enfermedad , e incluyen inhibidores de la fosfodiesterasa . [146] [147]
La Fundación CHDI financia una gran cantidad de iniciativas de investigación y genera muchas publicaciones. [148] La fundación CHDI es el mayor financiador de la investigación sobre la enfermedad de Huntington a nivel mundial y tiene como objetivo encontrar y desarrollar medicamentos que desaceleren la progresión de la EH. [144] [149] La CHDI antes se conocía como la Fundación High Q. En 2006, gastó 50 millones de dólares en la investigación sobre la enfermedad de Huntington. [144] La CHDI colabora con muchos laboratorios académicos y comerciales a nivel mundial y participa en la supervisión y gestión de proyectos de investigación, así como en la financiación. [150]
El silenciamiento génico tiene como objetivo reducir la producción de la proteína mutante, ya que la EH es causada por un solo gen dominante que codifica una proteína tóxica. Los experimentos de silenciamiento génico en modelos de ratón han demostrado que cuando se reduce la expresión de mHtt, los síntomas mejoran. [151] La seguridad de la interferencia de ARN y los métodos de silenciamiento génico de oligonucleótidos específicos de alelos (ASO) se ha demostrado en ratones y en el cerebro de macacos primates más grandes. [152] [153] El silenciamiento específico de alelos intenta silenciar la htt mutante mientras deja intacta la Htt de tipo salvaje. Una forma de lograr esto es identificar polimorfismos presentes en un solo alelo y producir medicamentos silenciadores génicos que se dirijan a polimorfismos solo en el alelo mutante. [154] El primer ensayo de silenciamiento génico que involucra a humanos con EH comenzó en 2015, probando la seguridad de IONIS-HTTRx, producido por Ionis Pharmaceuticals y dirigido por el Instituto de Neurología de UCL . [155] [156] La huntingtina mutante se detectó y cuantificó por primera vez en el líquido cefalorraquídeo de portadores de mutaciones de la enfermedad de Huntington en 2015 utilizando un novedoso inmunoensayo de "recuento de moléculas individuales" , [157] proporcionando una forma directa de evaluar si los tratamientos para reducir la huntingtina están logrando el efecto deseado. [158] [159] Un ensayo de fase 3 de este compuesto, rebautizado como tominersen y patrocinado por Roche Pharmaceuticals , comenzó en 2019, pero se detuvo en 2021 después de que la junta de monitoreo de seguridad concluyera que el balance riesgo-beneficio era desfavorable. [160] Un ensayo de terapia génica para reducir la huntingtina dirigido por Uniqure comenzó en 2019, y se han anunciado varios ensayos de compuestos moduladores de empalme para reducir la huntingtina administrados por vía oral. [161] Se están estudiando técnicas de empalme de genes para intentar reparar un genoma con el gen erróneo que causa la EH, utilizando herramientas como CRISPR/Cas9 . [147] PTC Therapeutics está evaluando pequeñas moléculas que inducen la inclusión de exones venenosos en la transcripción de HTT como una estrategia terapéutica para reducir la expresión de HTT . [162] [163]
Otra estrategia para reducir el nivel de huntingtina mutante es aumentar la velocidad a la que las células pueden eliminarla. [164] Como mHtt (y muchos otros agregados de proteínas ) se degradan por autofagia , aumentar la velocidad de autofagia tiene el potencial de reducir los niveles de mHtt y, por lo tanto, mejorar la enfermedad. [165] Se han probado inductores farmacológicos y genéticos de la autofagia en una variedad de modelos de enfermedad de Huntington; se ha demostrado que muchos reducen los niveles de mHtt y disminuyen la toxicidad. [164]
Entre los enfoques destinados a mejorar la supervivencia celular en presencia de huntingtina mutante se encuentran la corrección de la regulación transcripcional mediante inhibidores de la histona desacetilasa , la modulación de la agregación de huntingtina, la mejora del metabolismo y la función mitocondrial y la restauración de la función de las sinapsis . [151]
La terapia con células madre se utiliza para reemplazar las neuronas dañadas mediante el trasplante de células madre en las regiones afectadas del cerebro. Los experimentos en modelos animales (ratas y ratones únicamente) han dado resultados positivos. [166]
Cualquiera que sea su potencial terapéutico futuro, las células madre ya son una herramienta valiosa para estudiar la enfermedad de Huntington en el laboratorio. [167]
La ferroptosis es una forma de muerte celular regulada que se caracteriza por la acumulación de hidroperóxidos lipídicos dependientes del hierro hasta niveles letales. La ferroptosis mediada por ALOX5 actúa como una vía de muerte celular en caso de estrés oxidativo en la enfermedad de Huntington. [168] Los inhibidores de la ferroptosis son protectores en modelos de trastornos cerebrales degenerativos, incluidas las enfermedades de Parkinson, Huntington y Alzheimer. [168]
En 2020, hubo 197 ensayos clínicos relacionados con diversas terapias y biomarcadores para la enfermedad de Huntington enumerados como en curso, en reclutamiento o recientemente completados. [169] Los compuestos probados que no han logrado prevenir o retrasar la progresión de la enfermedad de Huntington incluyen remacemida , coenzima Q10 , riluzol , creatina , minociclina , etil-EPA , fenilbutirato y dimebon . [170]
{{cite journal}}: CS1 maint: DOI inactivo a partir de noviembre de 2024 ( enlace )