La terapia con células madre utiliza células madre para tratar o prevenir una enfermedad o afección. [1] A partir de 2016 [actualizar], la única terapia establecida que utiliza células madre es el trasplante de células madre hematopoyéticas . [2] Esto generalmente toma la forma de un trasplante de médula ósea , pero las células también pueden derivarse de sangre del cordón umbilical . Se están realizando investigaciones para desarrollar diversas fuentes de células madre, así como para aplicar tratamientos con células madre para enfermedades neurodegenerativas [3] y afecciones como la diabetes y las enfermedades cardíacas .
La terapia con células madre se ha vuelto controvertida tras avances como la capacidad de los científicos para aislar y cultivar células madre embrionarias , para crear células madre mediante transferencia nuclear de células somáticas y su uso de técnicas para crear células madre pluripotentes inducidas . Esta controversia suele estar relacionada con la política del aborto y la clonación humana . Además, los esfuerzos por comercializar tratamientos basados en trasplantes de sangre de cordón umbilical almacenada han sido controvertidos.
Durante más de 90 años, el trasplante de células madre hematopoyéticas (TCMH) se ha utilizado para tratar a personas con afecciones como leucemia y linfoma ; ésta es la única forma ampliamente practicada de terapia con células madre. [4] [5] [6] Durante la quimioterapia , la mayoría de las células en crecimiento son destruidas por los agentes citotóxicos . Estos agentes, sin embargo, no pueden discriminar entre las células leucémicas o neoplásicas y las células madre hematopoyéticas dentro de la médula ósea. Este es el efecto secundario de las estrategias de quimioterapia convencional que el trasplante de células madre intenta revertir; La médula ósea sana de un donante reintroduce células madre funcionales para reemplazar las células perdidas en el cuerpo del huésped durante el tratamiento. Las células trasplantadas también generan una respuesta inmune que ayuda a eliminar las células cancerosas; Sin embargo, este proceso puede ir demasiado lejos y provocar la enfermedad de injerto contra huésped , el efecto secundario más grave de este tratamiento. [7]
Otra terapia con células madre, llamada Prococvhymal, fue aprobada condicionalmente en Canadá en 2012 para el tratamiento de la enfermedad aguda de injerto contra huésped en niños que no responden a los esteroides. [8] Es una terapia madre alogénica basada en células madre mesenquimales (MSC) derivadas de la médula ósea de donantes adultos. Las MSC se purifican de la médula, se cultivan y se envasan, con hasta 10.000 dosis derivadas de un único donante. Las dosis se almacenan congeladas hasta que se necesiten. [9]
La FDA ha aprobado cinco productos de células madre hematopoyéticas derivadas de la sangre del cordón umbilical para el tratamiento de enfermedades sanguíneas e inmunológicas. [10]
En 2014, la Agencia Europea de Medicamentos recomendó la aprobación de células madre del limbo para personas con deficiencia grave de células madre del limbo debido a quemaduras en los ojos. [11]
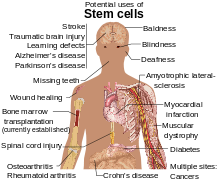
Las células madre se están estudiando por varias razones. También se están estudiando las moléculas y los exosomas liberados por las células madre en un esfuerzo por fabricar medicamentos. [12] Además de las funciones de las células mismas, se ha descubierto que los factores paracrinos solubles producidos por las células madre, conocidos como secretoma de células madre , son otro mecanismo por el cual las terapias basadas en células madre median sus efectos en enfermedades degenerativas , autoinmunes , y enfermedades inflamatorias . [13]
La mayoría de las células madre destinadas a la terapia regenerativa generalmente se aíslan de la médula ósea del paciente o del tejido adiposo . [14] [15] Las células madre mesenquimales pueden diferenciarse en las células que forman huesos, cartílagos, tendones y ligamentos, así como músculos, nervios y otros tejidos progenitores. Han sido el principal tipo de células madre estudiadas en el tratamiento de enfermedades que afectan a estos tejidos. [16] [17] La cantidad de células madre trasplantadas en tejido dañado puede alterar la eficacia del tratamiento. En consecuencia, las células madre derivadas de aspirados de médula ósea, por ejemplo, se cultivan en laboratorios especializados para expandirlas a millones de células. [14] [15] Aunque el tejido derivado de tejido adiposo también requiere procesamiento antes de su uso, la metodología de cultivo para células madre derivadas de tejido adiposo no es tan extensa como la de las células derivadas de médula ósea. [18] Si bien se cree que las células madre derivadas de la médula ósea son las preferidas para la reparación de huesos, cartílagos, ligamentos y tendones, otros creen que las técnicas de recolección menos desafiantes y el microambiente multicelular ya presentes en las células madre derivadas del tejido adiposo fracciones hacen de este último la fuente preferida para el trasplante autólogo. [19]
Se están investigando nuevas fuentes de células madre mesenquimales , incluidas las células madre presentes en la piel y la dermis, que son de interés por la facilidad con la que se pueden recolectar con un riesgo mínimo para el animal. [20] También se ha descubierto que las células madre hematopoyéticas viajan por el torrente sanguíneo y poseen la misma capacidad de diferenciación que otras células madre mesenquimales , nuevamente con una técnica de recolección muy no invasiva. [21]
Ha habido un interés más reciente en el uso de células madre mesenquimales extraembrionarias . Se están realizando investigaciones para examinar las capacidades diferenciadoras de las células madre que se encuentran en el cordón umbilical, el saco vitelino y la placenta de diferentes animales. Se cree que estas células madre tienen una mayor capacidad de diferenciación que sus homólogos adultos, incluida la capacidad de formar más fácilmente tejidos de origen endodérmico y ectodérmico. [22]
A partir de 2010, hubo una controversia generalizada sobre el uso de células madre embrionarias humanas . Esta controversia apunta principalmente a las técnicas utilizadas para derivar nuevas líneas de células madre embrionarias , lo que a menudo requiere la destrucción del blastocisto . La oposición al uso de células madre de embriones humanos en la investigación se basa a menudo en objeciones filosóficas, morales o religiosas. [23] Hay otras investigaciones con células madre que no implican la destrucción de un embrión humano, y dichas investigaciones involucran células madre adultas, células madre amnióticas y células madre pluripotentes inducidas.
En enero de 2009, la Administración de Alimentos y Medicamentos de Estados Unidos autorizó a Geron Corporation a realizar el primer ensayo clínico de una terapia basada en células madre embrionarias en humanos. El ensayo tenía como objetivo evaluar el fármaco GRNOPC1, células progenitoras de oligodendrocitos derivadas de células madre embrionarias , en personas con lesión aguda de la médula espinal . El ensayo se interrumpió en noviembre de 2011 para que la empresa pudiera centrarse en terapias en el "entorno actual de escasez de capital y condiciones económicas inciertas". [24] En 2013, la empresa de biotecnología y medicina regenerativa BioTime ( AMEX : BTX) adquirió los activos de células madre de Geron en una transacción de acciones, con el objetivo de reiniciar el ensayo clínico. [25]
Los científicos informaron en 2012 que las MSC, cuando se transfunden inmediatamente pocas horas después de la descongelación, pueden mostrar una función reducida o una menor eficacia en el tratamiento de enfermedades en comparación con aquellas MSC que se encuentran en la fase logarítmica de crecimiento celular (frescas), por lo que las MSC criopreservadas deben volver a llevarse a la fase logarítmica de crecimiento celular (frescas). Fase de crecimiento celular en cultivo in vitro antes de la administración. El nuevo cultivo de MSC ayudará a recuperarse del shock que sufren las células durante la congelación y descongelación. Varios ensayos clínicos de MSC que utilizaron productos criopreservados inmediatamente después de la descongelación han fracasado en comparación con los ensayos clínicos que utilizaron MSC frescas. [26]
La capacidad de desarrollar tejidos adultos funcionales de forma indefinida en cultivo mediante diferenciación dirigida crea nuevas oportunidades para la investigación de fármacos. Los investigadores pueden desarrollar líneas celulares diferenciadas y luego probar nuevos medicamentos en cada tipo de célula para examinar posibles interacciones in vitro antes de realizar estudios in vivo . Esto es fundamental en el desarrollo de fármacos para uso en investigación veterinaria debido a las posibilidades de interacciones específicas de cada especie. La esperanza es que tener estas líneas celulares disponibles para uso en investigación reduzca la necesidad de utilizar animales de investigación porque los efectos sobre el tejido humano in vitro proporcionarán información que normalmente no se conocía antes de la fase de pruebas con animales. [27]
Para su uso en aplicaciones de investigación o tratamiento, se necesitan grandes cantidades de células madre de alta calidad. Por lo tanto, es necesario desarrollar sistemas de cultivo que produzcan poblaciones puras de células madre específicas de tejido in vitro sin la pérdida del potencial de las células madre. Para ello se adoptan dos enfoques principales: cultivo celular bidimensional y tridimensional. [28]
El cultivo celular en dos dimensiones se ha realizado de forma rutinaria en miles de laboratorios de todo el mundo durante las últimas cuatro décadas. En plataformas bidimensionales, las células suelen estar expuestas a una superficie plana sólida y rígida en el lado basal y a líquido en la superficie apical. Habitar un sustrato rígido bidimensional requiere una adaptación dramática para las células supervivientes porque carecen de la matriz extracelular que es única para cada tipo de célula, lo que puede alterar el metabolismo celular y reducir su funcionalidad. [28]
Los sistemas de cultivo celular tridimensionales pueden crear un microambiente biomimético para las células madre, asemejándose a su matriz extracelular tridimensional (ECM) nativa. Los biomateriales avanzados han contribuido significativamente a los sistemas de cultivo celular tridimensionales en las últimas décadas, y se han propuesto biomateriales más únicos y complejos para mejorar la proliferación de células madre y la diferenciación controlada. Entre ellos, los biomateriales nanoestructurados son de particular interés porque tienen la ventaja de una alta relación superficie-volumen e imitan las características físicas y biológicas de la ECM natural a nanoescala. [28]
Se cree que las células madre median en la reparación a través de cinco mecanismos principales: 1) proporcionando un efecto antiinflamatorio, 2) dirigiéndose a los tejidos dañados y reclutando otras células, como las células progenitoras endoteliales , que son necesarias para el crecimiento del tejido, 3) apoyando la remodelación del tejido. sobre la formación de cicatrices, 4) inhibir la apoptosis y 5) diferenciarse en tejido óseo, cartilaginoso, tendinoso y ligamentario. [29] [30]
Para enriquecer aún más el suministro de sangre a las áreas dañadas y, en consecuencia, promover la regeneración de tejidos, se podría utilizar plasma rico en plaquetas junto con el trasplante de células madre. [19] [14] La eficacia de algunas poblaciones de células madre también puede verse afectada por el método de administración; por ejemplo, para regenerar el hueso, las células madre a menudo se introducen en un armazón donde producen los minerales necesarios para la generación de hueso funcional. [19] [14] [31] [15]
Se ha demostrado que las células madre tienen una inmunogenicidad baja debido al número relativamente bajo de moléculas de MHC que se encuentran en su superficie. Además, se ha descubierto que secretan quimiocinas que alteran la respuesta inmune y promueven la tolerancia del tejido nuevo. Esto permite realizar tratamientos alogénicos sin un alto riesgo de rechazo. [22]
Se han realizado investigaciones sobre los efectos de las células madre en modelos animales de degeneración cerebral , como en la enfermedad de Parkinson , la esclerosis lateral amiotrófica y la enfermedad de Alzheimer . [32] [33] [34] Se han realizado estudios preliminares relacionados con la esclerosis múltiple , [35] [36] [37] y un ensayo de fase 2 de 2020 encontró resultados significativamente mejores para los pacientes tratados con células madre mesenquimales en comparación con aquellos que recibieron una simulación tratamiento. [38] En enero de 2021, la FDA aprobó el primer ensayo clínico para una terapia con células madre en investigación para restaurar las células cerebrales perdidas en personas con enfermedad de Parkinson avanzada. [39]
Los cerebros adultos sanos contienen células madre neurales , que se dividen para mantener el número general de células madre o se convierten en células progenitoras . En animales de laboratorio adultos sanos, las células progenitoras migran dentro del cerebro y funcionan principalmente para mantener las poblaciones de neuronas para el olfato (el sentido del olfato). Se ha informado que la activación farmacológica de células madre neurales endógenas induce neuroprotección y recuperación del comportamiento en modelos de trastornos neurológicos en ratas adultas. [40] [41] [42]
El accidente cerebrovascular y la lesión cerebral traumática provocan la muerte celular , caracterizada por una pérdida de neuronas y oligodendrocitos dentro del cerebro. Se han realizado estudios clínicos y en animales sobre el uso experimental de células madre en casos de lesión de la médula espinal . [43] [44] [45] [37]
En 2017, un estudio a pequeña escala en personas de 60 años o más con envejecimiento frágil mostró, después del tratamiento intravenoso con células madre mesenquimales (MSC) de donantes jóvenes sanos, mejoras significativas en las medidas de rendimiento físico. MSC ayuda a bloquear la inflamación disminuyéndola, haciendo que los efectos de la fragilidad se reviertan. [46]
En 2012, se estudiaron células madre en personas con enfermedades cardíacas graves . [47] El trabajo de Bodo-Eckehard Strauer [48] fue desacreditado al identificar cientos de contradicciones fácticas. [49] Entre varios ensayos clínicos que informan que la terapia con células madre adultas es segura y efectiva, solo unos pocos estudios han reportado evidencia real de beneficio. [50] Algunos ensayos clínicos preliminares lograron solo mejoras modestas en la función cardíaca después del uso de la terapia con células madre de la médula ósea . [51] [52]
La terapia con células madre para el tratamiento del infarto de miocardio generalmente utiliza células madre autólogas de la médula ósea, pero se pueden usar otros tipos de células madre adultas, como las células madre derivadas del tejido adiposo. [53]
Los posibles mecanismos de recuperación incluyen: [32] Generación de células del músculo cardíaco, estimulación del crecimiento de nuevos vasos sanguíneos para repoblar el tejido cardíaco dañado y la secreción de factores de crecimiento .
La especificidad del repertorio de células inmunitarias humanas es lo que permite al cuerpo humano defenderse de los antígenos que se adaptan rápidamente. Sin embargo, el sistema inmunológico es vulnerable a la degradación durante la patogénesis de la enfermedad y, debido al papel crítico que desempeña en la defensa general, su degradación suele ser fatal para el organismo en su conjunto. Las enfermedades de las células hematopoyéticas se diagnostican y clasifican mediante una subespecialidad de patología conocida como hematopatología . La especificidad de las células inmunitarias es lo que permite el reconocimiento de antígenos extraños, lo que provoca mayores desafíos en el tratamiento de enfermedades inmunitarias. Se deben establecer coincidencias idénticas entre donante y receptor para que los tratamientos de trasplante tengan éxito, pero las coincidencias son poco comunes, incluso entre parientes de primer grado. La investigación que utiliza células madre adultas hematopoyéticas y células madre embrionarias ha proporcionado información sobre los posibles mecanismos y métodos de tratamiento para muchas de estas dolencias. [54]
Los glóbulos rojos humanos completamente maduros pueden generarse ex vivo mediante células madre hematopoyéticas (HSC), que son precursoras de los glóbulos rojos. En este proceso, las HSC crecen junto con las células del estroma , creando un entorno que imita las condiciones de la médula ósea, el sitio natural de crecimiento de los glóbulos rojos. Se añade eritropoyetina , un factor de crecimiento , que induce a las células madre a completar la diferenciación terminal en glóbulos rojos. [55] Investigaciones adicionales sobre esta técnica deberían tener beneficios potenciales para la terapia génica, la transfusión de sangre y la medicina tópica.
En 2004, los científicos del King's College de Londres descubrieron una forma de cultivar un diente completo en ratones [56] y pudieron cultivar dientes de bioingeniería de forma independiente en el laboratorio. Los investigadores confían en que la tecnología de regeneración dental se puede utilizar para hacer crecer dientes vivos en las personas.
En teoría, las células madre extraídas del paciente podrían convertirse en el laboratorio en un brote de diente que, cuando se implanta en las encías, dará lugar a un nuevo diente y se espera que crezca en un tiempo de más de tres semanas. [57] Se fusionará con la mandíbula y liberará sustancias químicas que estimulan a los nervios y vasos sanguíneos a conectarse con ella. El proceso es similar a lo que sucede cuando a los humanos les crecen los dientes permanentes originales. Sin embargo, quedan muchos desafíos por delante antes de que las células madre puedan ser una opción para reemplazar los dientes perdidos en el futuro. [58] [59]
Heller ha informado de éxito en el crecimiento de células ciliadas de la cóclea con el uso de células madre embrionarias . [60]
En una revisión de 2019 que analizó la regeneración auditiva y la medicina regenerativa, los progenitores óticos derivados de células madre tienen el potencial de mejorar enormemente la audición. [61]
Desde 2003, los investigadores han trasplantado con éxito células madre corneales en ojos dañados para restaurar la visión. "Las láminas de células de la retina utilizadas por el equipo se obtienen de fetos abortados, lo que algunas personas consideran objetable". Cuando estas láminas se trasplantan sobre la córnea dañada , las células madre estimulan una reparación renovada y, finalmente, restauran la visión. [62] El último acontecimiento de este tipo se produjo en junio de 2005, cuando investigadores del Hospital Queen Victoria de Sussex , Inglaterra, pudieron restaurar la vista de cuarenta personas utilizando la misma técnica. El grupo, liderado por Sheraz Daya , pudo utilizar con éxito células madre adultas obtenidas del paciente, de un familiar o incluso de un cadáver . Están en curso más rondas de juicios. [63]
Las personas con diabetes tipo 1 pierden la función de las células beta productoras de insulina dentro del páncreas. En una publicación de experimentos de 2007, los científicos lograron convencer a las células madre embrionarias para que se convirtieran en células beta en el laboratorio. En teoría, si las células beta se trasplantan con éxito, podrán reemplazar las que funcionan mal en un paciente diabético. [64] Sin embargo, existen efectos adversos de las altas concentraciones de glucosa en la terapia con células madre. [sesenta y cinco]

A partir de 2017, el uso de células madre mesenquimales (MSC) derivadas de células madre adultas estaba bajo investigación preliminar para posibles aplicaciones ortopédicas en traumatismos óseos y musculares, reparación de cartílago , osteoartritis , cirugía de disco intervertebral , cirugía del manguito rotador y trastornos musculoesqueléticos , entre otros. . [66] Otras áreas de investigación ortopédica para usos de MSC incluyen la ingeniería de tejidos y la medicina regenerativa . [66]
Las células madre también se pueden utilizar para estimular el crecimiento de tejidos humanos. En un adulto, el tejido herido suele ser reemplazado por tejido cicatricial , que se caracteriza en la piel por una estructura de colágeno desorganizada, pérdida de folículos pilosos y una estructura vascular irregular. Sin embargo, en el caso del tejido fetal herido, el tejido herido se reemplaza por tejido normal mediante la actividad de las células madre. [67] Un posible método para la regeneración de tejidos en adultos es colocar "semillas" de células madre adultas dentro de una "tierra" de lecho de tejido en el lecho de una herida y permitir que las células madre estimulen la diferenciación en las células del lecho de tejido. Este método provoca una respuesta regenerativa más similar a la curación de heridas fetales que a la formación de tejido cicatricial en adultos. [67] En 2018, los investigadores todavía estaban investigando diferentes aspectos del tejido del "suelo" que favorecen la regeneración. [67] Debido a las capacidades curativas generales de las células madre, han ganado interés para el tratamiento de heridas cutáneas, como el cáncer de piel . [68]
En 2013, los científicos han estado investigando un enfoque alternativo para el tratamiento del VIH-1/SIDA, basado en la creación de un sistema inmunológico resistente a las enfermedades mediante el trasplante de células madre y progenitoras hematopoyéticas autólogas, genéticamente modificadas (resistentes al VIH-1) ( GM-HSPC). [69]
En 2013, se descubrió que los estudios de células madre autólogas de la médula ósea sobre la función ventricular contenían "cientos" de discrepancias. [70] Los críticos informan que de 48 informes, solo parecían usarse cinco ensayos subyacentes, y que en muchos casos, ya sea que fueran aleatorios o simplemente observacionales de aceptación versus rechazo, era contradictorio entre los informes del mismo ensayo. Un par de informes con características iniciales y resultados finales idénticos se presentaron en dos publicaciones como, respectivamente, un ensayo aleatorizado de 578 pacientes y un estudio observacional de 391 sujetos. Otros informes requerían (imposibles) desviaciones estándar negativas en subconjuntos de personas o contenían sujetos fraccionarios, clases negativas de la NYHA. En general, se informó que muchas más personas recibieron células madre en los ensayos que la cantidad de células madre procesadas en el laboratorio del hospital durante ese tiempo. Una investigación universitaria, cerrada en 2012 sin informar, fue reabierta en julio de 2013. [71]
En 2014, un metanálisis sobre la terapia con células madre utilizando células madre de la médula ósea para enfermedades cardíacas reveló discrepancias en los informes de ensayos clínicos publicados, donde los estudios con un mayor número de discrepancias mostraron un aumento en los tamaños del efecto. [72] Otro metanálisis basado en los datos intrasujetos de 12 ensayos aleatorios no pudo encontrar ningún beneficio significativo de la terapia con células madre en los criterios de valoración primarios, como eventos adversos importantes o aumento en las medidas de la función cardíaca, y concluyó que no hubo beneficio. . [73]
Los resultados de 2018 del ensayo TIME, que utilizó un diseño de ensayo aleatorizado, doble ciego y controlado con placebo, concluyeron que "la administración de células mononucleares de médula ósea no mejoró la recuperación de la función del VI durante 2 años" en personas que sufrieron un infarto de miocardio. [74] En consecuencia, el ensayo BOOST-2 realizado en 10 centros médicos en Alemania y Noruega informó que el resultado del ensayo "no respalda el uso de BMC nucleados en pacientes con STEMI y FEVI moderadamente reducida". [75] Además, el ensayo tampoco cumplió con ningún otro criterio de valoración secundario de la resonancia magnética, [76] lo que llevó a la conclusión de que la terapia con células madre intracoronarias de la médula ósea no ofrece un beneficio funcional o clínico. [77]
En 2021, las inyecciones de células madre en EE. UU. provocaron infecciones graves en al menos 20 pacientes que recibieron productos derivados de la sangre del cordón umbilical comercializados como "tratamiento con células madre". [78] En 2023, se publicó el caso de una mujer que se infectó con Mycobacterium abscessus y sufrió meningitis después de un tratamiento con células madre para la esclerosis múltiple en una clínica comercial en Baja California, México. [79]
Las investigaciones realizadas en caballos, perros y gatos han llevado al desarrollo de tratamientos con células madre en medicina veterinaria que pueden abordar una amplia gama de lesiones y enfermedades, como infarto de miocardio , accidente cerebrovascular, daño de tendones y ligamentos , osteoartritis , osteocondrosis y distrofia muscular. , tanto en animales grandes como en humanos. [80] [81] [82] [83] Si bien la investigación de terapias basadas en células generalmente refleja las necesidades médicas humanas, el alto grado de frecuencia y gravedad de ciertas lesiones en los caballos de carreras ha puesto a la medicina veterinaria a la vanguardia de este novedoso enfoque regenerativo. [84] Los animales de compañía pueden servir como modelos clínicamente relevantes que imitan estrechamente las enfermedades humanas. [85] [86]
Las aplicaciones veterinarias de la terapia con células madre como medio de regeneración de tejidos han estado determinadas en gran medida por la investigación que comenzó con el uso de células madre mesenquimales derivadas de adultos para tratar animales con lesiones o defectos que afectaban a huesos, cartílagos, ligamentos y/o tendones. [87] [16] [88] Hay dos categorías principales de células madre utilizadas para tratamientos: células madre alogénicas derivadas de un donante genéticamente diferente dentro de la misma especie, [15] [89] y células madre mesenquimales autólogas , derivadas de la paciente antes de su uso en diversos tratamientos. [19] Una tercera categoría, las células madre xenógenas , o células madre derivadas de diferentes especies, se utilizan principalmente con fines de investigación, especialmente para tratamientos en humanos. [27]
El hueso tiene un proceso de curación natural único y bien documentado que normalmente es suficiente para reparar fracturas y otras lesiones comunes. Las roturas desalineadas debido a traumatismos graves, así como tratamientos como las resecciones de tumores de cáncer de hueso, son propensos a una curación inadecuada si se dejan únicamente al proceso natural. Se siembran estructuras compuestas de componentes naturales y artificiales con células madre mesenquimales y se colocan en el defecto. A las cuatro semanas de colocar el andamio, el hueso recién formado comienza a integrarse con el hueso viejo y a las 32 semanas se logra la unión completa. [90] Se necesitan más estudios para caracterizar completamente el uso de terapias basadas en células para el tratamiento de fracturas óseas.
Las células madre se han utilizado para tratar enfermedades óseas degenerativas en perros. El tratamiento normalmente recomendado para perros que padecen la enfermedad de Legg-Calvé-Perthes es extirpar la cabeza del fémur una vez que la degeneración ha progresado. Recientemente, se han inyectado células madre mesenquimales directamente en la cabeza del fémur, con éxito no sólo en la regeneración ósea, sino también en la reducción del dolor. [90]
Los tratamientos autólogos basados en células madre para lesiones de ligamentos , lesiones de tendones , osteoartritis , osteocondrosis y quistes óseos subcondrales han estado disponibles comercialmente para los veterinarios en ejercicio para tratar caballos desde 2003 en los Estados Unidos y desde 2006 en el Reino Unido. Los tratamientos basados en células madre autólogas para lesiones de tendones, lesiones de ligamentos y osteoartritis en perros han estado disponibles para los veterinarios en los Estados Unidos desde 2005. Más de 3000 caballos y perros de propiedad privada han sido tratados con células madre autólogas derivadas de tejido adiposo. La eficacia de estos tratamientos se ha demostrado en ensayos clínicos doble ciego en perros con osteoartritis de cadera y codo y caballos con daño en los tendones. [91] [92]
Los caballos de carreras son especialmente propensos a sufrir lesiones de tendones y ligamentos. Las terapias convencionales no logran que el caballo recupere su pleno potencial de funcionamiento. La curación natural, guiada por los tratamientos convencionales, conduce a la formación de tejido cicatricial fibroso que reduce la flexibilidad y el movimiento completo de las articulaciones. Los tratamientos tradicionales impidieron que un gran número de caballos volvieran a su plena actividad y también tienen una alta incidencia de nuevas lesiones debido a la naturaleza rígida del tendón cicatrizado. La introducción de células madre derivadas de la médula ósea y del tejido adiposo, junto con un estímulo mecánico natural, promovió la regeneración del tejido tendinoso. El movimiento natural promovió la alineación de las nuevas fibras y tendocitos con la alineación natural que se encuentra en los tendones ilesos. El tratamiento con células madre no sólo permitió que más caballos volvieran a trabajar plenamente y también redujo en gran medida la tasa de nuevas lesiones durante un período de tres años. [22]
El uso de células madre embrionarias también se ha aplicado a la reparación de tendones. Se demostró que las células madre embrionarias tienen una mejor tasa de supervivencia en el tendón, así como mejores capacidades de migración para llegar a todas las áreas del tendón dañado. La calidad general de la reparación también fue mayor, con una mejor arquitectura del tendón y mejor formación de colágeno. Tampoco se observó formación de tumores durante el período experimental de tres meses. Es necesario realizar estudios a largo plazo para examinar la eficacia a largo plazo y los riesgos asociados con el uso de células madre embrionarias. [22] Se han encontrado resultados similares en animales pequeños. [22]
La osteoartritis es la principal causa de dolor articular tanto en animales como en humanos. Los caballos y los perros son los más afectados por la artritis. La regeneración natural del cartílago es muy limitada. Todavía se están investigando diferentes tipos de células madre mesenquimales y otros aditivos para encontrar el mejor tipo de célula y método para el tratamiento a largo plazo. [22]
Las células mesenquimales derivadas del tejido adiposo son actualmente las más utilizadas para el tratamiento con células madre de la osteoartritis debido a su recolección no invasiva. Esta es una técnica no invasiva desarrollada recientemente para un uso clínico más sencillo. Los perros que recibieron este tratamiento mostraron mayor flexibilidad en sus articulaciones y menos dolor. [93]
Las células madre se han utilizado con éxito para mejorar la curación del corazón después de un infarto de miocardio en perros. Se extrajeron células madre derivadas del tejido adiposo y de la médula ósea y se las indujo a un destino de célula cardíaca antes de inyectarlas en el corazón. Se descubrió que el corazón tenía una mejor contractilidad y una reducción en el área dañada cuatro semanas después de que se aplicaron las células madre. [94]
En 2007 se estaba probando un parche elaborado con una sustancia porosa en la que se "sembran" células madre para inducir la regeneración de los tejidos en los defectos cardíacos. Se regeneró el tejido y el parche quedó bien incorporado al tejido del corazón. Se cree que esto se debe, en parte, a una mejor angiogénesis y a una reducción de la inflamación. Aunque los cardiomiocitos se produjeron a partir de células madre mesenquimales , no parecían ser contráctiles. Otros tratamientos que indujeron un destino cardíaco en las células antes del trasplante tuvieron mayor éxito en la creación de tejido cardíaco contráctil. [95]
La investigación de 2018, como el proyecto de investigación europeo nTRACK, tiene como objetivo demostrar que las nanopartículas multimodales pueden rastrear estructural y funcionalmente las células madre en la terapia de regeneración muscular. La idea es etiquetar células madre con nanopartículas de oro que estén completamente caracterizadas por su absorción, funcionalidad y seguridad. Las células madre marcadas se inyectarán en un músculo lesionado y se rastrearán mediante sistemas de imágenes. [96] Sin embargo, el sistema aún necesita ser demostrado a escala de laboratorio.
Spinal cord injuries are one of the most common traumas brought into veterinary hospitals.[90] Spinal injuries occur in two ways after the trauma: the primary mechanical damage, and in secondary processes, like inflammation and scar formation, in the days following the trauma. These cells involved in the secondary damage response secrete factors that promote scar formation and inhibit cellular regeneration. Mesenchymal stem cells that are induced to a neural cell fate are loaded onto a porous scaffold and are then implanted at the site of injury. The cells and scaffold secrete factors that counteract those secreted by scar forming cells and promote neural regeneration. Eight weeks later, dogs treated with stem cells showed immense improvement over those treated with conventional therapies. Dogs treated with stem cells were able to occasionally support their own weight, which has not been seen in dogs undergoing conventional therapies.[97][98][99]
In a study to evaluate the treatment of experimentally induced MS in dogs using laser activated non-expanded adipose derived stem cells. The results showed amelioration of the clinical signs over time confirmed by the resolution of the previous lesions on MRI. Positive migration of the injected cells to the site of lesion, increased remyelination detected by Myelin Basic Proteins, positive differentiation into Olig2 positive oligodendrocytes, prevented the glial scar formation and restored axonal architecture.[37]
Treatments are also in clinical trials to repair and regenerate peripheral nerves. Peripheral nerves are more likely to be damaged, but the effects of the damage are not as widespread as seen in injuries to the spinal cord. Treatments are currently in clinical trials to repair severed nerves, with early success. Stem cells induced to a neural fate injected in to a severed nerve. Within four weeks, regeneration of previously damaged stem cells and completely formed nerve bundles were observed.[20]
Stem cells are also in clinical phases for treatment in ophthalmology. Hematopoietic stem cells have been used to treat corneal ulcers of different origin of several horses. These ulcers were resistant to conventional treatments available, but quickly responded positively to the stem cell treatment. Stem cells were also able to restore sight in one eye of a horse with retinal detachment, allowing the horse to return to daily activities.[21]
Se están explorando las células madre para su uso en esfuerzos de conservación. Se recolectaron células madre espermatogoniales de una rata y se colocaron en un ratón huésped y se produjeron espermatozoides completamente maduros con la capacidad de producir descendencia viable. Actualmente se están realizando investigaciones para encontrar huéspedes adecuados para la introducción de células madre espermatogoniales de donantes. Si esto se convierte en una opción viable para los conservacionistas, se puede producir esperma a partir de individuos de alta calidad genética que mueren antes de alcanzar la madurez sexual, preservando una línea que de otro modo se perdería. [100]
A finales de la década de 1990 y principios de la de 2000, hubo una ola inicial de empresas y clínicas que ofrecían terapia con células madre, sin fundamentar las declaraciones de propiedades saludables ni contar con la aprobación regulatoria. [101] Para 2012, había surgido una segunda ola de empresas y clínicas, generalmente ubicadas en países en desarrollo donde la medicina está menos regulada y que ofrecen terapias con células madre en un modelo de turismo médico . [102] [103] Al igual que las empresas y clínicas de la primera ola, hicieron afirmaciones similares, sólidas, pero sin fundamento, principalmente por parte de clínicas en los Estados Unidos, México, Tailandia, India y Sudáfrica . [102] [103] Para 2016, la investigación indicó que había más de 550 clínicas de células madre solo en los EE. UU. que vendían terapias generalmente no probadas para una amplia gama de afecciones médicas en casi todos los estados del país, [104] alterando la dinámica de Turismo de células madre . En 2018, la FDA envió una carta de advertencia a StemGenex Biologic Laboratories en San Diego, que comercializaba un servicio en el que tomaba grasa corporal de personas, la procesaba en mezclas que, según decía, contenían varias formas de células madre y se las administraba a la persona. por inhalación, por vía intravenosa o por infusión en la médula espinal; La compañía dijo que el tratamiento era útil para muchas afecciones crónicas y potencialmente mortales. [105]
Los costos de las terapias con células madre varían ampliamente según la clínica, la afección y el tipo de célula, pero por lo general oscilan entre $ 10 000 y $ 20 000. [106] El seguro no cubre las inyecciones de células madre en las clínicas, por lo que los pacientes suelen utilizar la recaudación de fondos en línea. [107] En 2018, la Comisión Federal de Comercio de EE. UU . encontró que centros de salud y un médico individual hacían afirmaciones sin fundamento sobre terapias con células madre y forzaron reembolsos de unos 500.000 dólares. [108] La FDA presentó una demanda contra dos empresas de clínicas de células madre casi al mismo tiempo, buscando medidas cautelares permanentes contra su comercialización y uso de productos de células madre adiposas no aprobados. [109]
Aunque según los NIH no se han aprobado tratamientos con células madre para COVID-19 , y la agencia desaconseja el uso de MSC para la enfermedad, [110] algunas clínicas de células madre comenzaron a comercializar células madre no probadas y no aprobadas por la FDA y exosomas para COVID-19 en 2020. [111] La FDA tomó medidas inmediatas enviando cartas a las empresas en cuestión. [112] [113] La FTC también advirtió a una empresa de células madre por marketing engañoso relacionado con COVID-19. [114] [115]
{{cite book}}: |journal=ignorado ( ayuda ) ; Falta o está vacío |title=( ayuda )