La isquemia renal [1] es una enfermedad con una alta tasa de morbilidad y mortalidad. [2] Los vasos sanguíneos se encogen y sufren apoptosis , lo que da como resultado un flujo sanguíneo deficiente en los riñones. Se producen más complicaciones cuando la falla de las funciones renales da como resultado toxicidad en varias partes del cuerpo que puede causar choque séptico , hipovolemia y necesidad de cirugía. [3] No se sabe por completo qué causa la isquemia renal, pero se han dilucidado varias fisiopatologías relacionadas con esta enfermedad. Las posibles causas de la isquemia renal incluyen la activación de IL-17C y la hipoxia debido a la cirugía o el trasplante. Varios signos y síntomas incluyen lesión del endotelio microvascular, apoptosis de las células renales debido al estrés excesivo en el retículo endoplásmico, disfunciones de las mitocondrias , autofagia , inflamación de los riñones y reparación desadaptativa. [ cita requerida ]
La isquemia renal se puede diagnosticar comprobando los niveles de varios biomarcadores como la clusterina y la cistatina C. Si bien la duración de la isquemia se utilizó como biomarcador , se descubrió que tiene fallas significativas en la predicción de los resultados de la función renal. Hay más tratamientos emergentes en los ensayos clínicos, como Bendavia , para abordar la disfunción mitocondrial y el uso de la terapia con células madre mesenquimales . Varios agonistas y antagonistas de receptores han demostrado ser prometedores en estudios con animales; sin embargo, aún no se han probado clínicamente. [ cita requerida ]
Se sabe poco sobre las causas de la lesión isquémica en los riñones; sin embargo, se afirma que varias agresiones físicas se activan durante la lesión. El estrés físico, como el infarto, la cirugía y el trasplante, pueden producir isquemia renal. Los hábitos alimentarios y la genética también pueden causar lesión isquémica. Enfermedades como la sepsis también pueden causar isquemia renal. [4]
El infarto se define como el bloqueo del flujo sanguíneo en los tejidos u órganos, que puede causar necrosis o muerte de un grupo de células en el tejido. [5] En estudios con modelos de ratones, el pinzamiento del riñón puede provocar isquemia renal. [6]
La cirugía renal y el bypass de la arteria coronaria pueden producir isquemia renal y lesión por reperfusión, lo que podría derivar en una lesión renal aguda . Además, la isquemia renal puede provocar un retraso en la función del injerto después del trasplante renal y puede provocar el rechazo del trasplante. [7]
En estudios realizados con modelos de ratones, una dieta rica en grasas puede inducir una mayor lesión renal con isquemia-reperfusión renal en comparación con ratones con una dieta normal. [8] Esto se debe a que en un modelo de dieta rica en grasas, la acumulación de fosfolípidos dio lugar a un agrandamiento de los lisosomas en las células del túbulo proximal. [8] Esta acumulación de fosfolípidos conduce a un aumento de la agregación de ubiquitina en las células renales. Cuando esto sucede, la autofagia se vuelve exagerada y da lugar a un mal funcionamiento de las mitocondrias y a una inflamación del tejido. [8]
Una causa común de enfermedad renal isquémica es la aterosclerosis . [9] La aterosclerosis es un tipo específico de arteriosclerosis. La arteriosclerosis se define como el engrosamiento o endurecimiento o ambos de los vasos sanguíneos ; más específicamente, la aterosclerosis se refiere a la acumulación de colesterol y grasas en las paredes de las arterias. [10] Debido a que los vasos sanguíneos transportan oxígeno y nutrientes por todo el cuerpo, tener aterosclerosis restringe el flujo sanguíneo y, en consecuencia, impide que los nutrientes necesarios lleguen a los riñones. [10] Esto representa el 60-97% de las lesiones arteriales renales, lo que podría conducir a la oclusión de la arteria renal y atrofia isquémica de los riñones. [9]
En modelos de ratones y ensayos in vitro se han implicado varias vías genéticas que conducen a la apoptosis de las células renales. Se trata de genes proapoptóticos que pueden clasificarse en dos: vías extrínsecas e intrínsecas. Las vías extrínsecas se inducen directamente tras la lesión isquémica renal, mientras que las vías intrínsecas dependen de las vías de señalización mitocondrial. [11] Además, se han implicado varios genes como factores de riesgo en el desarrollo de la lesión isquémica. [12]
La activación de la pro-caspasa 8 inicia la apoptosis a través de la señalización de los receptores de muerte de la superficie celular, como las proteínas Fas y sus ligandos FADD y DAXX . [11] Esta serie de cascada de señalización generalmente regula la muerte celular programada o apoptosis . La regulación positiva de la proteína Fas y FADD se ha producido en modelos de ratones después de un período de 24 horas de lesión isquémica. [11] Esto también se muestra en ensayos basados en células en los que se monitorean las células tubulares después de una lesión similar a la isquémica. Esto muestra que la vía Fas puede desempeñar un papel en la patogénesis de la apoptosis de las células tubulares durante el período temprano de isquemia-reperfusión. El papel de DAXX aún no está claro; sin embargo, DAXX media tanto la apoptosis dependiente de Fas como la inducida por TGF-beta y la inducción renal de TGF-beta está bien documentada en estudios de isquemia renal. [11]
La activación de la procaspasa 9 depende de las vías de señalización mitocondrial , que están reguladas por la familia de proteínas Bcl-2 . La activación de las proteínas Bcl-2, como Bax y Bak, desencadena una cascada de señalización que da lugar a la liberación de citocromo c en el citosol. Esto, a su vez, activa la procaspasa 9 y da lugar a la apoptosis de las células. [11]
Se ha demostrado que los polimorfismos en los genes aumentan o disminuyen el riesgo de lesión isquémica renal. Se ha demostrado que genes como la apolipoproteína E (APO E) , que controla el metabolismo del colesterol, la NADPH oxidasa, que regula el estrés oxidativo, la enzima convertidora de angiotensina ( ECA ) para la regulación vasomotora, la HSP72 , que ayuda a la tolerancia a la lesión isquémica, las citocinas interleucinas , que son un modulador de la inflamación, y el VEGF , que regula la angiogénesis o la formación de vasos sanguíneos, tienen efectos significativos en la lesión renal aguda. [12]
Las apolipoproteínas E son proteínas que metabolizan las grasas en el cuerpo. En estudios de pacientes sometidos a injerto de derivación de la arteria coronaria , se descubrió que los portadores del alelo e4 de APO-E tenían un menor riesgo de lesión renal aguda en comparación con los no portadores del alelo. [12]
La NADPH oxidasa regula el estrés oxidativo al conjugarse con especies reactivas de oxígeno en las células. Se ha demostrado que los polimorfismos en la NADPH oxidasa p22phox y con el alelo T tienen un mayor riesgo de diálisis y mortalidad. [12]
La enzima convertidora de angiotensina regula el movimiento vasomotor al controlar la presión sanguínea que pasa por los riñones. De manera similar al polimorfismo APO-E, los pacientes con el alelo D de la ECA también tienen un mayor riesgo de lesión renal aguda después de un injerto de derivación de la arteria coronaria. [12]
En estudios con bebés, se ha demostrado que el gen HSP72 con el alelo G conlleva un mayor riesgo de lesión renal aguda. [12]
Los investigadores han descubierto que la IL-17C se activa en caso de lesión renal. En estudios realizados en ratones con hipoxia inducida, se observó una regulación positiva de la síntesis de IL-17C tras la pérdida de oxígeno en el riñón. Además, las variantes Knockout de IL-17C redujeron la inflamación causada por la activación de IL-17C. El uso de anticuerpos y ARNi contra IL-17C también proporcionó los mismos resultados. [13] Además, los estudios de IL-60174GG mostraron que los portadores de este polimorfismo tienen niveles más altos de creatinina en la sangre; sin embargo, los portadores del alelo G de IL-10 tienen un menor riesgo de muerte después de una falla orgánica. [12]
A diferencia del polimorfismo HSP72, los estudios en bebés muestran que el VEGF con un alelo A homocigoto resultó en un riesgo reducido de lesión renal aguda. [12]

A continuación se enumeran varias condiciones fisiopatológicas que cambian cuando el riñón sufre lesiones isquémicas. Esto incluye cambios en la vasculatura , estrés del retículo endoplasmático , disfunción de las mitocondrias , autofagia de las células, inflamación y reparación incorrecta o maladaptativa. [ cita requerida ]
Las funciones normales del riñón requieren una gran cantidad de oxígeno, por lo que el suministro de oxígeno al riñón está bien regulado. La producción de trifosfato de adenosina y óxido nítrico requiere una alta concentración de oxígeno. Estos compuestos, así como algunas especies reactivas de oxígeno, son necesarios para que el riñón funcione correctamente. Con una lesión, la respiración celular se ve comprometida. Esto conduce a un desequilibrio del suministro de oxígeno y de los productos de la respiración celular . Cuando eso sucede, el riñón sufre estrés oxidativo y la lesión del endotelio microvascular promueve el reclutamiento de leucocitos y plaquetas . Esto conduce a cambios en la perfusión y el suministro de oxígeno. [14]
Las proteínas mal plegadas y desplegadas se acumulan en el retículo endoplásmico, lo que desencadena la respuesta de las proteínas desplegadas (UPR, por sus siglas en inglés). La respuesta de las proteínas desplegadas es un mecanismo adaptativo para restablecer la homeostasis celular y tisular. Si el estrés es demasiado severo, se activa la respuesta desadaptativa y se induce la vía de la proteína homóloga C/EBP (CHOP, por sus siglas en inglés). Esto conduce a la apoptosis. [14]
En la isquemia renal aguda, los túbulos proximales son vulnerables a la disfunción mitocondrial porque dependen del metabolismo aeróbico y están en un estado más oxidado en comparación con los túbulos distales . [14] Cuando se produce una disfunción mitocondrial, se altera la respiración celular. Esto hace que las mitocondrias liberen proteínas proapoptóticas como el citocromo c y terminan en la muerte de las células renales. [ cita requerida ]
Durante el estrés isquémico, se activa la comunicación cruzada entre las mitocondrias y la UPR . Esto da lugar a la autofagia, mediante la cual las proteínas, los orgánulos y los componentes citoplasmáticos son reciclados y degradados por los lisosomas. El proceso de autofagia ayuda a eliminar componentes innecesarios de las células para mantener funciones más importantes. En este caso, la autofagia se induce en los riñones en respuesta a la hipoxia para protegerlos contra una mayor lesión renal. [14]
El proceso inflamatorio renal implica eventos que conducen a la lesión o muerte de las células renales. [15] Cuando los riñones experimentan respuestas inflamatorias, producen mediadores como la bradicinina , la histamina y citocinas proinflamatorias como la interleucina-1 y el factor de necrosis tumoral-a . En modelos de ratones, se observaron estudios en los que se eliminaron estos mediadores del plasma y se demostró que eran beneficiosos para los ratones. [15]
Cuando una lesión es grave, las respuestas adaptativas que se activan para restablecer la homeostasis normal de las células y los tejidos se vuelven inadaptadas, lo que conduce a un mal funcionamiento de las células y los tejidos, lo que podría conducir a la progresión de la enfermedad renal crónica. [14]

Las características renales pueden ser clínicamente sugestivas de isquemia renal. Dado que la insuficiencia renal puede correlacionarse con la hipertensión, se han observado ambas situaciones. [16] En general, los tamaños de los riñones difieren en pacientes con isquemia renal aguda. La hipertensión, la insuficiencia renal aguda, la azoemia progresiva y el edema pulmonar agudo también son signos de una lesión isquémica en desarrollo en pacientes hipertensos. [ cita requerida ]
En pacientes normales, la longitud de los dos riñones difiere solo en menos de 1,5 cm; sin embargo, los pacientes hipertensos tienden a tener un tamaño de riñón asimétrico, lo que sugiere fuertemente una enfermedad renal isquémica. [16]
La hipertensión renovascular o estenosis de la arteria renal se caracteriza por un aumento de la presión sanguínea a través de las arterias hacia los riñones. [17] Esto se debe a un estrechamiento anormal de las arterias. [17]
En pacientes con hipertensión , el tratamiento de la enfermedad con inhibidores de la enzima convertidora de angiotensina (IECA) a veces es necesario. [16] La tasa de filtración glomerular (TFG) en pacientes está regulada por la vasoconstricción de la arteriola eferente. [16] Cuando el paciente toma IECA, este efecto vasoconstrictor de la arteriola eferente se bloquea. Esto luego conduce a una disminución de la TFG y conduce a una insuficiencia renal aguda. Los estudios han demostrado que entre el 6 y el 38 % de los pacientes con enfermedad vascular renal o hipertensión desarrollarán isquemia renal aguda a través de insuficiencia renal aguda. [16]
La azoemia se caracteriza por un aumento de la creatinina y del nitrógeno ureico en sangre (BUN) en el plasma. Los pacientes con hipertensión renovascular a menudo sufren un deterioro de la función renal. [16]
De la misma manera, los pacientes que reciben tratamiento con un fármaco antihipertensivo para hipertensión renovascular, refractaria o grave presentan azotemia progresiva. [16] La toma de IECA puede provocar isquemia renal aguda debido a la alteración de la hemodinámica intrarrenal. [16]
El edema pulmonar agudo se caracteriza por la acumulación de líquido en los alvéolos pulmonares, lo que dificulta la respiración de los pacientes. [18] Los pacientes con hipertensión mal controlada e insuficiencia renal suelen presentar también edema pulmonar agudo recurrente. [16] Aunque los pacientes pueden tener otros factores de riesgo de padecer edema pulmonar, la hipertensión renovascular dependiente del volumen parece ser el factor dominante. [16]
La detección de biomarcadores es una forma de diagnosticar si un paciente está funcionando normalmente.

La ecografía Doppler dúplex (EDD) es una prueba de imagen que permite evaluar el flujo sanguíneo en el riñón o el sistema renal. La ecografía en modo B se combina con la ecografía Doppler para localizar y evaluar la arteria renal y la velocidad de la sangre que fluye a través de ella. Esta prueba es útil incluso en presencia de azotemia y en pacientes con hipertensión, ya que no es necesario suspender la administración de IECA. Al evaluar la velocidad del flujo sanguíneo, los médicos pueden medir si el riñón está recibiendo suficiente sangre y nutrientes para funcionar normalmente. [16]
Al igual que la DDS, la angiografía por resonancia magnética (ARM) también toma imágenes de los vasos sanguíneos. La ARM utiliza resonancia magnética y, a diferencia de una angiografía tradicional, no requiere la inserción de un catéter. [24] Esta prueba se puede utilizar para evaluar la estenosis y las oclusiones en el riñón. Esta prueba también se puede utilizar para determinar aneurismas en el cerebro. Otros usos clínicos de la ARM se utilizan para examinar los vasos sanguíneos en diferentes partes del cuerpo, como el tórax, las extremidades inferiores y el corazón. [25]
La actividad de la renina plasmática también se conoce como ensayo de renina. Este ensayo mide la actividad de la renina , también conocida como angiotensinogenasa , que desempeña un papel en la regulación de la presión arterial y la producción de orina. [26] Esta se considera una prueba no invasiva y los pacientes que toman IECA deben optar por realizarla. Esto se debe a que es útil para detectar la hipertensión renovascular, uno de los síntomas de la isquemia renal, con una sensibilidad que llega al 90%. [16] Sin embargo, la insuficiencia renal puede disminuir la precisión de esta prueba. [16]
La renografía utiliza radioisótopos para diagnosticar la enfermedad renovascular. Esta prueba compara la función normal del riñón con la del riñón estenótico midiendo la cantidad de radionucleótidos que llegan al riñón y que son excretados por él. [16] En la renografía se utilizan dos radionúclidos : Tc99m- MAG3 (mercaptoacetiltriglicina) y TC99m-DTPA (dietilentriaminopentacetato). [27] En esta prueba, los radionucleótidos se inyectan por vía intravenosa en el sistema. Luego, el compuesto avanza a través del sistema renal y se rastrea con una cámara gamma . [28] Luego, la cámara toma imágenes a intervalos y se toma una medición de la radiactividad. Al realizar esta exploración, los médicos pueden diferenciar entre la isquemia renal y la enfermedad renal intrínseca al verificar la cantidad de tiempo que tarda la radiactividad en alcanzar su punto máximo y disminuir. La hipertensión renovascular es muy sensible a esta imagenología, con una especificidad del 95% y una sensibilidad del 96%. [16]
Nuestro conocimiento sobre la isquemia renal proviene de estudios realizados en animales. Según estos estudios, los trasplantes de riñón y las series retrospectivas de nefrectomía parcial indican que el riesgo de deterioro de la función renal es mayor cuanto más persiste la lesión isquémica. [29] Sin embargo, según estudios históricos, se ha descubierto que el uso de la duración de la isquemia como marcador dicotómico tiene importantes defectos a la hora de predecir los resultados de la función renal. La duración de la isquemia renal no afecta a la función renal ni a corto ni a largo plazo. [29]
En los pacientes que reciben un trasplante de riñón o una derivación de la arteria coronaria , se administra un preacondicionamiento isquémico . En el preacondicionamiento isquémico, se le administra al riñón una cantidad tolerable de isquemia. Esto lo preacondiciona para tolerar lesiones posteriores inducidas por isquemia. Esto reduce la lisis celular y la apoptosis de las células renales y mejora la función renal general de los riñones después de la isquemia en comparación con no recibir el preacondicionamiento. [4]
.jpg/440px-Furosemide_(cropped).jpg)
La furosemida es un diurético común y se utiliza para prevenir o revertir la lesión renal aguda. [30] Un diurético es una sustancia que promueve la excreción de agua del cuerpo. [31] Cuando los riñones sufren isquemia, se produce una reperfusión o el retorno del suministro de sangre a los órganos. Como tal, el uso de diuréticos ha ayudado a eliminar el exceso de agua en los riñones después de la reperfusión. Tomar furosemida en forma de comprimidos, solución líquida o mediante inyección se utiliza como medida preventiva o como tratamiento de la isquemia renal y ha demostrado reducir la gravedad de la insuficiencia renal, reducir la apoptosis inducida por la isquemia y acelerar la recuperación de la función renal. Esto también ha llevado a la reducción de la necesidad de reemplazo renal quirúrgico en algunos pacientes. [30] [31] [29]
El fenoldopam se utiliza en el postoperatorio para tratar la lesión renal aguda , si se utiliza antes de que se produzca el daño renal. Al igual que la furosemida, se puede tomar por vía oral o intravenosa; sin embargo, la biodisponibilidad , o la cantidad del fármaco que llega a la circulación sanguínea, se reduce si se toma por vía oral. El fenoldopam se utiliza como vasodilatador y puede aumentar el flujo sanguíneo a los riñones, así como la secreción de renina. Por lo tanto, se puede utilizar para regular la presión arterial en las arterias y reducir la lesión por isquemia. [32]
Bendavia se encuentra actualmente en estudios clínicos dirigidos a la disfunción mitocondrial. Es protector en modelos de ratas de isquemia renal cuando se administró antes de la lesión. Bendavia se une a la cardiolipina en la membrana mitocondrial interna y esto inhibe la actividad de la peroxidasa del citocromo c. Esto protege la respiración durante la reperfusión temprana y acelera la recuperación de ATP. En los modelos animales, se encontró que la muerte y disfunción de las células tubulares se redujeron. [14]
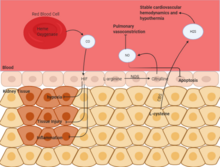
El monóxido de carbono (CO) ayuda a estabilizar el HIF , que ayuda a regular la autofagia y la respuesta hipóxica. A través de esto, se estabilizan la inflamación y la lesión tisular. El óxido nítrico (NO) es un subproducto del metabolismo de la arginina a citrulina por la NO sintasa . Este gas está disponible en todas las células, y se ha descubierto que la inhalación de NO es terapéuticamente activa. Esto reduce la vasoconstricción pulmonar y disminuye la apoptosis durante la isquemia renal. El sulfuro de hidrógeno (H2S) también es un producto endógeno de la actividad metabólica en las células. Este es un subproducto del metabolismo de la cisteína por la cistationina-b-sintasa . Al igual que con el NO, se ha descubierto que la inhalación de H2S es terapéutica y se ha demostrado que estabiliza la hipotermia y estabiliza la hemodinámica cardiovascular, lo que protege de la lesión isquémica. [33]
Las células madre mesenquimales (MSC) son células madre maduras multipotentes capaces de diferenciarse en diferentes tipos de células. Se trata de una línea de terapia prometedora, ya que la medicina regenerativa ha demostrado beneficios en la restauración de los riñones. Las MSC tienen propiedades antiinflamatorias y se han aplicado en pacientes animales y humanos. Debido a sus capacidades regenerativas, el riñón puede beneficiarse de ellas mediante la transdiferenciación en células renales. Además, pueden proporcionar propiedades antiinflamatorias e inmunomoduladoras y, por lo tanto, proteger el riñón y repararlo de la lesión isquémica. [34]
La lesión renal isquémica puede provocar fibrosis , disfunción renal irreversible y la necesidad de terapia de reemplazo renal . La isquemia renal aguda se asocia con una alta mortalidad. La enfermedad renal isquémica crónica (ERIC) generalmente implica pérdida de parénquima renal o reducción de la TFG causada por obstrucción vascular gradual. Clínicamente, el término “enfermedad renal isquémica” describe con mayor frecuencia la ERIC, que contribuye al 6-27% de la enfermedad renal terminal, particularmente entre pacientes mayores de 50 años [34]