
Un síndrome de cáncer hereditario ( síndrome de cáncer familiar , síndrome de cáncer hereditario , síndrome de predisposición al cáncer , síndrome de cáncer , etc.) es un trastorno genético en el que las mutaciones genéticas hereditarias en uno o más genes predisponen a los individuos afectados al desarrollo de cáncer y también pueden causar la aparición temprana de estos cánceres. Los síndromes de cáncer hereditario a menudo muestran no solo un alto riesgo de por vida de desarrollar cáncer, sino también el desarrollo de múltiples tumores primarios independientes . [1]
Muchos de estos síndromes son causados por mutaciones en los genes supresores de tumores , genes que están involucrados en proteger a la célula de volverse cancerosa. Otros genes que pueden verse afectados son los genes de reparación del ADN , los oncogenes y los genes involucrados en la producción de vasos sanguíneos ( angiogénesis ). [2] Ejemplos comunes de síndromes de cáncer hereditario son el síndrome de cáncer de mama y ovario hereditario y el cáncer de colon hereditario sin poliposis (síndrome de Lynch). [3] [4]
Los síndromes de cáncer hereditarios son la base de entre el 5 y el 10 % de todos los cánceres y existen más de 50 formas hereditarias identificables de cáncer. [5] La comprensión científica de los síndromes de susceptibilidad al cáncer se está expandiendo activamente: se están descubriendo síndromes adicionales, [6] la biología subyacente se está volviendo más clara y las pruebas genéticas están mejorando la detección, el tratamiento y la prevención de los síndromes de cáncer. [7] Dada la prevalencia del cáncer de mama y de colon, los síndromes más ampliamente reconocidos incluyen el síndrome de cáncer de mama y ovario hereditario y el cáncer de colon hereditario sin poliposis (síndrome de Lynch). [6]
Algunos cánceres poco frecuentes están fuertemente asociados con síndromes de predisposición hereditaria al cáncer. Se debe considerar la realización de pruebas genéticas en el caso de carcinoma adrenocortical ; tumores carcinoides ; cáncer gástrico difuso ; cáncer de trompa de Falopio/ peritoneal primario ; leiomiosarcoma ; cáncer medular de tiroides ; paraganglioma /feocromocitoma; carcinoma de células renales de histología cromófoba, oncocítica híbrida u oncocitoma ; carcinoma sebáceo ; y tumores de los cordones sexuales con túbulos anulares. [6] Los médicos de atención primaria pueden identificar a las personas que corren riesgo de padecer un síndrome de cáncer hereditario. [8]
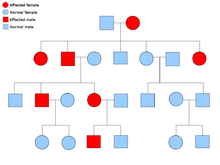
En todas las células del cuerpo hay dos copias de cada gen y cada una de ellas se denomina alelo . La mayoría de los síndromes de cáncer se transmiten de manera autosómica dominante mendeliana . En estos casos, solo tiene que estar presente un alelo defectuoso para que un individuo tenga predisposición al cáncer. Los individuos con un alelo normal y un alelo defectuoso se conocen como heterocigotos . Un individuo heterocigoto y una persona con dos alelos normales ( homocigoto ) tendrán un 50% de posibilidades de producir un niño afectado. [9] La mutación en el gen heredado se conoce como mutación de la línea germinal y una mutación adicional en el alelo normal da como resultado el desarrollo del cáncer. Esto se conoce como la hipótesis de los dos impactos de Knudson , donde el primer impacto del gen es la mutación heredada y el segundo impacto ocurre más tarde en la vida. [2] Como solo es necesario que mute un alelo (en comparación con ambos en los llamados "cánceres esporádicos"), el individuo tiene una mayor probabilidad de desarrollar el cáncer que la población general. [10]
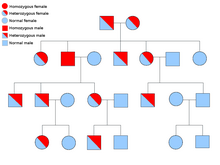
Con menor frecuencia, los síndromes pueden transmitirse como un rasgo autosómico recesivo . Ambos alelos de un gen deben estar mutados en los trastornos autosómicos recesivos para que un individuo tenga predisposición al cáncer. Una persona con dos alelos recesivos se conoce como homocigoto recesivo . Ambos padres deben tener al menos un alelo defectuoso para que un niño sea homocigoto recesivo. Si ambos padres tienen un alelo mutante y un alelo normal ( heterocigoto ), entonces tienen un 25% de posibilidades de producir un niño homocigoto recesivo (tiene predisposición), un 50% de posibilidades de producir un niño heterocigoto (portador del gen defectuoso) y un 25% de posibilidades de producir un niño con dos alelos normales. [9]
Ejemplos de síndromes de cáncer autosómico dominante son el síndrome linfoproliferativo autoinmune (síndrome de Canale-Smith), el síndrome de Beckwith-Wiedemann (aunque el 85% de los casos son esporádicos), [ cita requerida ] síndrome de Birt-Hogg-Dubé , síndrome de Carney , cordoma familiar , síndrome de Cowden , síndrome del nevo displásico con melanoma familiar , poliposis adenomatosa familiar , síndrome de cáncer de mama-ovario hereditario , cáncer gástrico difuso hereditario (HDGC), cáncer colorrectal hereditario sin poliposis (síndrome de Lynch), síndrome de Howel-Evans de cáncer de esófago con tilosis , síndrome de poliposis juvenil , síndrome de Li-Fraumeni , neoplasia endocrina múltiple tipo 1/2, osteocondromatosis múltiple , neurofibromatosis tipo 1/2, síndrome de carcinoma basocelular nevoide (síndrome de Gorlin), síndrome de Peutz-Jeghers , cáncer de próstata familiar . cáncer , cáncer de células renales leiomiomatosis hereditaria (LRCC), cáncer de células renales papilares hereditario , síndrome de paraganglioma -feocromocitoma hereditario, retinoblastoma , esclerosis tuberosa , enfermedad de von Hippel-Lindau y tumor de Wilms . [11]
Ejemplos de síndromes de cáncer autosómico recesivo son la ataxia-telangiectasia , el síndrome de Bloom , la anemia de Fanconi , la poliposis asociada a MUTYH, el síndrome de Rothmund-Thomson , el síndrome de Werner y el xeroderma pigmentoso . [11]
Aunque los síndromes de cáncer presentan un mayor riesgo de cáncer, este riesgo varía. En algunas de estas enfermedades, el cáncer no es su característica principal. [ cita requerida ]
La anemia de Fanconi es un trastorno con un amplio espectro clínico, que incluye: aparición temprana y mayor riesgo de cáncer; insuficiencia de la médula ósea ; y anomalías congénitas . Las manifestaciones más destacadas de este trastorno son las relacionadas con la hematopoyesis (producción de sangre por la médula ósea ); estas incluyen anemia aplásica , síndrome mielodisplásico y leucemia mieloide aguda . Los tumores hepáticos y los carcinomas de células escamosas del esófago , la orofaringe y la úvula son tumores sólidos comúnmente vinculados a la AF. Las anomalías congénitas incluyen: anomalías esqueléticas (especialmente las que afectan a las manos), manchas café con leche e hipopigmentación . Hasta la fecha, los genes que se sabe que causan FA son: FANCA , FANCB , FANCC , FANCD2 , FANCE , FANCF , FANCG , FANCI , FANCJ , FANCL , FANCM , FANCN , FANCO , FANCP y BRCA2 (anteriormente conocido como FANCD1). La herencia de este síndrome es principalmente autosómica recesiva , pero FANCB puede heredarse del cromosoma x materno o paterno ( herencia recesiva ligada al cromosoma X ). La vía FA está involucrada en la reparación del ADN cuando las dos hebras de ADN están unidas incorrectamente ( enlaces cruzados entre hebras ). Muchas vías están coordinadas por la vía FA para esto, incluida la reparación por escisión de nucleótidos , la síntesis de translesión y la recombinación homóloga . [12] [13] [14] [15] [16]
La poliposis adenomatosa familiar (PAF) es un síndrome autosómico dominante que aumenta en gran medida el riesgo de cáncer colorrectal . Alrededor de 1 de cada 8000 personas padecerá esta enfermedad y tiene una penetrancia de aproximadamente el 100% . Un individuo con esta enfermedad tendrá cientos a miles de adenomas benignos en todo el colon , que en la mayoría de los casos progresarán a cáncer. Otros tumores que han aumentado en frecuencia incluyen; osteomas , adenomas y carcinomas suprarrenales , tumores tiroideos y tumores desmoides . La causa de este trastorno es un gen APC mutado , que está involucrado en la regulación de la β-catenina . La APC defectuosa hace que la β-catenina se acumule en las células y active factores de transcripción involucrados en la proliferación celular , migración , diferenciación y apoptosis (muerte celular programada). [17] [18] [19]
El síndrome de cáncer de mama y ovario hereditario es un trastorno genético autosómico dominante causado por mutaciones genéticas de los genes BRCA1 y BRCA2 . En las mujeres, este trastorno aumenta principalmente el riesgo de cáncer de mama y de ovario , pero también aumenta el riesgo de carcinoma de las trompas de Falopio y carcinoma seroso papilar del peritoneo. En los hombres, el riesgo de cáncer de próstata aumenta. Otros cánceres que están inconsistentemente relacionados con este síndrome son el cáncer de páncreas , el cáncer de mama masculino , el cáncer colorrectal y los cánceres de útero y cuello uterino . Las mutaciones genéticas representan aproximadamente el 7% y el 14% del cáncer de mama y de ovario, respectivamente, y BRCA1 y BRCA2 representan el 80% de estos casos. BRCA1 y BRCA2 son genes supresores de tumores implicados en el mantenimiento y la reparación del ADN, lo que a su vez conduce a la inestabilidad del genoma. Las mutaciones en estos genes permiten un mayor daño al ADN, lo que puede conducir al cáncer. [20] [21]
El cáncer de colon hereditario sin poliposis , también conocido como síndrome de Lynch, es un síndrome de cáncer autosómico dominante que aumenta el riesgo de cáncer colorrectal. Es causado por mutaciones genéticas en los genes de reparación de desajustes del ADN (MMR), en particular MLH1 , MSH2 , MSH6 y PMS2 . Además del cáncer colorrectal, muchos otros cánceres aumentan en frecuencia. Estos incluyen; cáncer de endometrio , cáncer de estómago , cáncer de ovario , cánceres del intestino delgado y cáncer de páncreas . El cáncer de colon hereditario sin poliposis también está asociado con una aparición temprana de cáncer colorrectal. Los genes MMR están involucrados en la reparación del ADN cuando las bases en cada cadena de ADN no coinciden. Los genes MMR defectuosos permiten mutaciones de inserción y deleción continuas en regiones de ADN conocidas como microsatélites . Estas secuencias cortas y repetitivas de ADN se vuelven inestables, lo que lleva a un estado de inestabilidad de microsatélites (MSI). Los microsatélites mutados se encuentran a menudo en genes implicados en la iniciación y progresión de tumores, y la MSI puede mejorar la supervivencia de las células, lo que conduce al cáncer. [4] [22] [23] [24]
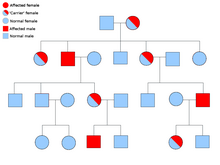
La mayoría de los casos de paraganglioma familiar son causados por mutaciones en los genes de la subunidad succinato deshidrogenasa (succinato:ubiquinona oxidorreductasa) ( SDHD , SDHAF2 , SDHC , SDHB ).
El gen PGL-1 está asociado con la mutación SDHD, y la mayoría de los individuos con paraganglioma tienen padres afectados en lugar de madres afectadas. El gen PGL1 y el gen PGL2 son autosómicos dominantes con impronta genética . El gen PGL-4 está asociado con la mutación SDHB y se asocia con un mayor riesgo de feocromocitoma, así como de cáncer de células renales y cáncer de tiroides no medular. [25]
El síndrome de Li-Fraumeni es un síndrome autosómico dominante causado principalmente por mutaciones en el gen TP53 , que aumenta en gran medida el riesgo de muchos cánceres y también está altamente asociado con la aparición temprana de estos cánceres. Los cánceres vinculados a este trastorno incluyen; sarcomas de tejidos blandos (que a menudo se encuentran en la infancia), osteosarcoma , cáncer de mama , cáncer de cerebro , leucemia y carcinoma adrenocortical . Las personas con síndrome de Li-Fraumeni a menudo tienen múltiples cánceres primarios independientes. La razón del gran espectro clínico de este trastorno puede deberse a otras mutaciones genéticas que modifican la enfermedad. La proteína producida por el gen TP53 , p53, está involucrada en la detención del ciclo celular , la reparación del ADN y la apoptosis . El p53 defectuoso puede no ser capaz de realizar adecuadamente estos procesos, lo que puede ser la razón de la formación de tumores. Debido a que solo el 60-80% de las personas con el trastorno tienen mutaciones detectables en TP53 , otras mutaciones en la vía p53 pueden estar involucradas en el síndrome de Li-Fraumeni. [26] [27] [28] [29] Las personas con síndrome de Li-Fraumeni necesitan un seguimiento intensivo durante toda su vida para la detección temprana del cáncer. [30] Consulte el síndrome de Li-Fraumeni para obtener más información.
La poliposis asociada a MUTYH comparte la mayoría de sus características clínicas con la poliposis familiar; la diferencia es que es un trastorno autosómico recesivo causado por mutaciones en el gen de reparación del ADN MUTYH . Los tumores con mayor riesgo de padecer este trastorno son el cáncer colorrectal, los adenomas gástricos y los adenomas duodenales. [17] [31]

El síndrome de carcinoma basocelular nevoide , también conocido como síndrome de Gorlin, es un síndrome de cáncer autosómico dominante en el que el riesgo de carcinoma basocelular es muy alto. La enfermedad se caracteriza por nevos de células basales , queratoquistes mandibulares y anomalías esqueléticas. Las estimaciones de la prevalencia del síndrome de carcinoma basocelular nevoide varían, pero es de aproximadamente 1 en 60000. La presencia de carcinoma basocelular es mucho mayor en individuos blancos que en negros; 80% y 38%, respectivamente. Los queratoquistes odontogénicos se encuentran en aproximadamente el 75% de los individuos con la enfermedad y a menudo ocurren temprano en la vida. Las anomalías esqueléticas más comunes ocurren en la cabeza y la cara, pero otras áreas a menudo se ven afectadas como la caja torácica . La mutación genética causante de esta enfermedad se produce en el gen PTCH , y el producto de PTCH es un supresor tumoral involucrado en la señalización celular . Aunque no se conoce el papel exacto de esta proteína en el síndrome de carcinoma basocelular nevoide, está involucrada en la vía de señalización hedgehog , conocida por controlar el crecimiento y desarrollo celular . [32] [33]
La enfermedad de von Hippel-Lindau es una afección genética autosómica dominante poco frecuente que predispone a las personas a desarrollar tumores benignos y malignos. Los tumores más comunes en la enfermedad de von Hippel-Lindau son los hemangioblastomas del sistema nervioso central y de la retina, los carcinomas renales de células claras, los feocromocitomas, los tumores neuroendocrinos pancreáticos, los quistes pancreáticos, los tumores del saco endolinfático y los cistoadenomas papilares del epidídimo. [34] [35] La enfermedad de von Hippel-Lindau es el resultado de una mutación en el gen supresor de tumores de von Hippel-Lindau en el cromosoma 3p25.3. [36]
El xeroderma pigmentoso es un trastorno autosómico recesivo caracterizado por sensibilidad a la luz ultravioleta (UV) , riesgo masivamente aumentado de quemaduras solares y mayor riesgo de cánceres de piel . El riesgo de cáncer de piel es más de 10000 veces mayor que el de los individuos normales e incluye muchos tipos de cáncer de piel, incluidos los cánceres de piel melanoma y no melanoma. Además, las áreas expuestas al sol de la lengua, los labios y los ojos tienen un mayor riesgo de volverse cancerosas. El xeroderma pigmentoso puede estar asociado con otros cánceres internos y tumores benignos. [ cita requerida ] Además del cáncer, algunas mutaciones genéticas que causan xeroderma pigmentoso están asociadas con la neurodegeneración . El xeroderma pigmentoso puede ser causado por mutaciones genéticas en 8 genes, que producen las siguientes enzimas : XPA , XPB , XPC , XPD , XPE , XPF , XPG y Pol η . XPA-XPF son enzimas de reparación por escisión de nucleótidos que reparan el ADN dañado por la luz ultravioleta y las proteínas defectuosas permitirán la acumulación de mutaciones causadas por la luz ultravioleta. Pol η es una polimerasa , que es una enzima involucrada en la replicación del ADN. Hay muchas polimerasas, pero pol η es la enzima que replica el ADN dañado por la luz ultravioleta. Las mutaciones en este gen producirán una enzima pol η defectuosa que no puede replicar el ADN con daño por luz ultravioleta. Las personas con mutaciones de este gen tienen un subconjunto de XP; enfermedad de variante XP. [37] [38]
Muchos síndromes de cáncer se deben a una alteración hereditaria de la capacidad de reparación del ADN . [ cita requerida ] Cuando hay una mutación hereditaria en un gen de reparación del ADN, este no se expresará o se expresará de forma alterada. En ese caso, la función de reparación probablemente será deficiente y, como consecuencia, los daños en el ADN tenderán a acumularse. Dichos daños en el ADN pueden causar errores durante la síntesis del ADN que conducen a mutaciones, algunas de las cuales pueden dar lugar al cáncer. Las mutaciones de reparación del ADN de la línea germinal que aumentan el riesgo de cáncer se enumeran en la Tabla.
Las pruebas genéticas pueden utilizarse para identificar genes o cromosomas mutados que se transmiten de generación en generación. Las personas que dan positivo en una prueba de una mutación genética no están necesariamente condenadas a desarrollar el cáncer asociado con la mutación, sin embargo tienen un mayor riesgo de desarrollar cáncer en comparación con la población general. Se recomienda que las personas se realicen una prueba genética si su historial médico familiar incluye: varios miembros de la familia con cáncer, alguien en su familia que contrajo cáncer a una edad particularmente temprana o por ser parte de un determinado grupo étnico . [7]

El proceso de detección genética es un procedimiento simple y no invasivo. Sin embargo, antes de que se realicen pruebas genéticas para detectar mutaciones, el paciente generalmente debe acudir a un proveedor de atención médica y pasar por una consulta individual , donde se analizan tanto los antecedentes personales como familiares de cáncer. El profesional médico puede entonces evaluar la probabilidad de que el paciente tenga la mutación y puede guiarlo a través del proceso que es la detección genética. [66] Es importante que se lleve a cabo esta consulta porque garantiza que la persona dé su consentimiento informado para participar en las pruebas genéticas, esté consciente y comprenda los pasos, los beneficios y las limitaciones del procedimiento y esté más informada sobre las consecuencias de los resultados de las pruebas de audición. [67] La prueba se puede realizar utilizando fluidos corporales o células del paciente, esto incluye; sangre (que es la más común), saliva, líquido amniótico e incluso células del interior de la boca obtenidas de un hisopo bucal . Luego, este material se envía a un laboratorio de genética especializado donde los técnicos lo examinarán, los resultados de la prueba se envían de regreso al proveedor de atención médica que solicitó el análisis y los resultados se discuten con el paciente. [7]
Las pruebas directas al consumidor se pueden obtener sin un profesional médico, pero no se recomiendan ya que el consumidor pierde la oportunidad de discutir su decisión con un profesional capacitado. [68] Según la Biblioteca Nacional de Medicina de los EE. UU., las pruebas genéticas en Estados Unidos cuestan entre $100 y $2000, dependiendo del tipo y la complejidad de la prueba. [69]
Las pruebas genéticas son importantes porque si el resultado es positivo, las personas son más conscientes de su propia salud y de la salud de sus familiares más cercanos. [70] Con la ayuda y el asesoramiento de un profesional médico, pueden tomar medidas para reducir su elevado riesgo de desarrollar cáncer a través de:
Existen otras formas de acciones preventivas, un ejemplo para el cáncer de mama y de ovario hereditario sería pasar por una cirugía: una histerectomía es la extirpación total o parcial del útero , mientras que una mastectomía es la extirpación de un seno ( mastectomía doble significa que se extirpan ambos senos), esto a menudo puede agregar años a su expectativa de vida . [72] Otra medida preventiva es la detección y los chequeos regulares del cáncer. Si una persona tiene el síndrome de Lynch , entonces debe hacerse una colonoscopia regular para examinar si hay algún cambio en las células que recubren la pared intestinal, los chequeos regulares se asocian con 7 años adicionales en la expectativa de vida en promedio para una persona con síndrome de Lynch. Esto se debe a que la detección temprana significa que las acciones preventivas y la cirugía correctas se pueden tomar más rápido. [73] También se recomienda la detección regular de las mamas para las mujeres diagnosticadas con mutaciones BRCA , además de que, estudios recientes muestran que los hombres con mayor riesgo de desarrollar cáncer de próstata debido a mutaciones BRCA pueden disminuir su riesgo tomando aspirina . [74] La aspirina es muy beneficiosa para reducir la prevalencia del cáncer; sin embargo, debe tomarse regularmente durante al menos un período de cinco años para tener algún efecto. [75]
A menudo, las mutaciones genéticas son más comunes en ciertos grupos étnicos, esto se debe a que una raza puede rastrear a sus antepasados hasta una ubicación geográfica, los genes mutados luego se transmiten de los antepasados a través de generaciones, por lo que algunas etnias son más susceptibles a las mutaciones, lo que aumenta sus posibilidades de desarrollar cáncer [61]. Como se mencionó anteriormente, esto puede ser útil ya que puede ayudar a los profesionales de la salud a evaluar el riesgo de un paciente de tener una mutación antes de someterse a pruebas. [66] El síndrome de Werner tiene una prevalencia de 1 en 200,000 nacidos vivos en los EE. UU., Pero afecta a individuos en Japón en 1 en 20,000-40,000 casos. [76] 1 de cada 40 judíos asquenazíes tiene una mutación BRCA, este es un gran contraste con la población general en los Estados Unidos, donde 1 de cada 400 personas se ven afectadas. Los judíos asquenazíes tienen un alto riesgo de desarrollar cáncer de mama y ovario hereditario y se recomienda que se sometan a pruebas genéticas para ver si tienen una mutación y exámenes de detección de cáncer regulares. [77]