Un defecto de nacimiento [a] es una condición anormal que está presente al nacer , independientemente de su causa. [2] Los defectos de nacimiento pueden resultar en discapacidades que pueden ser físicas , intelectuales o del desarrollo . [2] Las discapacidades pueden variar de leves a graves. [6] Los defectos de nacimiento se dividen en dos tipos principales: trastornos estructurales en los que se observan problemas con la forma de una parte del cuerpo y trastornos funcionales en los que existen problemas con el funcionamiento de una parte del cuerpo. [3] Los trastornos funcionales incluyen trastornos metabólicos y degenerativos . [3] Algunos defectos de nacimiento incluyen trastornos tanto estructurales como funcionales. [3]
Los defectos de nacimiento pueden ser resultado de trastornos genéticos o cromosómicos , exposición a ciertos medicamentos o sustancias químicas, o ciertas infecciones durante el embarazo . [4] Los factores de riesgo incluyen deficiencia de folato , beber alcohol o fumar durante el embarazo, diabetes mal controlada y una madre mayor de 35 años. [5] [6] Se cree que muchos involucran múltiples factores. [6] Los defectos de nacimiento pueden ser visibles al nacer o diagnosticarse mediante pruebas de detección . [10] Una serie de defectos se pueden detectar antes del nacimiento mediante diferentes pruebas prenatales . [10]
El tratamiento varía según el defecto en cuestión. [7] Esto puede incluir terapia , medicación, cirugía o tecnología de asistencia . [7] Los defectos de nacimiento afectaron a alrededor de 96 millones de personas en 2015. [update][ 11] En los Estados Unidos, ocurren en aproximadamente el 3% de los recién nacidos. [8] Resultaron en alrededor de 628.000 muertes en 2015, por debajo de las 751.000 en 1990. [9] [12] Los tipos con el mayor número de muertes son la enfermedad cardíaca congénita (303.000), seguida de los defectos del tubo neural (65.000). [9]
Gran parte del lenguaje utilizado para describir las enfermedades congénitas es anterior al mapeo genómico , y las enfermedades estructurales a menudo se consideran por separado de otras enfermedades congénitas. Ahora se sabe que muchas enfermedades metabólicas tienen una expresión estructural sutil, y las enfermedades estructurales a menudo tienen vínculos genéticos. Aun así, las enfermedades congénitas a menudo se clasifican sobre una base estructural, organizadas cuando es posible por el sistema orgánico primario afectado. [ cita requerida ]
Se utilizan varios términos para describir anomalías congénitas (algunos de ellos también se utilizan para describir afecciones no congénitas, y es posible que se aplique más de un término a una afección en particular).
Una anomalía de las extremidades se denomina dismelia . Estas incluyen todas las formas de anomalías de las extremidades, como amelia , ectrodactilia , focomelia , polimelia , polidactilia , sindactilia , polisindactilia , oligodactilia , braquidactilia , acondroplasia , aplasia o hipoplasia congénita , síndrome de banda amniótica y disostosis cleidocraneal . [17]
Los defectos cardíacos congénitos incluyen el conducto arterioso persistente , el defecto del tabique auricular , el defecto del tabique ventricular y la tetralogía de Fallot .
Las anomalías congénitas del sistema nervioso incluyen defectos del tubo neural como la espina bífida , la encefalocele y la anencefalia . Otras anomalías congénitas del sistema nervioso incluyen la malformación de Arnold-Chiari , la malformación de Dandy-Walker , la hidrocefalia , la microencefalia , la megalencefalia , la lisencefalia , la polimicrogiria , la holoprosencefalia y la agenesia del cuerpo calloso . [18]
Las anomalías congénitas del sistema gastrointestinal incluyen numerosas formas de estenosis y atresia , y perforación, como la gastrosquisis . [19]
Las anomalías congénitas del riñón y del tracto urinario incluyen el parénquima renal, los riñones y el sistema colector urinario. [20]
Los defectos pueden ser bilaterales o unilaterales y a menudo coexisten diferentes defectos en un mismo niño. [21]
Una enfermedad metabólica congénita también se denomina error congénito del metabolismo . La mayoría de estos son defectos de un solo gen , generalmente hereditarios. Muchos afectan la estructura de partes del cuerpo, pero algunos simplemente afectan la función. [22]
Otras condiciones genéticas bien definidas pueden afectar la producción de hormonas, receptores, proteínas estructurales y canales iónicos.
El consumo de alcohol por parte de la madre durante el embarazo puede causar un continuo de diversos defectos congénitos permanentes: anomalías craneofaciales, [23] daño cerebral, [24] discapacidad intelectual, [25] enfermedad cardíaca, anomalías renales, anomalías esqueléticas, anomalías oculares. [26]
La prevalencia de niños afectados se estima al menos en un 1% en EE. UU. [27] y también en Canadá.
Muy pocos estudios han investigado los vínculos entre el consumo de alcohol por parte del padre y la salud de los hijos. [28]
Sin embargo, recientes investigaciones realizadas en animales han demostrado una correlación entre la exposición paterna al alcohol y una disminución del peso al nacer de la descendencia. Los trastornos conductuales y cognitivos, incluidas las dificultades de aprendizaje y memoria, la hiperactividad y la menor tolerancia al estrés, se han relacionado con la ingestión de alcohol por parte del padre. [29] Las habilidades de gestión del estrés comprometidas de los animales cuyo padre macho estuvo expuesto al alcohol son similares a las respuestas exageradas al estrés que muestran los niños con síndrome de alcoholismo fetal debido al consumo de alcohol por parte de la madre. Estos defectos de nacimiento y trastornos conductuales se encontraron en casos de ingestión de alcohol por parte del padre tanto a largo como a corto plazo. [30] [31] En el mismo estudio realizado en animales, la exposición paterna al alcohol se correlacionó con una diferencia significativa en el tamaño de los órganos y el aumento del riesgo de que la descendencia presentara defectos del tabique ventricular al nacer. [31]
Las sustancias cuya toxicidad puede causar trastornos congénitos se denominan teratógenos , e incluyen ciertos medicamentos y drogas recreativas en el embarazo , así como muchas toxinas ambientales en el embarazo . [32]
Una revisión publicada en 2010 identificó seis mecanismos teratogénicos principales asociados con el uso de medicamentos: antagonismo del folato , alteración de las células de la cresta neural , alteración endocrina , estrés oxidativo , alteración vascular y teratogénesis mediada por receptores o enzimas específicas. [33]
Se estima que el 10% de todos los defectos congénitos son causados por la exposición prenatal a un agente teratogénico. [34] Estas exposiciones incluyen exposición a medicamentos o drogas, infecciones y enfermedades maternas y exposiciones ambientales y ocupacionales. El tabaquismo paterno también se ha relacionado con un mayor riesgo de defectos congénitos y cáncer infantil para la descendencia, donde la línea germinal paterna sufre daño oxidativo debido al uso de cigarrillos. [35] [36] Los defectos congénitos causados por teratógenos son potencialmente prevenibles. Casi el 50% de las mujeres embarazadas han estado expuestas a al menos un medicamento durante la gestación. [37] Durante el embarazo, una mujer también puede estar expuesta a teratógenos de ropa contaminada o toxinas dentro del líquido seminal de su pareja. [38] [30] [39] Un estudio adicional encontró que de 200 personas derivadas para asesoramiento genético por una exposición teratogénica, el 52% estuvo expuesto a más de un teratógeno potencial. [40]
La Agencia de Protección Ambiental de los Estados Unidos estudió 1065 sustancias químicas y medicamentos en su programa ToxCast (parte del CompTox Chemicals Dashboard ) utilizando modelos in silico y un ensayo basado en células madre pluripotentes humanas para predecir intoxicantes para el desarrollo in vivo en función de los cambios en el metabolismo celular tras la exposición a sustancias químicas. Los hallazgos del estudio publicado en 2020 fueron que el 19 % de las 1065 sustancias químicas arrojaron una predicción de toxicidad para el desarrollo . [41]
Probablemente, el fármaco teratogénico más conocido es la talidomida . Fue desarrollado a finales de la década de 1950 por Chemie Grünenthal como inductor del sueño y antiemético . Debido a su capacidad para prevenir las náuseas, se recetó a mujeres embarazadas en casi 50 países de todo el mundo entre 1956 y 1962. [42] Hasta que William McBride publicó el estudio que condujo a su retirada del mercado en 1961, nacieron entre 8.000 y 10.000 niños con malformaciones graves. Los trastornos más típicos inducidos por la talidomida fueron deformidades reduccionales de los huesos largos de las extremidades. La focomelia , por lo demás una deformidad rara, ayudó por tanto a reconocer el efecto teratogénico del nuevo fármaco. Entre otras malformaciones causadas por la talidomida se encontraban las de los oídos, los ojos, el cerebro, los riñones, el corazón y los tractos digestivo y respiratorio; el 40% de los niños afectados prenatalmente murieron poco después del nacimiento. [42] Como la talidomida se utiliza actualmente como tratamiento para el mieloma múltiple y la lepra , se han descrito varios nacimientos de niños afectados a pesar del uso estrictamente obligatorio de anticonceptivos entre las pacientes tratadas con ella.
La vitamina A es la única vitamina que es embriotóxica incluso en dosis terapéuticas, por ejemplo en multivitamínicos , porque su metabolito, el ácido retinoico , desempeña un papel importante como molécula señal en el desarrollo de varios tejidos y órganos. Su precursor natural, el β-caroteno , se considera seguro, mientras que el consumo de hígado animal puede provocar malformaciones, ya que el hígado almacena vitaminas lipofílicas, incluido el retinol. [42] La isotretinoína (ácido 13-cis-retinoico; nombre comercial Roaccutane), análogo de la vitamina A, que a menudo se usa para tratar el acné severo , es un teratógeno tan fuerte que una sola dosis tomada por una mujer embarazada (incluso por vía transdérmica ) puede provocar graves defectos de nacimiento. Debido a este efecto, la mayoría de los países tienen sistemas establecidos para garantizar que no se administre a mujeres embarazadas y que la paciente sea consciente de lo importante que es prevenir el embarazo durante y al menos un mes después del tratamiento. Las pautas médicas también sugieren que las mujeres embarazadas deben limitar la ingesta de vitamina A a aproximadamente 700 μg / día, ya que tiene potencial teratogénico cuando se consume en exceso. [43] [44] La vitamina A y sustancias similares pueden inducir abortos espontáneos, partos prematuros, defectos en los ojos ( microftalmia ), oídos, timo, deformidades faciales y defectos neurológicos ( hidrocefalia , microcefalia ) y cardiovasculares, así como discapacidad intelectual . [42]
La tetraciclina , un antibiótico , nunca debe prescribirse a mujeres en edad reproductiva ni a niños, debido a su efecto negativo sobre la mineralización ósea y dental . Los "dientes de tetraciclina" tienen un color marrón o grisáceo como resultado de un desarrollo defectuoso tanto de la dentina como del esmalte de los dientes . [42]
Se sabe que varios anticonvulsivos son altamente teratogénicos. La fenitoína , también conocida como difenilhidantoína, junto con la carbamazepina , es responsable del síndrome de hidantoína fetal , que típicamente puede incluir base nasal ancha, labio leporino y/o paladar hendido, microcefalia , hipoplasia de uñas y dedos , restricción del crecimiento intrauterino y discapacidad intelectual. La trimetadiona tomada durante el embarazo es responsable del síndrome de trimetadiona fetal , caracterizado por malformaciones craneofaciales, cardiovasculares, renales y de la columna vertebral, junto con un retraso en el desarrollo mental y físico. El valproato tiene efectos antifolato , lo que lleva a defectos relacionados con el cierre del tubo neural , como la espina bífida. Recientemente también se ha informado de un menor coeficiente intelectual y autismo como resultado de la exposición intrauterina al valproato. [42]
La anticoncepción hormonal se considera inocua para el embrión. Sin embargo, Peterka y Novotná [42] afirman que las progestinas sintéticas utilizadas para prevenir el aborto espontáneo en el pasado causaban con frecuencia la masculinización de los órganos reproductores externos de las recién nacidas debido a su actividad androgénica . El dietilestilbestrol es un estrógeno sintético utilizado desde la década de 1940 hasta 1971, cuando la exposición prenatal se ha relacionado con el adenocarcinoma de células claras de la vagina . Estudios posteriores mostraron riesgos elevados de otros tumores y malformaciones congénitas de los órganos sexuales para ambos sexos.
Todos los citostáticos son teratógenos potentes; el aborto suele recomendarse cuando se descubre un embarazo durante o antes de la quimioterapia. La aminopterina , un fármaco citostático con efecto antifolato , se utilizó durante los años 1950 y 1960 para inducir abortos terapéuticos . En algunos casos, el aborto no se produjo, pero los recién nacidos presentaron un síndrome fetal por aminopterina consistente en retraso del crecimiento, craneosinostosis , hidrocefalia, dismorfias faciales, discapacidad intelectual o deformidades en las piernas [42] [45]
El agua potable es a menudo un medio a través del cual viajan toxinas nocivas. Los metales pesados, los elementos, los nitratos, los nitritos y el flúor pueden ser transportados a través del agua y causar trastornos congénitos. [46]
El nitrato, que se encuentra principalmente en el agua potable de fuentes subterráneas, es un potente teratógeno. Un estudio de casos y controles en la Australia rural que se llevó a cabo tras frecuentes informes de mortalidad prenatal y malformaciones congénitas descubrió que quienes bebían agua subterránea que contenía nitrato, en lugar de agua de lluvia, corrían el riesgo de dar a luz niños con trastornos del sistema nervioso central, defectos musculoesqueléticos y defectos cardíacos. [47]
Los disolventes clorados y aromáticos, como el benceno y el tricloroetileno, a veces entran en el suministro de agua debido a descuidos en la eliminación de desechos. Un estudio de casos y controles en la zona descubrió que en 1986, la leucemia se estaba produciendo en los niños de Woburn, Massachusetts, a una tasa que era cuatro veces la tasa de incidencia esperada. Una investigación posterior reveló una conexión entre la alta incidencia de leucemia y un error en la distribución de agua que suministraba agua a la ciudad con una contaminación significativa con desechos de fabricación que contenían tricloroetileno. [48] Como disruptor endocrino , se demostró que el DDT induce abortos espontáneos , interfiere en el desarrollo del sistema reproductor femenino , causa hipotiroidismo congénito y, sospechosamente, obesidad infantil . [42]
El fluoruro, cuando se transmite a través del agua en niveles altos, también puede actuar como teratógeno. Dos informes sobre la exposición al fluoruro en China, que se controlaron para tener en cuenta el nivel de educación de los padres, encontraron que los niños nacidos de padres que estuvieron expuestos a 4,12 ppm de fluoruro crecieron con coeficientes intelectuales que eran, en promedio, siete puntos más bajos que sus contrapartes cuyos padres consumieron agua que contenía 0,91 ppm de fluoruro. En estudios realizados en ratas, un mayor contenido de fluoruro en el agua potable provocó un aumento de los niveles de acetilcolinesterasa, que puede alterar el desarrollo cerebral prenatal. Los efectos más significativos se observaron a un nivel de 5 ppm. [49]
El feto es aún más susceptible a sufrir daños por la ingestión de monóxido de carbono, que puede ser perjudicial si se inhala durante el embarazo, generalmente a través del humo de tabaco de primera o segunda mano. La concentración de monóxido de carbono en el bebé nacido de una madre no fumadora es de alrededor del 2%, y esta concentración aumenta drásticamente hasta un rango de 6%-9% si la madre fuma tabaco. Otras posibles fuentes de intoxicación prenatal por monóxido de carbono son los gases de escape de los motores de combustión, el uso de diclorometano (disolvente de pintura, quitaesmalte) en áreas cerradas, calentadores de agua a gas defectuosos, barbacoas en interiores, llamas abiertas en áreas mal ventiladas y exposición atmosférica en áreas altamente contaminadas. [50] La exposición al monóxido de carbono a niveles tóxicos durante los dos primeros trimestres del embarazo puede provocar una restricción del crecimiento intrauterino, lo que da lugar a un bebé con retraso del crecimiento y que nace más pequeño que el 90% de otros bebés de la misma edad gestacional. El efecto de la exposición crónica al monóxido de carbono puede depender de la etapa del embarazo en la que esté expuesta la madre. La exposición durante la etapa embrionaria puede tener consecuencias neurológicas, como disgenesia telencefálica, dificultades de comportamiento durante la infancia y reducción del volumen del cerebelo. Además, posibles defectos esqueléticos podrían resultar de la exposición al monóxido de carbono durante la etapa embrionaria, como malformaciones de manos y pies, displasia de cadera , subluxación de cadera, agenesia de una extremidad y atresia maxilar inferior con glosoptosis . Además, la exposición al monóxido de carbono entre los días 35 y 40 del desarrollo embrionario puede conducir a un mayor riesgo de que el niño desarrolle paladar hendido. La exposición al monóxido de carbono o la exposición al ozono contaminado también puede conducir a defectos cardíacos del tabique ventricular, la arteria pulmonar y las válvulas cardíacas. [51] Los efectos de la exposición al monóxido de carbono disminuyen más tarde en el desarrollo fetal durante la etapa fetal, pero aún pueden conducir a una encefalopatía anóxica . [52]
La contaminación industrial también puede provocar defectos congénitos. [53] Durante un período de 37 años, la Corporación Chisso , una empresa petroquímica y de plásticos, contaminó las aguas de la bahía de Minamata con aproximadamente 27 toneladas de metilmercurio , contaminando el suministro de agua local. Esto llevó a que muchas personas de la zona desarrollaran lo que se conoció como la " enfermedad de Minamata ". Debido a que el metilmercurio es un teratógeno, el envenenamiento por mercurio de los residentes de la bahía resultó en defectos neurológicos en la descendencia. Los bebés expuestos al envenenamiento por mercurio en el útero mostraron predisposiciones a la parálisis cerebral , ataxia , desarrollo psicomotor inhibido y discapacidad intelectual. [54]
Se ha demostrado que los vertederos tienen efectos adversos sobre el desarrollo fetal. Numerosas investigaciones han demostrado que los vertederos tienen varios efectos negativos sobre los bebés nacidos de madres que viven cerca de vertederos: bajo peso al nacer, defectos congénitos, aborto espontáneo y mortalidad fetal e infantil. Estudios realizados en torno al vertedero Love Canal , cerca de las cataratas del Niágara, y en el vertedero de Lipari, en Nueva Jersey, han demostrado una mayor proporción de bebés con bajo peso al nacer que en las comunidades más alejadas de los vertederos. Un estudio realizado en California mostró una correlación positiva entre el tiempo y la cantidad de vertidos y el bajo peso al nacer y las muertes neonatales. Un estudio realizado en el Reino Unido mostró una correlación entre las mujeres embarazadas que viven cerca de vertederos y un mayor riesgo de trastornos congénitos, como defectos del tubo neural, hipospadias , epispadias y defectos de la pared abdominal , como gastrosquisis y exomfalos. Un estudio realizado en una comunidad galesa también mostró una mayor incidencia de gastrosquisis. Otro estudio sobre 21 vertederos de residuos peligrosos europeos mostró que quienes vivían a menos de 3 km tenían un mayor riesgo de dar a luz a bebés con defectos congénitos y que a medida que aumentaba la distancia desde la tierra, el riesgo disminuía. Estos defectos congénitos incluían defectos del tubo neural, malformaciones de los tabiques cardíacos, anomalías de las arterias y las venas y anomalías cromosómicas. [55] Si observamos las comunidades que viven cerca de vertederos, nos referimos a la justicia ambiental. Una gran mayoría de los vertederos están ubicados cerca de comunidades pobres, en su mayoría negras. Por ejemplo, entre principios de la década de 1920 y 1978, aproximadamente el 25% de la población de Houston era negra. Sin embargo, más del 80% de los vertederos e incineradores durante ese período estaban ubicados en estas comunidades negras. [56]
Otro problema relacionado con la justicia ambiental es el envenenamiento por plomo . Un feto expuesto al plomo durante el embarazo puede tener problemas de aprendizaje y un crecimiento más lento. Algunas pinturas (antes de 1978) y tuberías contienen plomo. Por lo tanto, las mujeres embarazadas que viven en casas con pintura con plomo inhalan el polvo que contiene plomo, lo que provoca la exposición del feto al plomo. Cuando se utilizan tuberías de plomo para beber y cocinar agua, esta agua se ingiere, junto con el plomo, exponiendo al feto a esta toxina. Este problema es más frecuente en las comunidades más pobres porque más familias adineradas pueden permitirse el lujo de pintar sus casas y renovar las tuberías. [57]
La endometriosis puede afectar al feto de una mujer , provocando un 30% más de riesgo de malformaciones congénitas y un 50% más de riesgo de que los neonatos tengan un tamaño inferior al normal para su edad gestacional. [58]
Se ha vinculado el tabaquismo paterno antes de la concepción con un mayor riesgo de anomalías congénitas en la descendencia. [28]
Fumar provoca mutaciones del ADN en la línea germinal del padre, que pueden ser heredadas por la descendencia. El humo del cigarrillo actúa como un mutágeno químico en el ADN de las células germinales. Las células germinales sufren daño oxidativo, y los efectos se pueden ver en la producción alterada de ARNm, problemas de infertilidad y efectos secundarios en las etapas embrionarias y fetales del desarrollo. Este daño oxidativo puede resultar en modificaciones epigenéticas o genéticas de la línea germinal del padre. Los linfocitos fetales han sido dañados como resultado de los hábitos de fumar de un padre antes de la concepción. [36] [38]
Se han establecido correlaciones entre el tabaquismo paterno y el mayor riesgo de que los hijos desarrollen cánceres infantiles (incluida la leucemia aguda , los tumores cerebrales y el linfoma ) antes de los cinco años. Actualmente se sabe poco sobre cómo el tabaquismo paterno daña al feto y en qué período de tiempo el padre fuma es más perjudicial para los hijos. [36]
Una infección de transmisión vertical es una infección causada por bacterias , virus o, en casos raros, parásitos transmitidos directamente de la madre a un embrión , feto o bebé durante el embarazo o el parto. [59]
Al principio se creía que los trastornos congénitos eran el resultado de factores hereditarios únicamente. Sin embargo, a principios de la década de 1940, el oftalmólogo pediatra australiano Norman Gregg comenzó a reconocer un patrón en el que los bebés que llegaban a su consultorio desarrollaban cataratas congénitas a una tasa más alta que aquellos que las desarrollaban a partir de factores hereditarios. [60] El 15 de octubre de 1941, Gregg presentó un documento en el que explicaba sus hallazgos: 68 de los 78 niños con cataratas congénitas habían estado expuestos en el útero a la rubéola debido a un brote en los campamentos del ejército australiano. Estos hallazgos confirmaron, para Gregg, que, de hecho, podían existir causas ambientales para los trastornos congénitos.
Se sabe que la rubéola causa anomalías en los ojos, el oído interno, el corazón y, a veces, los dientes. Más específicamente, la exposición fetal a la rubéola durante las semanas cinco a diez del desarrollo (la sexta semana en particular) puede causar cataratas y microftalmia en los ojos. Si la madre se infecta con rubéola durante la novena semana, una semana crucial para el desarrollo del oído interno, puede producirse la destrucción del órgano de Corti , lo que provoca sordera. En el corazón, el conducto arterioso puede permanecer después del nacimiento, lo que provoca hipertensión. La rubéola también puede provocar defectos del tabique auricular y ventricular en el corazón. Si se expone a la rubéola en el segundo trimestre, el feto puede desarrollar malformaciones del sistema nervioso central. Sin embargo, debido a que las infecciones de rubéola pueden pasar desapercibidas, diagnosticarse erróneamente o no reconocerse en la madre, y/o algunas anomalías no son evidentes hasta más tarde en la vida del niño, no se conoce por completo la incidencia precisa de los defectos congénitos debidos a la rubéola. El momento de la infección de la madre durante el desarrollo fetal determina el riesgo y el tipo de defecto congénito. A medida que el embrión se desarrolla, el riesgo de anomalías disminuye. Si se expone al virus de la rubéola durante las primeras cuatro semanas, el riesgo de malformaciones es del 47%. La exposición durante las semanas cinco a ocho crea una probabilidad del 22%, mientras que entre las semanas 9 y 12 existe una probabilidad del 7%, seguida del 6% si la exposición se produce durante las semanas 13 a 16. La exposición durante las primeras ocho semanas de desarrollo también puede provocar un nacimiento prematuro y la muerte fetal. Estas cifras se calculan a partir de la inspección inmediata del bebé después del nacimiento. Por lo tanto, los defectos mentales no se tienen en cuenta en los porcentajes porque no son evidentes hasta más tarde en la vida del niño. Si se incluyeran, estas cifras serían mucho más altas. [61]
Otros agentes infecciosos incluyen el citomegalovirus , el virus del herpes simple , la hipertermia , la toxoplasmosis y la sífilis . La exposición materna al citomegalovirus puede causar microcefalia , calcificaciones cerebrales, ceguera, coriorretinitis (que puede causar ceguera), hepatoesplenomegalia y meningoencefalitis en los fetos. [61] La microcefalia es un trastorno en el que el feto tiene una cabeza atípicamente pequeña, [62] las calcificaciones cerebrales significan que ciertas áreas del cerebro tienen depósitos de calcio atípicos, [63] y la meningoencefalitis es el agrandamiento del cerebro. Los tres trastornos causan una función cerebral anormal o discapacidad intelectual. La hepatoesplenomegalia es el agrandamiento del hígado y el bazo que causa problemas digestivos. [64] También puede causar algo de kernicterus y petequias . El kernicterus causa pigmentación amarilla de la piel, daño cerebral y sordera. [65] La petequias es una hemorragia de los capilares que da lugar a manchas rojas o moradas en la piel. [66] Sin embargo, el citomegalovirus suele ser mortal en el embrión. El virus del Zika también puede transmitirse de la madre embarazada a su bebé y causar microcefalia.
El virus del herpes simple puede causar microcefalia , microftalmo (globos oculares anormalmente pequeños), [67] displasia de retina, hepatoesplenomegalia y discapacidad intelectual. [61] Tanto el microftalmo como la displasia de retina pueden causar ceguera. Sin embargo, el síntoma más común en los bebés es una respuesta inflamatoria que se desarrolla durante las primeras tres semanas de vida. [61] La hipertermia causa anencefalia , que es cuando parte del cerebro y el cráneo están ausentes en el bebé. [61] [68] La exposición de la madre a la toxoplasmosis puede causar calcificación cerebral, hidrocefalia (causa discapacidades mentales), [69] y discapacidad intelectual en los bebés. También se han informado otras anomalías congénitas, como coriorretinitis, microftalmo y defectos oculares. La sífilis causa sordera congénita, discapacidad intelectual y fibrosis difusa en órganos, como el hígado y los pulmones, si el embrión está expuesto. [61]
Por ejemplo, la falta de ácido fólico , una vitamina B, en la dieta de la madre puede causar deformidades celulares del tubo neural que resultan en espina bífida. Los trastornos congénitos como la deformidad del tubo neural se pueden prevenir en un 72% si la madre consume 4 mg de ácido fólico antes de la concepción y después de las doce semanas de embarazo. [70] El ácido fólico, o vitamina B 9 , ayuda al desarrollo del sistema nervioso fetal. [70]
Estudios con ratones han demostrado que la privación de alimentos al ratón macho antes de la concepción hace que las crías presenten niveles de glucosa en sangre significativamente más bajos. [71]
Los choques físicos externos o las limitaciones debidas al crecimiento en un espacio restringido pueden provocar una deformación o separación no deseada de las estructuras celulares, lo que da lugar a una forma final anormal o a estructuras dañadas que no pueden funcionar como se espera. Un ejemplo es el síndrome de Potter debido al oligohidramnios . Este hallazgo es importante para comprender en el futuro cómo la genética puede predisponer a las personas a enfermedades como la obesidad, la diabetes y el cáncer. [72]
En el caso de los organismos multicelulares que se desarrollan en el útero , la interferencia física o la presencia de otros organismos con un desarrollo similar, como los gemelos, puede dar lugar a que las dos masas celulares se integren en un todo mayor, y las células combinadas intenten seguir desarrollándose de una manera que satisfaga los patrones de crecimiento previstos para ambas masas celulares. [73] Las dos masas celulares pueden competir entre sí y pueden duplicar o fusionar varias estructuras. Esto da lugar a condiciones como los gemelos unidos , y el organismo fusionado resultante puede morir al nacer cuando debe abandonar el entorno vital del útero y debe intentar mantener sus procesos biológicos de forma independiente.
Las causas genéticas de los defectos de nacimiento incluyen la herencia de genes anormales de la madre o del padre, así como nuevas mutaciones en una de las células germinales que dieron origen al feto. Las células germinales masculinas mutan a un ritmo mucho más rápido que las células germinales femeninas y, a medida que el padre envejece, el ADN de las células germinales muta rápidamente. [35] [74] Si un óvulo es fertilizado con un espermatozoide que tiene el ADN dañado, existe la posibilidad de que el feto se desarrolle de manera anormal. [74] [75]
Los trastornos genéticos son todos congénitos (presentes al nacer), aunque pueden no manifestarse o reconocerse hasta más adelante en la vida. Los trastornos genéticos pueden agruparse en defectos de un solo gen, trastornos de múltiples genes o defectos cromosómicos . Los defectos de un solo gen pueden surgir de anomalías de ambas copias de un gen autosómico (un trastorno recesivo ) o de solo una de las dos copias (un trastorno dominante ). Algunas afecciones son resultado de deleciones o anomalías de unos pocos genes ubicados de forma contigua en un cromosoma. Los trastornos cromosómicos implican la pérdida o duplicación de porciones más grandes de un cromosoma (o un cromosoma entero) que contiene cientos de genes. Las anomalías cromosómicas grandes siempre producen efectos en muchas partes del cuerpo y sistemas de órganos diferentes.
Los defectos no genéticos en los espermatozoides, como centriolos deformados y otros componentes en la cola y el cuello del espermatozoide que son importantes para el desarrollo embrionario, pueden provocar defectos. [76] [77]
Un estatus socioeconómico bajo en un barrio desfavorecido puede incluir exposición a "factores de riesgo y factores de estrés ambientales". [78] Las desigualdades socioeconómicas se miden comúnmente con la puntuación de Cartairs-Morris, el índice de privación múltiple, el índice de privación de Townsend y la puntuación de Jarman. [79] La puntuación de Jarman, por ejemplo, considera "el desempleo, el hacinamiento, los padres solteros, los menores de cinco años, los ancianos que viven solos, la etnia, la clase social baja y la movilidad residencial". [79] En el metaanálisis de Vos, estos índices se utilizan para ver el efecto de los barrios de bajo nivel socioeconómico en la salud materna. En el metaanálisis, se recopilaron datos de estudios individuales desde 1985 hasta 2008. [79] Vos concluye que existe una correlación entre las adversidades prenatales y los barrios desfavorecidos. [79] Otros estudios han demostrado que el bajo nivel socioeconómico está estrechamente asociado con el desarrollo del feto en el útero y el retraso del crecimiento. [80] Los estudios también sugieren que los niños nacidos en familias de bajo nivel socioeconómico tienen "probabilidades de nacer prematuramente, con bajo peso al nacer o con asfixia, un defecto congénito, una discapacidad, síndrome de alcoholismo fetal o SIDA". [80] Bradley y Corwyn también sugieren que los trastornos congénitos surgen de la falta de nutrición de la madre, un estilo de vida pobre, el abuso de sustancias maternas y "vivir en un vecindario que contiene peligros que afectan el desarrollo fetal (vertederos de residuos tóxicos)". [80] En un metanálisis que examinó cómo las desigualdades influían en la salud materna, se sugirió que los vecindarios desfavorecidos a menudo promovían comportamientos como el tabaquismo, el consumo de drogas y alcohol. [78] Después de controlar los factores socioeconómicos y la etnia, varios estudios individuales demostraron una asociación con resultados como la mortalidad perinatal y el parto prematuro. [78]
En el caso de los supervivientes del bombardeo atómico de Hiroshima y Nagasaki , conocidos como Hibakusha , no se encontró ningún aumento estadísticamente demostrable de defectos de nacimiento/malformaciones congénitas entre sus hijos concebidos posteriormente, ni en los hijos concebidos posteriormente de supervivientes de cáncer que habían recibido radioterapia previamente . [81] [82] [83] [84] Las mujeres supervivientes de Hiroshima y Nagasaki que pudieron concebir, aunque estuvieron expuestas a cantidades sustanciales de radiación, tuvieron posteriormente hijos sin una mayor incidencia de anomalías/defectos de nacimiento que en la población japonesa en su conjunto. [85] [86]
Relativamente pocos estudios han investigado los efectos de la exposición paterna a la radiación en la descendencia. Después del desastre de Chernóbil , en la década de 1990 se asumió que la línea germinal de los padres irradiados sufrió mutaciones minisatélites en el ADN, que fue heredada por los descendientes. [30] [87] Más recientemente, sin embargo, la Organización Mundial de la Salud afirma que "los niños concebidos antes o después de la exposición de su padre no mostraron diferencias estadísticamente significativas en las frecuencias de mutación". [88] Este aumento estadísticamente insignificante también fue observado por investigadores independientes que analizaron a los hijos de los liquidadores . [89] Los estudios en animales han demostrado que dosis incomparablemente masivas de irradiación con rayos X de ratones machos resultaron en defectos de nacimiento de la descendencia. [38]
En la década de 1980, una prevalencia relativamente alta de casos de leucemia pediátrica en niños que vivían cerca de una planta de procesamiento nuclear en Cumbria occidental, Reino Unido, llevó a los investigadores a investigar si el cáncer era resultado de la exposición a la radiación paterna. Se encontró una asociación significativa entre la irradiación paterna y el cáncer de la descendencia, pero otras áreas de investigación cercanas a otras plantas de procesamiento nuclear no produjeron los mismos resultados. [38] [30] Más tarde se determinó que se trataba del grupo Seascale en el que la hipótesis principal es la afluencia de trabajadores extranjeros, que tienen una tasa de leucemia diferente dentro de su raza que el promedio británico, lo que dio como resultado el grupo observado de 6 niños más de lo esperado alrededor de Cumbria. [90]
Ciertas complicaciones del parto pueden ocurrir con mayor frecuencia en la edad avanzada de la madre (más de 35 años). Entre ellas se encuentran la restricción del crecimiento fetal, la preeclampsia, el desprendimiento de placenta, los partos prematuros y la muerte fetal. Estas complicaciones no solo pueden poner en riesgo al niño, sino también a la madre. [91]
Los efectos de la edad del padre sobre la descendencia aún no se comprenden bien y se estudian mucho menos que los efectos de la edad de la madre. [92] Los padres contribuyen proporcionalmente más mutaciones de ADN a su descendencia a través de sus células germinales que la madre, y la edad paterna determina cuántas mutaciones se transmiten. Esto se debe a que, a medida que los seres humanos envejecen, las células germinales masculinas adquieren mutaciones a un ritmo mucho más rápido que las células germinales femeninas. [35] [38] [74]
Se ha descubierto que un aumento de alrededor del 5% en la incidencia de defectos del tabique ventricular , defectos del tabique auricular y conducto arterioso persistente en la descendencia está correlacionado con la edad paterna avanzada. La edad paterna avanzada también se ha relacionado con un mayor riesgo de acondroplasia y síndrome de Apert . Los hijos nacidos de padres menores de 20 años muestran un mayor riesgo de verse afectados por conducto arterioso persistente, defectos del tabique ventricular y tetralogía de Fallot . Se plantea la hipótesis de que esto puede deberse a exposiciones ambientales o elecciones de estilo de vida. [92]
Las investigaciones han descubierto que existe una correlación entre la edad paterna avanzada y el riesgo de defectos congénitos como anomalías de las extremidades , síndromes que involucran múltiples sistemas y síndrome de Down . [74] [35] [93] Estudios recientes han concluido que entre el 5 y el 9 % de los casos de síndrome de Down se deben a efectos paternos, pero estos hallazgos son controvertidos. [74] [75] [35] [94]
Hay evidencia concreta de que la edad paterna avanzada está asociada con una mayor probabilidad de que la madre tenga un aborto espontáneo o de que se produzca la muerte fetal . [74]
Aunque se ha logrado un progreso significativo en la identificación de la etiología de algunos defectos congénitos, aproximadamente el 65% no tiene una causa conocida o identificable. [34] Estos se conocen como esporádicos, un término que implica una causa desconocida, aparición aleatoria independientemente de las condiciones de vida de la madre, [95] y un bajo riesgo de recurrencia para futuros hijos. Para el 20-25% de las anomalías parece haber una causa "multifactorial", lo que significa una interacción compleja de múltiples anomalías genéticas menores con factores de riesgo ambientales. Otro 10-13% de las anomalías tienen una causa puramente ambiental (por ejemplo, infecciones, enfermedad o abuso de drogas en la madre). Solo el 12-25% de las anomalías tienen una causa puramente genética. De estas, la mayoría son anomalías cromosómicas . [96]
Los trastornos congénitos no se limitan a los humanos y pueden encontrarse en una variedad de otras especies, incluido el ganado. Una de estas afecciones se denomina esquistosoma reflexus y se caracteriza por inversión espinal, exposición de las vísceras abdominales y anomalías en las extremidades. [97]
Los suplementos de folato reducen el riesgo de defectos del tubo neural. Hay evidencias provisionales que respaldan el papel de la L-arginina en la reducción del riesgo de restricción del crecimiento intrauterino . [98]
Las pruebas de detección de recién nacidos se introdujeron a principios de la década de 1960 e inicialmente se ocupaban de sólo dos trastornos. Desde entonces, la espectrometría de masas en tándem , la cromatografía de gases-espectrometría de masas y el análisis de ADN han hecho posible la detección de una gama mucho más amplia de trastornos. La detección de recién nacidos mide principalmente la actividad de metabolitos y enzimas utilizando una muestra de sangre seca. [99] Las pruebas de detección se llevan a cabo para detectar trastornos graves que pueden ser tratables hasta cierto punto. [100] El diagnóstico temprano hace posible la disponibilidad de información dietética terapéutica, terapia de reemplazo enzimático y trasplantes de órganos. [101] Diferentes países apoyan la detección de una serie de trastornos metabólicos ( errores innatos del metabolismo (IEM)) y trastornos genéticos, incluyendo la fibrosis quística y la distrofia muscular de Duchenne . [100] [102] La espectroscopia de masas en tándem también se puede utilizar para IEM, y la investigación de muerte súbita del lactante y el síndrome del bebé sacudido. [100]
La detección también se puede realizar de forma prenatal y puede incluir una ecografía obstétrica para obtener exploraciones como la ecografía nucal . Las ecografías 3D pueden brindar información detallada sobre anomalías estructurales.

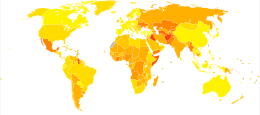
Las anomalías congénitas provocaron alrededor de 632.000 muertes al año en 2013, en comparación con 751.000 en 1990. [12] Los tipos con mayor mortalidad son los defectos cardíacos congénitos (323.000), seguidos de los defectos del tubo neural (69.000). [12]
Muchos estudios han encontrado que la frecuencia de aparición de ciertas malformaciones congénitas depende del sexo del niño (tabla). [104] [ 105] [106] [107] [108] Por ejemplo, la estenosis pilórica ocurre con mayor frecuencia en los varones, mientras que la dislocación congénita de cadera tiene entre cuatro y cinco veces más probabilidades de ocurrir en las mujeres. Entre los niños con un riñón, hay aproximadamente el doble de varones, mientras que entre los niños con tres riñones hay aproximadamente 2,5 veces más mujeres. El mismo patrón se observa entre los bebés con un número excesivo de costillas, vértebras, dientes y otros órganos que en un proceso de evolución han sufrido una reducción: entre ellos hay más mujeres. Por el contrario, entre los bebés con su escasez, hay más varones. Se ha demostrado que la anencefalia ocurre aproximadamente con el doble de frecuencia en las mujeres. [109] El número de niños que nacen con 6 dedos es dos veces mayor que el número de niñas. [110] Actualmente existen diversas técnicas para detectar anomalías congénitas en el feto antes del nacimiento. [111]
Alrededor del 3% de los recién nacidos tienen una "anomalía física importante", es decir, una anomalía física que tiene importancia estética o funcional. [112] Las anomalías físicas congénitas son la principal causa de mortalidad infantil en los Estados Unidos y representan más del 20% de todas las muertes infantiles. Entre el siete y el diez por ciento de todos los niños [ aclaración necesaria ] requerirán atención médica extensa para diagnosticar o tratar un defecto congénito. [113]
PM Rajewski y AL Sherman (1976) analizaron la frecuencia de anomalías congénitas en relación con el sistema del organismo. Se registró una prevalencia de varones en el caso de anomalías de órganos y sistemas filogenéticamente más jóvenes. [114]
En cuanto a la etiología, las diferencias sexuales pueden dividirse en dos grupos: antes y después de la diferenciación de las gónadas masculinas durante el desarrollo embrionario, que comienza a partir de la decimoctava semana. Por tanto, el nivel de testosterona en los embriones masculinos aumenta considerablemente. [118] Las diferencias hormonales y fisiológicas posteriores de los embriones masculinos y femeninos pueden explicar algunas diferencias sexuales en la frecuencia de defectos congénitos. [119] Es difícil explicar las diferencias observadas en la frecuencia de defectos congénitos entre los sexos mediante los detalles de las funciones reproductivas o la influencia de factores ambientales y sociales.
Los CDC y el Proyecto Nacional de Defectos Congénitos estudiaron la incidencia de los defectos congénitos en los EE. UU. Los hallazgos clave incluyen:
No se encontraron diferencias (en las frecuencias de defectos de nacimiento, mortinatos, etc.), lo que alivió la preocupación pública inmediata de que la radiación atómica pudiera generar una epidemia de niños con malformaciones.
{{cite book}}: |journal=ignorado ( ayuda )