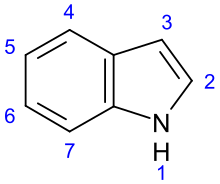
Los alcaloides indol son una clase de alcaloides que contienen una fracción estructural de indol ; Muchos alcaloides indol también incluyen grupos isopreno y, por lo tanto, se denominan alcaloides terpénicos indol o secologanina triptamina. Al contener más de 4100 compuestos diferentes conocidos, es una de las clases más grandes de alcaloides. [1] Muchos de ellos poseen una actividad fisiológica significativa y algunos de ellos se utilizan en medicina. El aminoácido triptófano es el precursor bioquímico de los alcaloides indol. [2]

La acción de algunos alcaloides indol se conoce desde hace mucho tiempo. Los aztecas utilizaban los hongos psilocibina que contienen alcaloides psilocibina y psilocina . La planta con flores Rauvolfia serpentina , que contiene reserpina, era una medicina común en la India alrededor del año 1000 a.C. Los africanos utilizaban las raíces del arbusto perenne de la selva tropical Iboga , que contiene ibogaína , como estimulante. En Nigeria se administraba una infusión de semillas de frijol de Calabar a personas acusadas de delitos : su rechazo por parte del estómago se consideraba un signo de inocencia; de lo contrario, la persona moría por la acción de la fisostigmina , presente en la planta y que provoca parálisis. del corazón y los pulmones. [3]
El consumo de centeno y cereales relacionados contaminados con el hongo Claviceps purpurea provoca intoxicación por cornezuelo y ergotismo en humanos y otros mamíferos. La relación entre el cornezuelo y el ergotismo no se estableció hasta 1717, y el alcaloide ergotamina , uno de los principales ingredientes activos del cornezuelo, se aisló en 1918. [4]
El primer alcaloide indol, la estricnina , fue aislado por Pierre Joseph Pelletier y Joseph Bienaimé Caventou en 1818 a partir de plantas del género Strychnos . La fórmula estructural correcta de la estricnina no se determinó hasta 1947, aunque la presencia del núcleo de indol en la estructura de la estricnina se estableció algo antes. [5] [6] El indol fue obtenido por primera vez por Adolf von Baeyer en 1866 mientras descomponía el índigo . [7]
Los alcaloides indol se distinguen según su biosíntesis. Los dos tipos de alcaloides indol son isoprenoides y no isoprenoides. Estos últimos incluyen elementos estructurales terpenoides , sintetizados por organismos vivos a partir de pirofosfato de dimetilalilo (DMAPP) y/o pirofosfato de isopentenilo (IPP): [8]
También existen clasificaciones puramente estructurales basadas en la presencia de carbazol , β-carbolina u otras unidades en el esqueleto carbonado de la molécula de alcaloide. [9] Se conocen unos 200 alcaloides indol diméricos con dos grupos indol. [10]
El número de alcaloides indol no isoprenoides conocidos es pequeño en comparación con el número de alcaloides indol. [2]
Uno de los derivados del indol más simples y aún más extendidos son las aminas biogénicas triptamina y 5-hidroxitriptamina ( serotonina ). [11] Aunque su asignación al alcaloide no es universalmente aceptada, [12] ambos se encuentran en plantas y animales. [13] El esqueleto de triptamina es parte de la gran mayoría de los alcaloides indol. [14] Por ejemplo, la N , N - dimetiltriptamina (DMT), la psilocina y su psilocibina fosforilada son los derivados más simples de la triptamina. [13] Algunos alcaloides indol simples no contienen triptamina, como la gramina y la glicozolina (esta última es un derivado del carbazol ). [15] Camalexin es un alcaloide indol simple producido por la planta Arabidopsis thaliana , a menudo utilizado como modelo para la biología vegetal. [dieciséis]
La prevalencia de los alcaloides de β-carbolina se asocia con la facilidad de formar el núcleo de β-carbolina a partir de triptamina en la reacción intramolecular de Mannich . Los derivados simples (no isoprenoides) de β-carbolina incluyen harmina , harmalina , harmane [17] y una estructura ligeramente más compleja de cantinona. [18] La harmalina fue aislada por primera vez en 1838 por Göbel [19] y la harmina en 1848 por Fritzche. [20] [21] [22]
Los alcaloides de piroloindol forman un grupo relativamente pequeño de derivados de triptamina. Se producen por metilación del núcleo de indol en la posición 3 y la posterior adición nucleofílica en el átomo de carbono en la posición 2 con el cierre del grupo etilamino en un anillo. Un representante típico de este grupo es la fisostigmina , [23] que fue aislada por Jobst y Hesse en 1864. [24] [25]

Los alcaloides indol isoprenoides incluyen residuos de triptófano o triptamina y bloques de construcción isoprenoides derivados del pirofosfato de dimetilalilo y pirofosfato de isopentenilo . [2]
Los alcaloides del cornezuelo de centeno son una clase de alcaloides indol hemiterpenoides relacionados con el ácido lisérgico , que, a su vez, se forma en reacciones de varias etapas que involucran triptófano y DMAPP. Muchos alcaloides del cornezuelo de centeno son amidas del ácido lisérgico. La amida más simple es la ergina , y las más complejas se pueden distinguir en los siguientes grupos: [26] [27]
Posteriormente se demostró que la ergotinina, descubierta en 1875, y la ergotoxina (1906) eran una mezcla de varios alcaloides. En forma pura, Arthur Stoll aisló los primeros alcaloides del cornezuelo de centeno, la ergotamina y su isómero ergotaminina en 1918. [27]
La mayoría de los alcaloides monoterpenoides incluyen un fragmento de 9 o 10 carbonos (en negrita en la imagen) (que se origina en la secologanina ), y la configuración permite agruparlos en las clases Corynanthe , Iboga y Aspidosperma . La parte monoterpenoide de sus esqueletos carbonados se ilustra a continuación con el ejemplo de los alcaloides ajmalicina y catarantina. Los átomos de carbono circulados faltan en los alcaloides que contienen el fragmento C 9 en lugar de C 10 . [14]
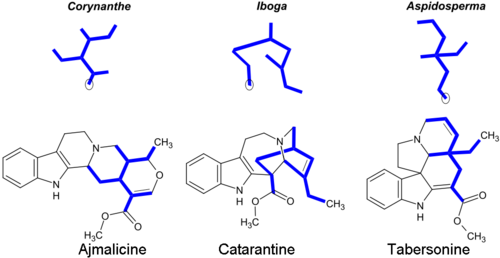
Los alcaloides de Corynanthe incluyen el esqueleto inalterado de secologanina, que está modificado en los alcaloides de Iboga y Aspidosperma . [28] Algunos alcaloides indol monoterpenoides representativos: [5] [29] [30]
También hay un pequeño grupo de alcaloides presentes en la planta Aristotelia – unos 30 compuestos, el más importante de los cuales es la peduncularina – que contienen una parte monoterpenoide C 10 que no proviene de la secologanina. [31]
Dímeros de derivados de estrictosidina, vagamente llamados bisindoles pero más complicados que eso. Se conocen más de 200 alcaloides indol diméricos. Se producen en organismos vivos mediante la dimerización de bases de indol monoméricas, en las siguientes reacciones: [32]
Además de los alcaloides bisindol, existen alcaloides diméricos que se forman mediante la dimerización del monómero indol con otro tipo de alcaloide. Un ejemplo es la tubulosina, que consta de fragmentos de indol e isoquinolina . [33]
Las plantas ricas en alcaloides indol no isoprenoides incluyen el harmal ( Peganum harmala ), que contiene harmane, harmina y harmalina, y el frijol Calabar ( Physostigma venenosum ) que contiene fisostigmina . [34] Algunos miembros de la familia Convolvulaceae , en particular Ipomoea violacea y Turbina corymbosa , contienen ergolinas y lisergamidas . [35] A pesar de la considerable diversidad estructural, la mayoría de los alcaloides indol monoterpenoides se localizan en tres familias de plantas dicotiledóneas : Apocynaceae (géneros Alstonia , Aspidosperma , Rauvolfia y Catharanthus ), Rubiaceae ( Corynanthe ) y Loganiaceae ( Strychnos ). [36] [37]
Los alcaloides indol también están presentes en los hongos. Por ejemplo, los hongos psilocibina contienen derivados de la triptamina y el Claviceps contiene derivados del ácido lisérgico. [34] La piel de muchas especies de sapos del género Bufo contiene un derivado de triptamina, bufotenina , y la piel y el veneno de la especie Bufo alvarius ( sapo del río Colorado ) contienen 5-MeO-DMT . [38] La serotonina , que es un neurotransmisor importante en los mamíferos, también se puede atribuir a los alcaloides indol simples. [39]
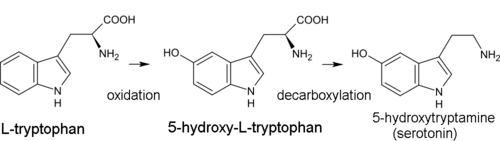
El precursor biogenético de todos los alcaloides indol es el aminoácido triptófano . Para la mayoría de ellos, el primer paso de síntesis es la descarboxilación del triptófano para formar triptamina . La dimetiltriptamina (DMT) se forma a partir de triptamina mediante metilación con la participación de la coenzima de S-adenosil metionina (SAM). La psilocina se produce por desfosforilación espontánea de la psilocibina . [41]
En la biosíntesis de la serotonina, el producto intermedio no es la triptamina sino el 5-hidroxitriptófano, que a su vez se descarboxila para formar 5-hidroxitriptamina (serotonina). [13]
La biosíntesis de alcaloides β-carbolina se produce mediante la formación de una base de Schiff a partir de triptamina y aldehído (o cetoácido ) y la posterior reacción intramolecular de Mannich , donde el átomo de carbono C(2) del indol sirve como nucleófilo. Luego, la aromaticidad se restablece mediante la pérdida de un protón en el átomo de C(2). El esqueleto de tetrahidro-β-carbolina resultante se oxida gradualmente a dihidro-β-carbolina y β-carbolina. En la formación de alcaloides simples de β-carbolina, como la harmina y la harmalina, el ácido pirúvico actúa como cetoácido. En la síntesis de alcaloides indol monoterpenoides, la secologanina desempeña el papel del aldehído. Los alcaloides del pirroloindol se sintetizan en los organismos vivos de forma similar. [42]

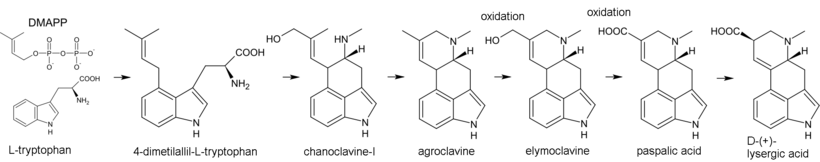
La biosíntesis de los alcaloides del cornezuelo de centeno comienza con la alquilación del triptófano mediante pirofosfato de dimetilalilo (DMAPP), donde el átomo de carbono C(4) en el núcleo del indol desempeña el papel de nucleófilo. El 4-dimetilalil-L-triptófano resultante sufre N-metilación. Otros productos de la biosíntesis son la chanoclavina-I y la agroclavina; esta última se hidroxila a elimoclavina, que a su vez se oxida formando ácido paspálico. En el proceso de transposición alilo, el ácido paspálico se convierte en ácido lisérgico. [43]
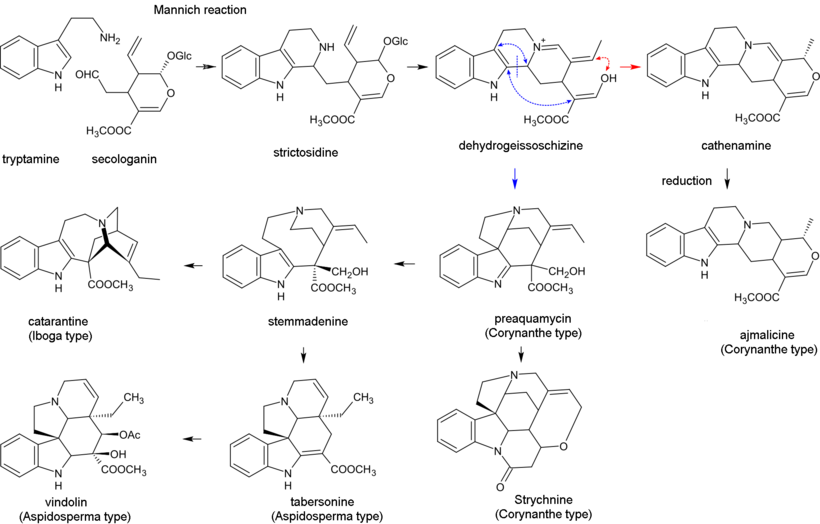
La biosíntesis de alcaloides indol monoterpenoides comienza con la reacción de Mannich de triptamina y secologanina; produce estrictosidina que se convierte en 4,21-deshidrogeissoschizina. Luego, la biosíntesis de la mayoría de los alcaloides que contienen la parte monoterpenoide no perturbada ( tipo Corynanthe ) procede mediante ciclación con la formación de catenamina y posterior reducción a ajmalicina en presencia de nicotinamida adenina dinucleótido fosfato (NADPH). En la biosíntesis de otros alcaloides, la 4,21-deshidrogeissoschizina se convierte primero en preakuammicina (un alcaloide del subtipo strychnos, tipo Corynanthe ) que da lugar a otros alcaloides del subtipo strychnos y de los tipos Iboga y Aspidosperma . Los alcaloides bisindol vinblastina y vincristina se producen en la reacción que involucra catarantina (alcaloide de tipo Iboga ) y vindolina (tipo Aspidosperma ). [29] [44]

Los alcaloides indol actúan sobre los sistemas nerviosos central y periférico . Además, los alcaloides de bisindol, vinblastina y vincristina, muestran efectos antineoplásicos . [45]
Debido a las similitudes estructurales con la serotonina, muchas triptaminas pueden interactuar con los receptores 5-HT de la serotonina . [46] El efecto principal de los psicodélicos serotoninérgicos como el LSD , la DMT y la psilocibina está relacionado con que son agonistas de los receptores 5-HT 2A . [47] [48] Por el contrario, la gramina es un antagonista del receptor 5-HT 2A . [49]
Las ergolinas , como el ácido lisérgico , incluyen elementos estructurales tanto de la triptamina como de la feniletilamina y, por tanto, actúan sobre todo el grupo de los receptores 5-HT, los adrenoceptores (principalmente de tipo α) y los receptores de dopamina (principalmente de tipo D 2 ). [50] [51] Entonces, la ergotamina es un agonista parcial de los receptores α-adrenérgicos y 5-HT 2 y, por lo tanto, estrecha los vasos sanguíneos y estimula la constricción del útero . La dihidroergotamina es más selectiva para los receptores α-adrenérgicos y tiene un efecto más débil sobre los receptores de serotonina. La ergometrina es un agonista de los receptores α-adrenérgicos, 5-HT 2 y parcialmente D 2 . [51] [52] En comparación con otros alcaloides del cornezuelo de centeno, la ergometrina tiene una mayor selectividad para estimular el útero. [52] El LSD , una ergolina psicodélica semisintética, es un agonista de los receptores 5-HT 2A , 5-HT 1A y, en menor medida, D 2 , y tiene un potente efecto psicodélico. [53] [54]
Algunos alcaloides indol monoterpenoides también interactúan con los adrenoceptores. Por ejemplo, la ajmalicina es un antagonista selectivo de los receptores adrenérgicos α 1 y, por tanto, tiene acción antihipertensiva . [55] [56] La yohimbina es más selectiva para el adrenoceptor α 2 ; [56] al bloquear los receptores adrenérgicos α 2 presinápticos , aumenta la liberación de norepinefrina , elevando así la presión arterial. La yohimbina se utilizó para el tratamiento de la disfunción eréctil en los hombres hasta la aparición de fármacos más eficaces. [57]
Algunos alcaloides afectan indirectamente el recambio de monoaminas. Entonces, harmina y harmalina son inhibidores selectivos reversibles de la monoaminooxidasa-A . [58] La reserpina reduce la concentración de monoaminas en las neuronas presinápticas y sinápticas , induciendo así efectos antihipertensivos y antipsicóticos. [55]
Algunos alcaloides indol interactúan con otros tipos de receptores. La mitraginina es un agonista del receptor opioide μ . [30] Los alcaloides dañinos son antagonistas del receptor GABA A , [59] y la ibogaína , de los receptores NMDA . [60] La fisostigmina es un inhibidor reversible de la acetilcolinesterasa . [61]

Las plantas y hongos que contienen alcaloides indol tienen una larga historia de uso en la medicina tradicional . La Rauvolfia serpentina , que contiene reserpina como principio activo, se utilizó durante más de 3.000 años en la India para tratar las mordeduras de serpientes y la locura . [62] En la Europa medieval, los extractos de cornezuelo se utilizaban en el aborto con medicamentos . [63]
Posteriormente, a las plantas se les unieron preparaciones puras de alcaloides indol. La reserpina fue el segundo fármaco antipsicótico (después de la clorpromazina ) ; sin embargo, mostró una acción relativamente débil y fuertes efectos secundarios, y ya no se utiliza para este propósito. [64] En cambio, se prescribe como un fármaco antihipertensivo , a menudo en combinación con otras sustancias. [sesenta y cinco]
Otros fármacos que afectan el sistema cardiovascular incluyen la ajmalina , que es un agente antiarrítmico de clase I, [66] y la ajmalicina, que se utiliza en Europa como fármaco antihipertensivo. [55] La fisostigmina, un inhibidor de la acetilcolinesterasa, y sus análogos sintéticos se utilizan en el tratamiento del glaucoma , la enfermedad de Alzheimer ( rivastigmina ) y la miastenia ( neostigmina , piridostigmina , distigmina ). [67] Los alcaloides del cornezuelo de centeno ergometrina (ergobazina, ergonovina), ergotamina y sus derivados sintéticos ( metilergometrina ) se aplican contra el sangrado uterino, [68] y los alcaloides de bisindol vinblastina y vincristina son agentes antitumorales. [69]
Los estudios en animales han demostrado que la ibogaína tiene potencial en el tratamiento de las adicciones a la heroína , la cocaína y el alcohol , lo que está asociado con el antagonismo de la ibogaína con los receptores NMDA . El uso médico de la ibogaína se ve obstaculizado por su estatus legal, ya que está prohibida en muchos países como una poderosa droga psicodélica con peligrosas implicaciones de sobredosis. Sin embargo, redes ilegales en Europa y Estados Unidos proporcionan ibogaína para el tratamiento de la adicción a las drogas. [70] [71]

Desde la antigüedad, las plantas que contienen alcaloides indol se han utilizado como drogas psicodélicas . Los aztecas usaban y los mazatecos continúan usando hongos de psilocibina y las semillas psicoactivas de especies de campanillas como Ipomoea tricolor . [72] Las tribus amazónicas utilizan la infusión psicodélica, ayahuasca , hecha de Psychotria viridis y Banisteriopsis caapi . [73] Psychotria viridis contiene la droga psicodélica DMT , mientras que Banisteriopsis caapi contiene alcaloides harmala , que actúan como inhibidores de la monoaminooxidasa . Se cree que la función principal de los alcaloides harmala en la ayahuasca es prevenir la metabolización del DMT en el tracto digestivo y el hígado , para que pueda cruzar la barrera hematoencefálica , mientras que el efecto directo de los alcaloides harmala sobre el sistema nervioso central es mínimo. [74] El veneno del sapo del río Colorado , Bufo alvarius , puede haberse utilizado como droga psicodélica, siendo sus componentes activos 5-MeO-DMT y bufotenina . [75] Una de las drogas psicodélicas recreativas más comunes , el LSD , es una ergolina semisintética (que contiene la fracción indol). [76]
{{cite book}}: Mantenimiento CS1: falta el editor de la ubicación ( enlace ).