
La cristalografía de rayos X es la ciencia experimental que determina la estructura atómica y molecular de un cristal , en la que la estructura cristalina hace que un haz de rayos X incidentes se difracte en muchas direcciones específicas. Al medir los ángulos y las intensidades de estos haces difractados, un cristalógrafo puede producir una imagen tridimensional de la densidad de electrones dentro del cristal. A partir de esta densidad electrónica se pueden determinar las posiciones de los átomos en el cristal, así como sus enlaces químicos , el desorden cristalográfico y otra información variada.
Dado que muchos materiales forman cristales (como sales , metales, minerales, semiconductores , así como diversas moléculas inorgánicas, orgánicas y biológicas), la cristalografía de rayos X ha sido fundamental en el desarrollo de muchos campos científicos. En sus primeras décadas de uso, este método determinó el tamaño de los átomos, las longitudes y tipos de enlaces químicos y las diferencias de escala atómica entre diversos materiales, especialmente minerales y aleaciones . El método también reveló la estructura y función de muchas moléculas biológicas, incluidas vitaminas , fármacos, proteínas y ácidos nucleicos como el ADN . La cristalografía de rayos X sigue siendo el método principal para caracterizar la estructura atómica de nuevos materiales y para discernir materiales que parecen similares en otros experimentos. Las estructuras cristalinas de rayos X también pueden explicar propiedades electrónicas o elásticas inusuales de un material, arrojar luz sobre interacciones y procesos químicos o servir como base para diseñar productos farmacéuticos contra enfermedades .
La cristalografía de rayos X está relacionada con muchos otros métodos para determinar estructuras atómicas. Se pueden producir patrones de difracción similares dispersando electrones o neutrones . Si no se pueden obtener cristales individuales de tamaño suficiente, se pueden aplicar otros métodos de rayos X para obtener información menos detallada; Dichos métodos incluyen difracción de fibras , difracción de polvo y (si la muestra no está cristalizada) dispersión de rayos X de ángulo pequeño (SAXS). Si el material investigado solo está disponible en forma de polvos nanocristalinos o tiene una cristalinidad deficiente, se pueden aplicar los métodos de difracción electrónica , microscopía electrónica de transmisión y cristalografía electrónica para determinar la estructura atómica.
Los cristales, aunque admirados durante mucho tiempo por su regularidad y simetría, no fueron investigados científicamente hasta el siglo XVII. Johannes Kepler planteó la hipótesis en su obra Strena seu de Nive Sexangula (Un regalo de año nuevo de nieve hexagonal) (1611) de que la simetría hexagonal de los cristales de los copos de nieve se debía a un empaquetamiento regular de partículas esféricas de agua. [1] El científico danés Nicolas Steno (1669) fue pionero en investigaciones experimentales sobre la simetría del cristal. Steno demostró que los ángulos entre las caras son los mismos en cada ejemplar de un tipo particular de cristal. [2] René Just Haüy (1784) descubrió que cada cara de un cristal se puede describir mediante simples patrones de apilamiento de bloques de la misma forma y tamaño. Por lo tanto, William Hallowes Miller en 1839 pudo darle a cada cara una etiqueta única de tres pequeños números enteros, los índices de Miller que siguen utilizándose para identificar las caras del cristal. El estudio de Haüy llevó a la idea de que los cristales son una matriz tridimensional regular (una red de Bravais ) de átomos y moléculas ; una sola celda unitaria se repite indefinidamente a lo largo de tres direcciones principales. En el siglo XIX, Johan Hessel , [3] Auguste Bravais , [4] Evgraf Fedorov , [5] Arthur Schönflies [6] y (tardíamente) William Barlow (1894 ) elaboraron un catálogo completo de las posibles simetrías de un cristal. ). Barlow propuso varias estructuras cristalinas en la década de 1880 que fueron validadas posteriormente mediante cristalografía de rayos X; [7] sin embargo, los datos disponibles eran demasiado escasos en la década de 1880 para aceptar sus modelos como concluyentes.

Wilhelm Röntgen descubrió los rayos X en 1895. [8] Los físicos no estaban seguros de la naturaleza de los rayos X, pero sospechaban que eran ondas de radiación electromagnética . La teoría de Maxwell sobre la radiación electromagnética fue bien aceptada y los experimentos de Charles Glover Barkla demostraron que los rayos X exhibían fenómenos asociados con ondas electromagnéticas, incluida la polarización transversal y líneas espectrales similares a las observadas en las longitudes de onda visibles. Barkla creó la notación de rayos X para líneas espectrales nítidas, observando en 1909 dos energías separadas, al principio nombrándolas "A" y "B" y luego suponiendo que puede haber líneas antes de "A", comenzó una numeración alfabética. comenzando con "K". [9] [10] Experimentos de rendija única en el laboratorio de Arnold Sommerfeld sugirieron que los rayos X tenían una longitud de onda de aproximadamente 1 angstrom . [11] Los rayos X no son sólo ondas, sino que también tienen propiedades de partículas, lo que hizo que Sommerfeld acuñara el nombre de Bremsstrahlung para los espectros continuos cuando se formaban cuando los electrones bombardeaban un material. [10] Albert Einstein introdujo el concepto de fotón en 1905, [12] pero no fue ampliamente aceptado hasta 1922, [13] [14] cuando Arthur Compton lo confirmó mediante la dispersión de rayos X de los electrones. [15] Las propiedades similares a las partículas de los rayos X, como la ionización de los gases, habían llevado a William Henry Bragg a argumentar en 1907 que los rayos X no eran radiación electromagnética. [16] [17] [18] [19] La visión de Bragg resultó impopular y la observación de la difracción de rayos X por Max von Laue en 1912 [20] confirmó que los rayos X son una forma de radiación electromagnética.

La idea de que los cristales pudieran usarse como rejillas de difracción de rayos X surgió en 1912 en una conversación entre Paul Peter Ewald y Max von Laue en el Jardín Inglés de Munich. Ewald había propuesto un modelo resonador de cristales para su tesis, pero este modelo no pudo validarse utilizando luz visible , ya que la longitud de onda era mucho mayor que el espacio entre los resonadores. Von Laue se dio cuenta de que se necesitaba radiación electromagnética de una longitud de onda más corta y sugirió que los rayos X podrían tener una longitud de onda comparable al espaciamiento de celdas unitarias en los cristales. Von Laue trabajó con dos técnicos, Walter Friedrich y su asistente Paul Knipping, para hacer brillar un haz de rayos X a través de un cristal de sulfato de cobre y registrar su difracción en una placa fotográfica . Después de ser revelada, la placa mostró una gran cantidad de puntos bien definidos dispuestos en un patrón de círculos que se cruzan alrededor del punto producido por el haz central. Los resultados fueron presentados a la Academia Bávara de Ciencias y Humanidades en junio de 1912 como "Interferenz-Erscheinungen bei Röntgenstrahlen" (fenómenos de interferencia en rayos X). [21] [22] Von Laue desarrolló una ley que conecta los ángulos de dispersión y el tamaño y la orientación de los espacios entre celdas unitarias en el cristal, por lo que recibió el Premio Nobel de Física en 1914. [23]

Después de la investigación pionera de Von Laue, el campo se desarrolló rápidamente, sobre todo por los físicos William Lawrence Bragg y su padre William Henry Bragg . En 1912-1913, el joven Bragg desarrolló la ley de Bragg , que conecta la dispersión con planos espaciados uniformemente dentro de un cristal. [8] [24] [25] [26] Los Braggs, padre e hijo, compartieron el Premio Nobel de Física de 1915 por su trabajo en cristalografía. Las primeras estructuras eran generalmente simples; A medida que los métodos computacionales y experimentales mejoraron durante las siguientes décadas, se hizo factible deducir posiciones atómicas confiables para disposiciones de átomos más complicadas.
Las primeras estructuras eran cristales y minerales inorgánicos simples, pero incluso éstos revelaban leyes fundamentales de la física y la química. La primera estructura de resolución atómica que se "resolvió" (es decir, se determinó) en 1914 fue la de la sal de mesa . [27] [28] [29] La distribución de electrones en la estructura de la sal de mesa mostró que los cristales no están necesariamente compuestos de moléculas unidas covalentemente y demostró la existencia de compuestos iónicos . [30] La estructura del diamante se resolvió en el mismo año, [31] [32] demostrando la disposición tetraédrica de sus enlaces químicos y mostrando que la longitud del enlace simple C-C era de aproximadamente 1,52 angstroms. Otras estructuras tempranas incluyeron cobre, [33] fluoruro de calcio (CaF 2 , también conocido como fluorita ), calcita (CaCO 3 ) y pirita (FeS 2 ) [34] en 1914; espinela (MgAl 2 O 4 ) en 1915; [35] [36] las formas rutilo y anatasa del dióxido de titanio (TiO 2 ) en 1916; [37] pirocroita (Mn(OH) 2 ) y, por extensión, brucita (Mg(OH) 2 ) en 1919. [38] [39] También en 1919, nitrato de sodio (NaNO 3 ) y dicloroyoduro de cesio (CsICl 2 ) fueron determinadas por Ralph Walter Graystone Wyckoff , y la estructura de wurtzita (ZnS hexagonal) se determinó en 1920. [40]
La estructura del grafito se resolvió en 1916 [41] mediante el método relacionado de difracción de polvo , [42] que fue desarrollado por Peter Debye y Paul Scherrer y, de forma independiente, por Albert Hull en 1917. [43] Se determinó la estructura del grafito. de difracción de monocristal en 1924 por dos grupos de forma independiente. [44] [45] Hull también utilizó el método del polvo para determinar las estructuras de varios metales, como el hierro [46] y el magnesio. [47]
La cristalografía de rayos X ha permitido comprender mejor los enlaces químicos y las interacciones no covalentes . Los estudios iniciales revelaron los radios típicos de los átomos y confirmaron muchos modelos teóricos de enlaces químicos, como el enlace tetraédrico del carbono en la estructura del diamante, [31] el enlace octaédrico de los metales observado en el hexacloroplatinato de amonio (IV), [48] y la resonancia observada en el grupo carbonato plano [34] y en moléculas aromáticas. [49] La estructura del hexametilbenceno de Kathleen Lonsdale de 1928 [50] estableció la simetría hexagonal del benceno y mostró una clara diferencia en la longitud del enlace entre los enlaces alifáticos C-C y los aromáticos C-C; Este hallazgo condujo a la idea de resonancia entre enlaces químicos, lo que tuvo profundas consecuencias para el desarrollo de la química. [51] Sus conclusiones fueron anticipadas por William Henry Bragg , quien publicó modelos de naftaleno y antraceno en 1921 basados en otras moléculas, una forma temprana de reemplazo molecular . [49] [52]
La primera estructura de un compuesto orgánico, la hexametilentetramina , se resolvió en 1923. [53] A esto le siguieron rápidamente varios estudios de diferentes ácidos grasos de cadena larga , que son un componente importante de las membranas biológicas . [54] [55] [56] [57] [58] [59] [60] [61] [62] En la década de 1930, se comenzaron a resolver las estructuras de moléculas mucho más grandes y con complejidad bidimensional. Un avance significativo fue la estructura de la ftalocianina , [63] una gran molécula plana que está estrechamente relacionada con las moléculas de porfirina importantes en biología, como el hemo , la corrina y la clorofila .
En la década de 1920, Victor Moritz Goldschmidt y más tarde Linus Pauling desarrollaron reglas para eliminar estructuras químicamente improbables y para determinar los tamaños relativos de los átomos. Estas reglas llevaron a la estructura de la brookita (1928) y a la comprensión de la estabilidad relativa de las formas rutilo , brookita y anatasa del dióxido de titanio .
La distancia entre dos átomos unidos es una medida sensible de la fuerza del enlace y su orden de enlace ; Por lo tanto, los estudios cristalográficos de rayos X han llevado al descubrimiento de tipos de enlaces aún más exóticos en la química inorgánica , como los dobles enlaces metal-metal, [64] [65] [66] los enlaces cuádruples metal-metal, [67] [ 68] [69] y enlaces de tres centros y dos electrones. [70] La cristalografía de rayos X (o, estrictamente hablando, un experimento de dispersión inelástica de Compton ) también ha proporcionado evidencia del carácter parcialmente covalente de los enlaces de hidrógeno . [71] En el campo de la química organometálica , la estructura de rayos X del ferroceno inició estudios científicos de compuestos sándwich , [72] [73] mientras que la de la sal de Zeise estimuló la investigación sobre "enlaces posteriores" y complejos metal-pi. [74] [75] [76] [77] Finalmente, la cristalografía de rayos X tuvo un papel pionero en el desarrollo de la química supramolecular , particularmente en la aclaración de las estructuras de los éteres de la corona y los principios de la química huésped-huésped .

La aplicación de la cristalografía de rayos X a la mineralogía comenzó con la estructura del granate , que fue determinada en 1924 por Menzer. En la década de 1920 se llevó a cabo un estudio cristalográfico sistemático con rayos X de los silicatos . Este estudio demostró que, a medida que se altera la relación Si / O , los cristales de silicato presentan cambios significativos en sus disposiciones atómicas. Machatschki amplió estos conocimientos a los minerales en los que el aluminio sustituye a los átomos de silicio de los silicatos. La primera aplicación de la cristalografía de rayos X a la metalurgia también se produjo a mediados de la década de 1920. [79] [80] [81] [82] [83] [84] En particular, la estructura de Linus Pauling de la aleación Mg 2 Sn [85] condujo a su teoría de la estabilidad y estructura de cristales iónicos complejos. [86] Se han analizado muchos sistemas inorgánicos y organometálicos complicados utilizando métodos monocristalinos, como fullerenos , metaloporfirinas y otros compuestos complicados. La difracción de monocristales también se utiliza en la industria farmacéutica . La base de datos estructural de Cambridge contiene más de 1.000.000 de estructuras a junio de 2019; Más del 99% de estas estructuras se determinaron mediante difracción de rayos X. [ cita necesaria ]
El 17 de octubre de 2012, el rover Curiosity en el planeta Marte, en " Rocknest ", realizó el primer análisis de difracción de rayos X del suelo marciano . Los resultados del analizador CheMin del rover revelaron la presencia de varios minerales, incluidos feldespato , piroxenos y olivino , y sugirieron que el suelo marciano en la muestra era similar a los " suelos basálticos erosionados " de los volcanes hawaianos . [78]
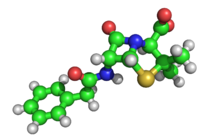
La cristalografía de rayos X de moléculas biológicas despegó con Dorothy Crowfoot Hodgkin , quien resolvió las estructuras del colesterol (1937), la penicilina (1946) y la vitamina B 12 (1956), por lo que recibió el Premio Nobel de Química en 1964. En 1969 logró resolver la estructura de la insulina , en la que trabajó durante más de treinta años. [87]

Las estructuras cristalinas de las proteínas (que son irregulares y cientos de veces más grandes que el colesterol) comenzaron a resolverse a finales de la década de 1950, comenzando con la estructura de la mioglobina del cachalote por Sir John Cowdery Kendrew , [88] por la que compartió el Premio Nobel de Medicina. Química con Max Perutz en 1962. [89] Desde ese éxito, se han determinado más de 130.000 estructuras cristalinas de rayos X de proteínas, ácidos nucleicos y otras moléculas biológicas. [90] El método competidor más cercano en número de estructuras analizadas es la espectroscopia de resonancia magnética nuclear (RMN) , que ha resuelto menos de una décima parte. [91] La cristalografía puede resolver estructuras de moléculas arbitrariamente grandes, mientras que la RMN en estado de solución está restringida a moléculas relativamente pequeñas (menos de 70 k Da ). La cristalografía de rayos X se utiliza de forma rutinaria para determinar cómo interactúa un fármaco con su proteína objetivo y qué cambios podrían mejorarlo. [92] Sin embargo, las proteínas de membrana intrínsecas siguen siendo difíciles de cristalizar porque requieren detergentes u otros desnaturalizantes para solubilizarlas de forma aislada, y dichos detergentes a menudo interfieren con la cristalización. Las proteínas de membrana son un componente importante del genoma e incluyen muchas proteínas de gran importancia fisiológica, como canales iónicos y receptores . [93] [94] Los productos criogénicos con helio se utilizan para prevenir daños por radiación en cristales de proteínas. [95]

El método más antiguo y preciso de cristalografía de rayos X es la difracción de rayos X de monocristal, en la que un haz de rayos X incide en un único cristal, produciendo haces dispersos que se registran a medida que el cristal gira gradualmente. [a] Para monocristales de suficiente pureza y regularidad, los datos de difracción de rayos X pueden determinar las longitudes y ángulos medios de los enlaces químicos con una precisión de unas pocas milésimas de angstrom y unas pocas décimas de grado , respectivamente. Los átomos de un cristal no son estáticos, sino que oscilan alrededor de sus posiciones medias, normalmente en menos de unas pocas décimas de angstrom. La cristalografía de rayos X puede medir el tamaño de estas oscilaciones.
A menudo se utilizan dos casos limitantes de cristalografía de rayos X: la cristalografía de "molécula pequeña" (que incluye sólidos inorgánicos continuos) y la cristalografía "macromolecular". La cristalografía de moléculas pequeñas normalmente involucra cristales con menos de 100 átomos en su unidad asimétrica ; Estas estructuras cristalinas suelen estar tan bien resueltas que los átomos pueden discernirse como "manchas" aisladas de densidad electrónica. Por el contrario, la cristalografía macromolecular suele implicar decenas de miles de átomos en la celda unitaria. Estas estructuras cristalinas generalmente están menos resueltas; los átomos y los enlaces químicos aparecen como tubos de densidad electrónica, en lugar de átomos aislados. En general, las moléculas pequeñas también son más fáciles de cristalizar que las macromoléculas; sin embargo, se ha demostrado que la cristalografía de rayos X es posible incluso para virus y proteínas con cientos de miles de átomos, gracias a la mejora de la tecnología y las imágenes cristalográficas. [96]
La técnica de cristalografía de rayos X monocristalina tiene tres pasos básicos. El primer paso, y a menudo el más difícil, es obtener un cristal adecuado del material en estudio. El cristal debe ser lo suficientemente grande (normalmente mayor que 0,1 mm en todas las dimensiones), de composición pura y de estructura regular, sin imperfecciones internas significativas como grietas o macladuras .
En el segundo paso, el cristal se coloca en un intenso haz de rayos X, generalmente de una sola longitud de onda ( rayos X monocromáticos ), produciendo el patrón regular de reflejos. Se miden los ángulos y las intensidades de los rayos X difractados, y cada compuesto tiene un patrón de difracción único. [97] A medida que el cristal gira gradualmente, los reflejos anteriores desaparecen y aparecen otros nuevos; la intensidad de cada punto se registra en cada orientación del cristal. Es posible que sea necesario recopilar varios conjuntos de datos, cada uno de los cuales cubre poco más de la mitad de una rotación completa del cristal y normalmente contiene decenas de miles de reflejos.
En el tercer paso, estos datos se combinan computacionalmente con información química complementaria para producir y refinar un modelo de la disposición de los átomos dentro del cristal. El modelo final y refinado de la disposición atómica (ahora llamado estructura cristalina ) generalmente se almacena en una base de datos pública.
Aunque la cristalografía se puede utilizar para caracterizar el desorden en un cristal impuro o irregular, la cristalografía generalmente requiere un cristal puro de alta regularidad para resolver la estructura de una disposición complicada de átomos. A veces se pueden obtener cristales puros y regulares a partir de materiales naturales o sintéticos, como muestras de metales, minerales u otros materiales macroscópicos. La regularidad de tales cristales a veces se puede mejorar con el recocido de cristales macromoleculares [98] [99] [100] y otros métodos. Sin embargo, en muchos casos, obtener un cristal con calidad de difracción es la principal barrera para resolver su estructura de resolución atómica. [101]
La cristalografía de moléculas pequeñas y macromoleculares difieren en la gama de posibles técnicas utilizadas para producir cristales con calidad de difracción. Las moléculas pequeñas generalmente tienen pocos grados de libertad conformacional y pueden cristalizarse mediante una amplia gama de métodos, como la deposición química de vapor y la recristalización . Por el contrario, las macromoléculas generalmente tienen muchos grados de libertad y su cristalización debe realizarse de manera que mantengan una estructura estable. Por ejemplo, las proteínas y las moléculas de ARN más grandes no pueden cristalizarse si su estructura terciaria ha sido desplegada ; por lo tanto, el rango de condiciones de cristalización está restringido a condiciones de solución en las que dichas moléculas permanecen plegadas.
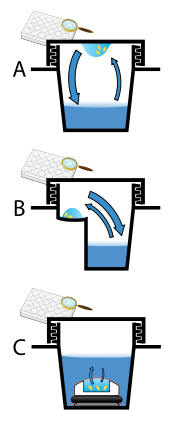
Los cristales de proteínas casi siempre se cultivan en solución. El enfoque más común es reducir muy gradualmente la solubilidad de las moléculas que la componen; si esto se hace demasiado rápido, las moléculas precipitarán de la solución, formando un polvo inútil o un gel amorfo en el fondo del recipiente. El crecimiento de cristales en solución se caracteriza por dos pasos: nucleación de un cristalito microscópico (que posiblemente tenga solo 100 moléculas), seguida del crecimiento de ese cristalito, idealmente hasta convertirlo en un cristal con calidad de difracción. [102] [103] Las condiciones de solución que favorecen el primer paso (nucleación) no siempre son las mismas condiciones que favorecen el segundo paso (crecimiento posterior). Las condiciones de la solución deberían desfavorecer el primer paso (nucleación) pero favorecer el segundo (crecimiento), de modo que solo se forme un cristal grande por gota. Si se favorece demasiado la nucleación, se formará una lluvia de pequeños cristalitos en la gota, en lugar de un cristal grande; si se favorece muy poco, no se formará ningún cristal. Otros enfoques implican la cristalización de proteínas bajo aceite, donde se dispensan soluciones acuosas de proteínas bajo aceite líquido y el agua se evapora a través de la capa de aceite. Diferentes aceites tienen diferentes permeabilidades de evaporación, por lo que producen cambios en las tasas de concentración de diferentes mezclas de percipiente/proteína. [104]
Es difícil predecir buenas condiciones para la nucleación o crecimiento de cristales bien ordenados. [105] En la práctica, las condiciones favorables se identifican mediante selección ; Se prepara un lote muy grande de moléculas y se prueba una amplia variedad de soluciones de cristalización. [106] Generalmente se prueban cientos, incluso miles, de condiciones de solución antes de encontrar la exitosa. Las diversas condiciones pueden utilizar uno o más mecanismos físicos para reducir la solubilidad de la molécula; por ejemplo, algunos pueden cambiar el pH, algunos contienen sales de la serie de Hofmeister o sustancias químicas que reducen la constante dieléctrica de la solución, y otros contienen polímeros grandes como el polietilenglicol que expulsan a la molécula de la solución mediante efectos entrópicos. También es común probar varias temperaturas para favorecer la cristalización, o bajar gradualmente la temperatura para que la solución se sobresatura. Estos métodos requieren grandes cantidades de la molécula objetivo, ya que utilizan altas concentraciones de la molécula que se va a cristalizar. Debido a la dificultad para obtener cantidades tan grandes ( miligramos ) de proteína de grado de cristalización, se han desarrollado robots que son capaces de dispensar con precisión gotas de prueba de cristalización del orden de 100 nanolitros de volumen. Esto significa que se utiliza 10 veces menos proteína por experimento en comparación con las pruebas de cristalización realizadas a mano (del orden de 1 microlitro ). [107]
Se sabe que varios factores inhiben o estropean la cristalización. Los cristales en crecimiento generalmente se mantienen a una temperatura constante y se protegen de golpes o vibraciones que puedan perturbar su cristalización. Las impurezas en las moléculas o en las soluciones de cristalización suelen ser perjudiciales para la cristalización. La flexibilidad conformacional de la molécula también tiende a hacer que la cristalización sea menos probable debido a la entropía. Las moléculas que tienden a autoensamblarse en hélices regulares a menudo no están dispuestas a ensamblarse en cristales. [ cita necesaria ] Los cristales pueden verse dañados por la macla , lo que puede ocurrir cuando una celda unitaria puede empaquetarse igualmente favorablemente en múltiples orientaciones; aunque los recientes avances en métodos computacionales pueden permitir resolver la estructura de algunos cristales maclados. Si no logra cristalizar una molécula objetivo, un cristalógrafo puede intentarlo nuevamente con una versión ligeramente modificada de la molécula; Incluso pequeños cambios en las propiedades moleculares pueden dar lugar a grandes diferencias en el comportamiento de cristalización.
El cristal se monta para realizar mediciones de manera que pueda mantenerse en el haz de rayos X y girarse. Existen varios métodos de montaje. En el pasado, los cristales se cargaban en capilares de vidrio con la solución de cristalización (el licor madre ). Hoy en día, los cristales de moléculas pequeñas suelen estar unidos con aceite o pegamento a una fibra de vidrio o a un bucle, que está hecho de nailon o plástico y unido a una varilla sólida. Los cristales de proteína se recogen mediante un asa y luego se congelan instantáneamente con nitrógeno líquido . [108] Esta congelación reduce el daño por radiación de los rayos X, así como el ruido en los picos de Bragg debido al movimiento térmico (el efecto Debye-Waller). Sin embargo, los cristales de proteínas no tratados a menudo se agrietan si se congelan rápidamente; por lo tanto, generalmente se remojan previamente en una solución crioprotectora antes de congelarlos. [109] Este remojo previo puede causar que el cristal se agriete, arruinándolo para la cristalografía. Generalmente, las criocondiciones exitosas se identifican mediante prueba y error.
El capilar o bucle se monta en un goniómetro , lo que permite colocarlo con precisión dentro del haz de rayos X y girarlo. Dado que tanto el cristal como el haz son a menudo muy pequeños, el cristal debe centrarse dentro del haz con una precisión de ~25 micrómetros, lo cual es ayudado por una cámara enfocada en el cristal. El tipo de goniómetro más común es el "goniómetro kappa", que ofrece tres ángulos de rotación: el ángulo ω, que gira alrededor de un eje perpendicular al haz; el ángulo κ, alrededor de un eje a ~50° con respecto al eje ω; y, finalmente, el ángulo φ alrededor del eje bucle/capilar. Cuando el ángulo κ es cero, los ejes ω y φ están alineados. La rotación κ permite un montaje conveniente del cristal, ya que el brazo en el que está montado el cristal puede girarse hacia el cristalógrafo. Las oscilaciones realizadas durante la recopilación de datos (mencionadas a continuación) involucran únicamente al eje ω. Un tipo más antiguo de goniómetro es el goniómetro de cuatro círculos y sus parientes, como el goniómetro de seis círculos.

Las intensidades relativas de las reflexiones proporcionan información para determinar la disposición de las moléculas dentro del cristal con detalle atómico. Las intensidades de estos reflejos pueden registrarse con una película fotográfica , un detector de área (como un detector de píxeles ) o con un sensor de imagen de dispositivo de carga acoplada (CCD). Los picos en ángulos pequeños corresponden a datos de baja resolución, mientras que los de ángulos altos representan datos de alta resolución; por lo tanto, se puede determinar un límite superior en la resolución final de la estructura a partir de las primeras imágenes. En este punto se pueden determinar algunas medidas de la calidad de la difracción, como la mosaicidad del cristal y su desorden general, como se observa en los anchos de los picos. En este punto también se pueden diagnosticar rápidamente algunas patologías del cristal que lo harían inadecuado para resolver la estructura.
Un conjunto de manchas es insuficiente para reconstruir todo el cristal; representa sólo una pequeña porción del conjunto tridimensional completo. Para recopilar toda la información necesaria, el cristal debe girarse paso a paso 180°, con una imagen grabada en cada paso; en realidad, se requieren poco más de 180° para cubrir el espacio recíproco , debido a la curvatura de la esfera de Ewald . Sin embargo, si el cristal tiene una simetría mayor, se puede registrar un rango angular más pequeño, como 90° o 45°. El eje de rotación debe cambiarse al menos una vez para evitar que se desarrolle un "punto ciego" en el espacio recíproco cercano al eje de rotación. Es habitual oscilar ligeramente el cristal (entre 0,5 y 2°) para captar una región más amplia de espacio recíproco.
Es posible que se necesiten múltiples conjuntos de datos para ciertos métodos de fases . Por ejemplo, la fase de dispersión anómala de múltiples longitudes de onda requiere que la dispersión se registre en al menos tres (y generalmente cuatro, por redundancia) longitudes de onda de la radiación de rayos X entrante. Un solo cristal puede degradarse demasiado durante la recopilación de un conjunto de datos, debido al daño por radiación; en tales casos, se deben tomar conjuntos de datos sobre múltiples cristales. [110]
La serie registrada de patrones de difracción bidimensionales, cada uno de los cuales corresponde a una orientación de cristal diferente, se convierte en un conjunto tridimensional. El procesamiento de datos comienza con la indexación de las reflexiones. Esto significa identificar las dimensiones de la celda unitaria y qué pico de imagen corresponde a qué posición en el espacio recíproco. Un subproducto de la indexación es determinar la simetría del cristal, es decir, su grupo espacial . Algunos grupos espaciales se pueden eliminar desde el principio. Por ejemplo, no se pueden observar simetrías de reflexión en moléculas quirales; por tanto, sólo se permiten 65 grupos espaciales de 230 posibles para moléculas de proteínas que casi siempre son quirales. La indexación generalmente se logra mediante una rutina de indexación automática . [111] Una vez asignada la simetría, los datos se integran . Esto convierte los cientos de imágenes que contienen miles de reflejos en un solo archivo, que consta (como mínimo) de registros del índice de Miller de cada reflejo y una intensidad para cada reflejo (en este estado, el archivo a menudo también incluye estimaciones de error). y medidas de parcialidad (qué parte de una reflexión determinada se registró en esa imagen)).
Un conjunto de datos completo puede consistir en cientos de imágenes separadas tomadas en diferentes orientaciones del cristal. Estos deben fusionarse y escalarse usando picos que aparecen en dos o más imágenes ( fusión ) y escalados para que haya una escala de intensidad consistente. Optimizar la escala de intensidad es fundamental porque la intensidad relativa de los picos es la información clave a partir de la cual se determina la estructura. La técnica repetitiva de recopilación de datos cristalográficos y la frecuentemente alta simetría de los materiales cristalinos hacen que el difractómetro registre muchas reflexiones equivalentes a simetría varias veces. Esto permite calcular el factor R relacionado con la simetría , un índice de confiabilidad basado en qué tan similares son las intensidades medidas de las reflexiones equivalentes a la simetría, [ aclaración necesaria ] evaluando así la calidad de los datos.
La intensidad de cada 'punto' de difracción es proporcional al módulo al cuadrado del factor de estructura . El factor de estructura es un número complejo que contiene información relativa tanto a la amplitud como a la fase de una onda . Para obtener un mapa de densidad electrónica interpretable , se deben conocer tanto la amplitud como la fase (un mapa de densidad electrónica permite al cristalógrafo construir un modelo inicial de la molécula). La fase no se puede registrar directamente durante un experimento de difracción: esto se conoce como problema de fase . Las estimaciones de la fase inicial se pueden obtener de diversas formas:

Una vez obtenidas las fases iniciales, se puede construir un modelo inicial. Las posiciones atómicas en el modelo y sus respectivos factores de Debye-Waller (o factores B , que representan el movimiento térmico del átomo) se pueden refinar para ajustarse a los datos de difracción observados, lo que idealmente produciría un mejor conjunto de fases. Luego se puede ajustar un nuevo modelo al nuevo mapa de densidad electrónica y se llevan a cabo sucesivas rondas de refinamiento. Este proceso iterativo continúa hasta que se maximiza la correlación entre los datos de difracción y el modelo. El acuerdo se mide mediante un factor R definido como
donde F es el factor de estructura . Un criterio de calidad similar es R libre , que se calcula a partir de un subconjunto (~10%) de reflexiones que no se incluyeron en el refinamiento de la estructura. Ambos factores R dependen de la resolución de los datos. Como regla general, R libre debe ser aproximadamente la resolución en angstroms dividida por 10; por lo tanto, un conjunto de datos con una resolución de 2 Å debería producir un R libre final de ~ 0,2. Las características de los enlaces químicos, como la estereoquímica, los enlaces de hidrógeno y la distribución de longitudes y ángulos de enlaces, son medidas complementarias de la calidad del modelo. En la construcción de modelos iterativos, es común encontrar sesgo de fase o sesgo de modelo: debido a que las estimaciones de fase provienen del modelo, cada ronda del mapa calculado tiende a mostrar densidad dondequiera que el modelo tenga densidad, independientemente de si realmente existe una densidad. Este problema se puede mitigar mediante la ponderación de máxima verosimilitud y la verificación mediante mapas de omisión . [118]
Puede que no sea posible observar todos los átomos de la unidad asimétrica. En muchos casos, el desorden cristalográfico mancha el mapa de densidad electrónica. Los átomos que se dispersan débilmente, como el hidrógeno, son habitualmente invisibles. También es posible que un solo átomo aparezca varias veces en un mapa de densidad electrónica, por ejemplo, si una cadena lateral de proteína tiene múltiples (<4) conformaciones permitidas. En otros casos, el cristalógrafo puede detectar que la estructura covalente deducida de la molécula era incorrecta o había cambiado. Por ejemplo, las proteínas pueden escindirse o sufrir modificaciones postraduccionales que no se detectaron antes de la cristalización.
Un desafío común en el refinamiento de las estructuras cristalinas resulta del desorden cristalográfico. El trastorno puede adoptar muchas formas pero en general implica la coexistencia de dos o más especies o conformaciones. No reconocer el desorden da como resultado una interpretación errónea. Los peligros de una modelización inadecuada del desorden se ilustran con la hipótesis descartada de la isomería de estiramiento de enlaces . [119] El desorden se modela con respecto a la población relativa de los componentes, a menudo sólo dos, y su identidad. En las estructuras de moléculas e iones grandes, el disolvente y los contraiones suelen estar desordenados.
El uso de métodos computacionales para el análisis de datos de difracción de rayos X en polvo está ahora generalizado. Por lo general, compara los datos experimentales con el difractograma simulado de una estructura modelo, teniendo en cuenta los parámetros instrumentales, y refina los parámetros estructurales o microestructurales del modelo utilizando un algoritmo de minimización basado en mínimos cuadrados . La mayoría de las herramientas disponibles que permiten la identificación de fases y el refinamiento estructural se basan en el método Rietveld , [120] [121] , algunas de ellas son software abierto y gratuito como FullProf Suite, [122] [123] Jana2006, [124] MAUD, [125 ] [126] [127] Rietan, [128] GSAS, [129] etc. mientras que otros están disponibles bajo licencias comerciales como Diffrac.Suite TOPAS, [130] Match!, [131] etc. La mayoría de estas herramientas también permiten Refinamiento de Le Bail (también conocido como coincidencia de perfiles), es decir, refinamiento de los parámetros de la celda en función de las posiciones de los picos de Bragg y los perfiles de los picos, sin tener en cuenta la estructura cristalográfica en sí. Herramientas más recientes permiten el refinamiento de datos tanto estructurales como microestructurales, como el programa FAULTS incluido en FullProf Suite, [132] que permite el refinamiento de estructuras con defectos planos (por ejemplo, fallas de apilamiento, hermanamientos, intercrecimientos).
Una vez finalizado el modelo de la estructura de una molécula, a menudo se deposita en una base de datos cristalográfica como la Cambridge Structural Database (para moléculas pequeñas), la Inorganic Crystal Structure Database (ICSD) (para compuestos inorgánicos) o el Protein Data Bank ( para proteínas y, a veces, ácidos nucleicos). Muchas estructuras obtenidas en empresas comerciales privadas para cristalizar proteínas de importancia medicinal no se depositan en bases de datos cristalográficas públicas.
La cristalografía a pequeña escala se puede realizar con una fuente de tubo de rayos X local , normalmente acoplada a un detector de placas de imagen . Tienen la ventaja de ser relativamente económicos y fáciles de mantener, y permiten una rápida detección y recolección de muestras. Sin embargo, la longitud de onda de la luz producida está limitada por la disponibilidad de diferentes materiales de ánodo . Además, la intensidad está limitada por la potencia aplicada y la capacidad de enfriamiento disponible para evitar que se derrita el ánodo. En tales sistemas, los electrones se desprenden de un cátodo y se aceleran a través de un fuerte potencial eléctrico de ~50 kV ; Al alcanzar una alta velocidad, los electrones chocan con una placa de metal, emitiendo bremsstrahlung y algunas fuertes líneas espectrales correspondientes a la excitación de los electrones de la capa interna del metal. El metal más comúnmente utilizado es el cobre, que se puede mantener frío fácilmente debido a su alta conductividad térmica y que produce fuertes líneas K α y K β . La línea K β a veces se suprime con una fina lámina de níquel (~10 µm). La variedad más simple y económica de tubo de rayos X sellado tiene un ánodo estacionario (el tubo de Crookes ) y funciona con ~2 kW de potencia del haz de electrones. La variedad más cara tiene una fuente de tipo ánodo giratorio que funciona con ~14 kW de potencia de haz de electrones.
Los rayos X generalmente se filtran (mediante el uso de filtros de rayos X ) a una sola longitud de onda (se hacen monocromáticas) y se coliman en una sola dirección antes de que se les permita incidir en el cristal. El filtrado no sólo simplifica el análisis de los datos, sino que también elimina la radiación que degrada el cristal sin aportar información útil. La colimación se realiza con un colimador (básicamente, un tubo largo) o con una inteligente disposición de espejos suavemente curvados. Los sistemas de espejos se prefieren para cristales pequeños (menos de 0,3 mm) o con celdas unitarias grandes (más de 150 Å).
Un desarrollo más reciente es el tubo de microenfoque , que puede ofrecer un flujo de haz al menos tan alto (después de la colimación) como las fuentes de ánodo giratorio, pero sólo requiere una potencia de haz de unas pocas decenas o cientos de vatios en lugar de varios kilovatios.
Las fuentes de radiación de sincrotrón son algunas de las fuentes de luz más brillantes de la Tierra y algunas de las herramientas más poderosas disponibles para los cristalógrafos de rayos X. Los haces de rayos X se generan en grandes máquinas llamadas sincrotrones que aceleran partículas cargadas eléctricamente, a menudo electrones, hasta casi la velocidad de la luz y las confinan en un bucle (aproximadamente) circular utilizando campos magnéticos.
Los sincrotrones son generalmente instalaciones nacionales, cada una con varias líneas de luz dedicadas donde se recopilan datos sin interrupción. Los sincrotrones fueron diseñados originalmente para ser utilizados por físicos de alta energía que estudiaban partículas subatómicas y fenómenos cósmicos . El componente más grande de cada sincrotrón es su anillo de almacenamiento de electrones. En realidad, este anillo no es un círculo perfecto, sino un polígono de muchos lados. En cada esquina del polígono o sector, imanes alineados con precisión doblan la corriente de electrones. A medida que la trayectoria de los electrones se desvía, emiten ráfagas de energía en forma de rayos X.
El uso de radiación sincrotrón frecuentemente tiene requisitos específicos para la cristalografía de rayos X. La intensa radiación ionizante puede causar daños por radiación a las muestras, particularmente a los cristales macromoleculares. La criocristalografía protege la muestra del daño por radiación al congelar el cristal a temperaturas de nitrógeno líquido (~100 K ). [133] Los métodos de criocristalografía también se aplican a fuentes domésticas de ánodos giratorios. [134] Sin embargo, la radiación de sincrotrón frecuentemente tiene la ventaja de longitudes de onda seleccionables por el usuario, lo que permite experimentos de dispersión anómala que maximizan la señal anómala. Esto es fundamental en experimentos como la dispersión anómala de una sola longitud de onda (SAD) y la dispersión anómala de múltiples longitudes de onda (MAD).
Se han desarrollado láseres de electrones libres para su uso en cristalografía de rayos X. [135] Estas son las fuentes de rayos X más brillantes disponibles actualmente; con los rayos X llegando en ráfagas de femtosegundos . La intensidad de la fuente es tal que los patrones de difracción de resolución atómica se pueden resolver para cristales que de otro modo serían demasiado pequeños para ser recolectados. Sin embargo, la intensa fuente de luz también destruye la muestra, [136] lo que requiere disparar múltiples cristales. Como cada cristal está orientado aleatoriamente en el haz, se deben recopilar cientos de miles de imágenes de difracción individuales para obtener un conjunto de datos completo. Este método, cristalografía en serie de femtosegundos , se ha utilizado para resolver la estructura de varias estructuras cristalinas de proteínas, notándose a veces diferencias con estructuras equivalentes recolectadas de fuentes de sincrotrón. [137]
Los cristales son conjuntos regulares de átomos y los rayos X son ondas electromagnéticas. Los átomos dispersan ondas de rayos X, principalmente a través de los electrones de los átomos. Así como una ola del océano que choca contra un faro produce ondas circulares secundarias que emanan del faro, un rayo X que choca contra un electrón produce ondas esféricas secundarias que emanan del electrón. Este fenómeno se conoce como dispersión elástica , y al electrón (o faro) se le conoce como dispersor . Una serie regular de dispersores produce una serie regular de ondas esféricas. Aunque estas ondas se anulan entre sí en la mayoría de las direcciones mediante interferencia destructiva , se suman constructivamente en algunas direcciones específicas.
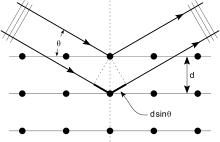
Se puede obtener una comprensión intuitiva de la difracción de rayos X a partir del modelo de difracción de Bragg . En este modelo, una reflexión dada está asociada con un conjunto de láminas espaciadas uniformemente que atraviesan el cristal, pasando generalmente por los centros de los átomos de la red cristalina. La orientación de un conjunto particular de hojas se identifica por sus tres índices de Miller ( h , k , l ) y su espaciado por d . William Lawrence Bragg propuso un modelo en el que los rayos X entrantes se dispersan especularmente (como un espejo) desde cada plano; A partir de esa suposición, los rayos X dispersados desde planos adyacentes se combinarán constructivamente ( interferencia constructiva ) cuando el ángulo θ entre el plano y los rayos X da como resultado una diferencia de longitud de trayectoria que es un múltiplo entero n de la longitud de onda de los rayos X λ. .
Se dice que una reflexión está indexada cuando sus índices de Miller (o, más correctamente, sus componentes recíprocos del vector reticular) han sido identificados a partir de la longitud de onda conocida y el ángulo de dispersión 2θ. Dicha indexación proporciona los parámetros de la celda unitaria , las longitudes y ángulos de la celda unitaria, así como su grupo espacial .

Cada patrón de difracción de rayos X representa una porción esférica de espacio recíproco, como puede verse en la construcción de la esfera de Ewald. Para un vector de onda incidente dado k 0, los únicos vectores de onda con la misma energía se encuentran en la superficie de una esfera. En el diagrama, el vector de onda k 1 se encuentra en la esfera de Ewald y también está en un vector reticular recíproco g 1 , por lo que satisface la ley de Bragg. Por el contrario, el vector de onda k 2 se diferencia del punto reticular recíproco y g 2 por el vector s , que se denomina error de excitación. Para monocristales grandes utilizados principalmente en cristalografía, sólo importa el caso de la ley de Bragg; para la difracción de electrones y algunos otros tipos de difracción de rayos X también son importantes los valores distintos de cero del error de excitación.
La dispersión de rayos X está determinada por la densidad de los electrones dentro del cristal. Dado que la energía de un rayo X es mucho mayor que la de un electrón de valencia, la dispersión puede modelarse como dispersión de Thomson , la interacción elástica de un rayo electromagnético con una partícula cargada.
La intensidad de la dispersión de Thomson para una partícula con masa m y carga elemental q es: [138]
Por tanto, los núcleos atómicos, que son mucho más pesados que un electrón, contribuyen de forma insignificante a la dispersión de los rayos X. En consecuencia, la dispersión coherente detectada en un átomo se puede aproximar con precisión analizando la dispersión colectiva de los electrones del sistema. [139]
El haz de rayos X entrante tiene polarización y debe representarse como una onda vectorial; sin embargo, para simplificar, representémosla aquí como una onda escalar. También ignoramos la complicación de la dependencia temporal de la onda y simplemente nos concentramos en la dependencia espacial de la onda. Las ondas planas se pueden representar mediante un vector de onda k en , por lo que la onda entrante en el momento t = 0 viene dada por
En la posición r dentro de la muestra, sea una densidad de dispersores f ( r ); estos dispersores producen una onda esférica dispersa de amplitud proporcional a la amplitud local de la onda entrante multiplicada por el número de dispersores en un volumen pequeño dV alrededor de r
donde S es la constante de proporcionalidad.
Considere la fracción de ondas dispersas que salen con un vector de onda saliente de k out y golpean una pantalla (detector) en r screen . Dado que no se pierde energía (dispersión elástica, no inelástica), las longitudes de onda son las mismas que las magnitudes de los vectores de onda | k en |=| k fuera |. Desde el momento en que el fotón se dispersa en r hasta que se absorbe en r pantalla , el fotón sufre un cambio de fase.
La radiación neta que llega a la pantalla r es la suma de todas las ondas dispersas por todo el cristal.
que puede escribirse como una transformada de Fourier
donde g = k out – k in es un vector reticular recíproco que satisface la ley de Bragg y la construcción de Ewald mencionada anteriormente. La intensidad medida de la reflexión será el cuadrado de esta amplitud.
Otras formas de dispersión elástica de rayos X además de la difracción monocristalina incluyen la difracción de polvo , la dispersión de rayos X de ángulo pequeño ( SAXS ) y varios tipos de difracción de fibra de rayos X , que fue utilizada por Rosalind Franklin para determinar la estructura de doble hélice. del ADN . En general, la difracción de rayos X monocristalina ofrece más información estructural que estas otras técnicas; sin embargo, requiere un cristal suficientemente grande y regular, que no siempre está disponible.
Estos métodos de dispersión generalmente utilizan rayos X monocromáticos , que están restringidos a una única longitud de onda con pequeñas desviaciones. También se puede utilizar un amplio espectro de rayos X (es decir, una combinación de rayos X con diferentes longitudes de onda) para llevar a cabo la difracción de rayos X, una técnica conocida como método de Laue. Este es el método utilizado en el descubrimiento original de la difracción de rayos X. La dispersión de Laue proporciona mucha información estructural con sólo una breve exposición al haz de rayos X y, por lo tanto, se utiliza en estudios estructurales de eventos muy rápidos ( cristalografía resuelta en el tiempo ). Sin embargo, no es tan adecuado como la dispersión monocromática para determinar la estructura atómica completa de un cristal y, por lo tanto, funciona mejor con cristales con disposiciones atómicas relativamente simples.
El modo de reflexión inversa Laue registra rayos X dispersos hacia atrás desde una fuente de amplio espectro. Esto es útil si la muestra es demasiado gruesa para que los rayos X se transmitan a través de ella. Los planos de difracción en el cristal se determinan sabiendo que la normal al plano de difracción biseca el ángulo entre el haz incidente y el haz difractado. Se puede utilizar un gráfico de Greninger [140] para interpretar la fotografía de Laue con reflexión posterior.
Debido a que interactúan a través de las fuerzas de Coulomb, la dispersión de electrones por la materia es 1000 o más veces más fuerte que la de los rayos X. Por lo tanto, los haces de electrones producen una fuerte dispersión múltiple o dinámica incluso en cristales relativamente delgados (>10 nm). Si bien existen similitudes entre la difracción de rayos X y electrones, como se puede encontrar en el libro de John M. Cowley , [141] el enfoque es diferente ya que se basa en el enfoque original de Hans Bethe [142] y resuelve Ecuación de Schrödinger para electrones relativistas , en lugar de un enfoque cinemático o de la ley de Bragg . Es posible obtener información sobre regiones muy pequeñas, hasta átomos individuales. La gama de aplicaciones para la difracción de electrones , la microscopía electrónica de transmisión y la cristalografía electrónica de transmisión con electrones de alta energía es extensa; consulte los enlaces relevantes para obtener más información y citas. Además de los métodos de transmisión, la difracción de electrones de baja energía [143] es una técnica en la que los electrones se retrodispersan de las superficies y se ha utilizado ampliamente para determinar estructuras superficiales a escala atómica, y la difracción de electrones de alta energía por reflexión es otra técnica que se utiliza ampliamente. ampliamente utilizado para monitorear el crecimiento de películas delgadas. [144]
La difracción de neutrones se utiliza para la determinación de estructuras, aunque ha sido difícil obtener haces de neutrones monocromáticos intensos en cantidades suficientes. Tradicionalmente se han utilizado reactores nucleares , aunque cada vez hay más disponibilidad de fuentes que produzcan neutrones por espalación . Al no tener carga, los neutrones se dispersan más desde los núcleos atómicos que desde los electrones. Por tanto, la dispersión de neutrones es útil para observar las posiciones de átomos ligeros con pocos electrones, especialmente el hidrógeno , que es esencialmente invisible en la difracción de rayos X. La dispersión de neutrones también tiene la propiedad de que el disolvente puede volverse invisible ajustando la proporción de agua normal, H 2 O, y agua pesada , D 2 O.
Varias mujeres fueron pioneras en la cristalografía de rayos X en una época en la que estaban excluidas de la mayoría de las demás ramas de las ciencias físicas. [145]
Kathleen Lonsdale fue estudiante de investigación de William Henry Bragg , quien tuvo 11 mujeres estudiantes de investigación de un total de 18. Es conocida tanto por su trabajo experimental como teórico. Lonsdale se unió a su equipo de investigación en cristalografía en la Royal Institution de Londres en 1923 y, tras casarse y tener hijos, volvió a trabajar con Bragg como investigador. Confirmó la estructura del anillo de benceno, realizó estudios sobre diamantes, fue una de las dos primeras mujeres elegidas para la Royal Society en 1945 y en 1949 fue nombrada la primera profesora titular de química y jefa del Departamento de Cristalografía en el University College de Londres . [146] Lonsdale siempre abogó por una mayor participación de las mujeres en la ciencia y dijo en 1970: "Cualquier país que quiera aprovechar al máximo todo su potencial científico y tecnólogo podría hacerlo, pero no debe esperar conseguir mujeres tan simplemente como atrapa a los hombres ... Es utópico, entonces, sugerir que cualquier país que realmente quiera que las mujeres casadas regresen a una carrera científica, cuando sus hijos ya no necesitan su presencia física, debería hacer arreglos especiales para alentarla a hacerlo. ¿entonces?". [147] Durante este período, Lonsdale comenzó una colaboración con William T. Astbury en un conjunto de 230 tablas de grupos espaciales que se publicó en 1924 y se convirtió en una herramienta esencial para los cristalógrafos.
.jpg/440px-Molecular_model_of_Penicillin_by_Dorothy_Hodgkin_(9663803982).jpg)
En 1932 Dorothy Hodgkin se incorporó al laboratorio del físico John Desmond Bernal, antiguo alumno de Bragg, en Cambridge, Reino Unido. Ella y Bernal tomaron las primeras fotografías de rayos X de proteínas cristalinas. Hodgkin también jugó un papel en la fundación de la Unión Internacional de Cristalografía . Recibió el Premio Nobel de Química en 1964 por su trabajo utilizando técnicas de rayos X para estudiar las estructuras de la penicilina, la insulina y la vitamina B12. Su trabajo sobre la penicilina comenzó en 1942 durante la guerra y sobre la vitamina B12 en 1948. Si bien su grupo creció lentamente, su enfoque predominante estaba en el análisis de rayos X de productos naturales. Es la única mujer británica que ha ganado un Premio Nobel en una materia científica.

Rosalind Franklin tomó la fotografía de rayos X de una fibra de ADN que resultó clave para el descubrimiento de la doble hélice por parte de James Watson y Francis Crick , por el que ambos ganaron el Premio Nobel de Fisiología o Medicina en 1962. Watson reveló en su relato autobiográfico del descubrimiento de la estructura del ADN, la doble hélice , [148] que había utilizado la fotografía de rayos X de Franklin sin su permiso. Franklin murió de cáncer cuando tenía 30 años, antes de que Watson recibiera el Premio Nobel. Franklin también llevó a cabo importantes estudios estructurales del carbono en el carbón y el grafito, y de virus vegetales y animales.
Isabella Karle, del Laboratorio de Investigación Naval de los Estados Unidos, desarrolló un enfoque experimental de la teoría matemática de la cristalografía. Su trabajo mejoró la velocidad y precisión de los análisis químicos y biomédicos. Sin embargo, sólo su marido Jerome compartió el Premio Nobel de Química de 1985 con Herbert Hauptman, "por sus destacados logros en el desarrollo de métodos directos para la determinación de estructuras cristalinas". Otros organismos que otorgan premios han colmado a Isabella de premios por derecho propio.
Las mujeres han escrito muchos libros de texto y artículos de investigación en el campo de la cristalografía de rayos X. Durante muchos años, Lonsdale editó las Tablas Internacionales de Cristalografía , que proporcionan información sobre redes cristalinas, simetría y grupos espaciales, así como datos matemáticos, físicos y químicos sobre estructuras. Olga Kennard de la Universidad de Cambridge , fundó y dirigió el Centro de Datos Cristalográficos de Cambridge , una fuente reconocida internacionalmente de datos estructurales sobre moléculas pequeñas, desde 1965 hasta 1997. Jenny Pickworth Glusker , científica británica, es coautora del Análisis de la estructura cristalina: una introducción , [149] publicado por primera vez en 1971 y a partir de 2010 en su tercera edición. Eleanor Dodson , una bióloga nacida en Australia, que comenzó como técnica de Dorothy Hodgkin, fue la principal impulsora detrás de CCP4 , el proyecto de computación colaborativa que actualmente comparte más de 250 herramientas de software con cristalógrafos de proteínas de todo el mundo.
Reimpreso en formato pdf para el XVIII Congreso de la IUCr, Glasgow, Escocia