La enfermedad de Chagas , también conocida como tripanosomiasis americana , es una enfermedad parasitaria tropical causada por Trypanosoma cruzi . Se transmite principalmente por insectos de la subfamilia Triatominae , conocidos como "vinchucas". Los síntomas cambian a lo largo de la infección. En la etapa inicial, los síntomas suelen estar ausentes o son leves, y pueden incluir fiebre, ganglios linfáticos inflamados , dolores de cabeza o hinchazón en el sitio de la picadura . [1] Después de cuatro a ocho semanas, las personas no tratadas entran en la fase crónica de la enfermedad, que en la mayoría de los casos no produce más síntomas. [2] [4] Hasta el 45% de las personas con infecciones crónicas desarrollan enfermedad cardíaca entre 10 y 30 años después de la enfermedad inicial, lo que puede provocar insuficiencia cardíaca . También pueden ocurrir complicaciones digestivas, incluido un esófago agrandado o un colon agrandado , en hasta el 21% de las personas, y hasta el 10% de las personas pueden experimentar daño a los nervios. [2]
El T. cruzi se transmite comúnmente a los humanos y otros mamíferos a través de la picadura de la vinchuca y las heces infectadas de la vinchuca. [5] La enfermedad también puede transmitirse a través de transfusiones de sangre , trasplantes de órganos , consumo de alimentos o bebidas contaminados con los parásitos y transmisión vertical (de una madre a su bebé). [1] El diagnóstico de la enfermedad temprana se realiza encontrando el parásito en la sangre usando un microscopio o detectando su ADN mediante la reacción en cadena de la polimerasa . [4] La enfermedad crónica se diagnostica encontrando anticuerpos para T. cruzi en la sangre. [6]
La prevención se centra en eliminar las vinchucas y evitar sus picaduras. [1] Esto puede implicar el uso de insecticidas o mosquiteros . [7] Otros esfuerzos preventivos incluyen el análisis de la sangre utilizada para transfusiones. Las infecciones tempranas se pueden tratar con los medicamentos benznidazol o nifurtimox , que generalmente curan la enfermedad si se administran poco después de que la persona se infecta, pero se vuelven menos efectivos cuanto más tiempo haya tenido la enfermedad de Chagas. Cuando se usa en enfermedades crónicas, la medicación puede retrasar o prevenir el desarrollo de los síntomas terminales. El benznidazol y el nifurtimox a menudo causan efectos secundarios , incluidos trastornos de la piel, irritación del sistema digestivo y síntomas neurológicos, que pueden hacer que se interrumpa el tratamiento. [2] [8] Se están desarrollando nuevos medicamentos para la enfermedad de Chagas, [9] y aunque se han estudiado vacunas experimentales en modelos animales, [10] [11] no se ha desarrollado una vacuna humana .
Se estima que 6,5 millones de personas, principalmente en México , América Central y América del Sur , padecen la enfermedad de Chagas en 2019, [1] [3] lo que resulta en aproximadamente 9490 muertes anuales. [3] La mayoría de las personas con la enfermedad son pobres , [12] y la mayoría no se da cuenta de que está infectada. [13] Las migraciones de población a gran escala han llevado la enfermedad de Chagas a nuevas regiones, que incluyen Estados Unidos y muchos países europeos. [1] La enfermedad afecta a más de 150 tipos de animales. [14]
La enfermedad fue descrita por primera vez en 1909 por el médico brasileño Carlos Chagas , de quien recibe su nombre. [1] La enfermedad de Chagas está clasificada como una enfermedad tropical desatendida . [15]

La enfermedad de Chagas se presenta en dos etapas: una etapa aguda , que se desarrolla una o dos semanas después de la picadura del insecto, y una etapa crónica , que se desarrolla durante muchos años. [2] [4] [16] La etapa aguda a menudo no presenta síntomas. [2] Cuando están presentes, los síntomas suelen ser menores y no específicos de ninguna enfermedad en particular. [4] Los signos y síntomas incluyen fiebre, malestar , dolor de cabeza y agrandamiento del hígado , el bazo y los ganglios linfáticos . [1] [2] [4] A veces, las personas desarrollan un nódulo hinchado en el sitio de la infección, que se llama " signo de Romaña " si está en el párpado, o "chagoma" si está en otra parte de la piel. [4] [17] En casos raros (menos del 1-5%), las personas infectadas desarrollan una enfermedad aguda grave, que puede implicar inflamación del músculo cardíaco , acumulación de líquido alrededor del corazón e inflamación del cerebro y los tejidos circundantes , y puede ser potencialmente mortal. La fase aguda suele durar entre cuatro y ocho semanas y se resuelve sin tratamiento. [2]
A menos que se traten con medicamentos antiparasitarios , las personas siguen infectadas con T. cruzi después de recuperarse de la fase aguda. La mayoría de las infecciones crónicas son asintomáticas, lo que se conoce como enfermedad de Chagas crónica indeterminada . Sin embargo, después de décadas de enfermedad, aproximadamente el 30-40% de las personas desarrollan disfunción orgánica ( enfermedad de Chagas crónica determinada ), que afecta con mayor frecuencia al corazón o al sistema digestivo . [2] [4]
La manifestación a largo plazo más común es la enfermedad cardíaca , que se presenta en el 14-45% de las personas con enfermedad de Chagas crónica. [2] Las personas con enfermedad cardíaca de Chagas a menudo experimentan palpitaciones cardíacas y, a veces, desmayos , debido a la función cardíaca irregular. Por electrocardiograma , las personas con enfermedad cardíaca de Chagas tienen con mayor frecuencia arritmias . A medida que la enfermedad progresa, los ventrículos del corazón se agrandan ( miocardiopatía dilatada ), lo que reduce su capacidad para bombear sangre. En muchos casos, el primer signo de la enfermedad cardíaca de Chagas es insuficiencia cardíaca , tromboembolia o dolor en el pecho asociado con anomalías en la microvasculatura . [18]
También es común en la enfermedad de Chagas crónica el daño al sistema digestivo, que afecta al 10-21% de las personas. [2] El agrandamiento del esófago o el colon son los problemas digestivos más comunes. [16] Las personas con esófago agrandado a menudo experimentan dolor ( odinofagia ) o dificultad para tragar ( disfagia ), reflujo ácido , tos y pérdida de peso. Las personas con colon agrandado a menudo experimentan estreñimiento y pueden desarrollar un bloqueo grave del intestino o su suministro de sangre . Hasta el 10% de las personas con infección crónica desarrollan daño nervioso que puede provocar entumecimiento y reflejos o movimiento alterados. [2] Si bien la enfermedad crónica generalmente se desarrolla durante décadas, algunas personas con enfermedad de Chagas (menos del 10%) progresan a daño cardíaco directamente después de la enfermedad aguda. [18]
Los signos y síntomas difieren para las personas infectadas con T. cruzi a través de vías menos comunes. Las personas infectadas a través de la ingestión de parásitos tienden a desarrollar una enfermedad grave dentro de las tres semanas posteriores al consumo, con síntomas que incluyen fiebre, vómitos , dificultad para respirar , tos y dolor en el pecho, abdomen y músculos . [2] Las personas infectadas congénitamente generalmente tienen pocos o ningún síntoma, pero pueden tener síntomas leves no específicos o síntomas graves como ictericia , dificultad respiratoria y problemas cardíacos. [2] Las personas infectadas a través de un trasplante de órganos o una transfusión de sangre tienden a tener síntomas similares a los de la enfermedad transmitida por vectores , pero los síntomas pueden no manifestarse durante una semana a cinco meses. [2] Las personas infectadas crónicamente que se inmunodeprimen debido a la infección por VIH pueden tener una enfermedad particularmente grave y distinta, caracterizada más comúnmente por inflamación en el cerebro y el tejido circundante o abscesos cerebrales . [4] Los síntomas varían ampliamente según el tamaño y la ubicación de los abscesos cerebrales, pero generalmente incluyen fiebre, dolores de cabeza, convulsiones, pérdida de sensibilidad u otros problemas neurológicos que indican sitios particulares de daño al sistema nervioso. [19] Ocasionalmente, estas personas también experimentan inflamación cardíaca aguda, lesiones cutáneas y enfermedades del estómago, intestino o peritoneo . [4]
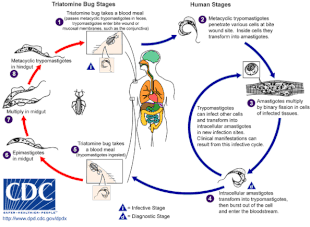
La enfermedad de Chagas es causada por una infección con el parásito protozoario T. cruzi , que generalmente se introduce en los humanos a través de la picadura de chinches triatomíneas, también llamadas "chinches besuconas". [4] Cuando el insecto defeca en el sitio de la picadura, formas móviles de T. cruzi llamadas tripomastigotes ingresan al torrente sanguíneo e invaden varias células huésped. [5] Dentro de una célula huésped, el parásito se transforma en una forma replicativa llamada amastigote, que experimenta varias rondas de replicación. [5] Los amastigotes replicados se transforman nuevamente en tripomastigotes, que rompen la célula huésped y se liberan en el torrente sanguíneo. [2] Los tripomastigotes luego se diseminan por todo el cuerpo a varios tejidos, donde invaden las células y se replican. [2] Durante muchos años, los ciclos de replicación del parásito y la respuesta inmune pueden dañar gravemente estos tejidos, en particular el corazón y el tracto digestivo. [2]

T. cruzi puede ser transmitida por varios insectos triatominos de los géneros Triatoma , Panstrongylus y Rhodnius . [2] Los principales vectores de infección humana son las especies de chinches triatominos que habitan en viviendas humanas, a saber, Triatoma infestans , Rhodnius prolixus , Triatoma dimidiata y Panstrongylus megistus . [20] Estos insectos son conocidos por varios nombres locales, incluidos vinchuca en Argentina, Bolivia, Chile y Paraguay, barbeiro (el barbero ) en Brasil, pito en Colombia, chinche en América Central y chipo en Venezuela. [21] Los insectos tienden a alimentarse de noche , prefiriendo superficies húmedas cerca de los ojos o la boca. [16] [20] Un insecto triatomino puede infectarse con T. cruzi cuando se alimenta de un huésped infectado. [16] T. cruzi se replica en el tracto intestinal del insecto y se elimina en las heces del insecto. [16] Cuando un triatomino infectado se alimenta, perfora la piel y se alimenta de sangre , defecando al mismo tiempo para hacer espacio para la nueva comida. [16] La picadura suele ser indolora, pero causa picazón. [16] Al rascarse la picadura, se introducen las heces cargadas de T. cruzi en la herida, lo que inicia la infección. [16]
Además de la propagación vectorial clásica, la enfermedad de Chagas puede transmitirse a través del consumo de alimentos o bebidas contaminadas con insectos triatominos o sus heces. [22] Dado que el calentamiento o el secado matan a los parásitos, las bebidas y especialmente los jugos de frutas son la fuente más frecuente de infección. [22] Esta ruta de transmisión oral se ha visto implicada en varios brotes, donde provocó síntomas inusualmente graves, probablemente debido a la infección con una carga parasitaria más alta que la de la picadura de un insecto triatomino— [6] [22] un solo triatomino aplastado en un alimento o bebida que alberga T cruzi puede contener alrededor de 600.000 tripomastigotes metacíclicos, mientras que la materia fecal de triatominos contiene 3.000-4.000 por μL. [23]
El T. cruzi puede transmitirse independientemente del insecto triatomino durante una transfusión de sangre, después de un trasplante de órganos o a través de la placenta durante el embarazo. [2] La transfusión con la sangre de un donante infectado infecta al receptor entre el 10 y el 25 % de las veces. [2] Para prevenir esto, las donaciones de sangre se examinan para detectar T. cruzi en muchos países con enfermedad de Chagas endémica, así como en los Estados Unidos. [6] De manera similar, el trasplante de órganos sólidos de un donante infectado puede transmitir T. cruzi al receptor. [2] Esto es especialmente cierto para el trasplante de corazón , que transmite T. cruzi entre el 75 y el 100 % de las veces, y menos para el trasplante de hígado (0-29 %) o de riñón (0-19 %). [2] Una madre infectada puede transmitir T. cruzi a su hijo a través de la placenta; esto ocurre en hasta el 15 % de los nacimientos de madres infectadas. [24] A partir de 2019, el 22,5 % de las nuevas infecciones se produjeron por transmisión congénita. [25]

En la fase aguda de la enfermedad, los signos y síntomas son causados directamente por la replicación de T. cruzi y la respuesta del sistema inmunológico a ella. [2] Durante esta fase, T. cruzi se puede encontrar en varios tejidos en todo el cuerpo y circulando en la sangre. [2] Durante las semanas iniciales de la infección, la replicación del parásito se controla mediante la producción de anticuerpos y la activación de la respuesta inflamatoria del huésped , en particular las células que se dirigen a patógenos intracelulares como las células NK y los macrófagos , impulsadas por moléculas de señalización inflamatoria como TNF-α e IFN-γ . [2]
Durante la enfermedad de Chagas crónica, el daño orgánico a largo plazo se desarrolla durante años debido a la replicación continua del parásito y al daño del sistema inmunológico. Al principio del curso de la enfermedad, T. cruzi se encuentra con frecuencia en las fibras musculares estriadas del corazón. [26] A medida que la enfermedad progresa, el corazón generalmente se agranda, con regiones sustanciales de fibra muscular cardíaca reemplazadas por tejido cicatricial y grasa . [26] Las áreas de inflamación activa están dispersas por todo el corazón, y cada una alberga células inmunes inflamatorias, típicamente macrófagos y células T. [ 26] Más tarde en la enfermedad, los parásitos rara vez se detectan en el corazón y pueden estar presentes solo en niveles muy bajos. [26]
En el corazón, el colon y el esófago, la enfermedad crónica conduce a una pérdida masiva de terminaciones nerviosas . [18] En el corazón, esto puede contribuir a arritmias y otras disfunciones cardíacas. [18] En el colon y el esófago, la pérdida del control del sistema nervioso es la principal causa de disfunción orgánica. [18] La pérdida de nervios perjudica el movimiento de los alimentos a través del tracto digestivo, lo que puede provocar el bloqueo del esófago o el colon y la restricción de su suministro de sangre. [18]

La presencia de T. cruzi en la sangre es diagnóstica de la enfermedad de Chagas. Durante la fase aguda de la infección, se puede detectar mediante el examen microscópico de sangre fresca anticoagulada , o su capa leucocítica , para parásitos móviles; o mediante la preparación de frotis de sangre delgados y gruesos teñidos con Giemsa , para la visualización directa de los parásitos. [4] [6] El examen del frotis de sangre detecta parásitos en el 34-85% de los casos. La sensibilidad aumenta si se utilizan técnicas como la centrifugación de microhematocrito para concentrar la sangre. [2] En el examen microscópico de frotis de sangre teñidos, los tripomastigotes de T. cruzi aparecen como organismos en forma de S o U con un flagelo conectado al cuerpo por una membrana ondulada. Un núcleo y una estructura más pequeña llamada kinetoplasto son visibles dentro del cuerpo del parásito; el kinetoplasto de T. cruzi es relativamente grande, lo que ayuda a distinguirlo de otras especies de tripanosomas que infectan a los humanos. [27]
Alternativamente, el ADN de T. cruzi puede detectarse mediante la reacción en cadena de la polimerasa (PCR). En la enfermedad de Chagas aguda y congénita, la PCR es más sensible que la microscopía, [25] y es más confiable que las pruebas basadas en anticuerpos para el diagnóstico de la enfermedad congénita porque no se ve afectada por la transferencia de anticuerpos contra T. cruzi de una madre a su bebé ( inmunidad pasiva ). [28] La PCR también se utiliza para monitorear los niveles de T. cruzi en receptores de trasplantes de órganos y personas inmunodeprimidas, lo que permite detectar la infección o reactivación en una etapa temprana. [2] [4] [25]
En la enfermedad de Chagas crónica, la concentración de parásitos en la sangre es demasiado baja para ser detectada de manera confiable mediante microscopía o PCR, [2] por lo que el diagnóstico generalmente se realiza mediante pruebas serológicas , que detectan anticuerpos de inmunoglobulina G contra T. cruzi en la sangre. [6] Se requieren dos resultados serológicos positivos, utilizando diferentes métodos de prueba, para confirmar el diagnóstico. [4] Si los resultados de la prueba no son concluyentes, se pueden utilizar métodos de prueba adicionales como Western blot . [2]
Existen varias pruebas de diagnóstico rápido de la enfermedad de Chagas, que son fáciles de transportar y pueden ser realizadas por personas sin formación especial. [29] Son útiles para el cribado de un gran número de personas y para realizar pruebas a personas que no pueden acceder a los centros sanitarios, pero su sensibilidad es relativamente baja [2] , y se recomienda utilizar un segundo método para confirmar un resultado positivo. [29] [30]
Los parásitos de T. cruzi pueden cultivarse a partir de muestras de sangre mediante hemocultivo , xenodiagnóstico o inoculando animales con la sangre de la persona. En el método de hemocultivo, los glóbulos rojos de la persona se separan del plasma y se añaden a un medio de crecimiento especializado para estimular la multiplicación del parásito. Puede llevar hasta seis meses obtener el resultado. El xenodiagnóstico implica alimentar a insectos triatominos con la sangre y luego examinar sus heces en busca del parásito entre 30 y 60 días después. [29] Estos métodos no se utilizan de forma rutinaria, ya que son lentos y tienen baja sensibilidad. [31] [29]

Los esfuerzos para prevenir la enfermedad de Chagas se han centrado en gran medida en el control de vectores para limitar la exposición a los insectos triatominos. Los programas de pulverización de insecticidas han sido el pilar del control de vectores, que consiste en rociar las casas y las áreas circundantes con insecticidas residuales. [32] Esto se hizo originalmente con insecticidas organoclorados , organofosforados y carbamatos , que fueron reemplazados en la década de 1980 por piretroides . [32] Estos programas han reducido drásticamente la transmisión en Brasil y Chile , [16] y han eliminado los principales vectores de ciertas regiones: Triatoma infestans de Brasil, Chile, Uruguay y partes de Perú y Paraguay , así como Rhodnius prolixus de América Central . [18] El control de vectores en algunas regiones se ha visto obstaculizado por el desarrollo de resistencia a los insecticidas entre los insectos triatominos. [32] En respuesta, los programas de control de vectores han implementado insecticidas alternativos (por ejemplo, fenitrotión y bendiocarb en Argentina y Bolivia ), tratamiento de animales domésticos (que también son alimento de los insectos triatominos) con pesticidas, pinturas impregnadas con pesticidas y otros enfoques experimentales. [32] En áreas con insectos triatominos, la transmisión de T. cruzi se puede prevenir durmiendo bajo mosquiteros y con mejoras en las viviendas que eviten que los insectos triatominos colonicen las casas. [16]
La transfusión de sangre era anteriormente el segundo modo más común de transmisión de la enfermedad de Chagas. [33] T. cruzi puede sobrevivir en sangre almacenada refrigerada y puede sobrevivir a la congelación y descongelación, lo que le permite persistir en sangre completa, glóbulos rojos concentrados , granulocitos , crioprecipitado y plaquetas . [33] El desarrollo e implementación de pruebas de detección en bancos de sangre ha reducido drásticamente el riesgo de infección durante la transfusión de sangre. [33] Casi todas las donaciones de sangre en los países latinoamericanos se someten a pruebas de detección de Chagas. [33] La detección generalizada también es común en naciones no endémicas con poblaciones significativas de inmigrantes de áreas endémicas, incluido el Reino Unido (implementado en 1999), España (2005), Estados Unidos (2007), Francia y Suecia (2009), Suiza (2012) y Bélgica (2013). [34] Las pruebas serológicas, típicamente ELISA , se utilizan para detectar anticuerpos contra las proteínas de T. cruzi en la sangre del donante. [33]
Los programas de prevención de la enfermedad de Chagas se han centrado en otros modos de transmisión. El tratamiento de las madres infectadas por T. cruzi durante el embarazo reduce el riesgo de transmisión congénita de la infección. [24] Con este fin, muchos países de América Latina han implementado pruebas de detección sistemáticas de la infección por T. cruzi en mujeres embarazadas y lactantes , y la Organización Mundial de la Salud recomienda realizar pruebas de detección a todos los niños nacidos de madres infectadas para evitar que la infección congénita se convierta en una enfermedad crónica. [1] [35] De manera similar a las transfusiones de sangre, muchos países con enfermedad de Chagas endémica examinan los órganos para trasplante con pruebas serológicas. [2]
No existe vacuna contra la enfermedad de Chagas. [8] Se han probado varias vacunas experimentales en animales infectados con T. cruzi y lograron reducir la cantidad de parásitos en la sangre y el corazón, [36] pero hasta 2016 ninguna vacuna candidata se había sometido a ensayos clínicos en humanos. [37]
.jpg/440px-NECT_treatment_(cropped).jpg)
La enfermedad de Chagas se maneja con medicamentos antiparasitarios para eliminar T. cruzi del cuerpo y tratamiento sintomático para abordar los efectos de la infección. [6] A partir de 2018, el benznidazol y el nifurtimox fueron los medicamentos antiparasitarios de elección para tratar la enfermedad de Chagas, [2] aunque el benznidazol es el único medicamento disponible en la mayor parte de América Latina. [38] Para cualquiera de los medicamentos, el tratamiento generalmente consiste en dos o tres dosis orales por día durante 60 a 90 días. [2] El tratamiento antiparasitario es más efectivo al principio del curso de la infección: elimina T. cruzi del 50 al 80% de las personas en la fase aguda (OMS: "casi el 100 %" [39] ), pero solo del 20 al 60% de las personas en la fase crónica. [6] El tratamiento de la enfermedad crónica es más efectivo en niños que en adultos, y la tasa de curación de la enfermedad congénita se acerca al 100% si se trata en el primer año de vida. [2] El tratamiento antiparasitario también puede retardar la progresión de la enfermedad y reducir la posibilidad de transmisión congénita. [1] La eliminación de T. cruzi no cura el daño cardíaco y gastrointestinal causado por la enfermedad de Chagas crónica, por lo que estas afecciones deben tratarse por separado. [6] El tratamiento antiparasitario no se recomienda para personas que ya han desarrollado miocardiopatía dilatada. [18]
El benznidazol suele considerarse el tratamiento de primera línea porque tiene efectos adversos más leves que el nifurtimox y se entiende mejor su eficacia. [2] [25] Tanto el benznidazol como el nifurtimox tienen efectos secundarios comunes que pueden hacer que se interrumpa el tratamiento. Los efectos secundarios más comunes del benznidazol son erupción cutánea, problemas digestivos, disminución del apetito , debilidad, dolor de cabeza y problemas para dormir . Estos efectos secundarios a veces se pueden tratar con antihistamínicos o corticosteroides y generalmente se revierten cuando se interrumpe el tratamiento. [2] Sin embargo, el benznidazol se interrumpe en hasta el 29% de los casos. [2] El nifurtimox tiene efectos secundarios más frecuentes, que afectan hasta al 97,5% de las personas que toman el fármaco. [2] Los efectos secundarios más comunes son pérdida de apetito, pérdida de peso, náuseas y vómitos y varios trastornos neurológicos que incluyen cambios de humor, insomnio , parestesia y neuropatía periférica . [2] El tratamiento se suspende hasta en el 75% de los casos. [2] [25] Ambos fármacos están contraindicados para su uso en mujeres embarazadas y personas con insuficiencia hepática o renal . [1] A partir de 2019, se ha reportado resistencia a estos fármacos. [38]
En la etapa crónica, el tratamiento implica controlar las manifestaciones clínicas de la enfermedad. El tratamiento de la miocardiopatía de Chagas es similar al de otras formas de enfermedad cardíaca. [2] Se pueden recetar betabloqueantes e inhibidores de la ECA , pero algunas personas con enfermedad de Chagas pueden no poder tomar la dosis estándar de estos medicamentos porque tienen presión arterial baja o frecuencia cardíaca baja . [2] [18] Para controlar los latidos cardíacos irregulares, a las personas se les pueden recetar medicamentos antiarrítmicos como amiodarona o se les puede implantar un marcapasos . [4] Se pueden usar anticoagulantes para prevenir la tromboembolia y el accidente cerebrovascular . [18] La enfermedad cardíaca crónica causada por una infección por T. cruzi no tratada es una razón común para la cirugía de trasplante cardíaco . [16] Debido a que los receptores de trasplantes toman medicamentos inmunosupresores para prevenir el rechazo de órganos , se los controla mediante PCR para detectar la reactivación de la enfermedad. Las personas con enfermedad de Chagas que se someten a un trasplante cardíaco tienen tasas de supervivencia más altas que el receptor promedio de trasplante cardíaco. [18]
La enfermedad gastrointestinal leve puede tratarse sintomáticamente, por ejemplo, utilizando laxantes para el estreñimiento o tomando un fármaco procinético como la metoclopramida antes de las comidas para aliviar los síntomas esofágicos. [4] [40] La cirugía para cortar los músculos del esfínter esofágico inferior ( cardiomiotomía ) se puede realizar en casos más graves de enfermedad esofágica, [40] y puede ser necesaria la extirpación quirúrgica de la parte afectada del órgano en casos de megacolon y megaesófago avanzados. [4] [31]


En 2019, se estimó que 6,5 millones de personas en todo el mundo padecían la enfermedad de Chagas, con aproximadamente 173.000 nuevas infecciones y 9.490 muertes cada año. [3] La enfermedad generó una carga económica anual mundial estimada en 7.200 millones de dólares en 2013, el 86% de la cual recae en los países endémicos. [34] [43] La enfermedad de Chagas provoca la pérdida de más de 800.000 años de vida ajustados por discapacidad cada año. [2]
El área endémica de la enfermedad de Chagas se extiende desde el sur de los Estados Unidos hasta el norte de Chile y Argentina, y Bolivia (6,1%), Argentina (3,6%) y Paraguay (2,1%) presentan la prevalencia más alta de la enfermedad. [2] Dentro de América Latina continental, la enfermedad de Chagas es endémica en 21 países: Argentina, Belice, Bolivia, Brasil, Chile, Colombia, Costa Rica, Ecuador, El Salvador, Guayana Francesa, Guatemala, Guyana, Honduras, México, Nicaragua, Panamá, Paraguay, Perú, Surinam, Uruguay y Venezuela. [1] [2] En las zonas endémicas, debido en gran medida a los esfuerzos de control de vectores y el cribado de las donaciones de sangre, las infecciones y muertes anuales han disminuido en un 67% y más del 73% respectivamente desde sus picos en la década de 1980 hasta 2010. [2] [44] La transmisión por insectos vectores y transfusión de sangre se ha interrumpido completamente en Uruguay (1997), Chile (1999) y Brasil (2006), [44] y en Argentina, la transmisión vectorial se había interrumpido en 13 de las 19 provincias endémicas hasta 2001. [45] Durante la crisis humanitaria de Venezuela , la transmisión vectorial ha comenzado a ocurrir en áreas donde anteriormente se había interrumpido, y las tasas de seroprevalencia de la enfermedad de Chagas han aumentado. [46] Las tasas de transmisión también han aumentado en la región del Gran Chaco debido a la resistencia a los insecticidas y en la cuenca del Amazonas debido a la transmisión oral. [2]
Si bien la tasa de enfermedad de Chagas transmitida por vectores ha disminuido en la mayor parte de América Latina, la tasa de enfermedad de transmisión oral ha aumentado, posiblemente debido a la creciente urbanización y deforestación que acercan a las personas a los triatominos y alteran la distribución de las especies de triatominos. [22] [47] [48] La enfermedad de Chagas transmitida por vía oral es motivo de especial preocupación en Venezuela, donde se han registrado 16 brotes entre 2007 y 2018. [46]
Chagas existe en dos zonas ecológicas diferentes. En la región del Cono Sur , el vector principal vive dentro y alrededor de las casas humanas. En América Central y México, la principal especie vectora vive tanto dentro de las viviendas como en áreas deshabitadas. En ambas zonas, Chagas ocurre casi exclusivamente en áreas rurales, donde T. cruzi también circula en animales salvajes y domésticos. [49] T. cruzi infecta comúnmente a más de 100 especies de mamíferos en América Latina, incluyendo zarigüeyas ( Didelphis spp.), [50] armadillos , titíes , murciélagos , varios roedores [51] y perros [50] todos los cuales pueden ser infectados por los vectores o por vía oral al comer insectos triatominos y otros animales infectados. [51] [50] Para los animales entomófagos este es un modo común. [50] Didelphis spp. son únicos en el sentido de que no requieren del triatomino para la transmisión, completando el ciclo de vida a través de su propia orina y heces. [50] La transmisión veterinaria también ocurre a través de transmisión vertical a través de la placenta, transfusión de sangre y trasplantes de órganos . [50]
Aunque tradicionalmente se considera que la enfermedad de Chagas es una enfermedad de las zonas rurales de América Latina, la migración internacional ha dispersado a quienes la padecen a numerosos países no endémicos, principalmente en América del Norte y Europa. [1] [34] En 2020, aproximadamente 300 000 personas infectadas viven en los Estados Unidos, [52] y en 2018 se estimó que entre 30 000 y 40 000 personas en los Estados Unidos tenían miocardiopatía de Chagas. [18] La gran mayoría de los casos en los Estados Unidos ocurren en inmigrantes de América Latina , [18] [25] pero la transmisión local es posible. Once especies de triatominos son nativas de los Estados Unidos, y algunos estados del sur tienen ciclos persistentes de transmisión de la enfermedad entre insectos vectores y reservorios animales, [2] [25] que incluyen ratas de bosque, zarigüeyas, mapaches , armadillos y zorrillos . [53] Sin embargo, la infección adquirida localmente es muy rara: solo se documentaron 28 casos entre 1955 y 2015. [2] [52] En 2013, el costo del tratamiento en los Estados Unidos se estimó en 900 millones de dólares anuales (costo global de 7 mil millones de dólares), que incluía hospitalización y dispositivos médicos como marcapasos. [43]
En 2019, la enfermedad de Chagas afectaba aproximadamente a entre 68 000 y 123 000 personas en Europa. [54] España, que tiene una alta tasa de inmigración procedente de América Latina, tiene la prevalencia más alta de la enfermedad. Se estima que entre 50 000 y 70 000 personas en España viven con la enfermedad de Chagas, lo que representa la mayoría de los casos europeos. [55] La prevalencia varía ampliamente dentro de los países europeos debido a los diferentes patrones de inmigración. [54] Italia tiene la segunda prevalencia más alta, seguida de los Países Bajos, el Reino Unido y Alemania. [55]

Es probable que T. cruzi circulara en mamíferos sudamericanos mucho antes de la llegada de los humanos al continente. [56] T. cruzi se ha detectado en restos humanos antiguos en toda Sudamérica, desde una momia Chinchorro de 9000 años de antigüedad en el desierto de Atacama , hasta restos de varias edades en Minas Gerais , hasta una momia de 1100 años tan al norte como el desierto de Chihuahua cerca del Río Grande . [56] Muchos de los primeros relatos escritos describen síntomas consistentes con la enfermedad de Chagas, con descripciones tempranas de la enfermedad a veces atribuidas a Miguel Díaz Pimenta (1707), Luís Gomes Ferreira (1735) y Theodoro JH Langgaard (1842). [56]
La descripción formal de la enfermedad de Chagas fue hecha por Carlos Chagas en 1909 después de examinar a una niña de dos años con fiebre, ganglios linfáticos inflamados y bazo e hígado agrandados. [56] Al examinar su sangre, Chagas vio tripanosomas idénticos a los que había identificado recientemente en el intestino posterior de los insectos triatominos y nombró Trypanosoma cruzi en honor a su mentor, el médico brasileño Oswaldo Cruz . [56] Envió chinches triatominos infectadas a Cruz en Río de Janeiro , quien demostró que la picadura del triatomino infectado también podía transmitir T. cruzi a los monos tití . [56] En solo dos años, 1908 y 1909, Chagas publicó descripciones de la enfermedad, el organismo que la causaba y el insecto vector necesario para la infección. [57] [58] [59] Casi inmediatamente después, por sugerencia de Miguel Couto , entonces profesor de la Facultad de Medicina de Río de Janeiro , la enfermedad fue ampliamente conocida como "enfermedad de Chagas". [57] El descubrimiento de Chagas le trajo renombre nacional e internacional, pero al destacar las deficiencias de la respuesta del gobierno brasileño a la enfermedad, Chagas atrajo críticas hacia sí mismo y hacia la enfermedad que llevaba su nombre, sofocando la investigación sobre su descubrimiento y probablemente frustrando su nominación para el Premio Nobel en 1921. [57] [60]
En la década de 1930, Salvador Mazza reavivó la investigación sobre la enfermedad de Chagas, describiendo más de mil casos en la provincia argentina del Chaco . [56] En Argentina, la enfermedad se conoce como mal de Chagas-Mazza en su honor. [61] Las pruebas serológicas para la enfermedad de Chagas se introdujeron en la década de 1940, demostrando que la infección por T. cruzi estaba muy extendida en América Latina. [56] Esto, combinado con los éxitos en la eliminación del vector de la malaria mediante el uso de insecticidas, estimuló la creación de campañas de salud pública centradas en el tratamiento de las casas con insecticidas para erradicar los insectos triatominos. [32] [56] La década de 1950 vio el descubrimiento de que el tratamiento de la sangre con violeta de cristal podía erradicar el parásito, lo que llevó a su uso generalizado en programas de detección de transfusiones en América Latina. [56] Los programas de control a gran escala comenzaron a tomar forma en la década de 1960, primero en São Paulo , luego en varios lugares de Argentina, luego programas a nivel nacional en América Latina. [62] Estos programas recibieron un impulso importante en la década de 1980 con la introducción de insecticidas piretroides, que no dejaban manchas ni olores después de la aplicación y eran más duraderos y rentables. [56] [62] Los organismos regionales dedicados al control de la enfermedad de Chagas surgieron con el apoyo de la Organización Panamericana de la Salud , con la Iniciativa del Cono Sur para la Eliminación de la Enfermedad de Chagas lanzada en 1991, seguida por la Iniciativa de los países Andinos (1997), la Iniciativa de los países centroamericanos (1997) y la Iniciativa de los países amazónicos (2004). [32]
El fexinidazol , un fármaco antiparasitario aprobado para el tratamiento de la tripanosomiasis africana, ha mostrado actividad contra la enfermedad de Chagas en modelos animales. A partir de 2019, se encuentra en ensayos clínicos de fase II para la enfermedad de Chagas crónica en España. [38] [63] Otros fármacos candidatos incluyen GNF6702 , un inhibidor del proteasoma que es eficaz contra la enfermedad de Chagas en ratones y se encuentra en estudios preliminares de toxicidad, y AN4169, que ha tenido resultados prometedores en modelos animales. [11] [64]
Se han probado varias vacunas experimentales en animales. Además de las vacunas de subunidades , algunos enfoques han implicado la vacunación con parásitos atenuados de T. cruzi u organismos que expresan algunos de los mismos antígenos que T. cruzi pero que no causan enfermedades humanas, como Trypanosoma rangeli o Phytomonas serpens . También se ha explorado la vacunación con ADN . A partir de 2019, la investigación sobre vacunas se ha limitado principalmente a modelos de animales pequeños. [10]
A partir de 2018, las pruebas diagnósticas estándar para la enfermedad de Chagas tenían una capacidad limitada para medir la efectividad del tratamiento antiparasitario, ya que las pruebas serológicas pueden permanecer positivas durante años después de que T. cruzi se elimina del cuerpo, y la PCR puede dar resultados falsos negativos cuando la concentración del parásito en la sangre es baja. Se están investigando varios biomarcadores potenciales de la respuesta al tratamiento, como los inmunoensayos contra antígenos específicos de T. cruzi , las pruebas de citometría de flujo para detectar anticuerpos contra diferentes etapas de vida de T. cruzi y los marcadores de cambios fisiológicos causados por el parásito, como alteraciones en la coagulación y el metabolismo de los lípidos . [18]
Otra área de investigación es el uso de biomarcadores para predecir la progresión de la enfermedad crónica. Se han estudiado los niveles séricos del factor de necrosis tumoral alfa , el péptido natriurético cerebral y auricular y la enzima convertidora de angiotensina 2 como indicadores del pronóstico de la miocardiopatía chagásica. [65]
El antígeno de fase aguda liberado por T. cruzi (SAPA), que se puede detectar en sangre mediante ELISA o Western blot, [24] se ha utilizado como indicador de infección aguda y congénita temprana. [65] Se ha desarrollado un ensayo para antígenos de T. cruzi en orina para diagnosticar enfermedades congénitas. [24]