Química bioortogonal
[15] Inauguró el campo de la química bioortogonal como la primera reacción con grupos funcionales completamente abióticos, aunque ya no se usa tanto.
Se ha demostrado que las azidas son biocompatibles en medicamentos aprobados por la FDA, como la azidotimidina, y mediante otros usos como reticuladores.
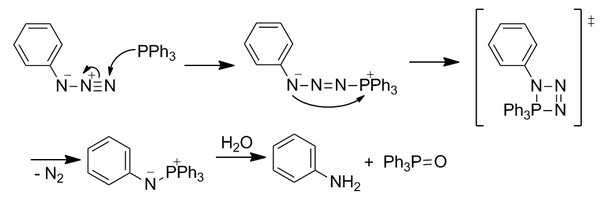
Sin embargo, esta reacción no es inmediatamente bioortogonal porque la hidrólisis rompe el enlace covalente en la aza-ilida.
La ilida reacciona con la trampa electrofílica del éster mediante ciclización intramolecular para formar un anillo de cinco miembros.
Se han desarrollado ligandos para prevenir el daño a las biomoléculas y facilitar su eliminación en aplicaciones in vitro.
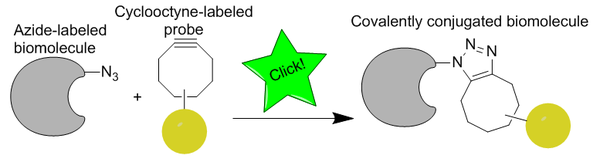
[17] El grupo azida es especialmente bioortogonal porque es extremadamente pequeño (favorable para la permeabilidad celular y evita perturbaciones), metabólicamente estable y no existe de forma natural en las células, por lo que no tiene reacciones secundarias biológicas competidoras.
[18] El alquino no es tan pequeño, pero todavía tiene la estabilidad y la ortogonalidad necesarias para el marcaje in vivo .
Sin embargo, era poco soluble en agua y la cinética apenas mejoró con respecto a la ligadura de Staudinger.
El ALO (octino sin arilo) se desarrolló para mejorar la solubilidad en agua, pero aún tenía una cinética deficiente.
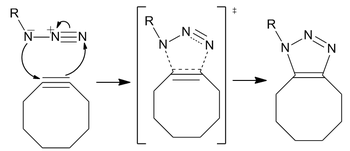
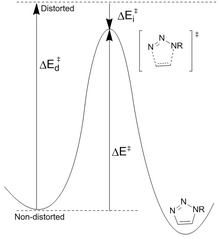
Se propuso que la sustitución de biarilo aumenta la tensión del anillo y proporciona conjugación con el alquino para mejorar la reactividad.
La BARAC (biarilazaciclooctinona) añadió un enlace amida que agrega un centro similar a sp2 para aumentar la velocidad por distorsión.
La BARAC tiene suficiente velocidad (y sensibilidad) en la medida en que no es necesario lavar el exceso de sonda para reducir el fondo.
Aunque la BARAC es extremadamente útil, su baja estabilidad requiere que se almacene a 0 °C, protegido de la luz y el oxígeno.
Keto-DIBO, en el que el grupo hidroxilo se ha convertido en una cetona, tiene un aumento de tres veces en la velocidad debido a un cambio en la conformación del anillo.
Los problemas con DIFO con estudios en ratones in vivo ilustran la dificultad de producir reacciones bioortogonales.
Aunque DIFO fue extremadamente reactivo en el marcaje de células, se desempeñó deficientemente en estudios con ratones debido a la unión con la albúmina sérica.
La hidrofobicidad del ciclooctino promueve el secuestro por membranas y proteínas séricas, reduciendo las concentraciones biodisponibles.
Los grupos atractores de electrones, como el flúor, aumentan la velocidad al disminuir la energía LUMO y la brecha HOMO-LUMO.
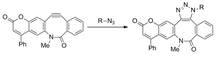
[24] Los ciclooctinos simétricos como BCN (biciclo[6.1.0]nonyne) forman un solo regioisómero tras la cicloadición[26] y pueden servir para abordar este problema en el futuro.
Los ciclooctinos enmascarados no pueden reaccionar con azidas en la oscuridad, pero se vuelven alquinos reactivos tras la irradiación con luz.
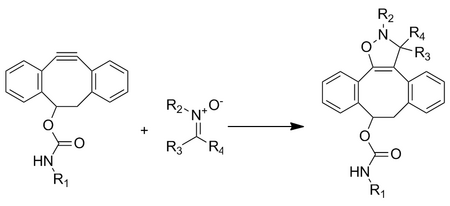
Aunque la reacción es extremadamente rápida, enfrenta problemas para incorporar la nitrona en biomoléculas a través del marcaje metabólico.
Las cicloadiciones dipolares 1,3 se han desarrollado como una reacción bioortogonal utilizando un óxido de nitrilo como dipolo 1,3 y un norborneno como dipolarófilo.
[34] Los norbornenos se seleccionaron como dipolarófilos debido a su equilibrio entre la reactividad y la estabilidad promovidas por cepas.
[36] Más recientemente, se describió el uso de un oxanorbornadieno en una reacción "iClick" a temperatura ambiente sin catalizador, en la que un aminoácido modelo se une a la fracción metálica, en un enfoque novedoso de las reacciones bioortogonales.
[12] La reacción procede con una cicloadición inicial [4+1] seguida de una reversión para eliminar un sumidero termodinámico y evitar la reversibilidad.
El isocianuro es un reportero químico favorecido debido a su pequeño tamaño, estabilidad, no toxicidad y ausencia en sistemas de mamíferos.
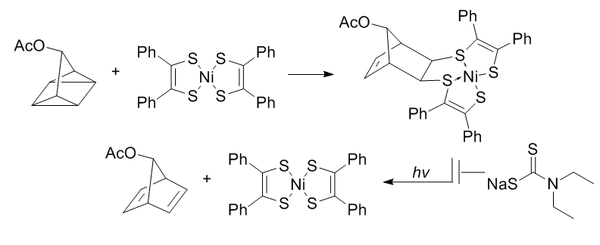
[13] El cuadriciclano es abiótico, no reactivo con biomoléculas (debido a su completa saturación), relativamente pequeño y altamente tenso (~80 kcal/mol).
Es capaz de reaccionar selectivamente con sistemas π pobres en electrones, pero no con alquenos simples, alquinos o ciclooctinos.
Para evitar la reversión a norbornadieno inducida por la luz, se añade dietilditiocarbamato para quelar el níquel del producto.
La química bioortogonal es una herramienta atractiva para experimentos de orientación previa en imágenes nucleares y radioterapia.