Cicloadición 1,3-dipolar
[4] Las siguientes observaciones apoyan el mecanismo pericíclico concertado, y refutan la biradical por etapas.
Ya se ha explicado anteriormente que es un 1,3-dipolo (una molécula que forma un dipolo eléctrico a nivel molecular por deslocalización electrónica de 4 electrones en un sistema π a lo largo de 3 átomos).
Ambos productos, isoxazolinas e isoxazoles, pueden ser escindidos por hidrogenación del enlace N-O para revelar la reacción aldólica de tipo β-hidroxicarbonilo o productos β-dicarbonilo de tipo Claisen, respectivamente.
Los dipolarofilos que contienen heteroátomos, como los carbonilos e iminas, también pueden sufrir cicloadición 1,3-dipolar.
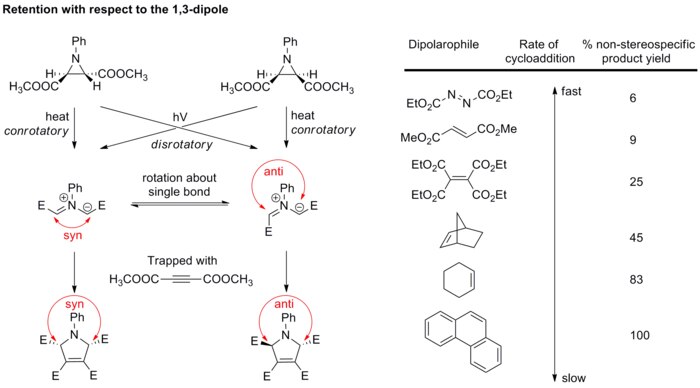
Como se ha mencionado antes, hay muchos ejemplos que muestran que estas reacciones pueden ser por etapas, por lo tanto, pueden presentar en esos casos una estereoespecificidad parcial o ninguna.
Si nos centramos en el dipolarófilo (concretamente en los alquenos), éste retiene la configuración cis/trans cuando se forma el ciclo como se aprecia en la siguiente figura:[16] En general, la estereoquímica del dipolo no es motivo de gran preocupación porque solo unos pocos dipolos podrían tener centros estereogénicos, y las estructuras de resonancia permiten la rotación de enlaces, lo que rompe la estereoquímica.
Así, la cicloadición da la sustitución en la posición C-3 regioselectiva (en la figura los números en rojo son los localizadores del anillo de pirazolina).
En la cicloadición de Diels-Alder, generalmente se observa la endo diastereoselectividad debida a interacciones orbitales secundarias.
Desafortunadamente, estas dos fuerzas a menudo se cancelan entre sí, causando una mala diastereoselección en la cicloadición 1,3-dipolar.
A continuación se muestran ejemplos de cicloadiciones diastereoselectivas 1,3-dipolares controladas por sustrato.