Autocatálisis
Esta ecuación se generaliza fácilmente a cualquier cantidad de reactivos, productos y reacciones.
Lejos del equilibrio, las velocidades de reacción directa e inversa ya no se equilibran y la concentración de reactivos y productos ya no es constante.
[2] Las reacciones autocatalíticas son aquellas en las que al menos uno de los productos es un reactivo.
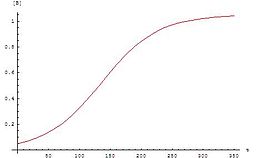
Si la concentración de un reactivo o producto en un experimento sigue una curva sigmoidea, la reacción puede ser autocatalítica.
Debe haber al menos algo de ácido presente inicialmente para iniciar el mecanismo catalizado; si no, la reacción debe comenzar por un camino alternativo no catalizado que generalmente es más lento.
Las ecuaciones anteriores para el mecanismo catalizado implicarían que la concentración del producto ácido permanece cero para siempre.
Sin embargo, hay muchos casos en los que los sistemas físicos se vuelven emergentes u ordenados espontáneamente.
Algunas reacciones autocatalíticas también generan orden en un sistema a expensas de su entorno.
Por ejemplo, (reacciones reloj) tienen intermedios cuyas concentraciones oscilan en el tiempo, correspondiente al orden temporal.
La transición al orden a medida que aumenta la distancia desde el equilibrio no suele ser continua.
El umbral entre el trastorno del equilibrio químico y el orden se conoce como transición de fase.
Una reacción química no puede oscilar sobre una posición de equilibrio final porque la segunda ley de la termodinámica requiere que un sistema termodinámico se acerque al equilibrio y no retroceda.
con las ecuaciones de velocidad Aquí, hemos descuidado el agotamiento del reactivo A, ya que su concentración es muy grande.
Tales oscilaciones son una forma de orden temporal emergente que no está presente en equilibrio.
En cambio, después de un tiempo suficiente, las oscilaciones se acercan a un ciclo límite.
[6] Otro sistema autocatalítico es uno impulsado por luz acoplada a reacciones de fotopolimerización.
La retroalimentación positiva puede expresarse como:[7] Observando que la tasa de fotopolimerización es proporcional a la intensidad[8] y que el índice de refracción es proporcional al peso molecular,[9] la retroalimentación positiva entre intensidad y fotopolimerización establece el comportamiento autocatalítico.
Se ha demostrado que la autocatálisis óptica da como resultado la formación de patrones espontáneos en fotopolímeros.
El resultado es un nuevo sistema que combina el comportamiento óptico autocatalítico con la descomposición espinodal.
La reacción de glucólisis global involucra glucosa, ADP, NAD, piruvato, ATP y NADH.
Las cantidades iniciales de reactivos determinan la distancia desde un equilibrio químico del sistema.
Cuanto mayores sean las concentraciones iniciales, más lejos está el sistema del equilibrio.
A medida que aumenta la concentración inicial, se produce un cambio brusco en el orden.
Las derivaciones generalmente se basan en una aproximación de la teoría del campo medio a las ecuaciones dinámicas microscópicas.
Esto se ha propuesto como un paso importante en el origen de la homoquiralidad biológica.
[15] En 1995, Stuart Kauffman propuso que la vida surgió inicialmente como redes químicas autocatalíticas.
[16] El etólogo británico Richard Dawkins escribió sobre la autocatálisis como una posible explicación para la abiogénesis en su libro de 2004 The Ancestor's Tale.
Cita experimentos realizados por Julius Rebek y sus colegas en el Instituto de Investigación Scripps en California, en los que combinaron amino adenosina y éster de pentafluorofenilo con el autocatalizador amino adenosina triacid éster (AATE).
Dos investigadores que han enfatizado su papel en los orígenes de la vida son Robert Ulanowicz[18] y Stuart Kauffman.
En última instancia, el metabolismo biológico mismo puede verse como un vasto conjunto autocatalítico, ya que todos los componentes moleculares de una célula biológica se producen por reacciones que involucran a este mismo conjunto de moléculas.