El síndrome de Lesch-Nyhan ( LNS ) es un trastorno hereditario poco frecuente causado por una deficiencia de la enzima hipoxantina-guanina fosforribosiltransferasa (HGPRT). Esta deficiencia se produce debido a mutaciones en el gen HPRT1 ubicado en el cromosoma X. El LNS afecta a aproximadamente 1 de cada 380.000 nacidos vivos. [3] El trastorno fue reconocido y caracterizado clínicamente por primera vez por el estudiante de medicina estadounidense Michael Lesch y su mentor, el pediatra William Nyhan , en Johns Hopkins . [4]
La deficiencia de HGPRT provoca una acumulación de ácido úrico en todos los fluidos corporales. La combinación de una mayor síntesis y una menor utilización de purinas conduce a altos niveles de producción de ácido úrico. Esto da como resultado niveles altos de ácido úrico en la sangre y la orina , asociados con gota grave y problemas renales. Los signos neurológicos incluyen un control muscular deficiente y una discapacidad intelectual moderada . Estas complicaciones suelen aparecer en el primer año de vida. A partir del segundo año de vida, una característica particularmente llamativa del LNS son las conductas de automutilación , caracterizadas por morderse los labios y los dedos. Los síntomas neurológicos incluyen muecas faciales, retorcimientos involuntarios y movimientos repetitivos de los brazos y las piernas similares a los observados en la enfermedad de Huntington . La causa de las anomalías neurológicas sigue siendo desconocida. Debido a que la falta de HGPRT hace que el cuerpo utilice mal la vitamina B 12 , algunos varones pueden desarrollar anemia megaloblástica . [5]
El síndrome de Lennox se hereda de forma recesiva ligada al cromosoma X ; la mutación genética suele ser portada por la madre y transmitida a su hijo, aunque un tercio de todos los casos surgen de novo (de nuevas mutaciones) y no tienen antecedentes familiares. El síndrome de Lennox está presente al nacer en los bebés varones. La mayoría de las personas con esta deficiencia, aunque no todas, tienen graves problemas mentales y físicos a lo largo de la vida. Los casos en mujeres son muy raros. [6]
Los síntomas provocados por la acumulación de ácido úrico ( síntomas de gota y renales ) responden bien al tratamiento con medicamentos como el alopurinol , que reducen los niveles de ácido úrico en la sangre. Los déficits mentales y la conducta autolesiva no responden bien al tratamiento. No existe cura, pero muchas personas afectadas llegan a la edad adulta. Varios tratamientos experimentales nuevos pueden aliviar los síntomas.
El síndrome de Leishmania se caracteriza por tres características principales: disfunción neurológica , alteraciones cognitivas y conductuales , incluida la automutilación, y sobreproducción de ácido úrico ( hiperuricemia ). El daño a los ganglios basales hace que los individuos afectados adopten una postura característica de esgrima debido a la naturaleza de la lesión. Algunos también pueden tener anemia macrocítica [7] debido a la síntesis defectuosa de ADN, muy probablemente debido a la síntesis deficiente de purina que conduce a un retraso de la división celular con respecto al aumento de la masa celular. [8] [9] Prácticamente todos los pacientes son varones; los varones experimentan retraso en el crecimiento y la pubertad , y la mayoría desarrolla testículos encogidos o atrofia testicular . Las mujeres portadoras tienen un mayor riesgo de artritis gotosa , pero por lo demás no suelen verse afectadas. [2]
Uno de los primeros síntomas de la enfermedad es la presencia de cristales de ácido úrico similares a arena en los pañales del bebé afectado. La sobreproducción de ácido úrico puede conducir al desarrollo de cristales de ácido úrico o cálculos en los riñones , uréteres o vejiga . Dichos cristales depositados en las articulaciones más adelante en la enfermedad pueden producir artritis similar a la gota , con hinchazón y dolor. La sobreproducción de ácido úrico está presente al nacer, pero puede no ser reconocida por los métodos de prueba de laboratorio clínico de rutina. La concentración sérica de ácido úrico suele ser normal, ya que el exceso de purinas se elimina rápidamente en la orina. Los cristales suelen aparecer como un material granulado de color naranja, o pueden fusionarse para formar múltiples cálculos diminutos o cálculos grandes separados que son difíciles de eliminar. Los cálculos, o piedras, suelen causar hematuria (sangre en la orina) y aumentan el riesgo de infección del tracto urinario . Algunas personas afectadas tienen daño renal debido a dichos cálculos renales . Los cálculos pueden ser la característica de presentación de la enfermedad, pero pueden pasar desapercibidos durante meses o incluso años. [10]
Los períodos previos y posteriores al nacimiento suelen ser normales en las personas con LNS. Las características de presentación más comunes son una disminución anormal del tono muscular ( hipotonía ) y un retraso en el desarrollo, que son evidentes entre los tres y seis meses de edad. Las personas afectadas tardan en sentarse, mientras que la mayoría nunca gatea ni camina . [11]
La irritabilidad se nota con mayor frecuencia junto con los primeros signos de deterioro del sistema nervioso. Durante los primeros años de vida, la afectación extrapiramidal causa contracciones musculares involuntarias anormales, como pérdida del control motor ( distonía ), movimientos de contorsión ( coreoatetosis ) y arqueamiento de la columna vertebral ( opistótonos ). También se presentan signos de afectación del sistema piramidal , que incluyen espasticidad, reflejos hiperactivos ( hiperreflexia ) y reflejos plantares extensores . [12] La semejanza con la parálisis cerebral atetoide es evidente en los aspectos neurológicos del LNS. Como resultado, a la mayoría de las personas se les diagnostica inicialmente parálisis cerebral. La discapacidad motora es tan extensa que la mayoría de las personas nunca caminan y se convierten en usuarios de sillas de ruedas de por vida. [13]
Las personas afectadas presentan deterioro cognitivo y alteraciones del comportamiento que aparecen entre los dos y tres años de edad. La autolesión incontrolable asociada con el síndrome de Lennox-Neon también suele comenzar a los tres años de edad. La autolesión comienza con morderse los labios y la lengua; a medida que la enfermedad progresa, los individuos afectados con frecuencia desarrollan mordeduras en los dedos y golpes en la cabeza. [14] La autolesión puede aumentar en momentos de estrés. La autolesión es una característica distintiva de la enfermedad y es evidente en el 85% de los varones afectados. [15]
La mayoría de las personas presentan deterioro cognitivo, lo que a veces es difícil de distinguir de otros síntomas debido a los trastornos de conducta y los déficits motores asociados con el síndrome. En muchos sentidos, las conductas pueden verse como una extensión psicológica de la compulsión de provocarse autolesiones, e incluyen rechazar golosinas o viajes deseados, devolver la amabilidad con frialdad o rabia, no responder correctamente a las preguntas de los exámenes a pesar de estudiar y tener el deseo de aprobar, y provocar la ira de los cuidadores cuando se desea afecto. [15]
También se presentan conductas compulsivas, como agresividad, vómitos , escupitajos y coprolalia (palabrotas involuntarias). El desarrollo de este tipo de conducta a veces se observa durante el primer año o en la primera infancia, pero otras personas pueden no desarrollarla hasta más adelante en la vida. [16]
Aunque las mujeres portadoras son generalmente asintomáticas , sí experimentan un aumento en la excreción de ácido úrico y algunas pueden desarrollar síntomas de hiperuricemia y sufrir gota en sus últimos años. La prueba en este contexto no tiene consecuencias clínicas, pero puede revelar la posibilidad de transmitir el rasgo a los hijos varones. Las mujeres también pueden requerir pruebas si un hijo varón desarrolla LNS. En este caso, una prueba negativa significa que la enfermedad del hijo es el resultado de una nueva mutación y el riesgo en los hermanos no aumenta. [17]
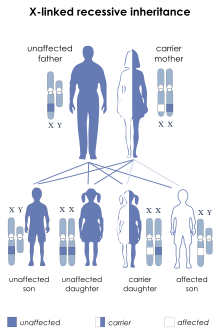
Las mujeres que portan una copia del gen defectuoso son portadoras y tienen un 50% de posibilidades de transmitir la enfermedad a sus hijos. Para que una mujer esté afectada, necesitaría tener dos copias del gen mutado, una de las cuales sería heredada de su padre. Los hombres afectados con LNS no suelen tener hijos debido a los efectos debilitantes de la enfermedad. Es posible que una mujer herede un cromosoma X de su padre no afectado, que porta una nueva mutación del gen HGPRT. En estas circunstancias, una niña podría nacer con LNS y, aunque hay algunos informes de que esto sucede, es muy raro. La abrumadora mayoría de los pacientes con LNS son varones. [ cita requerida ]
Una enfermedad relacionada menos grave, la deficiencia parcial de HPRT, se conoce como síndrome de Kelley-Seegmiller (el síndrome de Lesch-Nyhan implica una deficiencia total de HPRT). Los síntomas generalmente implican una menor afectación neurológica, pero la enfermedad aún causa gota y cálculos renales. [18]
El síndrome de Lyme se debe a mutaciones en el gen HPRT1 , [3] [19] llamado así porque codifica la enzima hipoxantina-guanina fosforribosiltransferasa (HPRT o HGPRT, EC 2.4.2.8). Esta enzima está involucrada en las vías bioquímicas que el cuerpo utiliza para producir purinas , uno de los componentes del ADN y el ARN . Los defectos de esta enzima conducen a un aumento de la producción de ácido úrico . Dado que el gen HPRT se encuentra en el cromosoma X , el síndrome de Lyme es una enfermedad hereditaria ligada al cromosoma X. [ cita requerida ]
El padre de un varón afectado no será portador del alelo mutante y no padecerá la enfermedad. Una portadora obligada sería una mujer que tiene un hijo afectado y otro pariente afectado en la línea materna. [ cita requerida ]
Si una mujer es la primera en su familia con un hijo afectado, la regla de Haldane predice una probabilidad de 2/3 de que ella sea portadora y una probabilidad de 1/3 de que el hijo tenga una nueva mutación de línea germinal . [ cita requerida ]
El riesgo para los hermanos de un individuo afectado depende del estado de portadora de la propia madre. Se le da un 50% de probabilidad a cualquier mujer portadora de transmitir la mutación HPRT1 en cada embarazo . Los hijos que hereden la mutación serán afectados mientras que las hijas que hereden la mutación serán portadoras. Por lo tanto, con cada embarazo, una mujer portadora tiene un 25% de probabilidad de tener un varón afectado, un 25% de probabilidad de tener una mujer portadora y un 50% de probabilidad de tener un varón o una mujer normales. [ cita requerida ]
Los varones con LNS no se reproducen debido a las características de la enfermedad. Sin embargo, si un varón con un fenotipo menos severo se reproduce, todas sus hijas serán portadoras y ninguno de sus hijos se verá afectado. [ cita requerida ]

Como en otras enfermedades ligadas al cromosoma X , los varones se ven afectados porque sólo tienen una copia del cromosoma X. En el síndrome de Lesch-Nyhan, el gen defectuoso es el de la hipoxantina-guanina fosforribosiltransferasa (HGPRT), un participante en el "reciclaje" de los nucleótidos de purina . Las mujeres portadoras tienen un segundo cromosoma X, que contiene una copia "normal" de HPRT, lo que evita que se desarrolle la enfermedad, aunque pueden tener un mayor riesgo de hiperuricemia. [ cita requerida ]
Se conocen numerosas mutaciones de HPRT. Las mutaciones que sólo reducen levemente la función de la enzima normalmente no causan la forma grave de LNS, pero sí producen una forma más leve de la enfermedad que aún presenta una sobreproducción de purinas acompañada de susceptibilidad a la gota y a la nefrolitiasis por ácido úrico . [ cita requerida ]
La formación del ADN (durante la división celular ) requiere nucleótidos , moléculas que son los componentes básicos del ADN. Las bases púricas ( adenina y guanina ) y las bases pirimidínicas ( timina y citosina ) se unen a la desoxirribosa y al fosfato y se incorporan según sea necesario. Normalmente, los nucleótidos se sintetizan de novo a partir de aminoácidos y otros precursores. Sin embargo, una pequeña parte se "recicla" a partir del ADN degradado de las células descompuestas. Esto se denomina "vía de recuperación". [ cita requerida ]
La HGPRT es la "enzima de rescate" de las purinas: canaliza la hipoxantina y la guanina de nuevo hacia la síntesis de ADN. La falla de esta enzima tiene dos resultados: [ cita requerida ]
Hasta ahora no estaba claro si las anomalías neurológicas en el sistema nervioso central se debían a la neurotoxicidad del ácido úrico o a una escasez relativa de nucleótidos de purina "nuevos" durante los pasos esenciales de la síntesis. Las mutaciones genéticas que afectan a las enzimas de la vía de síntesis de novo pueden contribuir a la enfermedad, aunque son poco frecuentes o desconocidas. Se ha sugerido que el ácido úrico es una posible causa de la neurotoxicidad, pero esto no está demostrado. [ cita requerida ]
Es importante destacar que la evidencia sugiere que una o más lesiones en las vías dopaminérgicas estriatales pueden ser centrales para los déficits neurológicos, especialmente la discinesia coreoatetoide y la automutilación. [20] [21] [22] La toxicidad de 6-hidroxidopamina en roedores puede ser un modelo animal útil para el síndrome, aunque esto no está demostrado. [23] Sin embargo, el vínculo entre la dopamina y la síntesis de purina es un nucleótido llamado guanosina trifosfato o "GTP". El primer paso de la síntesis de dopamina es la GTP ciclohidrolasa , y significativamente una deficiencia de este paso produce un síndrome que tiene una neuropatología similar al LNS. Por lo tanto, una falta de HGPRT puede producir un trastorno por deficiencia de nucleótidos (específicamente: deficiencia de GTP), lo que resulta en deficiencia de dopamina. [24]
Se ha propuesto que otro modelo animal para el síndrome de Liang se origina a partir del daño oxidativo, causado por la hiperuricemia que acompaña al síndrome de Liang. Esto se basa en la teoría de que el ácido úrico es un poderoso agente reductor y probablemente un importante antioxidante humano , en alta concentración en la sangre. Por lo tanto, se ha sugerido que los radicales libres , el estrés oxidativo y las especies reactivas de oxígeno pueden desempeñar algún papel en la neuropatología del síndrome de Liang. [22] [25] [26] [ se necesita una fuente no primaria ]
Sin embargo, algunas evidencias sugieren que el ácido úrico no tiene ningún papel en la neuropatología del síndrome de Lesch-Nyhan:
De manera similar, el ácido úrico no penetra bien la barrera hematoencefálica. Sin embargo, ahora se cree que el estrés oxidativo debido al ácido úrico influye en el síndrome metabólico , la aterosclerosis y el accidente cerebrovascular , todos síndromes asociados con niveles altos de ácido úrico. De manera similar, la superóxido dismutasa ("SOD") y los miméticos de la SOD como TEMPOL mejoran los efectos de la hiperuricemia. Asimismo, la 6-hidroxidopamina (el supuesto modelo animal para la neuropatía de Lesch-Nyhan) aparentemente actúa como una neurotoxina mediante la generación de especies reactivas de oxígeno. Puede ser que el estrés oxidativo inducido por alguna otra oxipurina como la xantina cause la enfermedad. [ cita requerida ]
Cuando un individuo afectado ha desarrollado completamente los tres elementos clínicos de sobreproducción de ácido úrico, disfunción neurológica y alteraciones cognitivas y conductuales, el diagnóstico de LNS se realiza fácilmente. El diagnóstico es menos fácil en las primeras etapas, cuando las tres características aún no son obvias. Los signos de comportamiento autolesivo (SIB), los resultados del análisis de pedigrí y la nueva biología molecular con pruebas genéticas (llamada tríada diagnóstica para LNS), a menudo confirman el diagnóstico. [28] La sospecha a menudo surge cuando el retraso del desarrollo del individuo está asociado con hiperuricemia. De lo contrario, el diagnóstico debe alegarse cuando el retraso del desarrollo está asociado con cálculos renales ( nefrolitiasis ) o sangre en la orina ( hematuria ), causados por cálculos de ácido úrico. En su mayor parte, el síndrome de Lesch-Nyhan se sospecha por primera vez cuando se desarrolla un comportamiento de lesión autoinfligida. Sin embargo, las conductas autolesivas ocurren en otras condiciones, incluyendo discapacidad intelectual no específica , autismo , síndrome de Rett , síndrome de Cornelia de Lange , síndrome de Tourette , disautonomía familiar , coreoacantocitosis , neuropatía sensorial incluyendo neuropatía sensorial hereditaria tipo 1, y varias condiciones psiquiátricas. De estos, solo los individuos con síndrome de Lesch-Nyhan, síndrome de Lange y disautonomía familiar muestran recurrentemente pérdida de tejido como consecuencia. Morderse los dedos y los labios es una característica definitiva del síndrome de Lesch-Nyhan; en otros síndromes asociados con la autolesión, las conductas generalmente consisten en golpes de cabeza y automutilación no específica, pero no morderse las mejillas, los labios y los dedos. El síndrome de Lesch-Nyhan debe considerarse claramente solo cuando la conducta autolesiva se presenta junto con hiperuricemia y disfunción neurológica. [29]
La relación de concentración de urato a creatinina (producto de degradación del fosfato de creatina en el músculo) en la orina está elevada. Este es un buen indicador de sobreproducción de ácido. En los niños menores de diez años con LNS, se encuentra típicamente una relación de urato a creatinina superior a dos. La excreción de urato en veinticuatro horas de más de 20 mg/kg también es típica, pero no es diagnóstica . A menudo hay hiperuricemia (concentración de ácido úrico sérico de >8 mg/dl) pero no es lo suficientemente confiable para el diagnóstico. La actividad de la enzima HGPRT en células de cualquier tipo de tejido (p. ej., sangre , fibroblastos cultivados o linfoblastos ) que sea inferior al 1,5 % de la actividad enzimática normal confirma el diagnóstico de síndrome de Lesch-Nyhan. Los estudios genéticos moleculares de las mutaciones del gen HPRT pueden confirmar el diagnóstico y son particularmente útiles para las "pruebas de portadores" posteriores en mujeres en riesgo, como parientes cercanos del lado femenino. [ cita requerida ]
El uso de pruebas bioquímicas para la detección de portadores es técnicamente exigente y no se utiliza a menudo. Los análisis bioquímicos que se han realizado en bulbos pilosos de mujeres en riesgo han tenido un pequeño número de resultados tanto falsos positivos como falsos negativos. Si solo se dispone de una mujer sospechosa de ser portadora para la prueba de mutación, puede ser adecuado cultivar sus linfocitos en 6-tioguanina (un análogo de la purina ), que permite que solo sobrevivan las células deficientes en HGPRT. Se encuentra una frecuencia de mutantes de 0,5–5,0 × 10 −2 en mujeres portadoras, mientras que en una mujer no portadora tiene una frecuencia de 1–20 × 10 −6 . Esta frecuencia suele ser diagnóstica por sí sola. [ cita requerida ]
Las pruebas genéticas moleculares son el método de prueba más eficaz, ya que HPRT1 es el único gen conocido que está asociado con el síndrome de Lesch-Nyhan. Todos los individuos que muestran el fenotipo completo de Lesch-Nyhan tienen mutaciones en el gen HPRT1. El análisis de secuencia de ARNm está disponible clínicamente y se puede utilizar para detectar mutaciones de HPRT1 en varones afectados por el síndrome de Lesch-Nyhan. Las técnicas como RT-PCR, PCR genómica multiplex y análisis de secuencia (ADNc y ADN genómico), utilizadas para el diagnóstico de enfermedades genéticas, se realizan con fines de investigación. Si las pruebas RT-PCR dan como resultado que el ADNc muestra la ausencia de un exón o exones completos, entonces se realiza una prueba de PCR genómica multiplex. La prueba de PCR genómica multiplex amplifica los nueve exones del gen HPRT1 como ocho productos de PCR. Si se elimina el exón en cuestión, la banda correspondiente faltará en la PCR multiplex. Sin embargo, si el exón está presente, se lo secuencia para identificar la mutación, lo que provoca la exclusión del exón del ADNc. Si no se crea ADNc mediante RT-PCR, se realiza una PCR multiplex con la idea de que la mayor parte o la totalidad del gen se elimina. [ cita requerida ]
El tratamiento del síndrome neurológico lisérgico es sintomático. La gota se puede tratar con alopurinol para controlar las cantidades excesivas de ácido úrico . Los cálculos renales se pueden tratar con litotricia , una técnica para romper los cálculos renales mediante ondas de choque o rayos láser. No existe un tratamiento estándar para los síntomas neurológicos del síndrome neurológico lisérgico. Algunos pueden aliviarse con los medicamentos carbidopa / levodopa , diazepam , fenobarbital o haloperidol . [5]
Es esencial controlar la sobreproducción de ácido úrico para reducir el riesgo de nefropatía , nefrolitiasis y artritis gotosa. El fármaco alopurinol se utiliza para detener la conversión de oxipurinas en ácido úrico y prevenir el desarrollo de tofos artríticos posteriores (producidos después de tener gota crónica), cálculos renales y nefropatía , la enfermedad renal resultante. El alopurinol se toma por vía oral, en una dosis típica de 3 a 20 mg/kg por día. Luego, la dosis se ajusta para reducir el nivel de ácido úrico al rango normal (<3 mg/dl). La mayoría de las personas afectadas pueden ser tratadas con alopurinol durante toda la vida. [ cita requerida ]
Ningún medicamento es eficaz para controlar las características motoras extrapiramidales de la enfermedad. Sin embargo, la espasticidad se puede reducir mediante la administración de baclofeno o benzodiazepinas . [ cita requerida ]
Hasta ahora no ha habido ningún método eficaz de tratamiento para los aspectos neuroconductuales de la enfermedad. Incluso los niños tratados desde el nacimiento con alopurinol desarrollan problemas conductuales y neurológicos, a pesar de que nunca han tenido altas concentraciones séricas de ácido úrico. La autolesión y otros comportamientos se manejan mejor con una combinación de intervenciones médicas, físicas y conductuales. La automutilación a menudo se reduce mediante el uso de sujeciones. El sesenta por ciento de las personas se extraen los dientes [ cita requerida ] para evitar la autolesión, lo que las familias han descubierto que es una técnica de manejo eficaz. [ cita requerida ] Debido a que el estrés aumenta la autolesión, el manejo conductual a través de técnicas aversivas (que normalmente reducirían la autolesión) en realidad aumenta la autolesión en personas con LNS. Casi todas las personas afectadas necesitan sujeciones para prevenir la autolesión, y se las sujeta más del 75% del tiempo. Esto a menudo es por su propia solicitud, y ocasionalmente implica sujeciones que parecerían ser ineficaces, ya que no previenen físicamente la mordedura. Las familias informan que las personas afectadas se sienten más cómodas cuando están sujetas. [ cita requerida ]
El Centro Médico y Educativo Matheny Matheny | Una organización sin fines de lucro para personas con necesidades especiales en Peapack, Nueva Jersey, tiene [ ¿cuándo? ] seis pacientes con síndrome de Lesch-Nyhan, se cree que es la mayor concentración de casos de LNS en una ubicación, y es reconocido como la principal fuente de información sobre temas de atención.
El tratamiento para pacientes con síndrome de Down, según el Dr. Gary E. Eddey, director médico [ aclaración necesaria ] , debe incluir: 1) uso juicioso de dispositivos de protección; 2) utilización de una técnica conductual comúnmente conocida como "ignorancia selectiva" con redirección de actividades; y 3) uso ocasional de medicamentos. [ cita requerida ]
Un artículo publicado en la edición del 13 de agosto de 2007 de la revista The New Yorker , escrito por Richard Preston , analiza la " estimulación cerebral profunda " como un posible tratamiento. El Dr. Takaomi Taira la ha realizado en unos pocos pacientes con síndrome de Lesch-Nyhan en Tokio y un grupo en Francia dirigido por el Dr. Philippe Coubes. Algunos pacientes experimentaron una disminución de los síntomas espásticos de autolesión. La técnica se desarrolló para tratar a personas con enfermedad de Parkinson , según Preston, hace más de 20 años. El tratamiento implica una cirugía invasiva para colocar cables que transportan una corriente eléctrica continua en una región específica del cerebro. [30]
Un avance alentador en el tratamiento de los aspectos neuroconductuales del síndrome neurológico leve fue la publicación en la edición de octubre de 2006 del Journal of Inherited Metabolic Disease de una terapia experimental que administraba S-adenosil-metionina (SAMe) por vía oral. [31] Este fármaco es un precursor de nucleótidos que proporciona una purina de fácil absorción, que se sabe que se transporta a través de la barrera hematoencefálica . Se ha demostrado que la administración de SAMe a pacientes adultos con síndrome neurológico leve mejora los atributos neuroconductuales y otros atributos neurológicos. El fármaco está disponible sin receta y se ha utilizado ampliamente para la depresión , pero su uso para tratar el síndrome neurológico leve debe realizarse solo bajo estricta supervisión médica, ya que se conocen los efectos secundarios. [ cita requerida ]
El pronóstico para las personas con síndrome nefrótico grave es malo. La muerte suele deberse a insuficiencia renal o complicaciones de la hipotonía, en la primera o segunda década de la vida. Las formas menos graves tienen un mejor pronóstico. [5]
Michael Lesch era un estudiante de medicina en Johns Hopkins y William Nyhan , un pediatra y genetista bioquímico, fue su mentor cuando ambos identificaron el LNS y su hiperuricemia asociada en dos hermanos afectados, de 4 y 8 años. [32] Lesch y Nyhan publicaron sus hallazgos en 1964. [33] En tres años, J. Edwin Seegmiller y sus colegas del NIH identificaron la causa metabólica . [34]