El monóxido de carbono ( fórmula química CO ) es un gas venenoso e inflamable, incoloro, inodoro, insípido y ligeramente menos denso que el aire. El monóxido de carbono está formado por un átomo de carbono y un átomo de oxígeno conectados por un triple enlace . Es el óxido de carbono más simple . En los complejos de coordinación , el ligando de monóxido de carbono se denomina carbonilo . Es un ingrediente clave en muchos procesos de la química industrial. [5]
La fuente más común de monóxido de carbono es la combustión parcial de compuestos que contienen carbono. Numerosas fuentes ambientales y biológicas generan monóxido de carbono. En la industria, el monóxido de carbono es importante en la producción de muchos compuestos, incluidos medicamentos, fragancias y combustibles. [6] Al emitirse a la atmósfera, el monóxido de carbono afecta a varios procesos que contribuyen al cambio climático . [7]
El CO en espacios interiores es uno de los contaminantes más tóxicos que afectan la calidad del aire en espacios interiores . El CO puede emitirse a partir del humo del tabaco y generarse a partir de estufas que queman combustible (madera, queroseno, gas natural, propano) y sistemas de calefacción que queman combustible (madera, petróleo, gas natural) que no funcionan correctamente, y a partir de conductos de humos bloqueados conectados a estos aparatos. [8] La intoxicación por monóxido de carbono es el tipo más común de intoxicación atmosférica mortal en muchos países. [9] [8] [10]
El monóxido de carbono tiene importantes funciones biológicas en todos los reinos filogenéticos. Es producido por muchos organismos, incluidos los humanos. En la fisiología de los mamíferos, el monóxido de carbono es un ejemplo clásico de hormesis , en la que las concentraciones bajas actúan como neurotransmisor endógeno ( gasotransmisor ) y las concentraciones altas son tóxicas , lo que provoca intoxicación por monóxido de carbono . Es isoelectrónico tanto con el anión cianuro CN − como con el nitrógeno molecular N 2 .
El monóxido de carbono es el oxocarbono más simple y es isoelectrónico con otras especies diatómicas triplemente enlazadas que poseen 10 electrones de valencia, incluyendo el anión cianuro , el catión nitrosonio , el monofluoruro de boro y el nitrógeno molecular . Tiene una masa molar de 28,0, lo que, según la ley de los gases ideales , lo hace ligeramente menos denso que el aire, cuya masa molar promedio es 28,8.
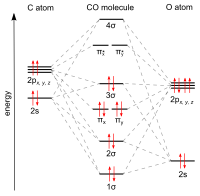
El carbono y el oxígeno están conectados por un triple enlace que consiste en dos enlaces pi netos y un enlace sigma . La longitud del enlace entre el átomo de carbono y el átomo de oxígeno es de 112,8 pm . [11] [12] Esta longitud de enlace es consistente con un triple enlace, como en el nitrógeno molecular (N 2 ), que tiene una longitud de enlace similar (109,76 pm) y casi la misma masa molecular . Los dobles enlaces carbono-oxígeno son significativamente más largos, 120,8 pm en formaldehído , por ejemplo. [13] El punto de ebullición (82 K) y el punto de fusión (68 K) son muy similares a los del N 2 (77 K y 63 K, respectivamente). La energía de disociación de enlace de 1072 kJ/mol es más fuerte que la del N 2 (942 kJ/mol) y representa el enlace químico más fuerte conocido. [14]
El estado electrónico fundamental del monóxido de carbono es un estado singlete [15] ya que no hay electrones desapareados.
La fuerza del enlace CO en el monóxido de carbono está indicada por la alta frecuencia de su vibración, 2143 cm -1 . [18] A modo de comparación, los carbonilos orgánicos como las cetonas y los ésteres absorben alrededor de 1700 cm -1 .
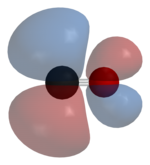
El carbono y el oxígeno juntos tienen un total de 10 electrones en la capa de valencia . Siguiendo la regla del octeto tanto para el carbono como para el oxígeno, los dos átomos forman un triple enlace , con seis electrones compartidos en tres orbitales moleculares de enlace, en lugar del doble enlace habitual que se encuentra en los compuestos carbonílicos orgánicos. Dado que cuatro de los electrones compartidos provienen del átomo de oxígeno y solo dos del carbono, un orbital de enlace está ocupado por dos electrones del oxígeno, formando un enlace dativo o dipolar . Esto provoca una polarización C←O de la molécula, con una pequeña carga negativa en el carbono y una pequeña carga positiva en el oxígeno. Los otros dos orbitales de enlace están ocupados cada uno por un electrón del carbono y uno del oxígeno, formando enlaces covalentes (polares) con una polarización C→O inversa, ya que el oxígeno es más electronegativo que el carbono. En la molécula de monóxido de carbono libre, una carga negativa neta δ – permanece en el extremo del carbono y la molécula tiene un pequeño momento dipolar de 0,122 D. [19]
La molécula es por tanto asimétrica: el oxígeno es más denso en electrones que el carbono y además tiene una carga ligeramente positiva, mientras que el carbono tiene una carga negativa.

El monóxido de carbono tiene un orden de enlace fraccionario calculado de 2,6, lo que indica que el "tercer" enlace es importante pero constituye algo menos que un enlace completo. [20] Por lo tanto, en términos de enlace de valencia, – C≡O + es la estructura más importante, mientras que :C=O no es un octeto, pero tiene una carga formal neutra en cada átomo y representa el segundo contribuyente de resonancia más importante. Debido al par solitario y la divalencia del carbono en esta estructura de resonancia, el monóxido de carbono a menudo se considera un carbeno extraordinariamente estabilizado . [21] Los isocianuros son compuestos en los que el O se reemplaza por un grupo NR (R = alquilo o arilo) y tienen un esquema de enlace similar.
Si el monóxido de carbono actúa como ligando , la polaridad del dipolo puede invertirse con una carga negativa neta en el extremo del oxígeno, dependiendo de la estructura del complejo de coordinación . [22] Véase también la sección "Química de coordinación" a continuación.
Estudios teóricos y experimentales muestran que, a pesar de la mayor electronegatividad del oxígeno, el momento dipolar apunta desde el extremo más negativo del carbono hacia el extremo más positivo del oxígeno. [23] [24] Los tres enlaces son, de hecho, enlaces covalentes polares que están fuertemente polarizados. La polarización calculada hacia el átomo de oxígeno es del 71% para el enlace σ y del 77% para ambos enlaces π . [25]
El estado de oxidación del carbono en el monóxido de carbono es +2 en cada una de estas estructuras. Se calcula contando todos los electrones enlazantes como pertenecientes al oxígeno, que es más electronegativo. Solo los dos electrones no enlazantes del carbono se asignan al carbono. En este recuento, el carbono tiene solo dos electrones de valencia en la molécula, en comparación con los cuatro del átomo libre.
El monóxido de carbono se produce en diversos entornos naturales y artificiales. La degradación fotoquímica de la materia vegetal, por ejemplo, genera unas 60 millones de toneladas al año. [27] Las concentraciones típicas en partes por millón son las siguientes:

El monóxido de carbono (CO) está presente en pequeñas cantidades (alrededor de 80 ppb ) en la atmósfera de la Tierra . La mayor parte del resto proviene de reacciones químicas con compuestos orgánicos emitidos por actividades humanas y de orígenes naturales debido a reacciones fotoquímicas en la troposfera que generan alrededor de 5 × 10 12 kilogramos por año. [35] Otras fuentes naturales de CO incluyen volcanes, incendios forestales y forestales , y otras formas diversas de combustión como combustibles fósiles . [36] También se emiten pequeñas cantidades del océano y de la actividad geológica porque el monóxido de carbono se presenta disuelto en roca volcánica fundida a altas presiones en el manto de la Tierra . [37] Debido a que las fuentes naturales de monóxido de carbono varían de un año a otro, es difícil medir con precisión las emisiones naturales del gas.
El monóxido de carbono tiene un efecto indirecto en el forzamiento radiativo al elevar las concentraciones de gases de efecto invernadero directos , incluidos el metano y el ozono troposférico . El CO puede reaccionar químicamente con otros componentes atmosféricos (principalmente el radical hidroxilo , • OH) que de otro modo destruirían el metano. [38] A través de procesos naturales en la atmósfera, se oxida a dióxido de carbono y ozono. El monóxido de carbono tiene una vida corta en la atmósfera (con una vida media de alrededor de uno a dos meses) y una concentración espacialmente variable. [39]
Debido a su larga vida útil en la troposfera media, el monóxido de carbono también se utiliza como trazador de columnas contaminantes. [40]
Más allá de la Tierra, el monóxido de carbono es la segunda molécula diatómica más común en el medio interestelar , después del hidrógeno molecular . Debido a su asimetría, esta molécula polar produce líneas espectrales mucho más brillantes que la molécula de hidrógeno, lo que hace que el CO sea mucho más fácil de detectar. El CO interestelar se detectó por primera vez con radiotelescopios en 1970. Ahora es el trazador más comúnmente utilizado de gas molecular en general en el medio interestelar de las galaxias, ya que el hidrógeno molecular solo se puede detectar utilizando luz ultravioleta, lo que requiere telescopios espaciales . Las observaciones de monóxido de carbono proporcionan gran parte de la información sobre las nubes moleculares en las que se forman la mayoría de las estrellas . [41] [42]
Beta Pictoris , la segunda estrella más brillante de la constelación de Pictor , muestra un exceso de emisión infrarroja en comparación con las estrellas normales de su tipo, lo cual es causado por grandes cantidades de polvo y gas (incluido monóxido de carbono) [43] [44] cerca de la estrella.
En la atmósfera de Venus, el monóxido de carbono se produce como resultado de la fotodisociación del dióxido de carbono por la radiación electromagnética de longitudes de onda inferiores a 169 nm . También se ha identificado espectroscópicamente en la superficie de la luna Tritón de Neptuno . [45]
El monóxido de carbono sólido es un componente de los cometas . [46] El componente volátil o "hielo" del cometa Halley es aproximadamente un 15% de CO. [47] A temperatura ambiente y a presión atmosférica, el monóxido de carbono en realidad solo es metaestable (ver reacción de Boudouard ) y lo mismo es cierto a bajas temperaturas donde el CO y el CO
2Son sólidos, pero pueden existir durante miles de millones de años en los cometas. Hay muy poco CO en la atmósfera de Plutón , que parece haberse formado a partir de cometas. Esto puede deberse a que hay (o había) agua líquida en el interior de Plutón.
El monóxido de carbono puede reaccionar con el agua para formar dióxido de carbono e hidrógeno:
Esta reacción se denomina reacción de desplazamiento de agua a gas cuando se produce en fase gaseosa, pero también puede producirse (muy lentamente) en una solución acuosa. Si la presión parcial de hidrógeno es lo suficientemente alta (por ejemplo, en un mar subterráneo), se formará ácido fórmico :
Estas reacciones pueden tener lugar en unos pocos millones de años incluso a temperaturas como las que se encuentran en Plutón. [48]
El monóxido de carbono es un contaminante atmosférico temporal en algunas zonas urbanas, proveniente principalmente de los gases de escape de los motores de combustión interna (incluidos vehículos, generadores portátiles y de respaldo, cortadoras de césped, hidrolavadoras, etc.), pero también de la combustión incompleta de varios otros combustibles (incluidos madera, carbón, carbón vegetal, petróleo, parafina, propano, gas natural y basura).
Se pueden observar grandes eventos de contaminación por CO desde el espacio sobre las ciudades. [49]
El monóxido de carbono es, junto con los aldehídos , parte de la serie de ciclos de reacciones químicas que forman el smog fotoquímico . Reacciona con el radical hidroxilo ( • OH) para producir un intermediario radical • HOCO, que transfiere rápidamente su hidrógeno radical a O 2 para formar el radical peroxi (HO 2 • ) y dióxido de carbono (CO 2 ). [50] El radical peroxi reacciona posteriormente con óxido de nitrógeno (NO) para formar dióxido de nitrógeno (NO 2 ) y radical hidroxilo. NO 2 da O( 3 P) a través de fotólisis, formando así O 3 tras la reacción con O 2 . Dado que el radical hidroxilo se forma durante la formación de NO 2 , el balance de la secuencia de reacciones químicas que comienzan con el monóxido de carbono y conducen a la formación de ozono es:
(donde hν se refiere al fotón de luz absorbido por la molécula de NO 2 en la secuencia)
Aunque la creación de NO 2 es el paso crítico que conduce a la formación de ozono de bajo nivel , también aumenta este ozono de otra manera, algo mutuamente excluyente, al reducir la cantidad de NO que está disponible para reaccionar con el ozono. [51]
El monóxido de carbono es uno de los contaminantes del aire interior más tóxicos . El monóxido de carbono puede emitirse a partir del humo del tabaco y generarse a partir de estufas que queman combustible (madera, queroseno, gas natural, propano) y sistemas de calefacción que queman combustible (madera, petróleo, gas natural) que funcionan mal y a partir de conductos de humos bloqueados conectados a estos aparatos. [8] En los países desarrollados, las principales fuentes de emisión de CO en interiores provienen de aparatos de cocina y calefacción que queman combustibles fósiles y que son defectuosos, están instalados incorrectamente o tienen un mantenimiento deficiente. [52] El mal funcionamiento de los aparatos puede deberse a una instalación defectuosa o a la falta de mantenimiento y uso adecuado. [8] En los países de ingresos bajos y medios, las fuentes más comunes de CO en los hogares son la quema de combustibles de biomasa y el humo del cigarrillo. [52]
Los mineros se refieren al monóxido de carbono como " humedad blanca " o "asesino silencioso". Se puede encontrar en áreas confinadas con poca ventilación tanto en minas de superficie como en minas subterráneas. Las fuentes más comunes de monóxido de carbono en las operaciones mineras son el motor de combustión interna y los explosivos; sin embargo, en las minas de carbón, el monóxido de carbono también se puede encontrar debido a la oxidación a baja temperatura del carbón. [53] La expresión " canario en la mina de carbón " se refería a una advertencia temprana de la presencia de monóxido de carbono. [54]
La intoxicación por monóxido de carbono es el tipo de intoxicación atmosférica mortal más común en muchos países. La exposición aguda también puede provocar efectos neurológicos a largo plazo, como cambios cognitivos y conductuales. La intoxicación grave por CO puede provocar pérdida de conocimiento, coma y muerte. La exposición crónica a bajas concentraciones de monóxido de carbono puede provocar letargo, dolores de cabeza, náuseas, síntomas similares a los de la gripe y problemas neuropsicológicos y cardiovasculares. [9] [8] [10]
El monóxido de carbono tiene una amplia gama de funciones en todas las disciplinas de la química. Las cuatro categorías principales de reactividad incluyen la catálisis de metal-carbonilo , la química radical y la química de cationes y aniones . [55]

La mayoría de los metales forman complejos de coordinación que contienen monóxido de carbono unido de forma covalente. Estos derivados, que se denominan carbonilos metálicos , tienden a ser más robustos cuando el metal se encuentra en estados de oxidación más bajos. Por ejemplo, el pentacarbonilo de hierro (Fe(CO) 5 ) es un líquido destilable y estable al aire. El carbonilo de níquel es un ejemplo de un complejo de carbonilo metálico que se forma por la combinación directa de monóxido de carbono con el metal: C. Elschenbroich (2006). Organometallics . VCH. ISBN 978-3-527-29390-2.
Estos complejos volátiles suelen ser muy tóxicos. Algunos complejos de metal-CO se preparan mediante la descarbonilación de disolventes orgánicos, no a partir de CO. Por ejemplo, el tricloruro de iridio y la trifenilfosfina reaccionan en 2-metoxietanol o DMF en ebullición para producir IrCl(CO)(PPh 3 ) 2 .
Como ligando, el CO se une a través del carbono, formando una especie de triple enlace. El par solitario del átomo de carbono dona densidad electrónica para formar un enlace sigma M-CO . Los dos orbitales π* del CO se unen a orbitales metálicos llenos. El efecto está relacionado con el modelo de Dewar-Chatt-Duncanson . Los efectos del enlace cuasi-triple MC se reflejan en el espectro infrarrojo de estos complejos. Mientras que el CO libre vibra a 2143 cm-1, sus complejos tienden a absorber cerca de 1950 cm-1.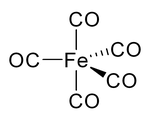
En presencia de ácidos fuertes, los alquenos reaccionan con los ácidos carboxílicos . La hidrólisis de esta especie (un ion acilio ) da lugar al ácido carboxílico, un proceso neto conocido como reacción de Koch-Haaf . [56] En la reacción de Gattermann-Koch , los arenos se convierten en derivados de benzaldehído en presencia de CO, AlCl 3 y HCl . [57]
Una mezcla de gas hidrógeno y CO reacciona con alquenos para dar aldehídos. El proceso requiere la presencia de catalizadores metálicos. [58]
Con los reactivos del grupo principal, el CO experimenta varias reacciones notables. La cloración del CO es la ruta industrial para obtener el importante compuesto fosgeno . Con el borano, el CO forma el aducto H 3 BCO , que es isoelectrónico con el catión acilio [H 3 CCO] + . El CO reacciona con el sodio para dar productos resultantes del acoplamiento C−C, como el acetilendiolato de sodio 2 Na+
· C
2Oh2−
2Reacciona con potasio fundido para dar una mezcla de un compuesto organometálico, acetilendiolato de potasio 2 K+
· C
2Oh2−
2, bencenohexolato de potasio 6 K+
do
6Oh6−
6, [59] y rodizonato de potasio 2 K+
· C
6Oh2−
6. [60]
Los compuestos ciclohexanohexona o triquinoilo (C 6 O 6 ) y ciclopentanopentona o ácido leucónico (C 5 O 5 ), que hasta ahora sólo se han obtenido en cantidades traza, pueden considerarse polímeros de monóxido de carbono. A presiones superiores a 5 GPa , el monóxido de carbono se convierte en policarbonilo , un polímero sólido que es metaestable a presión atmosférica pero es explosivo. [61] [62]
El monóxido de carbono se produce convenientemente en el laboratorio mediante la deshidratación del ácido fórmico o del ácido oxálico , por ejemplo con ácido sulfúrico concentrado . [56] [57] [63] Otro método es calentar una mezcla íntima de metal de zinc en polvo y carbonato de calcio , que libera CO y deja óxido de zinc y óxido de calcio :
El nitrato de plata y el yodoformo también producen monóxido de carbono:
Finalmente, las sales de oxalato metálico liberan CO al calentarse, dejando un carbonato como subproducto:
La combustión térmica es la fuente más común de monóxido de carbono. El monóxido de carbono se produce a partir de la oxidación parcial de compuestos que contienen carbono ; se forma cuando no hay suficiente oxígeno para producir dióxido de carbono (CO2 ) , como cuando se utiliza una estufa o un motor de combustión interna en un espacio cerrado.
Durante los procesos oxidativos para la producción de sustancias químicas se genera una gran cantidad de CO como subproducto, por lo que es necesario depurar los gases de escape del proceso.
Se han desarrollado muchos métodos para la producción de monóxido de carbono. [64]
Una fuente industrial importante de CO es el gas pobre , una mezcla que contiene principalmente monóxido de carbono y nitrógeno, formada por la combustión de carbono en el aire a alta temperatura cuando hay un exceso de carbono. En un horno, el aire pasa a través de un lecho de coque . El CO2 producido inicialmente se equilibra con el carbono caliente restante para dar CO. [65] La reacción del CO2 con el carbono para dar CO se describe como la reacción de Boudouard . [66] Por encima de los 800 °C, el CO es el producto predominante:
Otra fuente es el " gas de agua ", una mezcla de hidrógeno y monóxido de carbono producida mediante la reacción endotérmica de vapor y carbono:
Otros " gases de síntesis " similares pueden obtenerse a partir del gas natural y otros combustibles.
El monóxido de carbono también se puede producir mediante electrólisis a alta temperatura del dióxido de carbono con celdas electrolizadoras de óxido sólido . [67] Un método desarrollado en DTU Energy utiliza un catalizador de óxido de cerio y no tiene problemas de ensuciamiento del catalizador. [68] [69]
El monóxido de carbono también es un subproducto de la reducción de minerales de óxido metálico con carbono, que se muestra de forma simplificada a continuación:
El monóxido de carbono también se produce por la oxidación directa del carbono en un suministro limitado de oxígeno o aire.
Como el CO es un gas, el proceso de reducción puede ser impulsado por el calor, aprovechando la entropía positiva (favorable) de la reacción. El diagrama de Ellingham muestra que la formación de CO es favorecida por sobre la de CO 2 a altas temperaturas.
El monóxido de carbono es un gas industrial que tiene muchas aplicaciones en la fabricación de productos químicos a granel. [70] Se producen grandes cantidades de aldehídos mediante la reacción de hidroformilación de alquenos , monóxido de carbono y H 2 . La hidroformilación está acoplada al proceso de olefinas superiores de Shell para dar precursores a los detergentes .
El fosgeno , útil para preparar isocianatos, policarbonatos y poliuretanos, se produce haciendo pasar monóxido de carbono purificado y gas cloro a través de un lecho de carbón activado poroso , que actúa como catalizador . Se estimó que la producción mundial de este compuesto era de 2,74 millones de toneladas en 1989. [71]
El metanol se produce mediante la hidrogenación del monóxido de carbono. En una reacción relacionada, la hidrogenación del monóxido de carbono está asociada a la formación de enlaces C-C, como en el proceso Fischer-Tropsch, en el que el monóxido de carbono se hidrogena para formar combustibles de hidrocarburos líquidos. Esta tecnología permite convertir el carbón o la biomasa en diésel.
En el proceso Cativa , el monóxido de carbono y el metanol reaccionan en presencia de un catalizador homogéneo de iridio y ácido yodhídrico para producir ácido acético . Este proceso es responsable de la mayor parte de la producción industrial de ácido acético.
El monóxido de carbono es un potente agente reductor y se ha utilizado en pirometalurgia para reducir metales de menas desde tiempos antiguos. El monóxido de carbono elimina el oxígeno de los óxidos metálicos, reduciéndolos a metal puro a altas temperaturas, formando dióxido de carbono en el proceso. El monóxido de carbono no suele suministrarse tal cual, en fase gaseosa, en el reactor, sino que se forma a alta temperatura en presencia de mena portadora de oxígeno o de un agente carbonífero como el coque y a alta temperatura. El proceso de alto horno es un ejemplo típico de un proceso de reducción de metal de mena con monóxido de carbono.
De la misma manera, el gas de alto horno recogido en la parte superior del alto horno todavía contiene entre un 10% y un 30% de monóxido de carbono, y se utiliza como combustible en estufas Cowper y en hornos Siemens-Martin para la fabricación de acero en hogar abierto .
El investigador de la NASA Geoffrey Landis ha propuesto el uso del monóxido de carbono como combustible en Marte . Se han sugerido motores de monóxido de carbono/oxígeno para el uso en el transporte de superficie temprano, ya que tanto el monóxido de carbono como el oxígeno se pueden producir directamente a partir de la atmósfera de dióxido de carbono de Marte mediante electrólisis de circonio , sin utilizar ningún recurso hídrico marciano para obtener hidrógeno, que sería necesario para producir metano o cualquier combustible basado en hidrógeno. [72]
Landis también propuso fabricar el combustible a partir de la atmósfera de dióxido de carbono similar a la de Venus para una misión de retorno de muestras, en combinación con vehículos aéreos no tripulados alimentados con energía solar y el ascenso en globo cohete. [73]
El monóxido de carbono es una molécula bioactiva que actúa como molécula de señalización gaseosa . Se produce de forma natural mediante muchas vías enzimáticas y no enzimáticas, [74] la mejor comprendida de las cuales es la acción catabólica de la hemooxigenasa sobre el hemo derivado de hemoproteínas como la hemoglobina . [75] Tras el primer informe de que el monóxido de carbono es un neurotransmisor normal en 1993, [54] el monóxido de carbono ha recibido una importante atención clínica como regulador biológico.
Debido al papel del monóxido de carbono en el cuerpo, las anormalidades en su metabolismo se han relacionado con una variedad de enfermedades, incluyendo neurodegeneraciones, hipertensión, insuficiencia cardíaca e inflamación patológica. [76] En muchos tejidos, el monóxido de carbono actúa como antiinflamatorio , vasodilatador y estimulador del crecimiento neovascular . [77] En estudios con modelos animales, el monóxido de carbono redujo la gravedad de la sepsis bacteriana inducida experimentalmente , pancreatitis, lesión por isquemia/reperfusión hepática , colitis, osteoartritis, lesión pulmonar, rechazo de trasplante de pulmón y dolor neuropático, al tiempo que promueve la cicatrización de heridas de la piel. Por lo tanto, existe un interés significativo en el potencial terapéutico del monóxido de carbono como agente farmacéutico y estándar de atención clínica. [78]
En muchos laboratorios de todo el mundo se han realizado estudios sobre el monóxido de carbono por sus propiedades antiinflamatorias y citoprotectoras. [79] Estas propiedades tienen el potencial de usarse para prevenir el desarrollo de una serie de condiciones patológicas, incluidas la lesión por isquemia-reperfusión, el rechazo de trasplantes, la aterosclerosis, la sepsis grave, la malaria grave o la autoinmunidad. [78] Muchas iniciativas de administración de fármacos farmacéuticos han desarrollado métodos para administrar de forma segura el monóxido de carbono, y los ensayos clínicos controlados posteriores han evaluado el efecto terapéutico del monóxido de carbono. [80]
La microbiota también puede utilizar el monóxido de carbono como gasotransmisor . [81] La detección de monóxido de carbono es una vía de señalización facilitada por proteínas como CooA . [82] [83] [84] El alcance de las funciones biológicas de la detección de monóxido de carbono aún se desconoce.
El microbioma humano produce, consume y responde al monóxido de carbono. [74] Por ejemplo, en ciertas bacterias, el monóxido de carbono se produce a través de la reducción del dióxido de carbono por la enzima monóxido de carbono deshidrogenasa con bioenergética favorable para impulsar las operaciones celulares posteriores. [85] [74] En otro ejemplo, el monóxido de carbono es un nutriente para las arqueas metanogénicas que lo reducen a metano utilizando hidrógeno. [86]
El monóxido de carbono tiene ciertas propiedades antimicrobianas que se han estudiado para tratar enfermedades infecciosas. [74]
En los EE. UU., el monóxido de carbono se utiliza en sistemas de envasado en atmósfera modificada , principalmente en productos cárnicos frescos, como carne de res, cerdo y pescado, para mantener su aspecto fresco. El beneficio es doble: el monóxido de carbono protege contra el deterioro microbiano y mejora el color de la carne para que resulte atractiva para el consumidor. [87] El monóxido de carbono se combina con la mioglobina para formar carboximioglobina, un pigmento rojo cereza brillante. La carboximioglobina es más estable que la forma oxigenada de la mioglobina, la oximioglobina, que puede oxidarse al pigmento marrón metmioglobina . Este color rojo estable puede persistir mucho más tiempo que en la carne envasada normalmente. Los niveles típicos de monóxido de carbono utilizados en las instalaciones que utilizan este proceso están entre el 0,4 % y el 0,5 %. [87]
La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) otorgó por primera vez a esta tecnología el estatus de " generalmente reconocida como segura " (GRAS) en 2002 para su uso como sistema de envasado secundario, y no requiere etiquetado. En 2004, la FDA aprobó el CO como método de envasado primario, declarando que el CO no enmascara el olor a descomposición. [88] El proceso actualmente no está autorizado en muchos otros países, incluidos Japón, Singapur y la Unión Europea . [89] [90] [91]
En la historia antigua, Aníbal ejecutó a prisioneros romanos con humo de carbón durante la Segunda Guerra Púnica . [54]
El monóxido de carbono se había utilizado para el genocidio durante el Holocausto en algunos campos de exterminio , el más notable de los cuales fueron los camiones de gas en Chelmno , y en el programa de " eutanasia " Acción T4 . [92]
Los seres humanos han mantenido una relación compleja con el monóxido de carbono desde que aprendieron a controlar el fuego alrededor del año 800.000 a. C. Es probable que los primeros humanos descubrieran la toxicidad del envenenamiento por monóxido de carbono al introducir fuego en sus viviendas. El desarrollo temprano de las tecnologías de metalurgia y fundición que surgieron alrededor del año 6000 a. C. hasta la Edad del Bronce también afectó a la humanidad con la exposición al monóxido de carbono. Aparte de la toxicidad del monóxido de carbono, los nativos americanos indígenas pueden haber experimentado las propiedades neuroactivas del monóxido de carbono a través de rituales chamánicos junto al fuego. [54]
Las civilizaciones antiguas desarrollaron relatos mitológicos para explicar el origen del fuego, como Prometeo de la mitología griega, que compartía el fuego con los humanos. Aristóteles (384-322 a. C.) fue el primero en registrar que la quema de carbón producía humos tóxicos. El médico griego Galeno (129-199 d. C.) especuló que había un cambio en la composición del aire que causaba daño cuando se inhalaba, y muchos otros de la época desarrollaron una base de conocimiento sobre el monóxido de carbono en el contexto de la toxicidad de los humos de carbón . Cleopatra puede haber muerto por envenenamiento por monóxido de carbono . [54]
Georg Ernst Stahl mencionó el carbonarii halitus en 1697 en referencia a los vapores tóxicos que se pensaba que eran monóxido de carbono. Friedrich Hoffmann llevó a cabo la primera investigación científica moderna sobre el envenenamiento por monóxido de carbono del carbón en 1716. Herman Boerhaave llevó a cabo los primeros experimentos científicos sobre el efecto del monóxido de carbono (humos de carbón) en animales en la década de 1730. [54]
Se considera que Joseph Priestley fue el primero en sintetizar monóxido de carbono en 1772. Carl Wilhelm Scheele aisló de manera similar el monóxido de carbono del carbón vegetal en 1773 y pensó que podría ser la entidad carbónica que hace que los humos sean tóxicos. Torbern Bergman aisló el monóxido de carbono del ácido oxálico en 1775. Más tarde, en 1776, el químico francés de Lassone produjo CO calentando óxido de zinc con coque , pero concluyó erróneamente que el producto gaseoso era hidrógeno , ya que ardía con una llama azul. En presencia de oxígeno, incluidas las concentraciones atmosféricas, el monóxido de carbono arde con una llama azul, produciendo dióxido de carbono. Antoine Lavoisier realizó experimentos no concluyentes similares a los de Lassone en 1777. El gas fue identificado como un compuesto que contenía carbono y oxígeno por William Cruickshank en 1800. [54] [93]
En 1793, Thomas Beddoes y James Watt descubrieron que el monóxido de carbono (como hidrocarbonato ) aclaraba la sangre venosa. Watt sugirió que los humos de carbón podrían actuar como un antídoto contra el oxígeno en la sangre, y Beddoes y Watt también sugirieron en 1796 que el hidrocarbonato tiene una mayor afinidad por la fibra animal que el oxígeno. En 1854, Adrien Chenot sugirió de manera similar que el monóxido de carbono elimina el oxígeno de la sangre y luego es oxidado por el cuerpo a dióxido de carbono. [54] El mecanismo de envenenamiento por monóxido de carbono se atribuye ampliamente a Claude Bernard, cuyas memorias que comenzaron en 1846 y se publicaron en 1857 decían: "evita que la sangre arterial se vuelva venosa". Felix Hoppe-Seyler publicó de forma independiente conclusiones similares al año siguiente. [54]
El monóxido de carbono ganó reconocimiento como un reactivo esencial en la década de 1900. [5] Tres procesos industriales ilustran su evolución en la industria. En el proceso Fischer-Tropsch , el carbón y las materias primas relacionadas ricas en carbono se convierten en combustibles líquidos a través de la intermediación del CO. Originalmente desarrollada como parte del esfuerzo de guerra alemán para compensar su falta de petróleo doméstico, esta tecnología continúa hoy. También en Alemania, se descubrió que una mezcla de CO e hidrógeno se combinaba con olefinas para dar aldehídos . Este proceso, llamado hidroformilación , se utiliza para producir muchos productos químicos a gran escala, como surfactantes , así como compuestos especiales que son fragancias y medicamentos populares. Por ejemplo, el CO se utiliza en la producción de vitamina A. [94] En un tercer proceso importante, atribuido a investigadores de Monsanto , el CO se combina con metanol para dar ácido acético . La mayor parte del ácido acético se produce mediante el proceso Cativa . La hidroformilación y las síntesis de ácido acético son dos de los innumerables procesos de carbonilación .
{{cite book}}: CS1 maint: nombres numéricos: lista de autores ( enlace )Alrededor del 80 por ciento del hielo es hielo de agua y el monóxido de carbono congelado constituye otro 15 por ciento.
Descripción de la fisiología del monóxido de carbono de la Royal Society of Chemistry .