La trombofilia (a veces llamada hipercoagulabilidad o estado protrombótico ) es una anomalía de la coagulación sanguínea que aumenta el riesgo de trombosis (coágulos de sangre en los vasos sanguíneos). [1] [2] Estas anomalías se pueden identificar en el 50% de las personas que tienen un episodio de trombosis (como trombosis venosa profunda en la pierna) que no fue provocado por otras causas. [3] Una proporción significativa de la población tiene una anomalía trombofílica detectable, pero la mayoría de ellos desarrollan trombosis solo en presencia de un factor de riesgo adicional. [2]
No existe un tratamiento específico para la mayoría de las trombofilias, pero los episodios recurrentes de trombosis pueden ser una indicación para la anticoagulación preventiva a largo plazo . [2] La primera forma importante de trombofilia identificada por la ciencia médica, la deficiencia de antitrombina , se identificó en 1965, mientras que las anomalías más comunes (incluido el factor V Leiden ) se describieron en la década de 1990. [4] [5]

Las afecciones más comunes asociadas con la trombofilia son la trombosis venosa profunda (TVP) y la embolia pulmonar (EP), que se conocen colectivamente como tromboembolia venosa (TEV). La TVP generalmente ocurre en las piernas y se caracteriza por dolor, hinchazón y enrojecimiento de la extremidad. Puede provocar hinchazón y pesadez a largo plazo debido al daño a las válvulas de las venas. [6] El coágulo también puede desprenderse y migrar ( embolizar ) a las arterias de los pulmones. Dependiendo del tamaño y la ubicación del coágulo, esto puede provocar falta de aliento de aparición repentina , dolor en el pecho , palpitaciones y puede complicarse con colapso , shock y paro cardíaco . [2] [7]
La trombosis venosa también puede ocurrir en lugares más inusuales: en las venas del cerebro , el hígado ( trombosis de la vena porta y trombosis de la vena hepática ), la vena mesentérica , el riñón ( trombosis de la vena renal ) y las venas de los brazos . [2] No está tan bien establecido si la trombofilia también aumenta el riesgo de trombosis arterial (que es la causa subyacente de los ataques cardíacos y los accidentes cerebrovasculares ). [2] [8] [9] Sin embargo, datos más recientes sugieren que algunas formas de trombofilia hereditaria están asociadas con un mayor riesgo de accidente cerebrovascular isquémico arterial . [10]
La trombofilia se ha relacionado con abortos espontáneos recurrentes , [11] y posiblemente con diversas complicaciones del embarazo, como restricción del crecimiento intrauterino , muerte fetal , preeclampsia grave y desprendimiento de placenta . [2]
La deficiencia de proteína C puede causar púrpura fulminante , un trastorno grave de la coagulación en el recién nacido que provoca la muerte de los tejidos y hemorragias en la piel y otros órganos. La afección también se ha descrito en adultos. La deficiencia de proteína C y proteína S también se ha asociado con un mayor riesgo de necrosis cutánea al iniciar un tratamiento anticoagulante con warfarina o fármacos relacionados. [2] [12]
La trombofilia puede ser congénita o adquirida. La trombofilia congénita se refiere a afecciones congénitas (y generalmente hereditarias, en cuyo caso se puede utilizar " trombofilia hereditaria ") que aumentan la tendencia a desarrollar trombosis, mientras que, por otro lado, la trombofilia adquirida se refiere a afecciones que aparecen más adelante en la vida.
Los tipos más comunes de trombofilia congénita son aquellos que surgen como resultado de la hiperactividad de los factores de coagulación; por lo tanto, se consideran alteraciones de "ganancia de función". [13] Son relativamente leves en el estado heterocigoto habitual y, por lo tanto, se clasifican como defectos de "tipo II". [14] [15] Los más comunes son el factor V Leiden (una mutación en el gen F5 en la posición 1691) y la protrombina G20210A , una mutación en la protrombina (en la posición 20210 en la región 3' no traducida del gen). [1] [16] Los heterocigotos y homocigotos compuestos, aunque raros, tienen un riesgo significativo de trombosis. [13]
Las formas raras de trombofilia congénita son causadas típicamente por una deficiencia de anticoagulantes naturales. Se clasifican como "tipo I" y son más graves en su propensión a causar trombosis. [ 14] Las principales son la deficiencia de antitrombina III , la deficiencia de proteína C y la deficiencia de proteína S. [1] [16] Las trombofilias congénitas raras más leves son la mutación del factor XIII [16] y la disfibrinogenemia familiar (un fibrinógeno anormal ). [16] No está claro si los trastornos congénitos de la fibrinólisis (el sistema que destruye los coágulos) son contribuyentes principales al riesgo de trombosis. [14] La deficiencia congénita de plasminógeno , por ejemplo, causa principalmente síntomas oculares y, a veces, problemas en otros órganos, pero el vínculo con la trombosis ha sido más incierto. [17]
El grupo sanguíneo determina en gran medida el riesgo de trombosis. Las personas con grupos sanguíneos distintos del tipo O tienen un riesgo relativo de 2 a 4 veces mayor. El grupo sanguíneo O se asocia con niveles reducidos de factor de von Willebrand (debido a un mayor aclaramiento) y factor VIII, que está relacionado con el riesgo de trombosis. [5]
Varias enfermedades adquiridas aumentan el riesgo de trombosis. Un ejemplo destacado es el síndrome antifosfolípido [1] [16] , que es causado por anticuerpos contra los componentes de la membrana celular, en particular el anticoagulante lúpico (descubierto por primera vez en personas con la enfermedad lupus eritematoso sistémico pero detectado a menudo en personas sin la enfermedad), anticuerpos anticardiolipina y anticuerpos anti-β 2 -glicoproteína 1 ; por lo tanto, se considera una enfermedad autoinmune . En algunos casos, el síndrome antifosfolípido puede causar trombosis arterial y venosa. También está más fuertemente asociado con el aborto espontáneo y puede causar una serie de otros síntomas (como livedo reticularis de la piel y migraña ). [18]
La trombocitopenia inducida por heparina (TIH) se debe a una reacción del sistema inmunitario contra el fármaco anticoagulante heparina (o sus derivados). [1] Aunque recibe su nombre por los bajos recuentos plaquetarios asociados, la TIH está fuertemente asociada con el riesgo de trombosis venosa y arterial. [19] La hemoglobinuria paroxística nocturna (HPN) es una afección poco frecuente que resulta de alteraciones adquiridas en el gen PIGA , que desempeña un papel en la protección de las células sanguíneas frente al sistema del complemento . La HPN aumenta el riesgo de trombosis venosa, pero también se asocia con anemia hemolítica (anemia resultante de la destrucción de glóbulos rojos). [20] Tanto la TIH como la HPN requieren un tratamiento particular. [19] [20]
Las enfermedades hematológicas asociadas con un flujo sanguíneo lento pueden aumentar el riesgo de trombosis. Por ejemplo, la enfermedad de células falciformes (causada por mutaciones de la hemoglobina ) se considera un estado protrombótico leve inducido por un flujo sanguíneo deficiente. [1] De manera similar, los trastornos mieloproliferativos , en los que la médula ósea produce demasiadas células sanguíneas, predisponen a la trombosis, en particular en la policitemia vera (exceso de glóbulos rojos) y la trombocitosis esencial (exceso de plaquetas). Nuevamente, estas enfermedades generalmente requieren un tratamiento específico cuando se identifican. [21]
El cáncer , en particular cuando es metastásico (se disemina a otras partes del cuerpo), es un factor de riesgo reconocido de trombosis. [2] [16] Se han propuesto varios mecanismos, como la activación del sistema de coagulación por parte de las células cancerosas o la secreción de sustancias procoagulantes. Además, determinados tratamientos contra el cáncer (como el uso de catéteres venosos centrales para quimioterapia ) pueden aumentar aún más el riesgo de trombosis. [22]
El síndrome nefrótico , en el que las proteínas del torrente sanguíneo se liberan en la orina debido a enfermedades renales, puede predisponer a la trombosis; [1] esto es particularmente el caso en los casos más graves (como lo indican los niveles sanguíneos de albúmina por debajo de 25 g/L) y si el síndrome es causado por la afección llamada nefropatía membranosa . [23] La enfermedad inflamatoria intestinal ( colitis ulcerosa y enfermedad de Crohn ) predispone a la trombosis, particularmente cuando la enfermedad está activa. Se han propuesto varios mecanismos. [2] [24]
El embarazo se asocia con un mayor riesgo de trombosis de 2 a 7 veces. [25] Esto probablemente resulta de una hipercoagulabilidad fisiológica en el embarazo que protege contra la hemorragia posparto . [26] Esta hipercoagulabilidad a su vez probablemente esté relacionada con los altos niveles de estradiol y progesterona que ocurren durante el embarazo. [27]
Los estrógenos , cuando se utilizan en la anticoncepción hormonal combinada y en la terapia hormonal menopáusica (en combinación con progestágenos ), se han asociado con un riesgo de trombosis venosa de 2 a 6 veces mayor. El riesgo depende de los tipos de hormonas utilizadas, la dosis de estrógeno y la presencia de otros factores de riesgo trombofílicos. [28] Se dice que varios mecanismos, como la deficiencia de proteína S y el inhibidor de la vía del factor tisular , son responsables. [29]
La obesidad se ha considerado durante mucho tiempo un factor de riesgo de trombosis venosa. En numerosos estudios, duplica el riesgo, en particular en combinación con el uso de anticonceptivos orales o en el período posterior a la cirugía . Se han descrito varias anomalías de la coagulación en los obesos. El inhibidor del activador del plasminógeno-1 , un inhibidor de la fibrinólisis, está presente en niveles más altos en personas con obesidad. Las personas obesas también tienen un mayor número de microvesículas circulantes (fragmentos de células dañadas) que contienen factor tisular. La agregación plaquetaria puede estar aumentada y hay niveles más altos de proteínas de coagulación como el factor de von Willebrand, el fibrinógeno, el factor VII y el factor VIII . La obesidad también aumenta el riesgo de recurrencia después de un episodio inicial de trombosis. [30]
Una serie de condiciones que se han vinculado con la trombosis venosa son posiblemente genéticas y posiblemente adquiridas. [16] Estas incluyen: niveles elevados de factor VIII, factor IX , factor XI , fibrinógeno e inhibidor de la fibrinólisis activable por trombina , y niveles disminuidos de inhibidor de la vía del factor tisular . La resistencia a la proteína C activada que no es atribuible a mutaciones del factor V probablemente sea causada por otros factores y sigue siendo un factor de riesgo para la trombosis. [16]
Existe una asociación entre los niveles sanguíneos de homocisteína y la trombosis, [16] aunque esto no se ha reportado consistentemente en todos los estudios. [5] Los niveles de homocisteína están determinados por mutaciones en los genes MTHFR y CBS , pero también por los niveles de ácido fólico , vitamina B 6 y vitamina B 12 , que dependen de la dieta. [14]
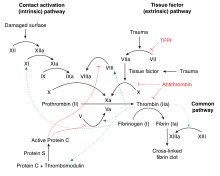
La trombosis es un problema multifactorial, ya que a menudo existen múltiples razones por las que una persona puede desarrollar una trombosis. Estos factores de riesgo pueden incluir cualquier combinación de anomalías en la pared de los vasos sanguíneos, anomalías en el flujo sanguíneo (como en el caso de la inmovilización) y anomalías en la consistencia de la sangre. La trombofilia es causada por anomalías en la consistencia de la sangre, que está determinada por los niveles de factores de coagulación y otras proteínas sanguíneas circulantes que participan en la "cascada de coagulación". [16]
La coagulación normal se inicia con la liberación del factor tisular del tejido dañado. El factor tisular se une al factor VIIa circulante . La combinación activa el factor X al factor Xa y el factor IX al factor IXa. El factor Xa (en presencia del factor V ) activa la protrombina en trombina. La trombina es una enzima central en el proceso de coagulación: genera fibrina a partir del fibrinógeno y activa una serie de otras enzimas y cofactores ( factor XIII , factor XI , factor V y factor VIII , TAFI) que mejoran el coágulo de fibrina. [14] El proceso es inhibido por TFPI (que inactiva el primer paso catalizado por el factor VIIa/factor tisular), la antitrombina (que inactiva la trombina, el factor IXa, Xa y XIa), la proteína C (que inhibe los factores Va y VIIIa en presencia de la proteína S) y la proteína Z (que inhibe el factor Xa). [14]
En la trombofilia, el equilibrio entre la actividad "procoagulante" y la "anticoagulante" está alterado. La gravedad del desequilibrio determina la probabilidad de que una persona desarrolle una trombosis. Incluso pequeñas perturbaciones de las proteínas, como la reducción de la antitrombina a solo el 70-80% del nivel normal, pueden aumentar el riesgo de trombosis; esto es en contraste con la hemofilia , que solo se produce si los niveles de factores de coagulación disminuyen notablemente. [14]
Además de sus efectos sobre la trombosis, los estados de hipercoagulabilidad pueden acelerar el desarrollo de la aterosclerosis , la enfermedad arterial que subyace al infarto de miocardio y otras formas de enfermedad cardiovascular. [31] [32]

Las pruebas para la trombofilia incluyen hemograma completo (con examen del frotis de sangre ), tiempo de protrombina , tiempo de tromboplastina parcial , prueba de trombodinámica , tiempo de trombina y tiempo de reptilasa , anticoagulante lúpico , anticuerpo anti-cardiolipina , anticuerpo anti-β2 glicoproteína 1 , resistencia a la proteína C activada, pruebas de fibrinógeno , factor V Leiden y mutación de protrombina , y niveles basales de homocisteína . [2] Las pruebas pueden ser más o menos extensas dependiendo del criterio clínico y las anomalías detectadas en la evaluación inicial. [2]
Para los casos hereditarios, el paciente debe tener al menos dos pruebas anormales más antecedentes familiares.
Existen opiniones divergentes sobre si se debe investigar la trombofilia en todas las personas con un episodio no provocado de trombosis. Incluso aquellos con una forma de trombofilia pueden no estar necesariamente en riesgo de una trombosis adicional, mientras que la trombosis recurrente es más probable en aquellos que han tenido trombosis previa incluso en aquellos que no tienen anomalías trombofílicas detectables. [8] [12] [33] La tromboembolia recurrente, o trombosis en sitios inusuales (p. ej., la vena hepática en el síndrome de Budd-Chiari ), es una indicación generalmente aceptada para la detección. Es más probable que sea rentable en personas con antecedentes personales o familiares importantes de trombosis. [34] Por el contrario, la combinación de trombofilia con otros factores de riesgo puede proporcionar una indicación para el tratamiento preventivo, por lo que la prueba de trombofilia puede realizarse incluso en aquellos que no cumplirían los criterios estrictos para estas pruebas. [33] La búsqueda de una anomalía de la coagulación normalmente no se realiza en pacientes en los que la trombosis tiene un desencadenante obvio. Por ejemplo, si la trombosis se debe a una inmovilización después de una cirugía ortopédica reciente , se considera "provocada" por la inmovilización y la cirugía y es menos probable que las investigaciones arrojen resultados clínicamente importantes. [12] [33]
Cuando se produce una tromboembolia venosa cuando un paciente presenta factores de riesgo importantes transitorios, como inmovilidad prolongada, cirugía o traumatismo, no es adecuado realizar pruebas de trombofilia porque el resultado de la prueba no cambiaría el tratamiento indicado del paciente. [35] [36] En 2013, la Sociedad Estadounidense de Hematología , como parte de las recomendaciones de la campaña Choosing Wisely , advirtió contra el uso excesivo de la detección de trombofilia; los resultados falsos positivos de las pruebas llevarían a que las personas fueran etiquetadas de manera inapropiada como personas con trombofilia y tratadas con anticoagulantes sin necesidad clínica. [35] Un estudio de 2016 estimó que se desperdiciaron más de $1 millón en pruebas de trombofilia inapropiadas en un año en un centro médico académico. [37]
En el Reino Unido, las directrices profesionales dan indicaciones específicas para las pruebas de trombofilia. Se recomienda que las pruebas se realicen solo después del asesoramiento adecuado y, por lo tanto, las investigaciones generalmente no se realizan en el momento en que se diagnostica la trombosis, sino en un momento posterior. [12] En situaciones particulares, como la trombosis de la vena retiniana , las pruebas se desaconsejan por completo porque la trombofilia no se considera un factor de riesgo importante. En otras afecciones raras generalmente relacionadas con la hipercoagulabilidad, como la trombosis venosa cerebral y la trombosis de la vena porta, no hay datos suficientes para afirmar con certeza si el cribado de la trombofilia es útil y, por lo tanto, las decisiones sobre el cribado de la trombofilia en estas afecciones no se consideran basadas en la evidencia . [12] Si se toma como guía la relación coste-efectividad ( años de vida ajustados por calidad a cambio del gasto), generalmente no está claro si las investigaciones de trombofilia justifican el costo a menudo alto, [38] a menos que las pruebas se restrinjan a situaciones seleccionadas. [39]
En 2021, el Colegio Estadounidense de Médicos Torácicos ofreció una recomendación relacionada con las pruebas en sus pautas sobre tromboembolia venosa. [40] Recomendaron considerar el dímero D positivo en la decisión de continuar o suspender la anticoagulación. El dímero D positivo puede sugerir que la tendencia trombótica en curso no se ha resuelto por completo.
En 2023, la Sociedad Estadounidense de Hematología publicó nuevas pautas para las pruebas de trombofilia. [41] Una desviación de sus pautas anteriores se relaciona con los pacientes con factores de riesgo transitorios importantes no quirúrgicos; las pruebas pueden ser apropiadas. Por otro lado, no se recomiendan las pruebas de trombofilia después de una tromboembolia venosa (TEV) provocada por cirugía, porque el riesgo de recurrencia es bajo. Algunos expertos sostienen que la TEV no provocada requiere anticoagulación indefinida (de por vida) y, por lo tanto, realizar pruebas de trombofilia no afectará el tratamiento. Casi todas las recomendaciones de las pautas se basaron en evidencia de "certeza muy baja". [41]
El aborto recurrente es una indicación para la detección de trombofilia, en particular anticuerpos antifosfolípidos (anticardiolipina IgG e IgM, así como anticoagulante lúpico), mutación del factor V Leiden y de la protrombina, resistencia a la proteína C activada y una evaluación general de la coagulación mediante una investigación conocida como tromboelastografía . [11]
Las mujeres que planean usar anticonceptivos orales no se benefician de la detección sistemática de trombofilias, ya que el riesgo absoluto de eventos trombóticos es bajo. [41] Si la mujer o un familiar de primer grado ha tenido trombosis, el riesgo de desarrollarla aumenta. La detección sistemática de este grupo seleccionado puede ser beneficiosa, [29] pero incluso cuando el resultado es negativo puede indicar un riesgo residual. [12] Por lo tanto, las pautas profesionales sugieren que se utilicen formas alternativas de anticoncepción en lugar de depender de la detección sistemática. [12]
La detección de trombofilia en personas con trombosis arterial generalmente se considera poco gratificante y generalmente se desaconseja, [12] excepto posiblemente en pacientes inusualmente jóvenes (especialmente cuando está precipitada por el tabaquismo o el uso de anticonceptivos hormonales que contienen estrógeno ) y aquellos en quienes la revascularización, como el bypass arterial coronario , falla debido a la rápida oclusión del injerto. [9]
Varios análisis de trombofilia pueden verse afectados por la presencia de anticoagulantes . Por lo tanto, la mayoría de los análisis de trombofilia deben realizarse después de que el paciente haya completado el tratamiento inicial de anticoagulación. [41] Los esfuerzos para eliminar los anticoagulantes orales directos utilizando carbón activado [42] pueden resultar útiles en este sentido.
Las pruebas moleculares como el factor V Leiden y la protrombina G20210A no se ven afectadas por el estado fisiológico del paciente.

No existe un tratamiento específico para la trombofilia, a menos que sea causada por una enfermedad médica subyacente (como el síndrome nefrótico), en cuyo caso es necesario el tratamiento de la enfermedad subyacente. En aquellos con trombosis no provocada y/o recurrente, o aquellos con una forma de trombofilia de alto riesgo, la decisión más importante es si se deben utilizar medicamentos anticoagulantes, como la warfarina , a largo plazo para reducir el riesgo de episodios posteriores. [3] Este riesgo debe sopesarse frente al riesgo de que el tratamiento cause un sangrado significativo, ya que el riesgo informado de sangrado importante es de más del 3% por año, y el 11% de los que sufren sangrado importante pueden morir como resultado. [3]
Además de las formas de trombofilia mencionadas anteriormente, el riesgo de recurrencia después de un episodio de trombosis está determinado por factores como la extensión y la gravedad de la trombosis original, si fue provocada (por ejemplo, por inmovilización o embarazo), el número de eventos trombóticos previos, el sexo masculino, la presencia de un filtro de vena cava inferior , la presencia de cáncer, síntomas de síndrome postrombótico y obesidad . [3] Estos factores tienden a ser más importantes en la decisión que la presencia o ausencia de una trombofilia detectable. [12] [43]
A las personas con síndrome antifosfolípido se les puede ofrecer anticoagulación a largo plazo después de un primer episodio de trombosis no provocado. El riesgo está determinado por el subtipo de anticuerpo detectado, por el título de anticuerpos (cantidad de anticuerpos), si se detectan múltiples anticuerpos y si se detecta repetidamente o solo en una ocasión. [18]
Las mujeres con trombofilia que están considerando quedarse embarazadas o que ya están embarazadas suelen necesitar alternativas a la warfarina durante el embarazo, especialmente en las primeras 13 semanas, cuando puede producir anomalías en el feto. La heparina de bajo peso molecular (HBPM, como la enoxaparina ) se utiliza generalmente como alternativa. [44] La warfarina y la HBPM se pueden utilizar de forma segura durante la lactancia. [44]
Algunos estudios han sugerido que la heparina de bajo peso molecular reduce el riesgo de aborto espontáneo cuando las mujeres sufren pérdidas recurrentes de embarazo secundarias a trombofilia. Cuando se analizan los resultados de todos los estudios en conjunto, no se pudo demostrar ningún beneficio estadísticamente significativo. [45]
En personas sin trombofilia detectable, el riesgo acumulado de desarrollar trombosis a los 60 años es de alrededor del 12%. Alrededor del 60% de las personas con deficiencia de antitrombina habrán experimentado trombosis al menos una vez a los 60 años, al igual que alrededor del 50% de las personas con deficiencia de proteína C y alrededor de un tercio de las personas con deficiencia de proteína S. Las personas con resistencia a la proteína C activada (generalmente resultante del factor V Leiden), por el contrario, tienen un riesgo absoluto ligeramente mayor de trombosis, ya que el 15% ha tenido al menos un evento trombótico a los sesenta años. [14] En general, los hombres tienen más probabilidades que las mujeres de experimentar episodios repetidos de trombosis venosa. [5]
Las personas con factor V Leiden tienen un riesgo relativamente bajo de trombosis, pero pueden desarrollarla en presencia de un factor de riesgo adicional, como la inmovilización. La mayoría de las personas con la mutación de la protrombina (G20210A) nunca desarrollan trombosis. [14]
Las trombofilias mayores ("tipo 1") son poco frecuentes. La deficiencia de antitrombina está presente en el 0,2% de la población general y en el 0,5-7,5% de las personas con trombosis venosa. La deficiencia de proteína C también está presente en el 0,2% de la población y se puede encontrar en el 2,5-6% de las personas con trombosis. Se desconoce la prevalencia exacta de la deficiencia de proteína S en la población; se encuentra en el 1,3-5% de las personas con trombosis. [14]
Las trombofilias menores ("tipo 2") son mucho más comunes. El factor V Leiden está presente en el 5% de la población de ascendencia del norte de Europa, pero es mucho más raro en las personas de ascendencia asiática o africana. En las personas con trombosis, el 10% tiene factor V Leiden. En aquellos que son derivados para pruebas de trombofilia, el 30-50% tienen el defecto. La mutación de la protrombina ocurre en tasas del 1-4% en la población general, del 5-10% de las personas con trombosis y del 15% de las personas derivadas para pruebas de trombofilia. Al igual que el factor V Leiden, esta anomalía es poco común en africanos y asiáticos. [14]
La prevalencia exacta del síndrome antifosfolípido no se conoce bien, ya que los distintos estudios emplean distintas definiciones de la enfermedad. Los anticuerpos antifosfolípidos se detectan en el 24 % de los pacientes derivados a pruebas de trombofilia. [18]

El médico alemán Rudolf Virchow categorizó las anormalidades en la consistencia de la sangre como un factor en el desarrollo de la trombosis en 1856. La naturaleza exacta de estas anormalidades permaneció esquiva hasta que la primera forma de trombofilia, la deficiencia de antitrombina , fue reconocida en 1965 por el hematólogo noruego Olav Egeberg. [46] La deficiencia de proteína C siguió en 1981, cuando fue descrita por investigadores del Instituto de Investigación Scripps y los Centros para el Control de Enfermedades de EE. UU . [47] La deficiencia de proteína S siguió en 1984, descrita por investigadores de la Universidad de Oklahoma . [4] [5] [48]
El síndrome antifosfolípido se describió en su totalidad en la década de 1980, después de varios informes previos de anticuerpos específicos en personas con lupus eritematoso sistémico y trombosis. [18] [49] El síndrome a menudo se atribuye al reumatólogo británico Graham RV Hughes, y a menudo se lo conoce como síndrome de Hughes por esa razón. [50]
Las trombofilias genéticas más comunes se describieron en la década de 1990. Muchos estudios habían indicado previamente que muchas personas con trombosis mostraban resistencia a la proteína C activada. En 1994, un grupo de Leiden , Países Bajos, identificó el defecto subyacente más común: una mutación en el factor V que lo hacía resistente a la acción de la proteína C activada. El defecto se denominó factor V Leiden , ya que las anomalías genéticas suelen recibir el nombre del lugar donde se descubren. [51] Dos años más tarde, el mismo grupo describió una mutación común en el gen de la protrombina que causaba una elevación de los niveles de protrombina y un leve aumento del riesgo de trombosis. [4] [5] [52]
Se sospecha que en el futuro se descubrirán otras anomalías genéticas subyacentes a la trombosis familiar mediante estudios de todo el código genético , buscando pequeñas alteraciones en los genes . [4] [5]