

Los marcos metalorgánicos ( MOF ) son una clase de polímeros porosos que consisten en grupos de metales (también conocidos como unidades de construcción secundarias, SBU) coordinados con ligandos orgánicos para formar estructuras unidimensionales, bidimensionales o tridimensionales. Los ligandos orgánicos incluidos a veces se denominan "puntales" o "enlaces", un ejemplo es el ácido 1,4-bencenodicarboxílico (BDC).
Más formalmente, un marco metal-orgánico es una estructura extendida potencialmente porosa hecha de iones metálicos y enlaces orgánicos. [1] [2] [3] Una estructura extendida es una estructura cuyas subunidades ocurren en una proporción constante y están dispuestas en un patrón repetitivo. Los MOF son una subclase de redes de coordinación, que es un compuesto de coordinación que se extiende, a través de entidades de coordinación repetidas, en una dimensión, pero con enlaces cruzados entre dos o más cadenas individuales, bucles o enlaces espiro, o un compuesto de coordinación que se extiende a través de entidades de coordinación repetidas en dos o tres dimensiones. Las redes de coordinación que incluyen MOF pertenecen además a los polímeros de coordinación , que es un compuesto de coordinación con entidades de coordinación repetidas que se extienden en una, dos o tres dimensiones. [4] La mayoría de los MOF reportados en la literatura son compuestos cristalinos , pero también hay MOF amorfos , [5] y otras fases desordenadas. [6]
En la mayoría de los casos, los poros de los MOF son estables durante la eliminación de las moléculas huésped (a menudo disolventes) y podrían rellenarse con otros compuestos. Debido a esta propiedad, los MOF son de interés para el almacenamiento de gases como el hidrógeno y el dióxido de carbono . Otras posibles aplicaciones de los MOF son la purificación de gases , la separación de gases , la remediación de agua , [7] en catálisis , como sólidos conductores y como supercondensadores . [8]
La síntesis y las propiedades de los MOF constituyen el foco principal de la disciplina llamada química reticular (del latín reticulum , "pequeña red"). [9] A diferencia de los MOF, los marcos orgánicos covalentes (COF) están hechos completamente de elementos ligeros (H, B, C, N y O) con estructuras extendidas. [10]
Los MOF se componen de dos componentes principales: un grupo de metales inorgánicos (a menudo denominado unidad de construcción secundaria o SBU) y una molécula orgánica llamada enlazador. Por este motivo, los materiales suelen denominarse materiales híbridos orgánico-inorgánicos. [4] Las unidades orgánicas suelen ser ligandos monovalentes, divalentes, trivalentes o tetravalentes . [11] La elección del metal y del enlazador determina la estructura y, por lo tanto, las propiedades del MOF. Por ejemplo, la preferencia de coordinación del metal influye en el tamaño y la forma de los poros al determinar cuántos ligandos pueden unirse al metal y en qué orientación.
Para describir y organizar las estructuras de los MOF, se ha desarrollado un sistema de nomenclatura. Las subunidades de un MOF, llamadas unidades de construcción secundarias (SBU), se pueden describir mediante topologías comunes a varias estructuras. A cada topología, también llamada red, se le asigna un símbolo, que consta de tres letras minúsculas en negrita. MOF-5 , por ejemplo, tiene una red pcu .
Los ligandos puente están unidos a las SBU . En el caso de los MOF, los ligandos puente típicos son los ácidos dicarboxílicos y tricarboxílicos. Estos ligandos suelen tener cadenas principales rígidas. Algunos ejemplos son el ácido benceno-1,4-dicarboxílico (BDC o ácido tereftálico), el ácido bifenil-4,4 ′ -dicarboxílico (BPDC) y el ácido tricarboxílico trimésico .

El estudio de los MOF tiene sus raíces en la química de coordinación y la química inorgánica del estado sólido, pero se convirtió en un nuevo campo. Además, los MOF se construyen a partir de ligandos orgánicos puente que permanecen intactos durante toda la síntesis. [13] La síntesis de zeolitas a menudo hace uso de una "plantilla". Las plantillas son iones que influyen en la estructura del marco inorgánico en crecimiento. Los iones de plantilla típicos son los cationes de amonio cuaternario, que se eliminan más tarde. En los MOF, la estructura está formada por la SBU (unidad de construcción secundaria) y los ligandos orgánicos. [14] [15] Un enfoque de plantilla que es útil para los MOF destinados al almacenamiento de gas es el uso de disolventes que se unen a los metales, como N , N -dietilformamida y agua. En estos casos, los sitios de metal quedan expuestos cuando se evacua el disolvente, lo que permite que el hidrógeno se una a estos sitios. [16]
Cuatro desarrollos fueron particularmente importantes en el avance de la química de los MOF. [17] (1) El principio geométrico de construcción donde las unidades que contenían metal se mantenían en formas rígidas. Los primeros MOF contenían átomos individuales unidos a enlaces de coordinación ditópicos. El enfoque no solo condujo a la identificación de un pequeño número de topologías preferidas que podrían ser el objetivo en la síntesis diseñada, sino que fue el punto central para lograr una porosidad permanente. (2) El uso del principio isorreticular donde el tamaño y la naturaleza de una estructura cambia sin cambiar su topología condujo a MOF con porosidad ultraalta y aberturas de poro inusualmente grandes. (3) La modificación post-sintética de los MOF aumentó su funcionalidad al reaccionar unidades orgánicas y complejos metalorgánicos con enlaces. (4) Los MOF multifuncionales incorporaron múltiples funcionalidades en un solo marco.
Dado que los ligandos en los MOF suelen unirse de forma reversible, el crecimiento lento de los cristales suele permitir que los defectos se vuelvan a disolver, lo que da como resultado un material con cristales a escala milimétrica y una densidad de defectos cercana al equilibrio. La síntesis solvotérmica es útil para el crecimiento de cristales adecuados para la determinación de la estructura, porque los cristales crecen en el transcurso de horas a días. Sin embargo, el uso de MOF como materiales de almacenamiento para productos de consumo exige una inmensa ampliación de su síntesis. La ampliación de escala de los MOF no se ha estudiado ampliamente, aunque varios grupos han demostrado que se pueden utilizar microondas para nuclear rápidamente cristales de MOF a partir de una solución. [18] [19] Esta técnica, denominada "síntesis solvotérmica asistida por microondas", se utiliza ampliamente en la literatura sobre zeolitas, [13] y produce cristales a escala micrométrica en cuestión de segundos a minutos, [18] [19] en rendimientos similares a los métodos de crecimiento lento.
Algunos MOF, como el mesoporoso MIL-100(Fe), [20] se pueden obtener en condiciones suaves a temperatura ambiente y en solventes verdes (agua, etanol) a través de métodos de síntesis escalables.
Se ha descrito una síntesis sin disolventes de una gama de MOF cristalinos. [21] Por lo general, el acetato de metal y el proligando orgánico se mezclan y se muelen con un molino de bolas . Cu 3 (BTC) 2 se puede sintetizar rápidamente de esta manera con un rendimiento cuantitativo. En el caso de Cu 3 (BTC) 2, la morfología del producto sintetizado sin disolventes fue la misma que la del Basolite C300 fabricado industrialmente. Se cree que la fusión localizada de los componentes debido a la alta energía de colisión en el molino de bolas puede ayudar a la reacción. La formación de ácido acético como subproducto en las reacciones en el molino de bolas también puede ayudar a que la reacción tenga un efecto disolvente [22] en el molino de bolas. Se ha demostrado que la adición de pequeñas cantidades de etanol para la síntesis mecanoquímica de Cu 3 (BTC) 2 reduce significativamente la cantidad de defectos estructurales en el material obtenido. [23]
Un avance reciente en la preparación sin disolventes de películas y compuestos de MOF es su síntesis mediante deposición química en fase de vapor . Este proceso, MOF-CVD, [24] se demostró por primera vez para ZIF-8 y consta de dos pasos. En un primer paso, se depositan capas precursoras de óxido metálico. En el segundo paso, estas capas precursoras se exponen a moléculas de ligando sublimadas , que inducen una transformación de fase a la red cristalina de MOF. La formación de agua durante esta reacción juega un papel crucial en la dirección de la transformación. Este proceso se amplió con éxito a un proceso integrado de sala limpia, de conformidad con los estándares de microfabricación industrial. [25]
Se han descrito numerosos métodos para el crecimiento de MOF como películas delgadas orientadas. Sin embargo, estos métodos solo son adecuados para la síntesis de un pequeño número de topologías de MOF. Un ejemplo de ello es la conversión asistida por vapor (VAC), que se puede utilizar para la síntesis de películas delgadas de varios MOF de tipo UiO. [26]
Los métodos de alto rendimiento (HT) son parte de la química combinatoria y una herramienta para aumentar la eficiencia. Existen dos estrategias sintéticas dentro de los métodos HT: en el enfoque combinatorio, todas las reacciones tienen lugar en un recipiente, lo que da lugar a mezclas de productos. En la síntesis paralela, las reacciones tienen lugar en diferentes recipientes. Además, se hace una distinción entre películas delgadas y métodos basados en disolventes. [27]
La síntesis solvotérmica se puede llevar a cabo de forma convencional en un reactor de teflón en un horno de convección o en reactores de vidrio en un horno de microondas (síntesis de microondas de alto rendimiento). El uso de un horno de microondas cambia, en parte de forma drástica, los parámetros de la reacción.
Además de la síntesis solvotérmica, se han producido avances en el uso de fluido supercrítico como disolvente en un reactor de flujo continuo. El agua supercrítica se utilizó por primera vez en 2012 para sintetizar MOF basados en cobre y níquel en tan solo unos segundos. [28] En 2020, se utilizó dióxido de carbono supercrítico en un reactor de flujo continuo a lo largo de la misma escala de tiempo que el método basado en agua supercrítica, pero el punto crítico más bajo del dióxido de carbono permitió la síntesis del MOF basado en circonio UiO-66. [29]
En la síntesis solvotérmica de alto rendimiento se utiliza un reactor solvotérmico con, por ejemplo, 24 cavidades para reactores de teflón. Este tipo de reactor se denomina a veces multiclav. El bloque del reactor o inserto del reactor está hecho de acero inoxidable y contiene 24 cámaras de reacción, que están dispuestas en cuatro filas. Con los reactores de teflón miniaturizados, se pueden utilizar volúmenes de hasta 2 ml. El bloque del reactor se sella en un autoclave de acero inoxidable; para ello, los reactores llenos se introducen en el fondo del reactor, los reactores de teflón se sellan con dos películas de teflón y se coloca la parte superior del reactor. A continuación, el autoclave se cierra en una prensa hidráulica. El reactor solvotérmico sellado se puede someter a un programa de temperatura y tiempo. La película de teflón reutilizable sirve para soportar la tensión mecánica, mientras que la película de teflón desechable sella los recipientes de reacción. Después de la reacción, los productos se pueden aislar y lavar en paralelo en un dispositivo de filtrado al vacío. Los productos se presentan por separado en el papel de filtro en una biblioteca de muestras y pueden caracterizarse posteriormente mediante difracción de rayos X en polvo automatizada. La información obtenida se utiliza después para planificar otras síntesis. [30]
Los eventos de reemplazo mineral pseudomórfico ocurren cuando una fase mineral entra en contacto con un fluido con el que está fuera de equilibrio. El reequilibrio tenderá a ocurrir para reducir la energía libre y transformar la fase inicial en una fase termodinámicamente más estable, involucrando subprocesos de disolución y reprecipitación. [31] [32]
Inspiradas por tales procesos geológicos, las películas delgadas de MOF se pueden cultivar mediante la combinación de deposición de capa atómica (ALD) de óxido de aluminio sobre un sustrato adecuado (por ejemplo, FTO) y la posterior síntesis solvotérmica por microondas. La capa de óxido de aluminio sirve tanto como agente director de la arquitectura como fuente de metal para la estructura principal de MOF. [33] La construcción del marco metalorgánico 3D poroso tiene lugar durante la síntesis por microondas, cuando el sustrato depositado en la capa atómica se expone a una solución del enlazador requerido en una mezcla de DMF / H2O 3:1 (v/v) a temperatura elevada. De manera análoga, Kornienko y colaboradores describieron en 2015 la síntesis de un MOF de cobalto-porfirina (Al2 ( OH) 2TCPP -Co; TCPP-H2 = 4,4 ′ ,4″,4‴-(porfirina-5,10,15,20-tetrail)tetrabenzoato), el primer catalizador MOF construido para la conversión electrocatalítica de CO2 acuoso a CO . [34]
Aunque la estructura tridimensional y el entorno interno de los poros se pueden controlar en teoría mediante la selección adecuada de nodos y grupos de enlace orgánicos, la síntesis directa de dichos materiales con las funcionalidades deseadas puede ser difícil debido a la alta sensibilidad de los sistemas MOF. La sensibilidad térmica y química, así como la alta reactividad de los materiales de reacción, pueden dificultar la formación de los productos deseados. El intercambio de moléculas huésped y contraiones y la eliminación de disolventes permiten cierta funcionalidad adicional, pero aún se limitan a las partes integrales de la estructura. [35] El intercambio post-sintético de enlaces orgánicos e iones metálicos es un área en expansión del campo y abre posibilidades para estructuras más complejas, mayor funcionalidad y mayor control del sistema. [35] [36]
Las técnicas de modificación post-sintética se pueden utilizar para intercambiar un grupo de enlace orgánico existente en un MOF prefabricado con un nuevo enlazador mediante intercambio de ligando o intercambio parcial de ligando. [36] [37] Este intercambio permite que los poros y, en algunos casos, la estructura general de los MOF, se adapten a fines específicos. Algunos de estos usos incluyen el ajuste fino del material para la adsorción selectiva, el almacenamiento de gas y la catálisis. [36] [16] Para realizar el intercambio de ligando, los cristales de MOF prefabricados se lavan con disolvente y luego se sumergen en una solución del nuevo enlazador. El intercambio a menudo requiere calor y ocurre en la escala de tiempo de unos pocos días. [37] El intercambio de ligando post-sintético también permite la incorporación de grupos funcionales en MOF que de otra manera no sobrevivirían a la síntesis de MOF, debido a la temperatura, el pH u otras condiciones de reacción, o dificultarían la síntesis en sí misma por competencia con grupos donantes en el ligando prestado. [36]
Las técnicas de modificación post-sintética también se pueden utilizar para intercambiar un ion metálico existente en un MOF prefabricado con un nuevo ion metálico mediante intercambio de iones metálicos. La metátesis metálica completa a partir de una parte integral de la estructura se ha logrado sin alterar la estructura de la estructura o de los poros del MOF. De manera similar al intercambio de ligando post-sintético, el intercambio de metal post-sintético se realiza lavando los cristales de MOF prefabricados con solvente y luego sumergiendo el cristal en una solución del nuevo metal. [38] El intercambio de metal post-sintético permite una ruta simple para la formación de MOF con la misma estructura pero con diferentes iones metálicos. [35]
Además de modificar la funcionalidad de los ligandos y los metales mismos, la modificación post-sintética se puede utilizar para ampliar la estructura del MOF. Mediante la modificación post-sintética, los MOF se pueden convertir de un material cristalino altamente ordenado a un material poroso heterogéneo. [39] Mediante el uso de técnicas post-sintéticas, es posible la instalación controlada de dominios dentro de un cristal MOF que exhiben características estructurales y funcionales únicas. Se han preparado MOF de núcleo-capa y otros MOF en capas donde las capas tienen una funcionalización única pero en la mayoría de los casos son cristalográficamente compatibles de capa a capa. [40]
En algunos casos, los nodos metálicos de MOF tienen un entorno insaturado, y es posible modificar este entorno utilizando diferentes técnicas. Si el tamaño del ligando coincide con el tamaño de la apertura del poro, es posible instalar ligandos adicionales en la estructura MOF existente. [41] [42] A veces, los nodos metálicos tienen una buena afinidad de unión con las especies inorgánicas. Por ejemplo, se demostró que los nodos metálicos pueden realizar una extensión y crear un enlace con el catión uranilo. [43]
Otro enfoque para aumentar la adsorción en MOF es alterar el sistema de tal manera que la quimisorción se vuelva posible. Esta funcionalidad se ha introducido mediante la fabricación de un material compuesto, que contiene un MOF y un complejo de platino con carbón activado . En un efecto conocido como derrame de hidrógeno , el H 2 puede unirse a la superficie del platino a través de un mecanismo disociativo que escinde la molécula de hidrógeno en dos átomos de hidrógeno y les permite viajar por el carbón activado hasta la superficie del MOF. Esta innovación produjo un aumento de tres veces en la capacidad de almacenamiento a temperatura ambiente de un MOF; sin embargo, la desorción puede tardar más de 12 horas, y a veces se observa una desorción reversible durante solo dos ciclos. [44] [45] La relación entre el derrame de hidrógeno y las propiedades de almacenamiento de hidrógeno en MOF no se entiende bien, pero puede resultar relevante para el almacenamiento de hidrógeno.

Los MOF tienen potencial como catalizadores heterogéneos , aunque no se han comercializado aplicaciones. [46] Su gran área superficial, porosidad ajustable, diversidad en grupos metálicos y funcionales los hacen especialmente atractivos para su uso como catalizadores. Las zeolitas son extraordinariamente útiles en catálisis. [47] Las zeolitas están limitadas por la coordinación tetraédrica fija de los puntos de conexión Si/Al y los enlaces de óxido de dos coordinaciones. Se conocen menos de 200 zeolitas. En contraste con este alcance limitado, los MOF exhiben geometrías de coordinación más diversas , enlaces politópicos y ligandos auxiliares (F − , OH − , H 2 O entre otros). También es difícil obtener zeolitas con tamaños de poro mayores a 1 nm, lo que limita las aplicaciones catalíticas de las zeolitas a moléculas orgánicas relativamente pequeñas (típicamente no más grandes que los xilenos ). Además, las condiciones sintéticas suaves que se emplean normalmente para la síntesis de MOF permiten la incorporación directa de funcionalidades delicadas en las estructuras del marco. Un proceso de este tipo no sería posible con zeolitas u otros materiales microporosos basados en óxidos cristalinos debido a las duras condiciones que se utilizan normalmente para su síntesis (por ejemplo, calcinación a altas temperaturas para eliminar las plantillas orgánicas). El marco metalorgánico MIL-101 es uno de los MOF más utilizados para la catálisis que incorpora diferentes metales de transición como el Cr. [48] Sin embargo, la estabilidad de algunos fotocatalizadores MOF en un medio acuoso y en condiciones fuertemente oxidantes es muy baja. [49] [50]
Las zeolitas aún no pueden obtenerse en forma enantiopura, lo que impide sus aplicaciones en síntesis catalítica asimétrica , por ejemplo, para las industrias farmacéutica, agroquímica y de fragancias. Los ligandos quirales enantiopuros o sus complejos metálicos se han incorporado a los MOF para dar lugar a catalizadores asimétricos eficientes. Incluso algunos materiales MOF pueden salvar la brecha entre las zeolitas y las enzimas cuando combinan sitios polinucleares aislados, respuestas dinámicas de anfitrión-huésped y un entorno de cavidad hidrofóbica . Los MOF pueden ser útiles para fabricar semiconductores. Los cálculos teóricos muestran que los MOF son semiconductores o aislantes con brechas de banda entre 1,0 y 5,5 eV que pueden alterarse cambiando el grado de conjugación en los ligandos, lo que indica su posibilidad de ser fotocatalizadores.

Al igual que otros catalizadores heterogéneos , los MOF pueden permitir una separación posterior a la reacción y una reciclabilidad más sencillas que los catalizadores homogéneos . En algunos casos, también proporcionan una estabilidad del catalizador muy mejorada. Además, suelen ofrecer selectividad en función del tamaño del sustrato. No obstante, si bien es claramente importante para las reacciones en sistemas vivos, la selectividad en función del tamaño del sustrato tiene un valor limitado en la catálisis abiótica, ya que generalmente se encuentran disponibles materias primas razonablemente puras.

Entre los primeros informes de catálisis basada en MOF se encontraba la cianosililación de aldehídos mediante un MOF 2D (rejillas cuadradas en capas) de fórmula Cd(4,4 ′ -bpy) 2 (NO 3 ) 2 . [51] Esta investigación se centró principalmente en la clatración selectiva por tamaño y forma. Un segundo conjunto de ejemplos se basó en un MOF bidimensional de rejilla cuadrada que contenía iones Pd (II) individuales como nodos y 2-hidroxipirimidinolatos como puntales. [52] A pesar de la saturación coordinativa inicial , los centros de paladio en este MOF catalizan la oxidación del alcohol, la hidrogenación de olefinas y el acoplamiento C–C de Suzuki. Como mínimo, estas reacciones implican necesariamente oscilaciones redox de los nodos metálicos entre los intermediarios Pd (II) y Pd (0) acompañadas de cambios drásticos en el número de coordinación, lo que ciertamente conduciría a la desestabilización y la posible destrucción del marco original si todos los centros de Pd son catalíticamente activos. La observación de la selectividad de forma y tamaño del sustrato implica que las reacciones catalíticas son heterogéneas y de hecho están ocurriendo dentro del MOF. Sin embargo, al menos para la hidrogenación, es difícil descartar la posibilidad de que la catálisis esté ocurriendo en la superficie de los grupos/ nanopartículas de paladio encapsuladas en MOF (es decir, sitios de descomposición parcial) o sitios defectuosos, en lugar de en nodos MOF de un solo átomo transitoriamente lábiles, pero por lo demás intactos. La catálisis basada en MOF "oportunista" se ha descrito para el compuesto cúbico, MOF-5. [53] Este material comprende nodos Zn 4 O saturados coordinativamente y puntales BDC completamente complejados (ver arriba para la abreviatura); Sin embargo, aparentemente cataliza la terc-butilación de Friedel-Crafts tanto del tolueno como del bifenilo . Además, la alquilación en para es fuertemente favorecida sobre la alquilación en orto, un comportamiento que se cree que refleja la encapsulación de los reactivos por el MOF.
El material de estructura porosa [Cu 3 (btc) 2 (H 2 O) 3 ] , también conocido como HKUST-1, [54] contiene grandes cavidades que tienen ventanas de diámetro ~6 Å. Las moléculas de agua coordinadas se eliminan fácilmente, dejando sitios Cu(II) abiertos. Kaskel y sus colaboradores demostraron que estos sitios de ácido de Lewis podrían catalizar la cianosililación de benzaldehído o acetona . La versión anhidra de HKUST-1 es un catalizador ácido. [55] En comparación con las vías catalizadas por Brønsted vs. ácido de Lewis , la selectividad del producto es distintiva para tres reacciones: isomerización de óxido de α-pineno, ciclización de citronelal y reordenamiento de α-bromoacetales, lo que indica que, de hecho, [Cu 3 (btc) 2 ] funciona principalmente como un catalizador de ácido de Lewis . También se ha demostrado que la selectividad del producto y el rendimiento de las reacciones catalíticas (por ejemplo, ciclopropanación ) se ven afectados por sitios defectuosos, como Cu(I) o por fracciones de ácido carboxílico desprotonadas de forma incompleta de los enlaces. [23]
MIL-101, un MOF de gran cavidad que tiene la fórmula [Cr 3 F(H 2 O) 2 O(BDC) 3 ], es un catalizador de cianosililación. [56] Las moléculas de agua coordinadas en MIL-101 se eliminan fácilmente para exponer los sitios Cr(III). Como se podría esperar, dada la mayor acidez de Lewis de Cr(III) frente a Cu(II), MIL-101 es mucho más activo que HKUST-1 como catalizador para la cianosililación de aldehídos . Además, el grupo de Kaskel observó que los sitios catalíticos de MIL-101, en contraste con los de HKUST-1, son inmunes a la reducción no deseada por benzaldehído . Long y sus colaboradores también han llevado a cabo la cianosililación de aldehídos aromáticos catalizada por ácidos de Lewis utilizando un MOF de fórmula Mn 3 [(Mn 4 Cl) 3 BTT 8 (CH 3 OH) 10 ]. [57] Este material contiene una estructura de poro tridimensional, con un diámetro de poro igual a 10 Å. En principio, cualquiera de los dos tipos de sitios de Mn (II) podría funcionar como catalizador . Las características notables de este catalizador son los altos rendimientos de conversión (para sustratos pequeños) y la buena selectividad del tamaño del sustrato, consistente con la catálisis localizada en el canal.
El enfoque de encapsulación de MOF invita a la comparación con estudios anteriores de catálisis oxidativa por sistemas de Fe ( porfirina ) encapsulados en zeolita [58] así como de Mn ( porfirina ) [59] . Los estudios de zeolita emplearon generalmente yodosilbenceno (PhIO), en lugar de TPHP como oxidante. La diferencia es probablemente significativa desde el punto de vista mecanístico, lo que complica las comparaciones. Brevemente, PhIO es un donante de un solo átomo de oxígeno, mientras que TBHP es capaz de un comportamiento más complejo. Además, para el sistema basado en MOF, es concebible que la oxidación proceda tanto a través de la transferencia de oxígeno desde un intermedio oxo de manganeso como de una vía de reacción en cadena de radicales iniciada por manganeso . Independientemente del mecanismo, el enfoque es prometedor para aislar y, por lo tanto, estabilizar las porfirinas contra la formación de dímeros con puentes oxo y la degradación oxidativa. [60]
La mayoría de los ejemplos de catálisis basada en MOF hacen uso de iones o átomos de metal como sitios activos. Entre las pocas excepciones se encuentran dos MOF que contienen níquel y dos de cobre sintetizados por Rosseinsky y colaboradores. [61] Estos compuestos emplean aminoácidos (L- o D- aspartato ) junto con dipiridilos como puntales. La química de coordinación es tal que el grupo amino del aspartato no puede ser protonado por HCl añadido , pero uno de los carboxilatos de aspartato sí. Por lo tanto, el aminoácido incorporado al marco puede existir en una forma que no es accesible para el aminoácido libre . Mientras que los compuestos basados en níquel son marginalmente porosos , debido a las pequeñas dimensiones del canal, las versiones de cobre son claramente porosas. El grupo de Rosseinsky demostró que los ácidos carboxílicos se comportan como catalizadores ácidos de Brønsted, facilitando (en los casos de cobre) la metanólisis por apertura de anillo de un epóxido pequeño y accesible a la cavidad con un rendimiento de hasta el 65%. Sin embargo, existen catalizadores homogéneos superiores.
Kitagawa y colaboradores han informado de la síntesis de un MOF catalítico que tiene la fórmula [Cd(4-BTAPA) 2 (NO 3 ) 2 ]. [62] El MOF es tridimensional, y consiste en un par idéntico de redes encadenadas, pero aún presenta poros de dimensiones moleculares. Los nodos consisten en iones de cadmio individuales , ligados octaédricamente por nitrógenos de piridilos. Sin embargo, desde el punto de vista de la catálisis , la característica más interesante de este material es la presencia de funcionalidades de amida accesibles para huéspedes . Las amidas son capaces de catalizar con base la condensación de Knoevenagel de benzaldehído con malononitrilo . Sin embargo, las reacciones con nitrilos más grandes solo se aceleran marginalmente, lo que implica que la catálisis tiene lugar principalmente dentro de los canales del material en lugar de en su exterior. Un hallazgo notable es la falta de catálisis por parte del puntal libre en solución homogénea, evidentemente debido a la unión de H intermolecular entre las moléculas de bptda. De esta manera, la arquitectura MOF genera una actividad catalítica que de otro modo no se encontraría.
En un interesante enfoque alternativo, Férey y sus colaboradores pudieron modificar el interior de MIL-101 a través de la coordinación de Cr (III) de uno de los dos átomos de nitrógeno disponibles de cada una de varias moléculas de etilendiamina . [63] Los extremos libres no coordinados de las etilendiaminas se utilizaron luego como catalizadores básicos de Brønsted, nuevamente para la condensación de Knoevenagel de benzaldehído con nitrilos .
Kim Kimoon y colaboradores describieron un tercer enfoque . [64] Utilizando un derivado funcionalizado con piridina del ácido tartárico y una fuente de Zn (II), pudieron sintetizar un MOF 2D denominado POST-1. POST-1 posee canales 1D cuyas secciones transversales están definidas por seis grupos de zinc trinucleares y seis puntales. Mientras que tres de las seis piridinas están coordinadas por iones de zinc, las tres restantes están protonadas y se dirigen hacia el interior del canal. Cuando se neutralizan, se descubre que los grupos piridilo no coordinados catalizan las reacciones de transesterificación , presumiblemente al facilitar la desprotonación del alcohol reactivo . La ausencia de catálisis significativa cuando se emplean alcoholes grandes sugiere firmemente que la catálisis ocurre dentro de los canales del MOF.

Los metales en la estructura MOF a menudo actúan como ácidos de Lewis . Los metales en MOF a menudo se coordinan con moléculas de solvente lábiles o contraiones que pueden eliminarse después de la activación del marco. La naturaleza ácida de Lewis de tales centros metálicos insaturados puede activar los sustratos orgánicos coordinados para transformaciones orgánicas posteriores. El uso de centros metálicos insaturados se demostró en la cianosililación de aldehídos e iminas por Fujita y colaboradores en 2004. [65] Informaron MOF de composición {[Cd(4,4 ′ -bpy) 2 (H 2 O) 2 ] • (NO 3 ) 2 • 4H 2 O} que se obtuvo al tratar el ligando puente lineal 4,4 ′ - bipiridina (bpy) con Cd(NO 3 ) 2 . Los centros de Cd(II) en este MOF poseen una geometría octaédrica distorsionada con cuatro piridinas en las posiciones ecuatoriales y dos moléculas de agua en las posiciones axiales para formar una red infinita bidimensional. En la activación, se eliminaron dos moléculas de agua dejando los centros metálicos insaturados y ácidos de Lewis. El carácter ácido de Lewis del centro metálico se probó en reacciones de cianosililación de imina donde la imina se une al centro metálico ácido de Lewis dando como resultado una mayor electrofilicidad de las iminas. Para la cianosililación de iminas, la mayoría de las reacciones se completaron en 1 h produciendo aminonitrilos en rendimiento cuantitativo. Kaskel y colaboradores [66] llevaron a cabo reacciones de cianosililación similares con metales insaturados coordinativamente en MOF tridimensionales (3D) como catalizadores heterogéneos. El marco 3D [Cu 3 (btc) 2 (H 2 O) 3 ] (btc: benceno-1,3,5-tricarboxilato ) ( HKUST-1 ) utilizado en este estudio fue informado por primera vez por Williams et al. [67] El marco abierto de [Cu 3 (btc) 2 (H 2 O) 3 ] está construido a partir de unidades tetracarboxilato cúprico diméricas (ruedas de paletas) con moléculas de agua que se coordinan con las posiciones axiales y ligandos puente btc. El marco resultante después de la eliminación de dos moléculas de agua de las posiciones axiales posee un canal poroso. Este MOF activado cataliza la trimetilcianosililación de benzaldehídos .con una conversión muy baja (<5% en 24 h) a 293 K. Cuando la temperatura de reacción se elevó a 313 K, se obtuvo una buena conversión del 57% con una selectividad del 89% después de 72 h. En comparación, se observó una conversión de menos del 10% para la reacción de fondo (sin MOF) en las mismas condiciones. Pero esta estrategia sufre algunos problemas como 1) la descomposición de la estructura con el aumento de la temperatura de reacción debido a la reducción de Cu(II) a Cu(I) por aldehídos ; 2) fuerte efecto de inhibición del disolvente; los disolventes donadores de electrones como el THF compitieron con los aldehídos por la coordinación con los sitios Cu(II), y no se observó ningún producto de cianosililación en estos disolventes; 3) la inestabilidad de la estructura en algunos disolventes orgánicos. Varios otros grupos también han informado del uso de centros metálicos en MOF como catalizadores. [57] [68] Nuevamente, la naturaleza deficiente en electrones de algunos metales y grupos de metales hace que los MOF resultantes sean catalizadores de oxidación eficientes . Mori y colaboradores [69] informaron MOF con unidades de rueda de paletas de Cu2 como catalizadores heterogéneos para la oxidación de alcoholes . La actividad catalítica del MOF resultante se examinó llevando a cabo la oxidación de alcohol con H2O2 como oxidante . También catalizó la oxidación de alcohol primario, alcohol secundario y alcoholes bencílicos con alta selectividad. Hill et al. [70] han demostrado la sulfoxidación de tioéteres utilizando un MOF basado en unidades de construcción de clúster de vanadio- oxo V6O13 .
Los enlaces funcionales también se pueden utilizar como sitios catalíticos. Un MOF 3D {[Cd(4-BTAPA) 2 (NO 3 ) 2 ] • 6H 2 O • 2DMF} (4-BTAPA = ácido 1,3,5-benceno tricarboxílico tris [N-(4-piridil)amida], DMF = N , N -dimetilformamida) construido por enlaces amida tridentados y sal de cadmio cataliza la reacción de condensación de Knoevenagel . [62] Los grupos piridina en el ligando 4-BTAPA actúan como ligandos que se unen a los centros octaédricos de cadmio, mientras que los grupos amida pueden proporcionar la funcionalidad para la interacción con los sustratos entrantes. Específicamente, la fracción −NH del grupo amida puede actuar como aceptor de electrones mientras que el grupo C=O puede actuar como donante de electrones para activar sustratos orgánicos para reacciones posteriores. Ferey et al. [71] informaron sobre un MOF robusto y altamente poroso [Cr 3 (μ 3 -O)F(H 2 O) 2 (BDC) 3 ] (BDC: benceno-1,4-dicarboxilato) donde en lugar de usar directamente los centros insaturados de Cr(III) como sitios catalíticos, los autores injertaron etilendiamina (ED) en los sitios de Cr(III). Los extremos no coordinados de ED pueden actuar como sitios catalíticos básicos. Se investigó el MOF injertado con ED para reacciones de condensación de Knoevenagel. Se observó un aumento significativo en la conversión para el MOF injertado con ED en comparación con el marco no tratado (98% frente a 36%). Otro ejemplo de modificación del enlazador para generar un sitio catalítico son los MOF basados en Al funcionalizados con yodo bien conocidos (MIL-53 y DUT-5) y los MOF basados en Zr (UiO-66 y UiO-67) para la oxidación catalítica de dioles. [72] [73]
El atrapamiento de metales nobles catalíticamente activos se puede lograr injertando grupos funcionales en el sitio metálico insaturado de los MOF. Se ha demostrado que la etilendiamina (ED) se injerta en los sitios metálicos de Cr y se puede modificar aún más para encapsular metales nobles como el Pd. [63] El Pd atrapado tiene una actividad catalítica similar a la del Pd/C en la reacción de Heck . Las nanopartículas de rutenio tienen actividad catalítica en varias reacciones cuando se atrapan en la estructura del MOF-5. [74] Este MOF encapsulado en Ru cataliza la oxidación del alcohol bencílico a benzaldehído , aunque se produce la degradación del MOF. El mismo catalizador se utilizó en la hidrogenación del benceno a ciclohexano . En otro ejemplo, las nanopartículas de Pd incrustadas en la estructura defectuosa del HKUST-1 permiten la generación de sitios básicos de Lewis ajustables. [75] Por lo tanto, este compuesto multifuncional de Pd/MOF es capaz de realizar la oxidación de alcohol bencílico y la condensación de Knoevenagel en etapas.
Los MOF pueden resultar útiles tanto para reacciones fotoquímicas como de polimerización debido a la capacidad de ajuste del tamaño y la forma de sus poros. Un MOF 3D {[Co(bpdc) 3 (bpy)] • 4DMF • H2O } (bpdc: bifenildicarboxilato, bpy: 4,4′ - bipiridina) fue sintetizado por Li y colaboradores. [76] Usando este MOF se estudió extensamente la fotoquímica de o -metildibencilcetona ( o -MeDBK). Se encontró que esta molécula tiene una variedad de propiedades de reacción fotoquímica incluyendo la producción de ciclopentanol . Los MOF se han usado para estudiar la polimerización en el espacio confinado de los canales MOF. Las reacciones de polimerización en espacio confinado pueden tener propiedades diferentes a la polimerización en espacio abierto. Kitagawa y colaboradores han estudiado estireno , divinilbenceno , acetilenos sustituidos , metacrilato de metilo y acetato de vinilo como posibles monómeros activados para polimerización radical . [77] [78] Debido al diferente tamaño del enlazador, el tamaño del canal MOF podría ajustarse en el orden de aproximadamente 25 y 100 Å 2 . Se demostró que los canales estabilizan la propagación de radicales y suprimen las reacciones de terminación cuando se utilizan como sitios de polimerización radical.
Existen varias estrategias para construir MOF homoquirales . La cristalización de MOF homoquirales a través de la autorresolución a partir de ligandos de enlace aquirales es una de las formas de lograr tal objetivo. Sin embargo, las muestras a granel resultantes contienen ambos enantiomorfos y son racémicas. Aoyama y colaboradores [79] obtuvieron con éxito MOF homoquirales en masa a partir de ligandos aquirales controlando cuidadosamente la nucleación en el proceso de crecimiento del cristal . Zheng y colaboradores [80] informaron la síntesis de MOF homoquirales a partir de ligandos aquirales manipulando químicamente la fluctuación estadística de la formación de pares enantioméricos de cristales. El crecimiento de cristales MOF bajo influencias quirales es otro enfoque para obtener MOF homoquirales utilizando ligandos de enlace aquirales. Rosseinsky y colaboradores [81] [82] han introducido un coligando quiral para dirigir la formación de MOF homoquirales controlando la lateralidad de las hélices durante el crecimiento del cristal. Morris y colaboradores [83] utilizaron líquido iónico con cationes quirales como medio de reacción para sintetizar MOF y obtuvieron MOF homoquirales. Sin embargo, la estrategia más sencilla y racional para sintetizar MOF homoquirales es utilizar los ligandos de enlace quirales disponibles para su construcción.
Lin y colaboradores han creado MOF homoquirales utilizando 2,2′ - bis(difenilfosfino)-1,1′ - binaftilo ( BINAP ) y 1,1′ - bi-2,2′ - naftol ( BINOL ) como ligandos quirales. [84] Estos ligandos pueden coordinarse con sitios metálicos catalíticamente activos para mejorar la enantioselectividad . Se pueden introducir selectivamente diversos grupos de enlace, como piridina , ácido fosfónico y ácido carboxílico , en las posiciones 3,3 ′ , 4,4 ′ y 6,6 ′ de la fracción 1,1'-binaftilo. Además, al cambiar la longitud de los ligandos de enlace, se puede ajustar selectivamente la porosidad y la estructura del marco del MOF.
Lin y colaboradores han demostrado que la posmodificación de MOF se puede lograr para producir MOF homoquirales enantioselectivos para su uso como catalizadores. [85] El MOF homoquiral 3D resultante {[Cd 3 (L) 3 Cl 6 ] • 4DMF • 6MeOH • 3H 2 O} (L=(R)-6,6'-dicloro-2,2'-dihidroxil-1,1'-binaftil-bipiridina) sintetizado por Lin demostró tener una eficiencia catalítica similar para la reacción de adición de dietilzinc en comparación con el análogo homogéneo cuando se pretrató con Ti(O i Pr) 4 para generar la especie Ti-BINOLate injertada. La actividad catalítica de los MOF puede variar dependiendo de la estructura del marco. Lin y otros encontraron que los MOF sintetizados a partir de los mismos materiales podrían tener actividades catalíticas drásticamente diferentes dependiendo de la estructura del marco presente. [86]
Otro enfoque para construir MOF homoquirales catalíticamente activos es incorporar complejos metálicos quirales que son catalizadores activos o precatalizadores directamente en las estructuras del armazón. Por ejemplo, Hupp y colaboradores [87] han combinado un ligando quiral y bpdc (bpdc: bifenildicarboxilato) con Zn(NO3 ) 2 y han obtenido redes 3D interpenetrantes dobles. La orientación del ligando quiral en los armazones hace que todos los sitios Mn(III) sean accesibles a través de los canales. Los armazones abiertos resultantes mostraron actividad catalítica hacia reacciones de epoxidación de olefinas asimétricas. No se observó una disminución significativa de la actividad del catalizador durante la reacción y el catalizador pudo reciclarse y reutilizarse varias veces. Lin y colaboradores [88] han informado sobre sistemas Ru-BINAP derivados de fosfonato de circonio. Los materiales híbridos porosos quirales basados en fosfonato de circonio que contienen los precatalizadores Ru(BINAP)(diamina)Cl 2 mostraron una excelente enantioselectividad (hasta 99,2 % ee) en la hidrogenación asimétrica de cetonas aromáticas.
Algunos materiales MOF pueden parecerse a enzimas cuando combinan sitios polinucleares aislados, respuestas dinámicas de anfitrión-huésped y ambiente de cavidad hidrofóbica que son características de una enzima. [89] Algunos ejemplos bien conocidos de catálisis cooperativa que involucra dos iones metálicos en sistemas biológicos incluyen: los sitios de dihierro en la metano monooxigenasa , dicopper en la citocromo c oxidasa y tricopper oxidasas que tienen analogía con los grupos polinucleares encontrados en los polímeros de coordinación 0D, como las unidades de rueda de paletas binucleares Cu 2 encontradas en MOP-1 [90] [91] y [Cu 3 (btc) 2 ] (btc=benceno-1,3,5-tricarboxilato) en HKUST-1 o unidades trinucleares como { Fe 3 O(CO 2 ) 6 } en MIL-88, [92] e IRMOP-51. [93] Por lo tanto, los MOF 0D tienen centros catalíticos biomiméticos accesibles. En los sistemas enzimáticos, las unidades proteínicas muestran "reconocimiento molecular", alta afinidad por sustratos específicos. Parece que los efectos de reconocimiento molecular están limitados en las zeolitas por la estructura rígida de la zeolita. [94] Por el contrario, las características dinámicas y la respuesta a la forma del huésped hacen que los MOF sean más similares a las enzimas. De hecho, muchos marcos híbridos contienen partes orgánicas que pueden rotar como resultado de estímulos, como la luz y el calor. [95] Los canales porosos en las estructuras MOF se pueden utilizar como sitios de fotocatálisis . En la fotocatálisis, el uso de complejos mononucleares suele estar limitado, ya sea porque solo experimentan un proceso de un solo electrón o por la necesidad de irradiación de alta energía. En este caso, los sistemas binucleares tienen una serie de características atractivas para el desarrollo de fotocatalizadores. [96] Para las estructuras MOF 0D, los nodos policatiónicos pueden actuar como puntos cuánticos semiconductores que se pueden activar con fotoestímulos y los enlaces sirven como antenas de fotones. [97] Los cálculos teóricos muestran que los MOF son semiconductores o aislantes con brechas de banda entre 1,0 y 5,5 eV que se pueden alterar cambiando el grado de conjugación en los ligandos. [98] Los resultados experimentales muestran que la brecha de banda de las muestras de tipo IRMOF se puede ajustar variando la funcionalidad del enlazador. [99] Se desarrolló una nanozima MOF integrada para la terapia antiinflamatoria. [100]
La implementación de MOF en la industria requiere una comprensión profunda de las propiedades mecánicas, ya que la mayoría de las técnicas de procesamiento (por ejemplo, extrusión y peletización) exponen a los MOF a tensiones mecánicas de compresión sustanciales. [ 101 ] La respuesta mecánica de las estructuras porosas es de interés ya que estas estructuras pueden exhibir una respuesta inusual a altas presiones. Si bien las zeolitas ( minerales de aluminosilicato microporosos ) pueden brindar algunas ideas sobre la respuesta mecánica de los MOF, la presencia de enlaces orgánicos en oposición a las zeolitas genera respuestas mecánicas novedosas. [102] Los MOF son estructuralmente muy diversos, lo que significa que es un desafío clasificar todas sus propiedades mecánicas. Además, la variabilidad en los MOF de un lote a otro y las condiciones experimentales extremas ( celdas de yunque de diamante ) significan que la determinación experimental de la respuesta mecánica a la carga es limitada, sin embargo, se han realizado muchos modelos computacionales para determinar las relaciones estructura-propiedad. Los principales sistemas MOF que se han explorado son los marcos de imidazolato zeolítico (ZIF), los MOF de carboxilato, los MOF basados en circonio, entre otros. [102] Generalmente, los MOF experimentan tres procesos bajo carga compresiva (lo cual es relevante en un contexto de procesamiento): amorfización, hiperllenado y/o transiciones de fase inducidas por presión. Durante la amorfización, los enlaces se doblan y la porosidad interna dentro del MOF colapsa. Durante el hiperllenado, el MOF que se comprime hidrostáticamente en un líquido (típicamente solvente) se expandirá en lugar de contraerse debido a un llenado de poros con el medio de carga. Finalmente, son posibles las transiciones de fase inducidas por presión donde la estructura del cristal se altera durante la carga. La respuesta del MOF depende predominantemente de las especies de enlace y los nodos inorgánicos.
Se han observado varios fenómenos mecánicos diferentes en los marcos de imidazolato zeolítico (ZIF), el MOF más ampliamente estudiado para propiedades mecánicas debido a sus muchas similitudes con las zeolitas. [102] Las tendencias generales para la familia ZIF son la tendencia del módulo de Young y la dureza de los ZIF a disminuir a medida que aumenta el volumen de poro accesible. [103] Los módulos volumétricos de la serie ZIF-62 aumentan con el aumento de la concentración de benzoimidazolato (bim − ). ZIF-62 muestra una transición de fase continua de poro abierto ( op ) a poro cerrado ( cp ) cuando la concentración de bim − es superior a 0,35 por unidad de fórmula. El tamaño y volumen de poro accesible de ZIF-62-bim 0,35 se pueden ajustar con precisión aplicando presiones adecuadas. [104] Otro estudio ha demostrado que bajo carga hidrostática en solvente, el material ZIF-8 se expande en lugar de contraerse. Esto es el resultado del hiperllenado de los poros internos con solvente. [105] Un estudio computacional demostró que los materiales ZIF-4 y ZIF-8 experimentan un mecanismo de ablandamiento por cizallamiento con amorfización (a ~ 0,34 GPa) del material bajo carga hidrostática, mientras que aún poseen un módulo volumétrico del orden de 6,5 GPa. [106] [107] Además, los MOF ZIF-4 y ZIF-8 están sujetos a muchas transiciones de fase dependientes de la presión. [103] [108]
Los MOF carboxilato se presentan en muchas formas y han sido ampliamente estudiados. En este artículo, se analizan HKUST-1, MOF-5 y la serie MIL como ejemplos representativos de la clase de MOF carboxilato.
El HKUST-1 consiste en una rueda de paletas de cobre dimérica que posee dos tipos de poros. Bajo peletización, los MOF como el HKUST-1 exhiben un colapso de poros. [109] Aunque la mayoría de los MOF de carboxilato tienen una expansión térmica negativa (se densifican durante el calentamiento), se encontró que la dureza y los módulos de Young disminuyen inesperadamente con el aumento de la temperatura debido al desorden de los enlaces. [110] También se encontró computacionalmente que una estructura más mesoporosa tiene un módulo volumétrico menor. Sin embargo, se observó un aumento del módulo volumétrico en sistemas con unos pocos mesoporos grandes frente a muchos mesoporos pequeños, aunque ambas distribuciones de tamaño de poro tenían el mismo volumen de poro total. [111] El HKUST-1 muestra un fenómeno de "hiperllenado" similar a las estructuras ZIF bajo carga hidrostática. [112]
MOF-5 tiene nodos tetranucleares en una configuración octaédrica con una estructura cúbica general. MOF-5 tiene una compresibilidad y un módulo de Young (~14,9 GPa) comparables a la madera, lo que se confirmó con la teoría funcional de la densidad (DFT) y la nanoindentación . [113] [114] Si bien se demostró que MOF-5 puede demostrar el fenómeno de hiperllenado dentro de un medio de carga de solvente, estos MOF son muy sensibles a la presión y experimentan amorfización/colapso de poro inducido por presión a una presión de 3,5 MPa cuando no hay fluido en los poros. [115]

Los MOF MIL-53 poseen una estructura de "estante para vinos". Se ha estudiado la anisotropía de estos MOF en el módulo de Young debido a la flexibilidad de la carga y al potencial de compresibilidad lineal negativa al comprimir en una dirección, debido a la capacidad del estante para vinos de abrirse durante la carga. [116] [117]

Los MOF basados en circonio, como el UiO-66, son una clase muy robusta de MOF (atribuida a fuertes nodos metálicos hexanucleares) con mayor resistencia al calor, solventes y otras condiciones severas, lo que los hace de interés en términos de propiedades mecánicas. [118] Las determinaciones del módulo de corte y la peletización han demostrado que los MOF UiO-66 son muy robustos mecánicamente y tienen una alta tolerancia al colapso de poros en comparación con los ZIF y los MOF de carboxilato. [109] [119] Aunque el MOF UiO-66 muestra una mayor estabilidad bajo peletización, los MOF UiO-66 se amorfizaron bastante rápido en condiciones de molienda de bolas debido a la destrucción de los nodos inorgánicos de coordinación del enlazador. [120]
El hidrógeno molecular tiene la energía específica más alta de todos los combustibles. Sin embargo, a menos que el gas hidrógeno se comprima, su densidad de energía volumétrica es muy baja, por lo que el transporte y almacenamiento de hidrógeno requieren procesos de compresión y licuefacción que consumen mucha energía. [121] [122] [123] Por lo tanto, el desarrollo de nuevos métodos de almacenamiento de hidrógeno que reduzcan la presión concomitante requerida para la densidad de energía volumétrica práctica es un área activa de investigación. [121] Los MOF atraen la atención como materiales para el almacenamiento de hidrógeno por adsorción debido a sus altas áreas de superficie específicas y relaciones de superficie a volumen, así como a sus estructuras químicamente ajustables. [44]
En comparación con un cilindro de gas vacío , un cilindro de gas lleno de MOF puede almacenar más hidrógeno a una presión dada porque las moléculas de hidrógeno se adsorben a la superficie de los MOF. Además, los MOF no tienen volumen muerto, por lo que casi no hay pérdida de capacidad de almacenamiento como resultado del bloqueo de espacio por el volumen no accesible. [11] Además, debido a que la captación de hidrógeno se basa principalmente en la fisisorción , muchos MOF tienen un comportamiento de captación y liberación completamente reversible. No se requieren grandes barreras de activación al liberar el hidrógeno adsorbido. [11] La capacidad de almacenamiento de un MOF está limitada por la densidad de la fase líquida del hidrógeno porque los beneficios proporcionados por los MOF solo se pueden obtener si el hidrógeno está en su estado gaseoso. [11]
El grado en que un gas puede adsorberse a la superficie de un MOF depende de la temperatura y la presión del gas. En general, la adsorción aumenta con la disminución de la temperatura y el aumento de la presión (hasta que se alcanza un máximo, normalmente de 20 a 30 bar, después del cual la capacidad de adsorción disminuye). [11] [44] [123] Sin embargo, los MOF que se utilizarán para el almacenamiento de hidrógeno en las pilas de combustible de los automóviles deben funcionar de manera eficiente a temperatura ambiente y a presiones entre 1 y 100 bar, ya que estos son los valores que se consideran seguros para las aplicaciones de automoción. [44]

El Departamento de Energía de los Estados Unidos (DOE) ha publicado una lista de objetivos técnicos anuales del sistema para el almacenamiento de hidrógeno a bordo de vehículos ligeros con pilas de combustible que orientan a los investigadores en este campo (5,5 % en peso/40 g L −1 para 2017; 7,5 % en peso/70 g L −1 como máximo). [124] Se han diseñado y sintetizado materiales con alta porosidad y gran área superficial, como los MOF, en un esfuerzo por cumplir estos objetivos. Estos materiales adsortivos generalmente funcionan mediante adsorción física en lugar de quimisorción debido a la gran brecha HOMO-LUMO y al bajo nivel de energía HOMO del hidrógeno molecular. Un material de referencia para este fin es el MOF-177, que se descubrió que almacena hidrógeno al 7,5 % en peso con una capacidad volumétrica de 32 g L −1 a 77 K y 70 bar. [125] MOF-177 consiste en grupos [Zn 4 O] 6+ interconectados por enlaces orgánicos de 1,3,5-bencenotribenzoato y tiene un área de superficie BET medida de 4630 m 2 g −1 . Otro material ejemplar es PCN-61 que exhibe una captación de hidrógeno de 6,24 % en peso y 42,5 g L −1 a 35 bar y 77 K y 2,25 % en peso a presión atmosférica. [126] PCN-61 consiste en unidades de rueda de paletas [Cu 2 ] 4+ conectadas a través de enlaces orgánicos de 5,5 ′ ,5 ′ ′ -benceno-1,3,5-triiltris(1-etinil-2-isoftalato) y tiene un área de superficie BET medida de 3000 m 2 g −1 . A pesar de estos prometedores ejemplos de MOF, las clases de materiales porosos sintéticos con el mayor rendimiento para el almacenamiento práctico de hidrógeno son el carbón activado y los marcos orgánicos covalentes (COF). [127]
Las aplicaciones prácticas de los MOF para el almacenamiento de hidrógeno se enfrentan a varios desafíos. Para la adsorción de hidrógeno cerca de la temperatura ambiente, sería necesario aumentar considerablemente la energía de enlace de hidrógeno. [44] Se han explorado varias clases de MOF, incluidos los MOF basados en carboxilato , los MOF basados en azolato heterocíclico , los MOF de cianuro metálico y los marcos orgánicos covalentes . Los MOF basados en carboxilato han recibido, con mucho, la mayor atención porque
Los metales de transición más comunes empleados en estructuras basadas en carboxilato son Cu 2+ y Zn 2+ . También se han explorado iones metálicos del grupo principal más ligeros. Be 12 (OH) 12 (BTB) 4 , el primer MOF sintetizado y caracterizado estructuralmente con éxito que consiste en un ion metálico ligero del grupo principal, muestra una alta capacidad de almacenamiento de hidrógeno, pero es demasiado tóxico para ser empleado en la práctica. [128] Se está haciendo un esfuerzo considerable en el desarrollo de MOF compuestos de otros iones metálicos ligeros del grupo principal, como el magnesio en Mg 4 (BDC) 3 . [44]
La siguiente es una lista de varios MOF que se consideran que tienen las mejores propiedades para el almacenamiento de hidrógeno a partir de mayo de 2012 (en orden decreciente de capacidad de almacenamiento de hidrógeno). [44] Si bien cada MOF descrito tiene sus ventajas, ninguno de estos MOF alcanza todos los estándares establecidos por el Departamento de Energía de los EE. UU. Por lo tanto, aún no se sabe si los materiales con áreas de superficie altas, poros pequeños o grupos de metales divalentes o trivalentes producen los MOF más favorables para el almacenamiento de hidrógeno. [11]
Hasta la fecha, el almacenamiento de hidrógeno en MOF a temperatura ambiente es una batalla entre maximizar la capacidad de almacenamiento y mantener tasas de desorción razonables, al tiempo que se conserva la integridad de la estructura adsorbente (por ejemplo, evacuando completamente los poros, preservando la estructura del MOF, etc.) a lo largo de muchos ciclos. Existen dos estrategias principales que rigen el diseño de MOF para el almacenamiento de hidrógeno:
La tendencia general en los MOF utilizados para el almacenamiento de hidrógeno es que cuanto mayor sea el área de superficie, más hidrógeno puede almacenar el MOF. Los materiales con una gran área de superficie tienden a presentar un mayor volumen de microporos y una densidad aparente inherentemente baja, lo que permite que se produzca una mayor adsorción de hidrógeno. [44]
La alta entalpía de adsorción de hidrógeno también es importante. Estudios teóricos han demostrado que las interacciones de 22–25 kJ/mol son ideales para el almacenamiento de hidrógeno a temperatura ambiente, ya que son lo suficientemente fuertes para adsorber H2 , pero lo suficientemente débiles para permitir una desorción rápida. [136] La interacción entre el hidrógeno y los enlaces orgánicos no cargados no es tan fuerte, y por eso se ha invertido una cantidad considerable de trabajo en la síntesis de MOF con sitios metálicos expuestos, a los que el hidrógeno se adsorbe con una entalpía de 5–10 kJ/mol. Sintéticamente, esto se puede lograr utilizando ligandos cuyas geometrías impiden que el metal se coordine completamente, eliminando moléculas de disolvente volátiles unidas al metal durante el curso de la síntesis y mediante impregnación postsintética con cationes metálicos adicionales. [16] [132] (C5H5 ) V (CO) 3 (H2 ) y Mo (CO) 5 (H2 ) son excelentes ejemplos de mayor energía de enlace debido a sitios de coordinación de metales abiertos ; [137] Sin embargo, sus altas energías de disociación de enlaces metal-hidrógeno resultan en una tremenda liberación de calor al cargarse con hidrógeno, lo que no es favorable para las celdas de combustible . [44] Por lo tanto, los MOF deberían evitar las interacciones orbitales que conducen a enlaces metal-hidrógeno tan fuertes y emplear interacciones dipolares inducidas por carga simples , como se demuestra en Mn 3 [(Mn 4 Cl) 3 (BTT) 8 ] 2 .
Una energía de asociación de 22–25 kJ/mol es típica de las interacciones dipolares inducidas por carga, por lo que existe interés en el uso de enlaces cargados y metales. [44] La fuerza del enlace metal-hidrógeno disminuye en los MOF, probablemente debido a la difusión de carga, por lo que se están estudiando iones metálicos 2+ y 3+ para fortalecer aún más esta interacción. Un problema con este enfoque es que los MOF con superficies metálicas expuestas tienen concentraciones más bajas de enlaces; esto los hace difíciles de sintetizar, ya que son propensos al colapso de la estructura. Esto también puede disminuir su vida útil. [16] [44]
Los MOF suelen ser sensibles a la humedad del aire. En particular, el IRMOF-1 se degrada en presencia de pequeñas cantidades de agua a temperatura ambiente. Los estudios sobre análogos de metales han revelado la capacidad de otros metales además del Zn para soportar mayores concentraciones de agua a altas temperaturas. [138] [139]
Para compensar esto, se requieren contenedores de almacenamiento especialmente construidos, lo que puede resultar costoso. Se sabe que los enlaces fuertes de metal-ligando, como en los marcos de metal-imidazolato, -triazolato y -pirazolato, disminuyen la sensibilidad de un MOF al aire, lo que reduce el costo de almacenamiento. [140]
En un material microporoso donde la fisisorción y las fuerzas de van der Waals débiles dominan la adsorción, la densidad de almacenamiento depende en gran medida del tamaño de los poros. Los cálculos de materiales homogéneos idealizados, como los carbones grafíticos y los nanotubos de carbono , predicen que un material microporoso con poros de 7 Å de ancho exhibirá una máxima absorción de hidrógeno a temperatura ambiente. Con este ancho, exactamente dos capas de moléculas de hidrógeno se adsorben en superficies opuestas sin dejar espacio entre ellas. [44] [141] Los poros de 10 Å de ancho también son de tamaño ideal porque con este ancho, pueden existir exactamente tres capas de hidrógeno sin espacio entre ellas. [44] (Una molécula de hidrógeno tiene una longitud de enlace de 0,74 Å con un radio de van der Waals de 1,17 Å para cada átomo; por lo tanto, su longitud de van der Waals efectiva es de 3,08 Å). [142]
Los defectos estructurales también desempeñan un papel importante en el rendimiento de los MOF. La absorción de hidrógeno a temperatura ambiente a través de un derrame en puente está determinada principalmente por defectos estructurales, que pueden tener dos efectos:
Los defectos estructurales también pueden dejar nodos que contienen metales sin coordinar por completo. Esto mejora el rendimiento de los MOF utilizados para el almacenamiento de hidrógeno al aumentar la cantidad de centros metálicos accesibles. [144] Finalmente, los defectos estructurales pueden afectar el transporte de fonones , lo que afecta la conductividad térmica del MOF. [145]
La adsorción es el proceso de atrapar átomos o moléculas que inciden sobre una superficie; por lo tanto, la capacidad de adsorción de un material aumenta con su área superficial. En tres dimensiones, la máxima área superficial se obtendrá mediante una estructura que sea altamente porosa, de modo que los átomos y las moléculas puedan acceder a las superficies internas. Este simple argumento cualitativo sugiere que las estructuras metalorgánicas (MOF) altamente porosas deberían ser excelentes candidatos para dispositivos de almacenamiento de hidrógeno.
La adsorción se puede clasificar ampliamente como uno de dos tipos: fisisorción o quimisorción . La fisisorción se caracteriza por interacciones de van der Waals débiles y entalpías de enlace típicamente menores a 20 kJ/mol. La quimisorción, alternativamente, se define por enlaces covalentes e iónicos más fuertes , con entalpías de enlace entre 250 y 500 kJ/mol. En ambos casos, los átomos o moléculas adsorbidos (es decir, las partículas que se adhieren a la superficie) son atraídos a la superficie adsorbente (sólida) debido a la energía superficial que resulta de las ubicaciones de enlace desocupadas en la superficie. El grado de superposición orbital determina entonces si las interacciones serán fisisortivas o quimisortivas. [146]
La adsorción de hidrógeno molecular en MOF es fisisortiva. Dado que el hidrógeno molecular solo tiene dos electrones, las fuerzas de dispersión son débiles, típicamente de 4 a 7 kJ/mol, y solo son suficientes para la adsorción a temperaturas inferiores a 298 K. [44]
Se logró una explicación completa del mecanismo de sorción de H 2 en MOF mediante un promedio estadístico en el gran conjunto canónico, explorando un amplio rango de presiones y temperaturas. [147] [148]
Se utilizan dos métodos de medición de la absorción de hidrógeno para la caracterización de los MOF como materiales de almacenamiento de hidrógeno: gravimétrico y volumétrico . Para obtener la cantidad total de hidrógeno en el MOF, se debe considerar tanto la cantidad de hidrógeno absorbido en su superficie como la cantidad de hidrógeno residente en sus poros. Para calcular la cantidad absorbida absoluta ( N abs ), la cantidad de exceso de superficie ( N ex ) se suma al producto de la densidad aparente de hidrógeno (ρ bulk ) y el volumen de poro del MOF ( V pore ), como se muestra en la siguiente ecuación: [149]
La masa aumentada del MOF debido al hidrógeno almacenado se calcula directamente mediante una microbalanza de alta sensibilidad. [149] Debido a la flotabilidad , la masa detectada de hidrógeno adsorbido disminuye nuevamente cuando se aplica una presión suficientemente alta al sistema porque la densidad del hidrógeno gaseoso circundante se vuelve cada vez más importante a presiones más altas. Por lo tanto, esta "pérdida de peso" debe corregirse utilizando el volumen del marco del MOF y la densidad del hidrógeno. [150]
El cambio en la cantidad de hidrógeno almacenado en el MOF se mide detectando la presión variada del hidrógeno a un volumen constante. [149] Luego, el volumen de hidrógeno adsorbido en el MOF se calcula restando el volumen de hidrógeno en el espacio libre del volumen total de hidrógeno dosificado. [151]
Existen seis métodos posibles que se pueden utilizar para el almacenamiento reversible de hidrógeno con una alta densidad volumétrica y gravimétrica, que se resumen en la siguiente tabla (donde ρ m es la densidad gravimétrica, ρ v es la densidad volumétrica, T es la temperatura de trabajo y P es la presión de trabajo): [152]
De estos, los cilindros de gas a alta presión y el hidrógeno líquido en tanques criogénicos son las formas menos prácticas de almacenar hidrógeno para fines de combustible debido a la presión extremadamente alta requerida para almacenar gas hidrógeno o la temperatura extremadamente baja requerida para almacenar hidrógeno líquido. Los demás métodos están siendo estudiados y desarrollados ampliamente. [152]
La gran área superficial y la característica de los sitios metálicos atómicos de los MOF los convierten en un candidato adecuado para electrocatalizadores , especialmente los relacionados con la energía. Hasta ahora, los MOF se han utilizado ampliamente como electrocatalizadores para la división del agua (reacción de evolución de hidrógeno y reacción de evolución de oxígeno), reducción de dióxido de carbono y reacción de reducción de oxígeno. [153] Actualmente existen dos rutas: 1. Utilizar MOF como precursores para preparar electrocatalizadores con soporte de carbono. [154] 2. Utilizar MOF directamente como electrocatalizadores. [155] [156] Sin embargo, algunos resultados han demostrado que algunos MOF no son estables en entornos electroquímicos. [157] La conversión electroquímica de MOF durante la electrocatálisis puede producir los materiales catalizadores reales, y los MOF son precatalizadores en tales condiciones. [158] Por lo tanto, reivindicar los MOF como electrocatalizadores requiere técnicas in situ acopladas a la electrocatálisis.

Una posible aplicación de los MOF es la obtención de imágenes y detección biológicas mediante fotoluminiscencia . Un gran subconjunto de MOF luminiscentes utiliza lantánidos en los grupos metálicos. La fotoluminiscencia de los lantánidos tiene muchas propiedades únicas que los hacen ideales para aplicaciones de obtención de imágenes, como bandas de emisión característicamente nítidas y generalmente no superpuestas en las regiones visible e infrarroja cercana (NIR) del espectro, resistencia al fotoblanqueo o "parpadeo" y largos tiempos de vida de la luminiscencia. [159] Sin embargo, las emisiones de lantánidos son difíciles de sensibilizar directamente porque deben sufrir transiciones ff prohibidas de LaPorte . La sensibilización indirecta de la emisión de lantánidos se puede lograr empleando el "efecto antena", donde los enlaces orgánicos actúan como antenas y absorben la energía de excitación, transfieren la energía al estado excitado del lantánido y producen luminiscencia del lantánido tras la relajación. [160] Un excelente ejemplo del efecto antena se demuestra con MOF-76, que combina iones de lantánidos trivalentes y enlaces de 1,3,5-bencenotricarboxilato (BTC) para formar SBU de varilla infinitas coordinadas en una red tridimensional. [161] Como lo demostraron varios grupos de investigación, el enlace BTC puede sensibilizar eficazmente la emisión de lantánidos, lo que da como resultado un MOF con longitudes de onda de emisión variables según la identidad del lantánido. [162] [163] Además, el grupo Yan ha demostrado que Eu 3+ - y Tb 3+ - MOF-76 se pueden utilizar para la detección selectiva de acetofenona de otros hidrocarburos monoaromáticos volátiles. Tras la absorción de acetofenona, el MOF muestra una disminución muy pronunciada, o extinción , de la intensidad de luminiscencia. [164]
Sin embargo, para su uso en imágenes biológicas se deben superar dos obstáculos principales:
En cuanto al primer punto, la síntesis de MOF a nanoescala (NMOF) se ha mencionado en una sección anterior. El último obstáculo aborda la limitación del efecto de antena. Los enlaces más pequeños tienden a mejorar la estabilidad de los MOF, pero tienen mayores absorciones de energía, predominantemente en las regiones ultravioleta (UV) y visible de alta energía. Se ha logrado una estrategia de diseño para MOF con propiedades de absorción desplazadas al rojo mediante el uso de enlaces cromóforos grandes. Estos enlaces a menudo están compuestos de especies poliaromáticas, lo que conduce a tamaños de poro grandes y, por lo tanto, a una menor estabilidad. Para evitar el uso de enlaces grandes, se requieren otros métodos para desplazar al rojo la absorbancia del MOF de modo que se puedan utilizar fuentes de excitación de menor energía. La modificación post-sintética (PSM) es una estrategia prometedora. Luo et al. introdujeron una nueva familia de MOF de lantánidos con enlaces orgánicos funcionalizados. Los MOF, denominados MOF-1114, MOF-1115, MOF-1130 y MOF-1131, están compuestos de SBU octaédricos unidos por enlaces dicarboxilato funcionalizados con amino. Los grupos amino de los enlaces sirvieron como sitios para reacciones PSM covalentes con salicilaldehído o 3-hidroxinaftaleno-2-carboxaldehído. Ambas reacciones extienden la conjugación π del enlace, lo que provoca un corrimiento al rojo en la longitud de onda de absorbancia de 450 nm a 650 nm. Los autores también proponen que esta técnica podría adaptarse a sistemas MOF similares y, al aumentar los volúmenes de poro con longitudes de enlace crecientes, se pueden usar reactivos conjugados pi más grandes para desplazar aún más al rojo las longitudes de onda de absorción. [167] Varios grupos, a saber, Foucault-Collet y colaboradores, han realizado imágenes biológicas utilizando MOF. En 2013, sintetizaron un Yb 3+ -NMOF emisor de NIR utilizando enlaces de dicarboxilato de fenilenvinileno (PVDC). Observaron la captación celular tanto en células HeLa como en células NIH-3T3 utilizando espectroscopia confocal, visible y NIR. [168] Aunque persisten bajos rendimientos cuánticos en agua y solución tampón Hepes, la intensidad de la luminiscencia sigue siendo lo suficientemente fuerte como para obtener imágenes de la captación celular tanto en los regímenes visible como NIR.
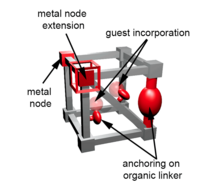
El desarrollo de nuevas vías para la gestión eficiente de los residuos nucleares es esencial a raíz de la creciente preocupación pública por la contaminación radiactiva , debido a la operación de plantas nucleares y el desmantelamiento de armas nucleares. La síntesis de nuevos materiales capaces de secuestrar y separar selectivamente actínidos es uno de los desafíos actuales reconocidos en el sector de los residuos nucleares. Las estructuras metalorgánicas (MOF) son una clase prometedora de materiales para abordar este desafío debido a su porosidad, modularidad, cristalinidad y capacidad de ajuste. Cada bloque de construcción de las estructuras MOF puede incorporar actínidos. Primero, un MOF se puede sintetizar a partir de sales de actínidos. En este caso, los nodos metálicos son actínidos. [43] [169] Además, los nodos metálicos se pueden extender, o el intercambio de cationes puede intercambiar metales por actínidos. [43] Los enlaces orgánicos se pueden funcionalizar con grupos capaces de captar actínidos. [170] [171] [172] [173] [174] Por último, la porosidad de los MOF se puede utilizar para incorporar moléculas huésped contenidas [175] [176] [177] y atraparlas en una estructura mediante la instalación de enlaces adicionales o de protección. [43]
La síntesis, caracterización y estudios relacionados con fármacos de MOF biocompatibles y de baja toxicidad han demostrado que tienen potencial para aplicaciones médicas. Muchos grupos han sintetizado varios MOF de baja toxicidad y han estudiado sus usos en la carga y liberación de varios fármacos terapéuticos para posibles aplicaciones médicas. Existe una variedad de métodos para inducir la liberación de fármacos, como la respuesta al pH, la respuesta magnética, la respuesta iónica, la respuesta a la temperatura y la respuesta a la presión. [178]
En 2010, Smaldone et al., un grupo de investigación internacional, sintetizó un MOF biocompatible denominado CD-MOF-1 a partir de productos naturales comestibles baratos. El CD-MOF-1 consiste en unidades base repetidas de 6 anillos de γ-ciclodextrina unidos entre sí por iones de potasio. La γ-ciclodextrina (γ-CD) es un oligosacárido cíclico simétrico que se produce en masa de forma enzimática a partir del almidón y consta de ocho residuos D-glucopiranosilo asimétricos unidos por α-1,4. [179] La estructura molecular de estos derivados de la glucosa, que se aproxima a un cono truncado, un cubo o un toro, genera una superficie exterior hidrófila y una cavidad interior no polar. Las ciclodextrinas pueden interactuar con moléculas de fármacos de tamaño adecuado para producir un complejo de inclusión. [180] El grupo de Smaldone propuso una síntesis barata y sencilla del CD-MOF-1 a partir de productos naturales. Disolvieron azúcar (γ-ciclodextrina) y una sal alcalina (KOH, KCl, benzoato de potasio) en agua destilada embotellada y dejaron que el alcohol de grano de 190 grados (Everclear) se difundiera en forma de vapor en la solución durante una semana. La síntesis dio como resultado un motivo cúbico (γ-CD) 6 repetitivo con un tamaño de poro de aproximadamente 1 nm. Posteriormente, en 2017, Hartlieb et al. en Northwestern realizaron más investigaciones con CD-MOF-1 que involucraban la encapsulación de ibuprofeno. El grupo estudió diferentes métodos de carga del MOF con ibuprofeno, así como también realizó estudios de biodisponibilidad relacionados en el MOF cargado con ibuprofeno. Investigaron dos métodos diferentes de carga de CD-MOF-1 con ibuprofeno; cristalización utilizando la sal de potasio de ibuprofeno como fuente de catión alcalino para la producción del MOF, y absorción y desprotonación del ácido libre de ibuprofeno en el MOF. A partir de ahí, el grupo realizó estudios in vitro e in vivo para determinar la aplicabilidad de CD-MOF-1 como un método de administración viable para ibuprofeno y otros AINE. Los estudios in vitro no mostraron toxicidad ni efecto sobre la viabilidad celular hasta 100 μM. Los estudios in vivo en ratones mostraron la misma absorción rápida de ibuprofeno que la muestra de control de sal de potasio de ibuprofeno con una concentración plasmática máxima observada dentro de los 20 minutos, y el cocristal tiene el beneficio adicional de duplicar la vida media en muestras de plasma sanguíneo. [181] El aumento de la vida media se debe a que CD-MOF-1 aumenta la solubilidad del ibuprofeno en comparación con la forma de sal pura.
Desde estos desarrollos, muchos grupos han realizado más investigaciones sobre la administración de fármacos con MOF biocompatibles y solubles en agua que involucran medicamentos comunes de venta libre. [182] En marzo de 2018, Sara Rojas y su equipo publicaron su investigación sobre la incorporación y administración de fármacos con varios MOF biocompatibles distintos de CD-MOF-1 a través de la administración cutánea simulada. El grupo estudió la carga y liberación de ibuprofeno (hidrofóbico) y aspirina (hidrofílico) en tres MOF biocompatibles (MIL-100(Fe), UiO-66(Zr) y MIL-127(Fe)). En condiciones cutáneas simuladas (medio acuoso a 37 °C), las seis combinaciones diferentes de MOF cargados con fármaco cumplieron "los requisitos para ser utilizados como sistemas de administración tópica de fármacos , como la carga útil liberada entre 1 y 7 días" y la administración de una concentración terapéutica del fármaco de elección sin causar efectos secundarios no deseados. [183] El grupo descubrió que la absorción del fármaco está "gobernada por el equilibrio hidrófilo/hidrófobo entre la carga y la matriz" y "la accesibilidad del fármaco a través de la estructura". La "liberación controlada en condiciones cutáneas sigue diferentes perfiles cinéticos dependiendo de: (i) la estructura de la estructura, con una liberación rápida desde la estructura muy abierta MIL-100 o una liberación más lenta del fármaco desde el sistema de poros unidimensionales estrechos de MIL-127 o (ii) la naturaleza hidrófoba/hidrófila de la carga, con una liberación rápida (aspirina) y lenta (ibuprofeno) desde la matriz UiO-66". Además, se utiliza una técnica sencilla de molienda de bolas para encapsular de manera eficiente los fármacos modelo 5-fluorouracilo, cafeína, ácido para-aminobenzoico y benzocaína. Tanto los estudios computacionales como los experimentales confirman la idoneidad de [Zn 4 O(dmcapz) 3 ] para incorporar altas cargas de las moléculas bioactivas estudiadas. [184]
Las investigaciones recientes que involucran MOF como método de administración de fármacos incluyen más que solo la encapsulación de medicamentos cotidianos como el ibuprofeno y la aspirina. A principios de 2018, Chen et al. publicaron detalles de su trabajo sobre el uso de MOF, ZIF-8 (marco de imidazolato zeolítico-8) en la investigación antitumoral "para controlar la liberación de un inhibidor de la autofagia, 3-metiladenina (3-MA), y evitar que se disipe en una gran cantidad antes de alcanzar el objetivo". [185] El grupo realizó estudios in vitro y determinó que "las proteínas relacionadas con la autofagia y el flujo de autofagia en células HeLa tratadas con nanopartículas de 3-MA@ZIF-8 muestran que la formación de autofagosomas está bloqueada significativamente, lo que revela que la disociación sensible al pH aumenta la eficiencia de la inhibición de la autofagia a la concentración equivalente de 3-MA". Esto muestra promesa para futuras investigaciones y aplicabilidad con MOF como métodos de administración de fármacos en la lucha contra el cáncer.
En 2014, los investigadores demostraron que pueden crear películas delgadas eléctricamente conductoras de MOF (Cu 3 (BTC) 2 (también conocido como HKUST-1 ; BTC, ácido benceno-1,3,5-tricarboxílico) infiltrado con la molécula 7,7,8,8-tetracianoquinododimetano) que podrían usarse en aplicaciones que incluyen energía fotovoltaica, sensores y materiales electrónicos y un camino hacia la creación de semiconductores. El equipo demostró una conductividad eléctrica ajustable y estable al aire con valores tan altos como 7 siemens por metro, comparable al bronce. [186]
Ni
3Se ha demostrado que el (2,3,6,7,10,11-hexaiminotrifenileno) 2 es un análogo de grafeno metalorgánico que tiene una brecha de banda natural , lo que lo convierte en un semiconductor, y es capaz de autoensamblarse. Es un ejemplo de estructura metalorgánica conductora . Representa una familia de compuestos similares. Debido a la simetría y geometría del 2,3,6,7,10,11-hexaiminotrifenileno (HITP), el complejo organometálico general tiene una naturaleza casi fractal que le permite autoorganizarse perfectamente. Por el contrario, el grafeno debe estar dopado para darle las propiedades de un semiconductor. Los gránulos de Ni 3 (HITP) 2 tenían una conductividad de 2 S/cm, un récord para un compuesto metalorgánico. [187] [188]
En 2018, los investigadores sintetizaron un MOF semiconductor bidimensional (Fe 3 (THT) 2 (NH 4 ) 3 , también conocido como THT, 2,3,6,7,10,11-trifenilenhexatiol) y mostraron una alta movilidad eléctrica a temperatura ambiente. [189] En 2020, el mismo material se integró en un dispositivo de fotodetección, detectando un amplio rango de longitudes de onda desde UV hasta NIR (400-1575 nm). [190] Esta fue la primera vez que se demostró el uso de un MOF semiconductor bidimensional en dispositivos optoelectrónicos. [191]
es una estructura MOF 2D, y hay ejemplos limitados de materiales que son intrínsecamente conductores, porosos y cristalinos. Los MOF 2D en capas tienen una estructura cristalina porosa que muestra conductividad eléctrica. Estos materiales están construidos a partir de moléculas de enlace trigonoide (fenileno o trifenileno) y seis grupos funcionales de –OH, - o –SH. Las moléculas de enlace trigonoide y los iones metálicos coordinados de forma cuadrada-planar como , , y forman capas con estructuras hexagonales que se parecen al grafeno en mayor escala. El apilamiento de estas capas puede construir sistemas de poros unidimensionales. Los MOF 2D similares al grafeno han mostrado conductividades decentes. Esto los convierte en una buena opción para ser probados como material de electrodo para la evolución de hidrógeno a partir del agua, reacciones de reducción de oxígeno, supercondensadores y detección de compuestos orgánicos volátiles (VOC). Entre estos MOF, ha exhibido la conductividad más baja, pero también la reacción más fuerte en la detección de VOC. [192] [193] [194]
Las biomoléculas se pueden incorporar durante el proceso de cristalización de MOF. Las biomoléculas, incluidas las proteínas, el ADN y los anticuerpos, se pueden encapsular dentro de ZIF-8. Las enzimas encapsuladas de esta manera fueron estables y activas incluso después de ser expuestas a condiciones adversas (por ejemplo, solventes agresivos y altas temperaturas). ZIF-8, MIL-88A, HKUST-1 y varios MOF luminiscentes que contienen metales lantánidos se utilizaron para el proceso de mineralización biomimética. [195]
Los tamaños de poro pequeños y ajustables de los MOF y las fracciones de alto vacío son prometedores como adsorbente para capturar CO 2 . [196] Los MOF podrían proporcionar una alternativa más eficiente a los métodos tradicionales basados en solventes de amina en la captura de CO 2 de las plantas de energía a carbón. [197]
Los MOF se podrían emplear en cada una de las tres configuraciones principales de captura de carbono para plantas de energía a carbón: precombustión, poscombustión y oxicombustión. [198] La configuración de poscombustión es la única que se puede adaptar a las plantas existentes, y es la que genera más interés e investigación. El gas de combustión se alimentaría a través de un MOF en una configuración de reactor de lecho empacado. El gas de combustión generalmente está a 40 a 60 °C con una presión parcial de CO2 de 0,13 – 0,16 bar. El CO2 puede unirse a la superficie del MOF a través de fisisorción (a través de interacciones de Van der Waals ) o quimisorción (a través de la formación de enlaces covalentes ). [199]
Una vez que el MOF está saturado, el CO2 se extrae del MOF a través de un cambio de temperatura o de un cambio de presión. Este proceso se conoce como regeneración. En una regeneración por cambio de temperatura, el MOF se calentaría hasta que el CO2 se desorba. Para lograr capacidades de trabajo comparables al proceso de amina, el MOF debe calentarse a alrededor de 200 °C. En un cambio de presión, la presión se reduciría hasta que el CO2 se desorba. [200]
Otra propiedad relevante de los MOF es su baja capacidad térmica. Las soluciones de monoetanolamina (MEA), el principal método de captura, tienen una capacidad térmica de entre 3 y 4 J/(g⋅K) ya que son principalmente agua. Esta alta capacidad térmica contribuye a la pérdida de energía en el paso de regeneración del disolvente, es decir, cuando el CO2 adsorbido se elimina de la solución de MEA. El MOF-177, un MOF diseñado para la captura de CO2 , tiene una capacidad térmica de 0,5 J/(g⋅K) a temperatura ambiente. [198]
Los MOF adsorben el 90% del CO2 mediante un proceso de oscilación de presión al vacío. El MOF Mg(dobdc) tiene una capacidad de carga de CO2 del 21,7% en peso . Aplicado a una planta de energía a gran escala, el costo de la energía aumentaría en un 65%, mientras que un sistema de base basado en aminas de la NETL de EE. UU . causaría un aumento del 81% (el objetivo es el 35%). El costo de captura sería de $57/tonelada, mientras que para el sistema de aminas el costo se estima en $72/tonelada. A ese ritmo, el capital necesario para implementar dicho proyecto en una planta de energía de 580 MW sería de $354 millones. [201]
Un MOF cargado con óxido de propileno puede actuar como catalizador , convirtiendo el CO2 en carbonatos cíclicos (moléculas en forma de anillo con muchas aplicaciones). También pueden eliminar el carbono del biogás . Este MOF se basa en lantánidos , que proporcionan estabilidad química. Esto es especialmente importante porque los gases a los que estará expuesto el MOF son calientes, con alto contenido de humedad y ácidos. [202] Los POF basados en triaminoguanidinio y los Zn/POF son nuevos materiales multifuncionales para la remediación ambiental y aplicaciones biomédicas. [203]
Las membranas MOF pueden imitar una selectividad iónica sustancial, lo que ofrece el potencial de su uso en la desalinización y el tratamiento del agua. En 2018, la ósmosis inversa suministró más de la mitad de la capacidad de desalinización mundial y la última etapa de la mayoría de los procesos de tratamiento del agua. La ósmosis no utiliza la deshidratación de iones ni el transporte selectivo de iones en canales biológicos y no es energéticamente eficiente. La industria minera utiliza procesos basados en membranas para reducir la contaminación del agua y recuperar metales. Las MOF podrían utilizarse para extraer metales como el litio del agua de mar y de los flujos de desechos. [204]
Las membranas MOF como las membranas ZIF-8 y UiO-66 con poros subnanómetros uniformes que consisten en ventanas a escala angstrom y cavidades a escala nanométrica mostraron un transporte selectivo ultrarrápido de iones de metales alcalinos. Las ventanas actuaron como filtros de selectividad iónica para iones de metales alcalinos, mientras que las cavidades funcionaron como poros para el transporte. Las membranas ZIF-8 [205] y UiO-66 [206] mostraron una selectividad LiCl / RbCl de ~4,6 y ~1,8, respectivamente, mucho más alta que la selectividad de 0,6 a 0,8 en las membranas tradicionales. [207] Un estudio de 2020 sugirió que un nuevo MOF llamado PSP-MIL-53 podría usarse junto con la luz solar para purificar el agua en solo media hora. [208]
También se prevé que los MOF sean medios muy eficaces para separar gases con un bajo coste energético mediante el cribado computacional de alto rendimiento a partir de sus propiedades de adsorción [209] o de penetración/difusión de gases [210] . Un ejemplo es el NbOFFIVE-1-Ni, también conocido como KAUST-7, que puede separar el propano y el propileno por difusión con una selectividad cercana al 100 %. [211] Las propiedades de selectividad molecular específicas proporcionadas por el crecimiento del marco orgánico metálico montado en la superficie de Cu-BDC (SURMOF-2) sobre una capa de alúmina encima de un transistor de efecto de campo de grafeno (GFET) con compuerta trasera pueden proporcionar un sensor que solo es sensible al etanol, pero no al metanol o al isopropanol. [212]
Se ha demostrado que los MOF capturan vapor de agua del aire. [213] En 2021, en condiciones húmedas, un prototipo de laboratorio de polímero-MOF produjo 17 litros (4,5 gal) de agua por kg por día sin energía adicional. [214] [215]
Los MOF también podrían utilizarse para aumentar la eficiencia energética en aplicaciones de refrigeración de espacios a temperatura ambiente. [216] [217]

Al enfriar el aire exterior, una unidad de refrigeración debe lidiar tanto con el calor sensible del aire como con el calor latente . Las unidades típicas de aire acondicionado por compresión de vapor (VCAC) manejan el calor latente en el aire a través de aletas de enfriamiento que se mantienen por debajo de la temperatura del punto de rocío del aire húmedo en la entrada. Estas aletas condensan el agua, deshidratando el aire y reduciendo así sustancialmente el contenido de calor del aire. El uso de energía del enfriador depende en gran medida de la temperatura del serpentín de enfriamiento y mejoraría enormemente si la temperatura de este serpentín pudiera elevarse por encima del punto de rocío . [218] Esto hace que sea deseable manejar la deshumidificación a través de otros medios además de la condensación. Uno de estos medios es adsorber el agua del aire en un desecante recubierto sobre los intercambiadores de calor, utilizando el calor residual extraído de la unidad para desorber el agua del sorbente y así regenerar el desecante para un uso repetido. Esto se logra al tener dos unidades condensador/evaporador a través de las cuales se puede invertir el flujo de refrigerante una vez que el desecante en el condensador está saturado, convirtiendo así al condensador en el evaporador y viceversa. [216]
Las áreas superficiales y porosidades extremadamente altas de los MOF los han convertido en el tema de mucha investigación en aplicaciones de adsorción de agua. [216] [219] [220] [221] La química puede ayudar a ajustar la humedad relativa óptima para la adsorción/desorción y la agudeza de la absorción de agua. [216] [222]
Algunos MOF también presentan polarización eléctrica espontánea, que ocurre debido al ordenamiento de dipolos eléctricos (enlazadores polares o moléculas huésped) por debajo de una cierta temperatura de transición de fase. [223] Si este orden dipolar de largo alcance puede ser controlado por el campo eléctrico externo, un MOF se llama ferroeléctrico. [224] Algunos MOF ferroeléctricos también presentan ordenamiento magnético, lo que los convierte en multiferroicos de fase estructural única. Esta propiedad material es muy interesante para la construcción de dispositivos de memoria con alta densidad de información. El mecanismo de acoplamiento del multiferroico molecular tipo I [(CH 3 ) 2 NH 2 ][Ni(HCOO) 3 ] es un acoplamiento indirecto mediado por deformación elástica espontánea. [225]