Las vacunas contra la polio son vacunas que se utilizan para prevenir la poliomielitis (polio). [2] [3] Se utilizan dos tipos: un poliovirus inactivado administrado por inyección (IPV) y un poliovirus debilitado administrado por vía oral (OPV). [2] La Organización Mundial de la Salud (OMS) recomienda que todos los niños estén completamente vacunados contra la polio. [2] Las dos vacunas han eliminado la polio de la mayor parte del mundo, [4] [5] y han reducido el número de casos notificados cada año de un estimado de 350.000 en 1988 a 33 en 2018. [6] [7]
Las vacunas antipoliomielíticas inactivadas son muy seguras. [2] Puede producirse un leve enrojecimiento o dolor en el lugar de la inyección. [2] Las vacunas antipoliomielíticas orales causan alrededor de tres casos de poliomielitis paralítica asociada a la vacuna por cada millón de dosis administradas. [2] Esto se compara con los 5.000 casos por millón de personas que quedan paralizadas después de una infección de polio. [8] Ambos tipos de vacunas son generalmente seguros para administrar durante el embarazo y en personas que tienen VIH/SIDA pero que por lo demás están bien. [2] Sin embargo, la aparición del poliovirus circulante derivado de la vacuna (cVDPV), una forma del virus de la vacuna que ha vuelto a causar poliomielitis, ha llevado al desarrollo de la nueva vacuna antipoliomielítica oral tipo 2 (nOPV2), cuyo objetivo es hacer que la vacuna sea más segura y, por lo tanto, detener nuevos brotes de cVDPV. [9]
La primera demostración exitosa de una vacuna contra la polio fue realizada por Hilary Koprowski en 1950, con un virus vivo atenuado que la gente bebía. [10] La vacuna no fue aprobada para su uso en los Estados Unidos, pero se utilizó con éxito en otros lugares. [10] El éxito de una vacuna antipolio inactivada (muerta), desarrollada por Jonas Salk , se anunció en 1955. [2] [11] Otra vacuna antipolio oral viva atenuada fue desarrollada por Albert Sabin y entró en uso comercial en 1961. [2] [12]
La vacuna contra la polio está en la Lista de Medicamentos Esenciales de la Organización Mundial de la Salud . [13]

La interrupción de la transmisión del virus de persona a persona mediante la vacunación es importante para la erradicación mundial de la polio [14] , ya que no existe un estado de portador a largo plazo del poliovirus en individuos con una función inmunitaria normal, los virus de la polio no tienen un reservorio fuera de los primates en la naturaleza [15] y la supervivencia del virus en el medio ambiente durante un período prolongado de tiempo parece ser remota. Hay dos tipos de vacunas: la vacuna antipoliomielítica inactivada (IPV) y la vacuna antipoliomielítica oral (OPV).
Cuando se utiliza la vacuna antipoliomielítica inactivada (IPV), el 90% o más de las personas desarrollan anticuerpos protectores contra los tres serotipos del virus de la polio después de dos dosis de la vacuna antipoliomielítica inactivada (IPV), y al menos el 99% son inmunes al virus de la polio después de tres dosis. La duración de la inmunidad inducida por la IPV no se conoce con certeza, aunque se cree que una serie completa proporciona protección durante muchos años. [16] La IPV reemplazó a la vacuna oral en muchos países desarrollados en la década de 1990, principalmente debido al (pequeño) riesgo de polio derivada de la vacuna en la vacuna oral. [17] [18]
Las vacunas antipoliomielíticas orales eran más fáciles de administrar que la IPV, ya que eliminaban la necesidad de jeringas estériles y, por lo tanto, eran más adecuadas para las campañas de vacunación masiva. La OPV también brindaba una inmunidad más duradera que la vacuna de Salk, ya que proporciona inmunidad humoral e inmunidad mediada por células . [19]
Una dosis de OPV trivalente produce inmunidad a los tres serotipos de poliovirus en aproximadamente el 50% de los receptores. [20] Tres dosis de OPV viva atenuada producen anticuerpos protectores contra los tres tipos de poliovirus en más del 95% de los receptores. Al igual que con otras vacunas de virus vivos, la inmunidad iniciada por OPV es probablemente de por vida. [16] La OPV produce una inmunidad excelente en el intestino , el sitio primario de entrada del poliovirus salvaje, que ayuda a prevenir la infección con virus salvaje en áreas donde el virus es endémico . [21] La administración oral no requiere equipo médico especial ni capacitación extensa. El poliovirus atenuado derivado de la vacuna antipoliomielítica oral se excreta durante unos días después de la vacunación, potencialmente infectando y por lo tanto induciendo inmunidad indirectamente en individuos no vacunados, y amplificando así los efectos de las dosis administradas. [22] En conjunto, estas ventajas la han convertido en la vacuna favorita de muchos países, y ha sido preferida por la iniciativa de erradicación global. [23]
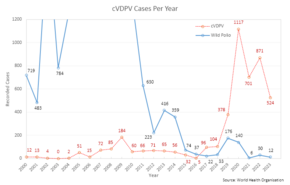
La principal desventaja de la OPV se deriva de su naturaleza inherente. Como virus atenuado pero activo, puede inducir poliomielitis paralítica asociada a la vacuna (VAPP) en aproximadamente un individuo por cada 2,7 millones de dosis administradas. [23] El virus vivo puede persistir circulando en poblaciones subvacunadas (denominado poliovirus variante o poliovirus circulante derivado de la vacuna , cVDPV) y con el tiempo puede revertirse a una forma neurovirulenta que causa polio paralítica. [23] Esta reversión genética del patógeno a una forma virulenta lleva un tiempo considerable y no afecta a la persona que fue vacunada originalmente. Con los casos de polio salvaje en mínimos históricos, 2017 fue el primer año en el que se registraron más casos de cVDPV que de poliovirus salvaje. [24]
Hasta hace poco, se utilizaba una vacuna antipoliomielítica oral trivalente que contenía las tres cepas del virus y que había erradicado casi por completo la infección de polio en todo el mundo. [25] Con la erradicación completa del poliovirus salvaje tipo 2 [26], esta vacuna se eliminó gradualmente en 2016 y se reemplazó con una vacuna bivalente que contenía solo los tipos 1 y 3, complementada con una vacuna antipoliomielítica oral monovalente tipo 2 en las regiones donde se sabía que circulaba el cVDPV tipo 2. [23] El cambio a la vacuna bivalente y la inmunidad faltante asociada contra las cepas de tipo 2, entre otros factores, llevaron a brotes de poliovirus circulante derivado de la vacuna tipo 2 (cVDPV2), que aumentaron de 2 casos en 2016 a 1037 casos en 2020. [27]
En 2021 se concedió la licencia de emergencia a una nueva vacuna OPV2 (nOPV2), modificada genéticamente para reducir la probabilidad de mutaciones activadoras que provoquen enfermedades, y posteriormente la licencia completa en diciembre de 2023. [28] Esta vacuna tiene una mayor estabilidad genética que la vacuna oral tradicional y es menos probable que revierta a una forma virulenta. [29] [9] Se están desarrollando vacunas genéticamente estabilizadas dirigidas a los tipos 1 y 3 del poliovirus, con la intención de que eventualmente reemplacen por completo a las vacunas Sabin. [30]
En los países con polio endémica o donde el riesgo de casos importados es alto, la OMS recomienda la vacuna OPV al nacer seguida de una serie primaria de tres dosis de OPV y al menos una dosis de IPV a partir de las 6 semanas de edad, con un mínimo de 4 semanas entre las dosis de OPV. En los países con una cobertura de inmunización >90% y bajo riesgo de importación, la OMS recomienda una o dos dosis de IPV a partir de los 2 meses de edad seguidas de al menos dos dosis de OPV, con una separación de 4 a 8 semanas entre las dosis, dependiendo del riesgo de exposición. En los países con los niveles más altos de cobertura y los menores riesgos de importación y transmisión, la OMS recomienda una serie primaria de tres inyecciones de IPV, con una dosis de refuerzo después de un intervalo de seis meses o más si la primera dosis se administró antes de los 2 meses de edad. [2]
Las vacunas antipoliomielíticas inactivadas son muy seguras. Puede producirse un leve enrojecimiento o dolor en el lugar de la inyección. Por lo general, es seguro administrarlas a mujeres embarazadas y a personas que tienen VIH/SIDA pero que por lo demás están bien. [2]
La vacuna antipoliomielítica inactivada puede provocar una reacción alérgica en algunas personas, ya que contiene cantidades mínimas de antibióticos , estreptomicina , polimixina B y neomicina . No debe administrarse a ninguna persona que tenga una reacción alérgica a estos medicamentos. Los signos y síntomas de una reacción alérgica, que suelen aparecer en cuestión de minutos o unas horas después de recibir la vacuna inyectada, incluyen dificultades para respirar, debilidad, ronquera o sibilancia, fluctuaciones de la frecuencia cardíaca, erupción cutánea y mareos. [32]
Un posible efecto adverso de la vacuna oral Sabin es su potencial para recombinarse en una forma que causa infección neurológica y parálisis. [33] La vacuna oral Sabin produce poliomielitis paralítica asociada a la vacuna (VAPP) en aproximadamente un individuo por cada 2,7 millones de dosis administradas, con síntomas idénticos a los de la polio salvaje. [23] Debido a su estabilidad genética mejorada, la nueva vacuna oral (nOPV) tiene un riesgo reducido de que esto ocurra. [34]
En 1960, se determinó que las células renales de mono rhesus utilizadas para preparar las vacunas contra el virus de la poliomielitis estaban infectadas con el virus simio-40 (SV40), [35] que también se descubrió en 1960 y es un virus natural que infecta a los monos. En 1961, se descubrió que el SV40 causaba tumores en roedores . [36] Más recientemente, el virus se encontró en ciertas formas de cáncer en humanos, por ejemplo , tumores cerebrales y óseos , mesotelioma pleural y peritoneal y algunos tipos de linfoma no Hodgkin . [37] [38] Sin embargo, no se ha determinado que el SV40 cause estos cánceres. [39]
Se encontró que el SV40 estaba presente en las existencias de la forma inyectable de la IPV en uso entre 1955 y 1963. [35] No se encuentra en la forma OPV. [35] Más de 98 millones de estadounidenses recibieron una o más dosis de la vacuna contra la polio entre 1955 y 1963 cuando una proporción de la vacuna estaba contaminada con SV40; se estima que entre 10 y 30 millones de estadounidenses pueden haber recibido una dosis de vacuna contaminada con SV40. [35] Análisis posteriores sugirieron que las vacunas producidas por los países del antiguo bloque soviético hasta 1980, y utilizadas en la URSS , China , Japón y varios países africanos , pueden haber estado contaminadas, lo que significa que cientos de millones más pueden haber estado expuestos al SV40. [40]
En 1998, el Instituto Nacional del Cáncer llevó a cabo un estudio a gran escala, utilizando información sobre casos de cáncer de la base de datos SEER del instituto. Los resultados publicados del estudio no revelaron un aumento de la incidencia de cáncer en personas que podrían haber recibido una vacuna que contenía SV40. [41] Otro estudio a gran escala realizado en Suecia examinó las tasas de cáncer de 700.000 personas que habían recibido una vacuna contra la polio potencialmente contaminada en fecha tan reciente como 1957; el estudio volvió a revelar que no había un aumento de la incidencia de cáncer entre las personas que habían recibido vacunas contra la polio que contenían SV40 y las que no. [42] Sin embargo, la cuestión de si el SV40 causa cáncer en los seres humanos sigue siendo controvertida, y será necesario desarrollar mejores ensayos para la detección del SV40 en los tejidos humanos para resolver la controversia. [39]

Durante la carrera para desarrollar una vacuna oral contra la polio, se llevaron a cabo varios ensayos humanos a gran escala. Para 1958, los Institutos Nacionales de Salud habían determinado que la OPV producida usando las cepas Sabin era la más segura. [43] Sin embargo, entre 1957 y 1960, Hilary Koprowski continuó administrando su vacuna en todo el mundo. En África, las vacunas se administraron a aproximadamente un millón de personas en los territorios belgas (ahora la República Democrática del Congo , Ruanda y Burundi ). [44] [45] Los resultados de estos ensayos humanos han sido controvertidos, [46] y surgieron acusaciones infundadas en la década de 1990 de que la vacuna había creado las condiciones necesarias para la transmisión del virus de inmunodeficiencia simia de los chimpancés a los humanos, causando VIH/SIDA . Sin embargo, estas hipótesis han sido refutadas de manera concluyente . [44] En 2004, los casos de poliomielitis en África se habían reducido a un pequeño número de regiones aisladas en la parte occidental del continente, con casos esporádicos en otras partes. Recientemente, la oposición local a las campañas de vacunación ha surgido debido a la falta de información adecuada, [47] [48] a menudo relacionada con temores de que la vacuna pueda inducir esterilidad . [49] Desde entonces, la enfermedad ha resurgido en Nigeria y en varias otras naciones africanas sin la información necesaria, lo que los epidemiólogos creen que se debe a la negativa de ciertas poblaciones locales a permitir que sus hijos reciban la vacuna contra la polio. [50]
La vacuna de Salk, IPV, se basa en tres cepas de referencia salvajes y virulentas , Mahoney (poliovirus tipo 1), MEF-1 (poliovirus tipo 2) y Saukett (poliovirus tipo 3), cultivadas en un tipo de cultivo de tejido de riñón de mono (línea celular Vero ), que luego se inactivan con formalina . [51] La vacuna de Salk inyectada confiere inmunidad mediada por IgG en el torrente sanguíneo, lo que evita que la infección de polio progrese a viremia y protege las neuronas motoras , eliminando así el riesgo de polio bulbar y síndrome post-polio .
En los Estados Unidos, la vacuna se administra junto con las vacunas contra el tétano , la difteria y la tos ferina acelular ( DTaP ) y una dosis pediátrica de la vacuna contra la hepatitis B. [20] En el Reino Unido, la IPV se combina con las vacunas contra el tétano, la difteria, la tos ferina y Haemophilus influenzae tipo b. [52]

,_Live_at_PRC70_Exhibition_(20191203153024).jpg/440px-Poliomyelitis_Vaccine_Type_I_Type_III_in_Dragee_Candy_(Human_Diploid_Cell),_Live_at_PRC70_Exhibition_(20191203153024).jpg)
La OPV es una vacuna atenuada , producida por el paso del virus a través de células no humanas a una temperatura subfisiológica , que produce mutaciones espontáneas en el genoma viral. [53] Las vacunas orales contra la polio fueron desarrolladas por varios grupos, uno de los cuales fue dirigido por Albert Sabin . Otros grupos, dirigidos por Hilary Koprowski y HR Cox , desarrollaron sus propias cepas de vacunas atenuadas. En 1958, los Institutos Nacionales de Salud crearon un comité especial sobre vacunas vivas contra la polio. Las diversas vacunas fueron evaluadas cuidadosamente por su capacidad para inducir inmunidad a la polio, manteniendo al mismo tiempo una baja incidencia de neuropatogenicidad en monos. Los ensayos clínicos a gran escala realizados en la Unión Soviética a fines de la década de 1950 y principios de la de 1960 por Mikhail Chumakov y sus colegas demostraron la seguridad y alta eficacia de la vacuna. [54] [55] Con base en estos resultados, las cepas Sabin fueron elegidas para su distribución mundial. [43] Cincuenta y siete sustituciones de nucleótidos distinguen la cepa Sabin 1 atenuada de su progenitor virulento (el serotipo Mahoney), dos sustituciones de nucleótidos atenúan la cepa Sabin 2 y 10 sustituciones están implicadas en la atenuación de la cepa Sabin 3. [51] El principal factor atenuante común a las tres vacunas Sabin es una mutación ubicada en el sitio de entrada del ribosoma interno del virus , [56] que altera las estructuras de tallo-bucle y reduce la capacidad del poliovirus para traducir su plantilla de ARN dentro de la célula huésped. [57] El poliovirus atenuado en la vacuna Sabin se replica de manera muy eficiente en el intestino, el sitio primario de infección y replicación, pero no puede replicarse de manera eficiente dentro del tejido del sistema nervioso . En 1961, se autorizó la vacuna oral monovalente contra el poliovirus tipo 1 y 2 (MOPV), y en 1962, se autorizó la MOPV tipo 3. En 1963 se autorizó la vacuna OPV trivalente (TOPV), que se convirtió en la vacuna de elección en los Estados Unidos y en la mayoría de los demás países del mundo, sustituyendo en gran medida a la vacuna antipoliomielítica inactivada. [58] Una segunda oleada de inmunizaciones masivas condujo a una reducción aún más drástica del número de casos de poliomielitis. Entre 1962 y 1965, unos 100 millones de estadounidenses (aproximadamente el 56% de la población en ese momento) recibieron la vacuna Sabin. El resultado fue una reducción sustancial del número de casos de poliomielitis, incluso en comparación con los niveles muy reducidos tras la introducción de la vacuna Salk. [59]
La vacuna antipoliomielítica oral se suministra generalmente en viales que contienen entre 10 y 20 dosis de vacuna. Una dosis única de vacuna antipoliomielítica oral (normalmente dos gotas) contiene 1.000.000 de unidades infecciosas de Sabin 1 (eficaz contra PV1), 100.000 unidades infecciosas de la cepa Sabin 2 y 600.000 unidades infecciosas de Sabin 3. La vacuna contiene pequeñas trazas de antibióticos ( neomicina y estreptomicina ), pero no contiene conservantes . [60]
En un sentido genérico, la vacunación funciona preparando el sistema inmunológico con un " inmunógeno ". La estimulación de la respuesta inmunitaria, mediante el uso de un agente infeccioso, se conoce como inmunización . El desarrollo de inmunidad a la polio bloquea eficazmente la transmisión de persona a persona del poliovirus salvaje, protegiendo así tanto a los receptores individuales de la vacuna como a la comunidad en general . [14]
El desarrollo de dos vacunas contra la polio condujo a las primeras inoculaciones masivas modernas . Los últimos casos de poliomielitis paralítica causada por transmisión endémica del virus salvaje en los Estados Unidos ocurrieron en 1979, con un brote entre los Amish en varios estados del Medio Oeste . [20]
En la década de 1930, el poliovirus se percibía como especialmente aterrador, ya que se sabía poco sobre cómo se transmitía la enfermedad o cómo se podía prevenir. Este virus también era conocido por afectar principalmente a los niños adinerados, lo que lo convertía en un objetivo principal para el desarrollo de vacunas, a pesar de su mortalidad y morbilidad relativamente bajas. [61] A pesar de esto, hasta el momento la comunidad de investigadores en el campo había observado en gran medida una moratoria informal sobre cualquier desarrollo de vacunas, ya que se percibía que presentaba un riesgo demasiado alto para una probabilidad de éxito demasiado baja. [62] [63]
Esta situación cambió a principios de la década de 1930, cuando grupos estadounidenses aceptaron el desafío: Maurice Brodie dirigió un equipo del laboratorio de salud pública de la ciudad de Nueva York y John A. Kolmer colaboró con el Instituto de Investigación de Medicina Cutánea de Filadelfia. La rivalidad entre estos dos investigadores dio lugar a una mentalidad de tipo racial que, combinada con una falta de supervisión de los estudios médicos, se reflejó en la metodología y los resultados de cada una de estas primeras iniciativas de desarrollo de vacunas. [64] [65] [61]
Kolmer comenzó su proyecto de desarrollo de vacunas en 1932 y finalmente se centró en producir una vacuna de virus vivo o atenuado . Inspirado por el éxito de las vacunas contra la rabia y la fiebre amarilla, esperaba utilizar un proceso similar para desnaturalizar el virus de la polio. [64] Para atenuar su vacuna contra la polio, pasó repetidamente el virus a través de monos. [66] Utilizando métodos de producción que luego se describieron como "espeluznantemente amateur, el equivalente terapéutico de la ginebra de bañera", [67] Kolmer molió las médulas espinales de sus monos infectados y las sumergió en una solución de sal. Luego filtró la solución a través de una malla, la trató con ricinolato y refrigeró el producto durante 14 días [64] para finalmente crear lo que más tarde sería criticado prominentemente como un "verdadero brebaje de brujas". [68]
En consonancia con las normas de la época, Kolmer completó un ensayo animal relativamente pequeño con 42 monos antes de proceder a la autoexperimentación en 1934. [63] Probó su vacuna en sí mismo, sus dos hijos y su asistente. [63] Le dio su vacuna a sólo 23 niños más antes de declararla segura y enviarla a médicos y departamentos de salud para una prueba más amplia de eficacia. [63] En abril de 1935, pudo informar que había probado la vacuna en 100 niños sin efectos nocivos. [69] La primera presentación formal de los resultados de Kolmer no se produciría hasta noviembre de 1935, cuando presentó los resultados de 446 niños y adultos que había vacunado con su vacuna atenuada. [69] También informó que juntos el Instituto de Investigación de Medicina Cutánea y la Compañía Merrell de Cincinnati (el fabricante que tenía la patente de su proceso de ricinoleación) habían distribuido 12.000 dosis de vacuna a unos 700 médicos en los Estados Unidos y Canadá. [69] Kolmer no describió ningún seguimiento de este programa de vacunación experimental ni proporcionó a estos médicos instrucciones sobre cómo administrar la vacuna o cómo informar sobre los efectos secundarios. [69] Kolmer dedicó la mayor parte de sus publicaciones posteriores a explicar lo que creía que era la causa de los más de 10 casos notificados de polio paralítica tras la vacunación, en muchos casos en ciudades donde no se había producido ningún brote de polio. [69] [70] Seis de estos casos habían sido mortales. [69] Kolmer no tenía un grupo de control, pero afirmó que muchos más niños se habrían enfermado. [70]
Casi al mismo tiempo que el proyecto de Kolmer, Maurice Brodie se había unido al inmunólogo William H. Park en el Departamento de Salud de la Ciudad de Nueva York , donde trabajaron juntos en el poliovirus. Con la ayuda de la financiación de la Comisión del Baile del Cumpleaños del Presidente (un predecesor de lo que se convertiría en March of Dimes ), Brodie pudo continuar con el desarrollo de una vacuna inactivada o de "virus muerto". El proceso de Brodie también comenzó triturando las médulas espinales de monos infectados y luego tratando las médulas con varios germicidas, [71] encontrando finalmente que una solución de formaldehído era la más efectiva. El 1 de junio de 1934, Brodie pudo publicar su primer artículo académico que describía su exitosa inducción de inmunidad en tres monos con el virus de la polio inactivado. [72] [73] A través del estudio continuo en otros 26 monos, Brodie finalmente concluyó que la administración de la vacuna de virus vivo tendía a resultar en inmunidad humoral mientras que la administración de la vacuna de virus muerto tendía a resultar en inmunidad tisular . [69]
Poco después, siguiendo un protocolo similar al de Kolmer, Brodie procedió a la autoexperimentación sobre sí mismo y sus compañeros de trabajo en el laboratorio del Departamento de Salud de Nueva York . [63] El progreso de Brodie fue cubierto con entusiasmo por la prensa popular mientras el público esperaba que una vacuna exitosa estuviera disponible. [73] Tales informes no mencionaron a los 12 niños en un asilo de la ciudad de Nueva York que fueron sometidos a ensayos de seguridad tempranos. [63] Como ninguno de los sujetos experimentó efectos nocivos, Park, descrito por los contemporáneos como "alguien que nunca dejaba crecer la hierba bajo sus pies", [74] declaró que la vacuna era segura. [66] Cuando un brote severo de polio abrumó al condado de Kern , California, se convirtió en el primer sitio de prueba para la nueva vacuna en muy poco tiempo. Entre noviembre de 1934 y mayo de 1935, se administraron más de 1.500 dosis de la vacuna en el condado de Kern. Aunque los resultados iniciales fueron muy prometedores, la falta de personal y el mal diseño del protocolo dejaron a Brodie expuesto a críticas cuando publicó los resultados de California en agosto de 1935. [73] [69] A través de médicos privados, Brodie también llevó a cabo un estudio de campo más amplio, que incluyó a 9.000 niños que recibieron la vacuna y 4.500 controles de la misma edad y ubicación que no recibieron la vacuna. Una vez más, los resultados fueron prometedores. De los que recibieron la vacuna, solo unos pocos desarrollaron polio. La mayoría había estado expuesta antes de la vacunación y ninguno había recibido la serie completa de dosis de vacuna que se estaban estudiando. [69] Además, una epidemia de polio en Raleigh , Carolina del Norte, proporcionó una oportunidad para que el Servicio de Salud Pública de los EE. UU. realizara un ensayo altamente estructurado de la vacuna Brodie utilizando fondos de la Comisión del Baile de Cumpleaños. [66] [69]
Mientras su trabajo estaba en curso, la comunidad más amplia de bacteriólogos comenzó a plantear inquietudes con respecto a la seguridad y eficacia de las nuevas vacunas contra el poliovirus. [62] En ese momento, había muy poca supervisión de los estudios médicos y el tratamiento ético de los participantes del estudio dependía en gran medida de la presión moral de los científicos académicos pares . [64] Las vacunas inactivadas de Brodie enfrentaron el escrutinio de muchos que pensaban que las vacunas con virus muertos no podían ser eficaces. Si bien los investigadores pudieron replicar la inmunidad tisular que había producido en sus ensayos con animales, la sabiduría predominante era que la inmunidad humoral era esencial para una vacuna eficaz. [69] Kolmer cuestionó directamente el enfoque del virus muerto en revistas académicas. [71] Sin embargo, los estudios de Kolmer habían suscitado aún más preocupación con el aumento de informes de niños que quedaron paralizados después de la vacunación con su vacuna de virus vivo y, en particular, con parálisis que comenzaba en el brazo en lugar del pie en muchos casos. [75] Tanto Kolmer como Brodie fueron convocados para presentar su investigación en la Reunión Anual de la Asociación Estadounidense de Salud Pública en Milwaukee, Wisconsin, en octubre de 1935. [62] Además, se le pidió a Thomas M. Rivers que discutiera cada uno de los trabajos presentados como un destacado crítico del esfuerzo de desarrollo de la vacuna. [62] Esto dio como resultado que la APHA organizara un Simposio sobre Poliomielitis que se realizaría en la Reunión Anual de su Rama Sur el mes siguiente. [62] Fue durante la discusión en esta reunión que James Leake, del Servicio de Salud Pública de los EE. UU., se puso de pie para presentar de inmediato evidencia clínica de que la vacuna de Kolmer había causado varias muertes y luego supuestamente acusó a Kolmer de ser un asesino. [62] Como Rivers recordó en su historia oral, "Se desató el infierno y parecía como si todos estuvieran tratando de hablar al mismo tiempo... Jimmy Leake usó el lenguaje más fuerte que jamás haya escuchado en una reunión científica". [62] En respuesta a los ataques de todos lados, se informó que Brodie se puso de pie y declaró: "Parece que, según el Dr. Rivers, mi vacuna no es buena y, según el Dr. Leake, la del Dr. Kolmer es peligrosa". [62] Kolmer simplemente respondió diciendo: "Caballeros, esta es una de las ocasiones en las que desearía que el piso se abriera y me tragara". [62] En última instancia, se demostró indudablemente que la vacuna viva de Kolmer era peligrosa y ya había sido retirada en septiembre de 1935 antes de la reunión de Milwaukee. [75] [70][69] Aunque el consenso del simposio fue en gran medida escéptico sobre la eficacia de la vacuna de Brodie, su seguridad no estaba en duda y la recomendación fue que se realizara un ensayo mucho más grande y bien controlado. [75] Sin embargo, cuando tres niños enfermaron de polio paralítica después de una dosis de la vacuna, los directores de la Warm Springs Foundation en Georgia (que actuaban como los principales financiadores del proyecto) solicitaron que se retirara en diciembre de 1935. [75] Después de su retirada, se reanudó la moratoria previamente observada sobre el desarrollo de la vacuna contra la poliomielitis humana y no habría otro intento durante casi 20 años. [69] [70]
Aunque Brodie fue sin duda el que más avanzó en la búsqueda de una vacuna contra el virus de la polio, sufrió las repercusiones más significativas en su carrera debido a su condición de investigador menos conocido. [73] Los investigadores modernos reconocen que Brodie bien pudo haber desarrollado una vacuna eficaz contra la polio, sin embargo, la ciencia y la tecnología básicas de la época eran insuficientes para comprender y utilizar este avance. [69] El trabajo de Brodie utilizando virus inactivados con formalina se convertiría más tarde en la base de la vacuna de Salk, pero no viviría para ver este éxito. [69] Brodie fue despedido de su puesto a los tres meses de la publicación del simposio. [69] Aunque pudo encontrar otro puesto en el laboratorio, murió de un ataque cardíaco solo tres años después, a la edad de 36 años. [69] [73] Por el contrario, Park, de quien la comunidad creía que estaba llegando a la senilidad en este punto de su vejez, pudo retirarse de su puesto con honores [62] antes de su muerte en 1939. [66] Kolmer, ya un investigador establecido y respetado, regresó a la Universidad de Temple como profesor de medicina. [69] Kolmer tuvo una carrera muy productiva, recibió múltiples premios y publicó innumerables artículos, trabajos y libros de texto hasta su jubilación en 1957. [66] [62] [70] [76]
En 1948 se produjo un gran avance cuando un grupo de investigación dirigido por John Enders en el Hospital Infantil de Boston cultivó con éxito el virus de la polio en tejido humano en el laboratorio. [77] Este grupo había cultivado recientemente con éxito paperas en cultivo celular . En marzo de 1948, Thomas H. Weller estaba intentando cultivar el virus de la varicela en tejido pulmonar embrionario. Había inoculado la cantidad planificada de tubos cuando se dio cuenta de que había algunos tubos sin usar. Recuperó una muestra de cerebro de ratón infectado con el virus de la polio y la añadió a los tubos de ensayo restantes, por si acaso el virus pudiera crecer. Los cultivos de varicela no crecieron, pero los cultivos de polio tuvieron éxito. Este desarrollo facilitó enormemente la investigación de vacunas y, en última instancia, permitió el desarrollo de vacunas contra la polio. Enders y sus colegas, Thomas H. Weller y Frederick C. Robbins , fueron reconocidos en 1954 por sus esfuerzos con un Premio Nobel de Fisiología o Medicina . [78] Otros avances importantes que llevaron al desarrollo de las vacunas contra la polio fueron: la identificación de tres serotipos de poliovirus (Poliovirus tipo 1 – PV1, o Mahoney; PV2, Lansing; y PV3, Leon); el hallazgo de que antes de la parálisis, el virus debe estar presente en la sangre; y la demostración de que la administración de anticuerpos en forma de gammaglobulina protege contra la polio paralítica. [62] [51] [79]

A principios de la década de 1950, las tasas de polio en los EE. UU. eran superiores a 25 000 al año; en 1952 y 1953, EE. UU. experimentó un brote de 58 000 y 35 000 casos de polio, respectivamente, frente a una cifra típica de unos 20 000 al año, con muertes en esos años que ascendieron a 3200 y 1400. [80] En medio de esta epidemia de polio en EE. UU., se invirtieron millones de dólares en encontrar y comercializar una vacuna contra la polio por parte de intereses comerciales, incluidos los Laboratorios Lederle en Nueva York bajo la dirección de HR Cox . En Lederle también trabajaba el virólogo e inmunólogo nacido en Polonia Hilary Koprowski , del Instituto Wistar de Filadelfia, que ensayó la primera vacuna contra la polio que tuvo éxito en 1950. [10] [45] Sin embargo, su vacuna, al ser un virus vivo atenuado que se administraba por vía oral, todavía estaba en fase de investigación y no estaría lista para su uso hasta cinco años después de que la vacuna contra la polio de Jonas Salk (una vacuna inyectable con virus muertos) hubiera llegado al mercado. La vacuna atenuada de Koprowski se preparó mediante sucesivos pases a través de los cerebros de ratones albinos suizos. En el séptimo pase, las cepas de la vacuna ya no podían infectar el tejido nervioso ni causar parálisis. Después de uno a tres pases más en ratas, la vacuna se consideró segura para el uso humano. [43] [81] El 27 de febrero de 1950, la vacuna viva atenuada de Koprowski se probó por primera vez en un niño de 8 años que vivía en Letchworth Village , una institución para personas con discapacidad física y mental ubicada en Nueva York. Después de que el niño no presentara efectos secundarios, Koprowski amplió su experimento para incluir a otros 19 niños. [43] [82]


La primera vacuna eficaz contra la polio fue desarrollada en 1952 por Jonas Salk y un equipo de la Universidad de Pittsburgh que incluía a Julius Youngner , Byron Bennett, L. James Lewis y Lorraine Friedman, lo que requirió años de pruebas posteriores. Salk apareció en la radio CBS para informar sobre una prueba exitosa en un pequeño grupo de adultos y niños el 26 de marzo de 1953; dos días después, los resultados se publicaron en JAMA . [70] Leone N. Farrell inventó una técnica de laboratorio clave que permitió la producción en masa de la vacuna por un equipo que ella dirigió en Toronto. [83] [84] A partir del 23 de febrero de 1954, la vacuna se probó en la escuela primaria Arsenal y en el Watson Home for Children en Pittsburgh, Pensilvania . [85]
La vacuna de Salk se utilizó entonces en una prueba llamada Francis Field Trial, dirigida por Thomas Francis , el mayor experimento médico de la historia en ese momento. La prueba comenzó con unos 4.000 niños en la escuela primaria Franklin Sherman en McLean, Virginia , [86] [87] y finalmente involucró a 1,8 millones de niños, en 44 estados desde Maine hasta California . [88] Al concluir el estudio, aproximadamente 440.000 recibieron una o más inyecciones de la vacuna, unos 210.000 niños recibieron un placebo , que consistía en medios de cultivo inofensivos , y 1,2 millones de niños no recibieron ninguna vacuna y sirvieron como grupo de control, que luego sería observado para ver si alguno contraía polio. [43]
Los resultados del ensayo de campo se anunciaron el 12 de abril de 1955 (el décimo aniversario de la muerte del presidente Franklin D. Roosevelt , cuya enfermedad paralítica se creía generalmente que había sido causada por la polio). La vacuna de Salk había sido 60-70% efectiva contra PV1 (poliovirus tipo 1), más del 90% efectiva contra PV2 y PV3, y 94% efectiva contra el desarrollo de la polio bulbar. [89] Poco después de que la vacuna de Salk fuera autorizada en 1955, se lanzaron campañas de vacunación infantil. En los EE. UU., luego de una campaña de inmunización masiva promovida por March of Dimes , el número anual de casos de polio cayó de 35.000 en 1953 a 5.600 en 1957. [90] Para 1961 solo se registraron 161 casos en los Estados Unidos. [91]
Una semana antes del anuncio de los resultados del ensayo de campo Francis en abril de 1955, Pierre Lépine, en el Instituto Pasteur de París, también había anunciado una vacuna eficaz contra la polio. [92] [93]
En abril de 1955, poco después de que comenzara la vacunación masiva contra la polio en los EE. UU., el Cirujano General comenzó a recibir informes de pacientes que contrajeron polio paralítica aproximadamente una semana después de haber sido vacunados con la vacuna contra la polio Salk de la compañía farmacéutica Cutter , y la parálisis comenzó en la extremidad en la que se inyectó la vacuna. [94] La vacuna Cutter se había utilizado para vacunar a 409.000 niños en el oeste y medio oeste de los Estados Unidos. [95] Investigaciones posteriores mostraron que la vacuna Cutter había causado 260 casos de polio, matando a 11. [94] En respuesta, el Cirujano General retiró del mercado todas las vacunas contra la polio fabricadas por Cutter Laboratories, pero no antes de que se produjeran 260 casos de enfermedad paralítica. También se informó de que las vacunas contra la polio de Eli Lilly, Parke-Davis, Pitman-Moore y Wyeth habían paralizado a numerosos niños. Pronto se descubrió que algunos lotes de la vacuna antipoliomielítica Salk fabricada por Cutter, Wyeth y otros laboratorios no habían sido inactivados adecuadamente, lo que permitió que el virus de la poliomielitis estuviera vivo en más de 100.000 dosis de vacuna. En mayo de 1955, los Institutos Nacionales de Salud y los Servicios de Salud Pública establecieron un Comité Técnico sobre la Vacuna Antipoliomielítica para probar y revisar todos los lotes de la vacuna antipoliomielítica y asesorar al Servicio de Salud Pública sobre qué lotes debían liberarse para uso público. Estos incidentes redujeron la confianza pública en la vacuna antipoliomielítica, lo que llevó a una caída en las tasas de vacunación. [96]

Al mismo tiempo que Salk estaba probando su vacuna, tanto Albert Sabin como Hilary Koprowski seguían trabajando en el desarrollo de una vacuna utilizando virus vivos. Durante una reunión en Estocolmo para discutir las vacunas contra la polio en noviembre de 1955, Sabin presentó los resultados obtenidos en un grupo de 80 voluntarios, mientras que Koprowski leyó un documento que detallaba los hallazgos de un ensayo en el que participaron 150 personas. [43] Sabin y Koprowski finalmente lograron desarrollar vacunas. Debido al compromiso con la vacuna de Salk en Estados Unidos, Sabin y Koprowski realizaron sus pruebas fuera de los Estados Unidos, Sabin en México [53] y la Unión Soviética, [97] Koprowski en el Congo y Polonia. [45] En 1957, Sabin desarrolló una vacuna trivalente que contenía cepas atenuadas de los tres tipos de poliovirus. [97] En 1959, diez millones de niños en la Unión Soviética recibieron la vacuna oral de Sabin. Por este trabajo, Sabin recibió la medalla de la Orden de la Amistad de los Pueblos , descrita como el más alto honor civil de la Unión Soviética. [98] La vacuna oral de Sabin que utiliza virus vivos comenzó a usarse comercialmente en 1961. [2]
Una vez que la vacuna oral de Sabin se volvió ampliamente disponible, suplantó a la vacuna inyectable de Salk, que había sido empañada en la opinión pública por el incidente Cutter de 1955, en el que las vacunas de Salk preparadas incorrectamente por una compañía provocaron que varios niños murieran o quedaran paralizados. [70]
En noviembre de 1987 se autorizó en los Estados Unidos una IPV de potencia mejorada, y actualmente es la vacuna de elección allí. [20] La primera dosis de la vacuna contra la polio se administra poco después del nacimiento, generalmente entre 1 y 2 meses de edad, y una segunda dosis se administra a los 4 meses de edad. [20] El momento de la tercera dosis depende de la formulación de la vacuna, pero debe administrarse entre los 6 y los 18 meses de edad. [52] Se administra una vacuna de refuerzo entre los 4 y 6 años de edad, para un total de cuatro dosis al ingresar a la escuela o antes. [21] En algunos países, se administra una quinta vacuna durante la adolescencia . [52] La vacunación de rutina de adultos (de 18 años de edad y mayores) en los países desarrollados no es necesaria ni recomendada porque la mayoría de los adultos ya son inmunes y tienen un riesgo muy pequeño de exposición al poliovirus salvaje en sus países de origen. [20] En 2002, se aprobó para su uso en los Estados Unidos una vacuna combinada pentavalente (de cinco componentes) (llamada Pediarix) [99] [100] que contenía IPV. [101] [100]

En 1988 se inició un esfuerzo mundial para erradicar la polio, liderado por la Organización Mundial de la Salud (OMS), UNICEF [ 102] y la Fundación Rotaria , que se ha basado en gran medida en la vacuna oral contra la polio desarrollada por Albert Sabin y Mikhail Chumakov (vacuna Sabin-Chumakov). [103]
La polio fue eliminada en las Américas en 1994. [104] La enfermedad fue eliminada oficialmente en 36 países del Pacífico occidental, incluidos China y Australia, en 2000. [105] [106] Europa fue declarada libre de polio en 2002. [107] Desde enero de 2011, no se han reportado casos de la enfermedad en la India, por lo que en febrero de 2012 el país fue retirado de la lista de la OMS de países endémicos de polio. En marzo de 2014, la India fue declarada país libre de polio. [108] [109] [110]
Aunque la transmisión del poliovirus se ha interrumpido en gran parte del mundo, la transmisión del poliovirus salvaje continúa y crea un riesgo constante de importación de poliovirus salvaje a regiones que anteriormente estaban libres de polio. Si se producen importaciones de poliovirus, pueden desarrollarse brotes de poliomielitis, especialmente en áreas con baja cobertura de vacunación y saneamiento deficiente. Como resultado, se deben mantener altos niveles de cobertura de vacunación. [104] En noviembre de 2013, la OMS anunció un brote de polio en Siria. En respuesta, el gobierno armenio publicó un aviso pidiendo a los armenios sirios menores de 15 años que se vacunen contra la polio. [111] En 2014, el poliovirus se había propagado a 10 países, principalmente en África, Asia y Oriente Medio , y Pakistán, Siria y Camerún aconsejaron la vacunación a los viajeros que salieran del país. [112]
Los programas de vacunación contra la polio han sido resistidos por algunas personas en Pakistán, Afganistán y Nigeria, los tres países en los que aún hay casos de polio en 2017. Casi todos los líderes religiosos y políticos musulmanes han respaldado la vacuna, [113] pero una minoría marginal cree que las vacunas se están utilizando en secreto para la esterilización de los musulmanes. [50] El hecho de que la CIA organizara un programa de vacunación falso en 2011 para ayudar a encontrar a Osama bin Laden es una causa adicional de desconfianza. [114] En 2015, la OMS anunció un acuerdo con los talibanes para alentarlos a distribuir la vacuna en las áreas que controlan. [115] Sin embargo, los talibanes paquistaníes no lo apoyaron. El 11 de septiembre de 2016, dos hombres armados no identificados asociados con los talibanes paquistaníes, Jamaat-ul-Ahrar, dispararon a Zakaullah Khan, un médico que estaba administrando vacunas contra la polio en Pakistán. El líder de Jamaat-ul-Ahrar se atribuyó la responsabilidad del tiroteo y declaró que el grupo seguiría cometiendo este tipo de ataques. La resistencia y el escepticismo ante las vacunas han ralentizado el proceso de erradicación de la polio en los dos países endémicos restantes. [114]
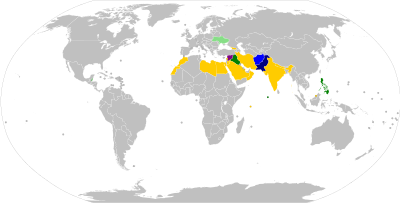
Los viajeros que deseen entrar o salir de determinados países deben vacunarse contra la polio, normalmente como máximo 12 meses y al menos 4 semanas antes de cruzar la frontera, y poder presentar un registro/certificado de vacunación en los controles fronterizos. [116] : 25–27 La mayoría de los requisitos se aplican únicamente a los viajes hacia o desde los países denominados "polioendémicos", "afectados por la polio", "exportadores de polio", "de transmisión de la polio" o "de alto riesgo". [117] A fecha de agosto de 2020, Afganistán y Pakistán son los únicos países polioendémicos del mundo (donde la polio salvaje aún no ha sido erradicada ). [118] Varios países tienen requisitos adicionales de vacunación preventiva contra la polio para viajar, por ejemplo hacia y desde "países clave en riesgo", que a fecha de diciembre de 2020 incluyen a China, Indonesia, Mozambique, Myanmar y Papua Nueva Guinea. [117] [119]
A partir de 2015 [actualizar], la Alianza Mundial para Vacunas e Inmunización suministra la vacuna inactivada a los países en desarrollo por tan sólo 0,75 euros (aproximadamente 0,89 dólares estadounidenses ) por dosis en viales de 10 dosis. [143]
En Pakistán se ha extendido la idea errónea de que la vacuna contra la polio contiene componentes prohibidos y puede causar impotencia e infertilidad en los niños varones, lo que ha llevado a algunos padres a no vacunar a sus hijos. Esta creencia es más común en la provincia de Khyber Pakhtunkhwa y en la región de FATA . También se han producido ataques a los equipos de vacunación contra la polio, lo que ha obstaculizado los esfuerzos internacionales para erradicar la polio en Pakistán y en todo el mundo. [144] [145]
{{cite journal}}: CS1 maint: DOI inactivo a partir de agosto de 2024 ( enlace )La resistencia a la vacunación contra la polio es una postura marginal. Casi todos los académicos y líderes políticos musulmanes han respaldado la vacuna, y todos los países de mayoría musulmana, salvo unos pocos, han erradicado la enfermedad por completo.