El grupo 12 , según la numeración moderna de la IUPAC , [1] es un grupo de elementos químicos de la tabla periódica . Incluye el cinc (Zn), el cadmio (Cd), el mercurio (Hg), [2] [3] [4] y el copernicio (Cn). [5] Anteriormente, este grupo se denominaba IIB (pronunciado como "grupo dos B", ya que "II" es un número romano ) por el CAS y el antiguo sistema de la IUPAC. [nota 1]
Los tres elementos del grupo 12 que se encuentran en la naturaleza son el cinc, el cadmio y el mercurio. Todos ellos se utilizan ampliamente en aplicaciones eléctricas y electrónicas, así como en diversas aleaciones. Los dos primeros miembros del grupo comparten propiedades similares, ya que son metales sólidos en condiciones estándar. El mercurio es el único metal que se sabe que es líquido a temperatura ambiente; como el punto de ebullición del copernicio aún no se ha medido con la suficiente precisión [nota 2] , aún no se sabe si es líquido o gas en condiciones estándar. Si bien el cinc es muy importante en la bioquímica de los organismos vivos, el cadmio y el mercurio son altamente tóxicos. Como el copernicio no se encuentra en la naturaleza, debe sintetizarse en el laboratorio.
Al igual que otros grupos de la tabla periódica , los miembros del grupo 12 muestran patrones en su configuración electrónica, especialmente en las capas más externas, que resultan en tendencias en su comportamiento químico:
Los elementos del grupo 12 son todos metales blandos, diamagnéticos y divalentes . Tienen los puntos de fusión más bajos entre todos los metales de transición . [8] El zinc es de color blanco azulado y brillante, [9] aunque la mayoría de los grados comerciales comunes del metal tienen un acabado opaco. [10] El zinc también se conoce en contextos no científicos como spelter . [11] El cadmio es blando, maleable , dúctil y de color blanco azulado. El mercurio es un metal líquido, pesado, de color blanco plateado. Es el único metal líquido común a temperaturas ordinarias y, en comparación con otros metales, es un mal conductor del calor, pero un buen conductor de la electricidad. [12]
La siguiente tabla es un resumen de las propiedades físicas clave de los elementos del grupo 12. Los datos del copernicio se basan en simulaciones de la teoría relativista de la densidad funcional. [13]
El zinc es algo menos denso que el hierro y tiene una estructura cristalina hexagonal . [14] El metal es duro y quebradizo a la mayoría de las temperaturas, pero se vuelve maleable entre 100 y 150 °C (212 y 302 °F). [9] [10] Por encima de los 210 °C (410 °F), el metal se vuelve quebradizo nuevamente y se puede pulverizar golpeándolo. [15] El zinc es un buen conductor de electricidad . [9] Para un metal, el zinc tiene puntos de fusión (419,5 °C, 787,1 °F) y de ebullición (907 °C, 1665 °F) relativamente bajos. [8] El cadmio es similar en muchos aspectos al zinc, pero forma compuestos complejos . [16] A diferencia de otros metales, el cadmio es resistente a la corrosión y, como resultado, se usa como capa protectora cuando se deposita sobre otros metales. Como metal a granel, el cadmio es insoluble en agua y no es inflamable ; Sin embargo, en su forma en polvo puede arder y liberar humos tóxicos. [17] El mercurio tiene una temperatura de fusión excepcionalmente baja para un metal del bloque d. Una explicación completa de este hecho requiere una profunda excursión a la física cuántica , pero se puede resumir de la siguiente manera: el mercurio tiene una configuración electrónica única donde los electrones llenan todas las subcapas 1s, 2s, 2p, 3s, 3p, 3d, 4s, 4p, 4d, 4f, 5s, 5p, 5d y 6s disponibles. Como dicha configuración resiste fuertemente la eliminación de un electrón, el mercurio se comporta de manera similar a los elementos de los gases nobles , que forman enlaces débiles y, por lo tanto, sólidos que se funden fácilmente. La estabilidad de la capa 6s se debe a la presencia de una capa 4f llena. Una capa f apantalla mal la carga nuclear que aumenta la interacción atractiva de Coulomb de la capa 6s y el núcleo (ver contracción de los lantánidos ). La ausencia de una capa f interna llena es la razón de la temperatura de fusión algo más alta del cadmio y el zinc, aunque ambos metales todavía se funden fácilmente y, además, tienen puntos de ebullición inusualmente bajos. El oro tiene átomos con un electrón 6s menos que el mercurio. Esos electrones se eliminan más fácilmente y se comparten entre los átomos de oro formando enlaces metálicos relativamente fuertes . [18] [19]
El zinc, el cadmio y el mercurio forman una amplia gama de aleaciones . Entre las que contienen zinc, el latón es una aleación de zinc y cobre . Otros metales que desde hace tiempo se sabe que forman aleaciones binarias con el zinc son el aluminio , el antimonio , el bismuto , el oro , el hierro, el plomo , el mercurio, la plata , el estaño , el magnesio , el cobalto , el níquel , el telurio y el sodio . [11] Aunque ni el zinc ni el circonio son ferromagnéticos , su aleación ZrZn
2exhibe ferromagnetismo por debajo de 35 K. [9] El cadmio se utiliza en muchos tipos de aleaciones de soldadura y cojinetes , debido a un bajo coeficiente de fricción y resistencia a la fatiga. [20] También se encuentra en algunas de las aleaciones de menor punto de fusión, como el metal de Wood . [21] Debido a que es un líquido, el mercurio disuelve otros metales y las aleaciones que se forman se denominan amalgamas . Por ejemplo, tales amalgamas se conocen con oro, zinc, sodio y muchos otros metales. Debido a que el hierro es una excepción, los matraces de hierro se han utilizado tradicionalmente para comercializar mercurio. Otros metales que no forman amalgamas con mercurio incluyen tantalio , tungsteno y platino . La amalgama de sodio es un agente reductor común en la síntesis orgánica y también se utiliza en lámparas de sodio de alta presión . El mercurio se combina fácilmente con el aluminio para formar una amalgama de mercurio y aluminio cuando los dos metales puros entran en contacto. Como la amalgama reacciona con el aire para formar óxido de aluminio, pequeñas cantidades de mercurio corroen el aluminio. Por este motivo, no se permite el uso de mercurio a bordo de un avión en la mayoría de las circunstancias debido al riesgo de que forme una amalgama con las partes de aluminio expuestas en el avión. [22]
La mayor parte de la química se ha observado solo para los primeros tres miembros del grupo 12. La química del copernicio no está bien establecida y, por lo tanto, el resto de la sección trata solo del zinc, el cadmio y el mercurio.
Todos los elementos de este grupo son metales . La similitud de los radios metálicos del cadmio y el mercurio es un efecto de la contracción de los lantánidos . Por lo tanto, la tendencia en este grupo es diferente a la tendencia en el grupo 2, los alcalinotérreos , donde el radio metálico aumenta suavemente de arriba a abajo del grupo. Los tres metales tienen puntos de fusión y ebullición relativamente bajos, lo que indica que el enlace metálico es relativamente débil, con relativamente poca superposición entre la banda de valencia y la banda de conducción . [23] Por lo tanto, el zinc está cerca del límite entre los elementos metálicos y metaloides , que generalmente se coloca entre el galio y el germanio , aunque el galio participa en semiconductores como el arseniuro de galio .
El zinc y el cadmio son electropositivos , mientras que el mercurio no lo es. [23] Como resultado, el zinc y el cadmio metálicos son buenos agentes reductores. Los elementos del grupo 12 tienen un estado de oxidación de +2 en el que los iones tienen la configuración electrónica d 10 bastante estable , con una subcapa completa . Sin embargo, el mercurio se puede reducir fácilmente al estado de oxidación +1; por lo general, como en el ion Hg2+
2, dos iones de mercurio(I) se unen para formar un enlace metal-metal y una especie diamagnética . [24] El cadmio también puede formar especies como [Cd 2 Cl 6 ] 4− en la que el estado de oxidación del metal es +1. Al igual que con el mercurio, la formación de un enlace metal-metal da como resultado un compuesto diamagnético en el que no hay electrones desapareados; por lo tanto, hace que la especie sea muy reactiva. El zinc(I) se conoce principalmente en la fase gaseosa, en compuestos como el Zn 2 Cl 2 lineal , análogo al calomelanos . En la fase sólida, se conoce el compuesto bastante exótico decametildizincoceno (Cp*Zn–ZnCp*).
Los elementos del grupo 12 suelen considerarse elementos del bloque d , pero no elementos de transición , ya que la capa d está llena. Algunos autores clasifican estos elementos como elementos del grupo principal porque los electrones de valencia están en orbitales ns 2. Sin embargo, comparten muchas características con los elementos vecinos del grupo 11 en la tabla periódica, que se consideran casi universalmente elementos de transición. Por ejemplo, el zinc comparte muchas características con el metal de transición vecino, el cobre. Los complejos de zinc merecen su inclusión en la serie de Irving-Williams , ya que el zinc forma muchos complejos con la misma estequiometría que los complejos de cobre (II), aunque con constantes de estabilidad más pequeñas . [25] Hay poca similitud entre el cadmio y la plata, ya que los compuestos de plata (II) son raros y los que existen son agentes oxidantes muy fuertes. Asimismo, el estado de oxidación común del oro es +3, lo que impide que haya mucha química común entre el mercurio y el oro, aunque existen similitudes entre el mercurio(I) y el oro(I), como la formación de complejos diciano lineales, [M(CN) 2 ] − . Según la definición de la IUPAC de metal de transición como un elemento cuyo átomo tiene una subcapa d incompleta, o que puede dar lugar a cationes con una subcapa d incompleta , [26] el zinc y el cadmio no son metales de transición, mientras que el mercurio sí lo es. Esto se debe a que solo se sabe que el mercurio tiene un compuesto donde su estado de oxidación es mayor que +2, en el fluoruro de mercurio(IV) (aunque su existencia es discutida, ya que experimentos posteriores que intentaron confirmar su síntesis no pudieron encontrar evidencia de HgF 4 ). [27] [28] Sin embargo, esta clasificación se basa en un compuesto altamente atípico observado en condiciones de no equilibrio y está en desacuerdo con la química más típica del mercurio, y Jensen ha sugerido que sería mejor considerar al mercurio como un metal que no es de transición. [29]
Aunque el grupo 12 se encuentra en el bloque d de la tabla periódica moderna de 18 columnas, los electrones d del cinc, el cadmio y (casi siempre) el mercurio se comportan como electrones centrales y no participan en la formación de enlaces. Este comportamiento es similar al de los elementos del grupo principal , pero contrasta marcadamente con el de los elementos vecinos del grupo 11 ( cobre , plata y oro ), que también tienen subcapas d llenas en su configuración electrónica del estado fundamental , pero se comportan químicamente como metales de transición. Por ejemplo, el enlace en el sulfuro de cromo (II) (CrS) involucra principalmente a los electrones 3d; el del sulfuro de hierro (II) (FeS) involucra tanto a los electrones 3d como a los 4s; pero el del sulfuro de cinc (ZnS) involucra solo a los electrones 4s y los electrones 3d se comportan como electrones centrales. De hecho, se puede hacer una comparación útil entre sus propiedades y los dos primeros miembros del grupo 2 , el berilio y el magnesio , y en diseños anteriores de la tabla periódica de forma corta, esta relación se ilustra más claramente. Por ejemplo, el zinc y el cadmio son similares al berilio y al magnesio en sus radios atómicos , radios iónicos , electronegatividades y también en la estructura de sus compuestos binarios y su capacidad para formar iones complejos con muchos ligandos de nitrógeno y oxígeno , como hidruros complejos y aminas . Sin embargo, el berilio y el magnesio son átomos pequeños, a diferencia de los metales alcalinotérreos más pesados y como los elementos del grupo 12 (que tienen una mayor carga nuclear pero el mismo número de electrones de valencia ), y las tendencias periódicas hacia abajo del grupo 2 desde el berilio hasta el radio (similar a la de los metales alcalinos ) no son tan suaves cuando se desciende del berilio al mercurio (que es más similar a la de los grupos principales del bloque p) debido a las contracciones del bloque d y de los lantánidos . También son las contracciones del bloque d y de los lantánidos las que le dan al mercurio muchas de sus propiedades distintivas. [29]
Los tres iones metálicos forman muchas especies tetraédricas , como MCl2−
4Tanto el zinc como el cadmio también pueden formar complejos octaédricos como los iones de agua [M(H 2 O) 6 ] 2+ que están presentes en soluciones acuosas de sales de estos metales. [35] El carácter covalente se logra utilizando los orbitales s y p. El mercurio, sin embargo, rara vez excede un número de coordinación de cuatro. También se conocen números de coordinación de 2, 3, 5, 7 y 8.
Los elementos del grupo 12 se han encontrado a lo largo de la historia, siendo utilizados desde la antigüedad hasta su descubrimiento en laboratorios. El grupo en sí no ha adquirido un nombre trivial , pero en el pasado se le ha llamado grupo IIB .
Se ha descubierto que el zinc se utiliza en formas impuras en la antigüedad, así como en aleaciones como el latón, que se ha descubierto que tienen más de 2000 años de antigüedad. [36] [37] El zinc fue reconocido claramente como un metal bajo la designación de Fasada en el Léxico médico atribuido al rey hindú Madanapala (de la dinastía Taka) y escrito alrededor del año 1374. [38] El metal también era útil para los alquimistas . [39] El nombre del metal se documentó por primera vez en el siglo XVI, [40] [41] y probablemente se deriva del alemán zinke para la apariencia de aguja de los cristales metálicos. [42]

El aislamiento del cinc metálico en Occidente puede haber sido logrado independientemente por varias personas en el siglo XVII. [43] Al químico alemán Andreas Marggraf se le suele dar crédito por descubrir el cinc metálico puro en un experimento de 1746 calentando una mezcla de calamina y carbón en un recipiente cerrado sin cobre para obtener un metal. [44] Los experimentos en ranas realizados por el médico italiano Luigi Galvani en 1780 con latón allanó el camino para el descubrimiento de las baterías eléctricas , la galvanización y la protección catódica . [45] [46] En 1799, el amigo de Galvani, Alessandro Volta , inventó la pila voltaica . [45] La importancia biológica del cinc no se descubrió hasta 1940 cuando se demostró que la anhidrasa carbónica , una enzima que depura el dióxido de carbono de la sangre, tenía cinc en su sitio activo . [47]
En 1817, Friedrich Stromeyer y Karl Samuel Leberecht Hermann descubrieron cadmio en Alemania como una impureza en minerales de carbonato de cinc (calamina) . [48] Recibió su nombre del latín cadmia para " calamina ", una mezcla de minerales que contenía cadmio, que a su vez recibió su nombre del personaje mitológico griego Κάδμος Cadmus , el fundador de Tebas . [49] Stromeyer finalmente aisló el metal cadmio tostando y reduciendo el sulfuro . [50] [51] [52]
En 1927, la Conferencia Internacional de Pesas y Medidas redefinió el metro en términos de una línea espectral roja de cadmio (1 m = 1.553.164,13 longitudes de onda). [53] Esta definición ha sido modificada desde entonces (véase kriptón ). Al mismo tiempo, el Prototipo Internacional de Metro se utilizó como estándar para la longitud de un metro hasta 1960, [54] cuando en la Conferencia General de Pesas y Medidas el metro se definió en términos de la línea de emisión naranja-roja en el espectro electromagnético del átomo de kriptón -86 en el vacío . [55]
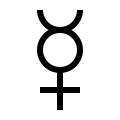
Se ha encontrado mercurio en tumbas egipcias que datan del año 1500 a. C. [56] , donde se utilizaba en cosmética. También lo utilizaban los antiguos chinos, que creían que mejoraría y prolongaría la salud. [57] Hacia el año 500 a. C., el mercurio se utilizaba para hacer amalgamas (del latín medieval amalgama, "aleación de mercurio") con otros metales. [58] Los alquimistas pensaban que el mercurio era la materia prima a partir de la cual se formaban todos los metales. Creían que se podían producir distintos metales variando la calidad y la cantidad de azufre que contenía el mercurio. El más puro de ellos era el oro, y el mercurio se utilizaba en los intentos de transmutar metales básicos (o impuros) en oro, que era el objetivo de muchos alquimistas. [59]
Hg es el símbolo químico moderno del mercurio. Proviene de hydrargyrum , una forma latinizada de la palabra griega Ύδραργυρος ( hydrargyros ), que es una palabra compuesta que significa "agua-plata" (hydr- = agua, argyros = plata) —ya que es líquido como el agua y brillante como la plata. El elemento recibió su nombre del dios romano Mercurio , conocido por su velocidad y movilidad. Está asociado con el planeta Mercurio ; el símbolo astrológico del planeta es también uno de los símbolos alquímicos del metal. [60] El mercurio es el único metal para el que el nombre planetario alquímico se convirtió en el nombre común. [59]
El elemento más pesado conocido del grupo 12, el copernicio, fue creado por primera vez el 9 de febrero de 1996 en la Gesellschaft für Schwerionenforschung (GSI) en Darmstadt , Alemania, por Sigurd Hofmann, Victor Ninov et al. [61] Luego fue nombrado oficialmente por la Unión Internacional de Química Pura y Aplicada (IUPAC) en honor a Nicolás Copérnico el 19 de febrero de 2010, el 537 aniversario del nacimiento de Copérnico. [62]
Al igual que en la mayoría de los otros grupos del bloque d , la abundancia en la corteza terrestre de los elementos del grupo 12 disminuye con un número atómico más alto. El zinc es el más abundante en el grupo con 65 partes por millón (ppm), mientras que el cadmio con 0,1 ppm y el mercurio con 0,08 ppm son órdenes de magnitud menos abundantes. [63] El copernicio, como elemento sintético con una vida media de unos pocos minutos, puede estar presente únicamente en los laboratorios donde se produjo.

Los metales del grupo 12 son calcófilos , lo que significa que los elementos tienen bajas afinidades por los óxidos y prefieren unirse con sulfuros . Los calcófilos se formaron cuando la corteza se solidificó bajo las condiciones reductoras de la atmósfera de la Tierra primitiva. [64] Los minerales comercialmente más importantes de los elementos del grupo 12 son los minerales de sulfuro. [23] La esfalrita , que es una forma de sulfuro de zinc, es el mineral que contiene zinc más extraído porque su concentrado contiene entre un 60 y un 62 % de zinc. [14] No se conocen depósitos significativos de minerales que contengan cadmio. La greenockita (CdS), el único mineral de cadmio de importancia, casi siempre está asociada con la esfalrita (ZnS). Esta asociación es causada por la similitud geoquímica entre el zinc y el cadmio, lo que hace que la separación geológica sea poco probable. Como consecuencia, el cadmio se produce principalmente como un subproducto de la minería, fundición y refinación de minerales sulfídicos de zinc y, en menor grado, plomo y cobre . [65] [66] Un lugar donde se puede encontrar cadmio metálico es la cuenca del río Vilyuy en Siberia . [67] Aunque el mercurio es un elemento extremadamente raro en la corteza terrestre , [68] debido a que no se mezcla geoquímicamente con aquellos elementos que constituyen la mayoría de la masa de la corteza, los minerales de mercurio pueden estar altamente concentrados considerando la abundancia del elemento en la roca ordinaria. Los minerales de mercurio más ricos contienen hasta un 2,5% de mercurio en masa, e incluso los depósitos concentrados más pobres tienen al menos un 0,1% de mercurio (12.000 veces la abundancia media de la corteza). Se encuentra como metal nativo (raro) o en cinabrio (HgS), corderoita , livingstonita y otros minerales , siendo el cinabrio el mineral más común. [69]
Aunque los minerales de mercurio y zinc se encuentran en cantidades suficientemente grandes como para ser extraídos, el cadmio es demasiado similar al zinc y, por lo tanto, siempre está presente en pequeñas cantidades en los minerales de zinc de donde se recupera. Los recursos mundiales identificados de zinc suman alrededor de 1.900 millones de toneladas . [70] Los grandes depósitos se encuentran en Australia, Canadá y los Estados Unidos, con las mayores reservas en Irán . [64] [71] [72] Al ritmo actual de consumo, se estima que estas reservas se agotarán en algún momento entre 2027 y 2055. [73] [74] Se han extraído alrededor de 346 millones de toneladas a lo largo de la historia hasta 2002, y una estimación encontró que alrededor de 109 millones de toneladas de eso siguen en uso. [75] En 2005, China fue el principal productor de mercurio con casi dos tercios de la participación mundial, seguido de Kirguistán . [76] Se cree que varios otros países tienen una producción no registrada de mercurio a partir de procesos de electroobtención de cobre y por recuperación de efluentes. Debido a la alta toxicidad del mercurio, tanto la extracción de cinabrio como su refinación son causas históricas y peligrosas de envenenamiento por mercurio. [77]
El zinc es el cuarto metal más común en uso, solo detrás del hierro , el aluminio y el cobre , con una producción anual de aproximadamente 10 millones de toneladas. [78] En todo el mundo, el 95% del zinc se extrae de depósitos de mineral sulfídico , en los que la esfalrita (ZnS) casi siempre se mezcla con los sulfuros de cobre, plomo y hierro. El metal zinc se produce mediante metalurgia extractiva . [79] La tostación convierte el concentrado de sulfuro de zinc producido durante el procesamiento en óxido de zinc. [80] Para un procesamiento posterior se utilizan dos métodos básicos: pirometalurgia o electroobtención . El procesamiento de pirometalurgia reduce el óxido de zinc con carbono o monóxido de carbono a 950 °C (1740 °F) en el metal, que se destila como vapor de zinc. [81] El vapor de zinc se recoge en un condensador. [80] El procesamiento de electroobtención lixivia el zinc del concentrado de mineral mediante ácido sulfúrico . [82] Después de este paso, se utiliza la electrólisis para producir metal zinc. [80]
El cadmio es una impureza común en los minerales de zinc y se aísla principalmente durante la producción de zinc. Algunos concentrados de minerales de zinc a partir de minerales de zinc sulfídicos contienen hasta un 1,4 % de cadmio. [83] El cadmio se aísla del zinc producido a partir del polvo de combustión mediante destilación al vacío si el zinc se funde o se precipita el sulfato de cadmio de la solución de electrólisis. [84]
Los minerales de mercurio más ricos contienen hasta un 2,5% de mercurio en masa, e incluso los depósitos concentrados más pobres tienen al menos un 0,1% de mercurio, siendo el cinabrio (HgS) el mineral más común en los depósitos. [85] El mercurio se extrae calentando el cinabrio en una corriente de aire y condensando el vapor. [86]
Los elementos superpesados como el copernicio se producen bombardeando elementos más ligeros en aceleradores de partículas que inducen reacciones de fusión . Mientras que la mayoría de los isótopos del copernicio se pueden sintetizar directamente de esta manera, algunos de los más pesados sólo se han observado como productos de desintegración de elementos con números atómicos más altos . [87] La primera reacción de fusión para producir copernicio fue realizada por GSI en 1996, que informó de la detección de dos cadenas de desintegración del copernicio-277 (aunque una fue posteriormente retractada, ya que se había basado en datos fabricados por Victor Ninov ): [61]
Debido a las similitudes físicas que comparten, los elementos del grupo 12 se pueden encontrar en muchas situaciones comunes. El zinc y el cadmio se utilizan comúnmente como agentes anticorrosión (galvanización) [2] ya que atraerán toda la oxidación local hasta que se corroan por completo. [88] Estos recubrimientos protectores se pueden aplicar a otros metales mediante galvanización por inmersión en caliente de una sustancia en la forma fundida del metal, [89] o mediante el proceso de galvanoplastia que puede pasivarse mediante el uso de sales de cromato . [90] Los elementos del grupo 12 también se utilizan en electroquímica , ya que pueden actuar como una alternativa al electrodo de hidrógeno estándar , además de ser un electrodo de referencia secundario. [91]
En los EE. UU., el zinc se utiliza predominantemente para galvanizar (55 %) y para latón , bronce y otras aleaciones (37 %). [92] La reactividad relativa del zinc y su capacidad para atraer la oxidación hacia sí mismo lo convierten en un ánodo de sacrificio eficiente en la protección catódica (CP). Por ejemplo, la protección catódica de una tubería enterrada se puede lograr conectando ánodos hechos de zinc a la tubería. [93] El zinc actúa como ánodo (terminal negativo) al corroerse lentamente a medida que pasa corriente eléctrica a la tubería de acero. [93] [nota 6] El zinc se utiliza para proteger catódicamente los metales que están expuestos al agua de mar contra la corrosión. [94] [95] El zinc se utiliza como material de ánodo para baterías, como las de zinc-carbono [96] [97] o las baterías/pilas de combustible de zinc-aire . [98] [99] [100] Una aleación ampliamente utilizada que contiene zinc es el latón, en el que el cobre se alea con entre un 3% y un 45% de zinc, dependiendo del tipo de latón. [93] El latón es generalmente más dúctil y más fuerte que el cobre y tiene una resistencia superior a la corrosión . [93] Estas propiedades lo hacen útil en equipos de comunicación, hardware, instrumentos musicales y válvulas de agua. [93] Otras aleaciones ampliamente utilizadas que contienen zinc incluyen alpaca , metal de máquina de escribir, soldadura blanda y de aluminio y bronce comercial . [9] Las aleaciones de principalmente zinc con pequeñas cantidades de cobre, aluminio y magnesio son útiles en la fundición a presión , así como en la fundición centrifugada , especialmente en las industrias automotriz, eléctrica y de hardware. [9] Estas aleaciones se comercializan con el nombre de Zamak . [101] Aproximadamente una cuarta parte de toda la producción de zinc en los Estados Unidos (2009) se consume en forma de compuestos de zinc, una variedad de los cuales se utilizan industrialmente. [92]
El cadmio tiene muchos usos industriales comunes, ya que es un componente clave en la producción de baterías, está presente en pigmentos de cadmio , [102] recubrimientos, [90] y se usa comúnmente en galvanoplastia. [20] En 2009, el 86% del cadmio se utilizó en baterías , predominantemente en baterías recargables de níquel-cadmio . La Unión Europea prohibió el uso de cadmio en electrónica en 2004 con varias excepciones, pero redujo el contenido permitido de cadmio en electrónica al 0,002%. [103] La galvanoplastia de cadmio , que consume el 6% de la producción mundial, se puede encontrar en la industria aeronáutica debido a la capacidad de resistir la corrosión cuando se aplica a componentes de acero. [20]
El mercurio se utiliza principalmente para la fabricación de productos químicos industriales o para aplicaciones eléctricas y electrónicas. Se utiliza en algunos termómetros, especialmente los que se utilizan para medir altas temperaturas. Una cantidad cada vez mayor se utiliza como mercurio gaseoso en lámparas fluorescentes , [104] mientras que la mayoría de las otras aplicaciones se eliminan lentamente debido a las regulaciones de salud y seguridad, [105] y en algunas aplicaciones se reemplaza con una aleación Galinstan menos tóxica pero considerablemente más cara . [106] El mercurio y sus compuestos se han utilizado en medicina, aunque hoy son mucho menos comunes de lo que eran antes, ahora que los efectos tóxicos del mercurio y sus compuestos se entienden más ampliamente. [107] Todavía se utiliza como ingrediente en amalgamas dentales . A fines del siglo XX, el mayor uso de mercurio [108] [109] fue en el proceso de celda de mercurio (también llamado proceso Castner-Kellner ) en la producción de cloro y sosa cáustica . [110]
El copernicio no tiene ningún uso más allá de la investigación debido a su altísima radiactividad.
Los elementos del grupo 12 tienen múltiples efectos sobre los organismos biológicos, ya que el cadmio y el mercurio son tóxicos, mientras que la mayoría de las plantas y animales necesitan zinc en cantidades mínimas.
El zinc es un oligoelemento esencial , necesario para las plantas, [111] los animales, [112] y los microorganismos . [113] Es "típicamente el segundo metal de transición más abundante en los organismos" después del hierro y es el único metal que aparece en todas las clases de enzimas . [111] Hay de 2 a 4 gramos de zinc [114] distribuidos por todo el cuerpo humano, [115] y desempeña "roles biológicos ubicuos". [116] Un estudio de 2006 estimó que alrededor del 10% de las proteínas humanas (2800) se unen potencialmente al zinc, además de cientos que transportan y trafican el zinc. [111] En los EE. UU., la ingesta dietética recomendada (IDR) es de 8 mg/día para mujeres y 11 mg/día para hombres. [117] La suplementación excesiva dañina puede ser un problema y probablemente no debería exceder los 20 mg/día en personas sanas, [118] aunque el Consejo Nacional de Investigación de EE. UU. estableció una ingesta máxima tolerable de 40 mg/día. [119]
El mercurio y el cadmio son tóxicos y pueden causar daños ambientales si entran en los ríos o en el agua de lluvia. Esto puede provocar la contaminación de los cultivos [120], así como la bioacumulación de mercurio en la cadena alimentaria, lo que conduce a un aumento de las enfermedades causadas por el envenenamiento por mercurio y cadmio [121] .
{{cite book}}: |journal=ignorado ( ayuda ){{cite book}}: |work=ignorado ( ayuda )