En química , las tendencias periódicas son patrones específicos que están presentes en la tabla periódica y que ilustran diferentes aspectos de ciertos elementos cuando se agrupan por período y/o grupo . Fueron descubiertos por el químico ruso Dmitri Mendeleev en 1863. Las principales tendencias periódicas incluyen el radio atómico , la energía de ionización , la afinidad electrónica , la electronegatividad , la valencia y el carácter metálico . Estas tendencias existen debido a las configuraciones electrónicas similares de los elementos dentro de sus respectivos grupos o períodos; reflejan la naturaleza periódica de los elementos. Estas tendencias dan una evaluación cualitativa de las propiedades de cada elemento. [1] [2]
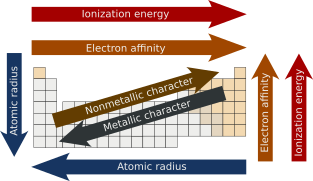
El radio atómico es la distancia desde el núcleo atómico hasta el orbital electrónico más externo de un átomo . En general, el radio atómico disminuye a medida que avanzamos de izquierda a derecha en un período , y aumenta cuando bajamos de grupo . Esto se debe a que en los períodos, los electrones de valencia se encuentran en la misma capa más externa . El número atómico aumenta en el mismo período mientras se mueve de izquierda a derecha, lo que a su vez aumenta la carga nuclear efectiva . El aumento de las fuerzas de atracción reduce el radio atómico de los elementos . Cuando bajamos en el grupo, el radio atómico aumenta debido a la adición de una nueva capa. [3] [4]
La energía de ionización es la cantidad mínima de energía que un electrón en un átomo o ion gaseoso debe absorber para salir de la influencia de la fuerza de atracción del núcleo . También se le conoce como potencial de ionización. La primera energía de ionización es la cantidad de energía que se requiere para eliminar el primer electrón de un átomo neutro . La energía necesaria para extraer el segundo electrón del átomo neutro se llama segunda energía de ionización y así sucesivamente. [5]
En términos de tendencia, a medida que uno se mueve de izquierda a derecha a lo largo de un período en la tabla periódica moderna , la energía de ionización aumenta a medida que aumenta la carga nuclear y disminuye el tamaño atómico . La disminución del tamaño atómico da como resultado una fuerza de atracción más potente entre los electrones y el núcleo. Sin embargo, supongamos que uno baja en un grupo . En ese caso, la energía de ionización disminuye a medida que aumenta el tamaño atómico debido a la adición de una capa de valencia , disminuyendo así la atracción del núcleo hacia los electrones. [6] [7]
La energía liberada cuando se agrega un electrón a un átomo gaseoso neutro para formar un anión se conoce como afinidad electrónica. [8] En cuanto a la tendencia, a medida que se avanza de izquierda a derecha a lo largo de un período , la afinidad electrónica aumentará a medida que aumenta la carga nuclear y el tamaño atómico disminuye, lo que resulta en una fuerza de atracción más potente del núcleo y el electrón agregado. Sin embargo, supongamos que uno baja en un grupo . En ese caso, la afinidad electrónica disminuirá a medida que aumente el tamaño atómico debido a la adición de una capa de valencia , disminuyendo así la atracción del núcleo hacia los electrones. Aunque pueda parecer que el flúor debería tener la mayor afinidad electrónica, su pequeño tamaño genera suficiente repulsión entre los electrones, dando como resultado que el cloro tenga la mayor afinidad electrónica de la familia de los halógenos . [9]
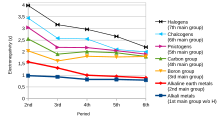
La tendencia de un átomo en una molécula a atraer el par de electrones compartido hacia sí mismo se conoce como electronegatividad. Es una propiedad adimensional porque es sólo una tendencia. [10] La escala más utilizada para medir la electronegatividad fue diseñada por Linus Pauling . La escala ha sido nombrada escala de Pauling en su honor. Según esta escala, el flúor es el elemento más electronegativo, mientras que el cesio es el elemento menos electronegativo . [11]
En términos de tendencia, a medida que uno se mueve de izquierda a derecha a lo largo de un período en la tabla periódica moderna , la electronegatividad aumenta a medida que aumenta la carga nuclear y disminuye el tamaño atómico . Sin embargo, si uno baja en un grupo , la electronegatividad disminuye a medida que aumenta el tamaño atómico debido a la adición de una capa de valencia , disminuyendo así la atracción del átomo hacia los electrones. [12]
Sin embargo, en el grupo XIII ( Familia del Boro ), la electronegatividad primero disminuye del boro al aluminio y luego aumenta a lo largo del grupo. Se debe al hecho de que el tamaño atómico aumenta a medida que bajamos en el grupo, pero al mismo tiempo la carga nuclear efectiva aumenta debido al mal blindaje de los electrones d y f internos. Como resultado, la fuerza de atracción del núcleo para los electrones aumenta y, por tanto, aumenta la electronegatividad del aluminio al talio . [13] [14]
La valencia de un elemento es el número de electrones que debe perder o ganar un átomo para obtener una configuración electrónica estable . En términos simples, es la medida de la capacidad combinatoria de un elemento para formar compuestos químicos . Los electrones que se encuentran en la capa más externa se conocen generalmente como electrones de valencia ; el número de electrones de valencia determina la valencia de un átomo. [15] [16]
En cuanto a la tendencia, mientras se mueve de izquierda a derecha a lo largo de un período , el número de electrones de valencia de los elementos aumenta y varía entre uno y ocho. Pero la valencia de los elementos primero aumenta de 1 a 4, y luego disminuye a 0 a medida que llegamos a los gases nobles . Sin embargo, a medida que descendemos en un grupo , el número de electrones de valencia generalmente no cambia. De ahí que en muchos casos los elementos de un determinado grupo tengan la misma valencia . Sin embargo, esta tendencia periódica no siempre se sigue para los elementos más pesados, especialmente para el bloque f y los metales de transición . Estos elementos muestran valencia variable ya que tienen un orbital d como penúltimo orbital y un orbital s como orbital más externo. Las energías de estos orbitales (n-1)d y ns (por ejemplo, 4d y 5s) son relativamente cercanas. [17] [18]
Las propiedades metálicas generalmente aumentan en los grupos , ya que la disminución de la atracción entre los núcleos y los electrones más externos hace que estos electrones estén más débilmente unidos y, por lo tanto, sean capaces de conducir calor y electricidad . A lo largo de cada período , de izquierda a derecha, la creciente atracción entre los núcleos y los electrones más externos hace que el carácter metálico disminuya . Por el contrario, el carácter no metálico disminuye a lo largo de los grupos y aumenta a lo largo de los períodos. [19] [20]