El glaucoma es un grupo de enfermedades oculares que pueden provocar daños en el nervio óptico . El nervio óptico transmite información visual del ojo al cerebro. El glaucoma puede causar pérdida de la visión si no se trata. Se le ha llamado el "ladrón silencioso de la vista" porque la pérdida de la visión suele producirse lentamente durante un largo período de tiempo. [5] Un factor de riesgo importante para el glaucoma es el aumento de la presión dentro del ojo, conocida como presión intraocular (PIO) . [1] Se asocia con la vejez, antecedentes familiares de glaucoma y ciertas afecciones médicas o el uso de algunos medicamentos. [6] La palabra glaucoma proviene de la palabra griega antigua γλαυκός ( glaukós ), que significa 'brillante, azul verdoso, gris'.
Existen diferentes tipos de glaucoma, pero los más comunes se denominan glaucoma de ángulo abierto y glaucoma de ángulo cerrado . [7] Dentro del ojo, un líquido llamado humor acuoso ayuda a mantener la forma y proporciona nutrientes. El humor acuoso normalmente drena a través de la malla trabecular . En el glaucoma de ángulo abierto, el drenaje se ve impedido, lo que hace que el líquido se acumule y aumente la presión dentro del ojo. Esta presión elevada puede dañar el nervio óptico. En el glaucoma de ángulo cerrado, el drenaje del ojo se bloquea de repente, lo que lleva a un aumento rápido de la presión intraocular. Esto puede provocar dolor ocular intenso , visión borrosa y náuseas . El glaucoma de ángulo cerrado es una emergencia que requiere atención inmediata. [1]
Si se trata a tiempo, es posible retrasar o detener la progresión del glaucoma. Los exámenes oculares regulares, especialmente si la persona tiene más de 40 años o tiene antecedentes familiares de glaucoma, son esenciales para la detección temprana. [8] El tratamiento generalmente incluye la prescripción de gotas para los ojos, medicamentos , tratamiento con láser o cirugía. [1] [9] El objetivo de estos tratamientos es disminuir la presión ocular. [2]
El glaucoma es una de las principales causas de ceguera en afroamericanos , hispanoamericanos [10] [11] y asiáticos. [12] Se presenta con mayor frecuencia entre personas mayores, [ 1] y el glaucoma de ángulo cerrado es más común en mujeres. [2]

En 2013, la prevalencia mundial de glaucoma en la población de 40 a 80 años se estimó en 3,54%, lo que afecta a 64,3 millones de personas en todo el mundo. [14] Ese mismo año, había 2,97 millones de personas en América del Norte con glaucoma de ángulo abierto. Para 2040, se proyectaba que la prevalencia de todos los tipos de glaucoma aumentaría a 111,82 millones en todo el mundo y a 4,72 millones en América del Norte. [14]
A nivel mundial, el glaucoma es la segunda causa principal de ceguera , [2] mientras que las cataratas son una causa más común. En los Estados Unidos, el glaucoma es una de las principales causas de ceguera en los afroamericanos, que tienen tasas más altas de glaucoma primario de ángulo abierto, [15] [16] y en los hispanoamericanos . [10] [11] La pérdida de visión bilateral puede afectar negativamente la movilidad e interferir con la conducción. [17]
Un metaanálisis publicado en 2009 encontró que las personas con glaucoma primario de ángulo abierto no tienen mayores tasas de mortalidad ni mayor riesgo de muerte cardiovascular. [18]
Según un metanálisis publicado en 2024 en JAMA Ophthalmology , en 2022 aproximadamente 4,22 millones de personas en los EE. UU. tenían glaucoma y 1,49 millones sufrían problemas de visión debido a esta afección. [19] El estudio descubrió que los adultos negros tenían aproximadamente el doble de probabilidades de verse afectados por glaucoma que los adultos blancos. La prevalencia del glaucoma fue del 1,62 % entre las personas de 18 años o más y del 2,56 % entre las de 40 años o más, mientras que el glaucoma que afecta la visión se produjo en el 0,57 % y el 0,91 % de estos grupos de edad, respectivamente. [20]

El glaucoma de ángulo abierto generalmente no presenta síntomas al principio de la enfermedad. [21] Sin embargo, puede progresar gradualmente y causar dificultades en la visión. [21] Generalmente implica déficits en la visión periférica seguidos de pérdida de la visión central a medida que progresa la enfermedad, pero con menos frecuencia puede presentarse como pérdida de la visión central o áreas irregulares de pérdida de la visión. [21] En un examen ocular, se observan cambios en el nervio óptico que indican daño en la cabeza del nervio óptico (aumento de la relación copa-disco en el examen fundoscópico ). [21]
El glaucoma agudo de ángulo cerrado, una emergencia médica debido al riesgo de pérdida inminente de la visión permanente, se caracteriza por dolor ocular repentino, ver halos alrededor de las luces, ojos rojos , presión intraocular muy alta , náuseas y vómitos y disminución repentina de la visión. [21] El glaucoma agudo de ángulo cerrado puede presentarse además con edema corneal, vasos conjuntivales congestionados y una pupila fija y dilatada en el examen. [22]
En el glaucoma pueden aparecer manchas opacas en el cristalino, conocidas como glaukomflecken. [23] La palabra es alemana y significa "manchas de glaucoma".
El glaucoma puede afectar a cualquier persona. Algunas personas tienen un mayor riesgo o susceptibilidad a desarrollar glaucoma debido a ciertos factores de riesgo . Los factores de riesgo del glaucoma incluyen la edad avanzada, la presión intraocular alta, los antecedentes familiares de glaucoma y el uso de medicamentos esteroides. [1]
La hipertensión ocular (aumento de la presión dentro del ojo) es un factor de riesgo importante para el glaucoma, pero solo alrededor del 10 al 70 % de las personas (según el grupo étnico) con glaucoma primario de ángulo abierto en realidad tienen una presión ocular elevada. [24] La hipertensión ocular (una presión intraocular por encima del umbral tradicional de 21 mmHg (28 hPa) o incluso por encima de 24 mmHg (32 hPa)) no es necesariamente una condición patológica, pero aumenta el riesgo de desarrollar glaucoma.
Un estudio con 1636 personas de entre 40 y 80 años que tenían una presión intraocular superior a 24 mmHg en al menos un ojo, pero sin indicios de daños oculares, mostró que después de cinco años, el 9,5 % de los participantes no tratados y el 4,4 % de los participantes tratados habían desarrollado síntomas glaucomatosos, lo que significa que solo una de cada diez personas no tratadas con presión intraocular elevada desarrollará síntomas glaucomatosos durante ese período de tiempo. Por lo tanto, es un tema de debate si todas las personas con una presión intraocular elevada deben recibir terapia para el glaucoma. A partir de 2018, la mayoría de los oftalmólogos favorecieron el tratamiento de aquellos con factores de riesgo adicionales. [25]
Para las presiones oculares, a menudo se utiliza un valor de 28 hPa (21 mmHg) por encima de la presión atmosférica 1.010 hPa (760 mmHg), y las presiones más altas conducen a un mayor riesgo. [2] [26] Sin embargo, algunos pueden tener una presión ocular alta durante años y nunca desarrollar daño. [2] Por el contrario, puede producirse daño al nervio óptico con una presión normal, conocido como glaucoma de tensión normal. [27] En caso de presión intraocular superior a lo normal, se cree que el mecanismo del glaucoma de ángulo abierto es la salida impedida del humor acuoso a través de la malla trabecular, mientras que en el glaucoma de ángulo cerrado el iris bloquea la malla trabecular. [2] El diagnóstico se logra realizando un examen ocular . [1] A menudo, el nervio óptico muestra una cantidad anormal de ahuecamiento . [2]
Los antecedentes familiares positivos son un factor de riesgo para el glaucoma. El riesgo relativo de tener glaucoma primario de ángulo abierto aumenta aproximadamente entre dos y cuatro veces para las personas que tienen un hermano con glaucoma. [28] El glaucoma, en particular el glaucoma primario de ángulo abierto, está asociado con mutaciones en varios genes , incluidos MYOC , ASB10, WDR36 , NTF4 , TBK1 , [29] y RPGRIP1 . [30] Muchos de estos genes están involucrados en procesos celulares críticos que están implicados en el desarrollo y la progresión del glaucoma, incluida la regulación de la presión intraocular, la salud de las células ganglionares de la retina y la función del nervio óptico. [31] El glaucoma de tensión normal, que comprende el 30-90% del glaucoma primario de ángulo abierto (dependiendo del grupo étnico), [24] también está asociado con mutaciones genéticas (incluidos los genes OPA1 y OPTN ). [32]
Además, existen algunas enfermedades genéticas raras que aumentan el riesgo de glaucoma, como el síndrome de Axenfeld-Rieger y el glaucoma congénito primario , que se asocia con mutaciones en CYP1B1 o LTBP2 . [33] Se heredan de forma autosómica recesiva. [33] El síndrome de Axenfeld-Rieger se hereda de forma autosómica dominante y se asocia con PITX2 o FOXC1 . [34]
La prevalencia total del glaucoma es aproximadamente la misma en América del Norte y Asia. Sin embargo, la prevalencia del glaucoma de ángulo cerrado es cuatro veces mayor en Asia que en América del Norte. [14]
En los Estados Unidos, el glaucoma es más común en afroamericanos , latinos y asiático-americanos . [21]
Otros factores pueden causar glaucoma, conocido como "glaucoma secundario", incluido el uso prolongado de esteroides (glaucoma inducido por esteroides); afecciones que restringen gravemente el flujo sanguíneo al ojo, como retinopatía diabética grave y oclusión de la vena central de la retina (glaucoma neovascular); traumatismo ocular (glaucoma por recesión angular); iris en meseta ; e inflamación de la capa media de la estructura vascular pigmentada del ojo ( uveítis ), conocida como glaucoma uveítico .
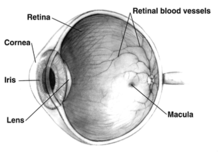
El efecto principal del glaucoma es el daño al nervio óptico. Finalmente, este daño conduce a la pérdida de visión, que puede empeorar con el tiempo. La causa subyacente del glaucoma de ángulo abierto sigue sin estar clara. Existen varias teorías sobre su etiología exacta. Solo en el grupo étnico de los blancos el principal factor de riesgo y el foco del tratamiento es el aumento de la presión intraocular. [24] La presión intraocular es una función de la producción de humor acuoso líquido por los procesos ciliares del ojo y su drenaje a través de la malla trabecular. El humor acuoso fluye desde los procesos ciliares hacia la cámara posterior , limitada posteriormente por el cristalino y las zónulas de Zinn , y anteriormente por el iris . Luego fluye a través de la pupila del iris hacia la cámara anterior , limitada posteriormente por el iris y anteriormente por la córnea .
Desde aquí, la malla trabecular drena el humor acuoso a través del seno venoso escleral ( canal de Schlemm ) hacia los plexos esclerales y la circulación sanguínea general. [36]
En el glaucoma de ángulo abierto o amplio, el flujo a través de la malla trabecular se reduce debido a la degeneración y obstrucción de esta última, cuya función original es absorber el humor acuoso. La pérdida de la absorción del humor acuoso conduce a una mayor resistencia y, por lo tanto, a una acumulación crónica e indolora de presión en el ojo. [37]
En el glaucoma primario de ángulo cerrado, el ángulo iridocorneal se estrecha o se cierra por completo, lo que obstruye el flujo de humor acuoso hacia la malla trabecular para su drenaje. Esto suele deberse al desplazamiento hacia delante del iris contra la córnea, lo que produce el cierre del ángulo. Esta acumulación de humor acuoso provoca un aumento agudo de la presión y daño al nervio óptico. [21]
La fisiopatología del glaucoma no se entiende bien. Existen varias teorías sobre el mecanismo del daño al nervio óptico en el glaucoma. La teoría biomecánica plantea la hipótesis de que los axones de las células ganglionares de la retina (que forman la cabeza del nervio óptico y la capa de fibras nerviosas de la retina) son particularmente susceptibles al daño mecánico por aumentos en la presión intraocular a medida que pasan a través de poros en la lámina cribosa . Por lo tanto, los aumentos en la presión intraocular causarían daño nervioso como se ve en el glaucoma. [21] La teoría vascular plantea la hipótesis de que una disminución del suministro de sangre a las células ganglionares de la retina conduce a un daño nervioso. Esta disminución en el suministro de sangre puede deberse al aumento de las presiones intraoculares, y también puede deberse a hipotensión sistémica, vasoespasmo o aterosclerosis. [21] Esto está respaldado por evidencia de que las personas con presión arterial baja, particularmente presión arterial diastólica baja, tienen un mayor riesgo de glaucoma. [21]
La teoría de la neurodegeneración primaria plantea la hipótesis de que un proceso neurodegenerativo primario puede ser responsable de la degeneración en la cabeza del nervio óptico en el glaucoma. [21] Esto sería coherente con un posible mecanismo del glaucoma de tensión normal (aquellos con glaucoma de ángulo abierto con presiones oculares normales) y está respaldado por evidencia que muestra una correlación del glaucoma con la demencia de Alzheimer y otras causas de deterioro cognitivo. [38] [39] Tanto los estudios experimentales como los clínicos implican que el estrés oxidativo juega un papel en la patogénesis del glaucoma de ángulo abierto [40] así como en la enfermedad de Alzheimer. [41]
La degeneración de los axones de las células ganglionares de la retina (el nervio óptico) es un sello distintivo del glaucoma. [42] La relación inconsistente de la neuropatía óptica glaucomatosa con el aumento de la presión intraocular ha provocado hipótesis y estudios sobre la estructura anatómica, el desarrollo ocular, el traumatismo por compresión nerviosa, el flujo sanguíneo del nervio óptico, el neurotransmisor excitatorio, el factor trófico, la degeneración de las células ganglionares de la retina o de los axones, las células de soporte gliales, el sistema inmunológico, los mecanismos de envejecimiento de la pérdida de neuronas y el corte de las fibras nerviosas en el borde escleral. [43] [44] [45] [46] [47] [48] [49]


La detección del glaucoma es una parte integral de un examen ocular estándar realizado por optometristas y oftalmólogos. [50] La evaluación del glaucoma implica obtener una historia clínica completa, con énfasis en la evaluación de los factores de riesgo.
Las pruebas de evaluación basal del glaucoma incluyen la medición de la presión intraocular mediante tonometría, la evaluación del ángulo de la cámara anterior mediante tomografía de coherencia óptica , la inspección del ángulo de drenaje ( gonioscopia ) y la evaluación de la capa de fibras nerviosas de la retina con un examen del fondo de ojo , la medición del espesor corneal ( paquimetría ) y la prueba del campo visual . [50]
El glaucoma se ha clasificado en tipos específicos: [51]
Glaucoma primario (H40.1-H40.2)
Variantes del glaucoma primario
El glaucoma primario de ángulo cerrado se produce por el contacto entre el iris y la malla trabecular, que a su vez obstruye la salida del humor acuoso del ojo. Este contacto entre el iris y la malla trabecular (MT) puede dañar gradualmente la función de la malla hasta que deja de seguir el ritmo de la producción de humor acuoso y la presión aumenta. En más de la mitad de los casos, el contacto prolongado entre el iris y la MT provoca la formación de sinequias (en realidad, "cicatrices").
Estos causan una obstrucción permanente del drenaje del humor acuoso. En algunos casos, la presión puede aumentar rápidamente en el ojo, lo que causa dolor y enrojecimiento (cierre angular sintomático o llamado "agudo"). En esta situación, la visión puede volverse borrosa y pueden verse halos alrededor de las luces brillantes. Los síntomas que acompañan pueden incluir dolor de cabeza y vómitos.
El diagnóstico se realiza a partir de signos y síntomas físicos: pupilas dilatadas a medias y que no responden a la luz, córnea edematosa (turbia), visión reducida, enrojecimiento y dolor. Sin embargo, la mayoría de los casos son asintomáticos. Antes de la pérdida muy grave de la visión, estos casos solo se pueden identificar mediante un examen, generalmente realizado por un profesional de la visión.
Glaucoma del desarrollo (Q15.0)
Glaucoma secundario (H40.3-H40.6)
El glaucoma neovascular , un tipo poco común de glaucoma, es difícil o casi imposible de tratar y suele estar causado por la retinopatía diabética proliferativa (PDR) o la oclusión de la vena central de la retina (CRVO). También puede ser desencadenado por otras afecciones que provocan isquemia de la retina o del cuerpo ciliar . Las personas con un flujo sanguíneo deficiente al ojo tienen un alto riesgo de padecer esta afección.
El glaucoma neovascular se produce cuando se forman nuevos vasos anormales en el ángulo del ojo que comienzan a bloquear el drenaje. Las personas que padecen esta afección comienzan a perder la visión rápidamente. A veces, la enfermedad aparece muy rápidamente, especialmente después de procedimientos de cirugía de cataratas.
El glaucoma tóxico es un glaucoma de ángulo abierto con un aumento significativo e inexplicable de la presión intraocular que sigue una patogenia desconocida. La presión intraocular a veces puede alcanzar los 80 mmHg (11 kPa). Se manifiesta característicamente como inflamación del cuerpo ciliar y edema trabecular masivo que a veces se extiende al canal de Schlemm. Esta afección se diferencia del glaucoma maligno por la presencia de una cámara anterior profunda y clara y la falta de desviación del humor acuoso. Además, el aspecto corneal no es tan turbio. Puede producirse una reducción de la agudeza visual después de una degradación neurorretiniana.
El glaucoma absoluto (H44.5) es la etapa final de todos los tipos de glaucoma. El ojo no tiene visión, no hay reflejo pupilar a la luz ni respuesta pupilar y tiene un aspecto pétreo. Hay dolor intenso en el ojo. El tratamiento del glaucoma absoluto es un procedimiento destructivo como la ciclocrioaplicación, la ciclofotocoagulación o la inyección de alcohol al 99%.

En el glaucoma, los defectos del campo visual son resultado de un daño en la capa de fibras nerviosas de la retina (CFNR). Los defectos del campo visual se observan principalmente en el glaucoma primario de ángulo abierto. Debido a la anatomía única de la CFNR, se observan muchos patrones notables en el campo visual. La mayoría de los cambios glaucomatosos tempranos se observan dentro del campo visual central, principalmente en el área de Bjerrum, a 10-20° de la fijación. [53]
Los siguientes son los defectos del campo glaucomatoso más comunes:


El Grupo de Trabajo de Servicios Preventivos de los Estados Unidos afirmó en 2013 que no había pruebas suficientes para recomendar o no la detección del glaucoma. [59] Por lo tanto, no existe un programa nacional de detección en los Estados Unidos. Sin embargo, la Academia Estadounidense de Oftalmología recomienda la detección a partir de los 40 años. [2]
En el Reino Unido existe un programa de detección del glaucoma. Se recomienda a las personas en riesgo que se hagan un examen ocular al menos una vez al año. [60]
El objetivo del tratamiento del glaucoma en pacientes con presión intraocular elevada es disminuir la presión intraocular (PIO), lo que ralentiza la progresión del glaucoma y preserva la calidad de vida de los pacientes, con efectos secundarios mínimos. [61] [62] [63] Esto requiere técnicas de diagnóstico y exámenes de seguimiento adecuados, y una selección juiciosa de los tratamientos para cada paciente. Aunque el aumento de la PIO es solo uno de los principales factores de riesgo del glaucoma, actualmente la base del tratamiento del glaucoma es reducirla mediante diversos fármacos o técnicas quirúrgicas.
El flujo vascular y las teorías neurodegenerativas de la neuropatía óptica glaucomatosa han impulsado estudios sobre diversas estrategias terapéuticas neuroprotectoras, incluidos compuestos nutricionales, algunos de los cuales pueden ser considerados por los médicos como seguros para su uso en la actualidad, mientras que otros están en fase de prueba. [64] [65] [66] El estrés mental también se considera una consecuencia y causa de la pérdida de visión, lo que significa que el entrenamiento en el manejo del estrés, el entrenamiento autógeno y otras técnicas para afrontar el estrés pueden ser útiles. [67] [68]
Existen varios grupos de medicamentos hipotensores que se pueden utilizar para reducir la presión intraocular, generalmente colirios. La elección del medicamento suele depender de la dosis, la duración y los efectos secundarios de cada medicamento. Sin embargo, en general, los análogos de prostaglandinas son el tratamiento de primera línea para el glaucoma. [63] [69]
Los análogos de prostaglandinas, como el latanoprost , el bimatoprost y el travoprost , reducen la presión intraocular al aumentar la salida del líquido acuoso a través del ángulo de drenaje. Suele prescribirse una vez al día por la noche. Los efectos secundarios sistémicos de esta clase son mínimos. Sin embargo, pueden causar efectos secundarios locales, como enrojecimiento de la conjuntiva, cambio en el color del iris y alargamiento de las pestañas. [63] [69]
Existen otras clases de medicamentos que podrían utilizarse como segunda línea en caso de fracaso del tratamiento o presencia de contraindicaciones para los análogos de prostaglandinas. [70] [69] Estos incluyen:
Cada uno de estos medicamentos puede tener efectos secundarios locales y sistémicos. Limpiar el ojo con una gasa absorbente después de la administración de las gotas para los ojos puede resultar en menos efectos adversos. [71] Inicialmente, las gotas para el glaucoma pueden comenzar a administrarse en uno o ambos ojos. [72]
También se están investigando los posibles efectos neuroprotectores de varios medicamentos tópicos y sistémicos. [73] [74] [75] [76]
La falta de cumplimiento de la medicación y de las visitas de seguimiento es una de las principales causas del fracaso del tratamiento y de la progresión de la enfermedad en los pacientes con glaucoma. La falta de cumplimiento puede conducir a un aumento de las tasas de complicaciones, aumentando así la necesidad de intervenciones no farmacológicas, incluida la cirugía. La educación y la comunicación con el paciente deben ser constantes para mantener planes de tratamiento exitosos para esta enfermedad de por vida sin síntomas tempranos. [77]
La trabeculoplastia con láser de argón (ALT) se puede utilizar para tratar el glaucoma de ángulo abierto, pero es una solución temporal, no una cura. Se apunta un punto de láser de argón de 50 μm a la malla trabecular para estimular la apertura de la malla y permitir una mayor salida del líquido acuoso. Por lo general, se trata la mitad del ángulo a la vez. La trabeculoplastia láser tradicional utiliza un láser de argón térmico en un procedimiento de trabeculoplastia con láser de argón .
La iridotomía periférica con láser Nd:YAG (LPI) se puede utilizar en pacientes susceptibles o afectados por glaucoma de ángulo cerrado o síndrome de dispersión pigmentaria . Durante la iridotomía láser, se utiliza energía láser para hacer una pequeña abertura de espesor completo en el iris para igualar la presión entre la parte frontal y posterior del iris, corrigiendo así cualquier abultamiento anormal del iris. En personas con ángulos estrechos, esto puede descubrir la malla trabecular. En algunos casos de cierre angular intermitente o de corto plazo, esto puede reducir la presión ocular. La iridotomía láser reduce el riesgo de desarrollar un ataque de cierre angular agudo. En la mayoría de los casos, también reduce el riesgo de desarrollar cierre angular crónico o adherencias del iris a la malla trabecular. Las simulaciones de dinámica de fluidos computacional (CFD) han demostrado que un tamaño óptimo de iridotomía para aliviar la diferencia de presión entre el lado anterior y posterior del iris es de alrededor de 0,1 mm a 0,2 mm. [78] Esto coincide con la práctica clínica de la LPI, donde se utiliza habitualmente un tamaño de iridotomía de 150 a 200 micrones. Sin embargo, a veces son necesarios tamaños de iridotomía mayores.

Para tratar el glaucoma se realizan tanto cirugías láser como convencionales. La cirugía es el tratamiento principal para quienes padecen glaucoma congénito . [79] Generalmente, estas operaciones son una solución temporal, ya que aún no existe una cura para el glaucoma.
La canaloplastia es un procedimiento no penetrante que utiliza tecnología de microcatéter . Para realizar una canaloplastia, se realiza una incisión en el ojo para acceder al canal de Schlemm de manera similar a una viscocanalostomía. Un microcatéter rodeará el canal alrededor del iris, agrandando el canal de drenaje principal y sus canales colectores más pequeños mediante la inyección de un material estéril similar a un gel llamado viscoelástico . Luego se retira el catéter y se coloca una sutura dentro del canal y se ajusta.
Al abrir el canal, se puede aliviar la presión dentro del ojo, aunque la razón no está clara, ya que el canal (de Schlemm) no tiene ninguna resistencia significativa a los fluidos en el glaucoma o en ojos sanos. No se dispone de resultados a largo plazo. [80] [81]
La cirugía convencional más común que se realiza para el glaucoma es la trabeculectomía . En esta, se realiza un colgajo de espesor parcial en la pared escleral del ojo y se hace una abertura debajo del colgajo para retirar una parte de la malla trabecular. Luego, el colgajo escleral se sutura de nuevo en su lugar sin apretarlo para permitir que el líquido salga del ojo a través de esta abertura, lo que da como resultado una presión intraocular reducida y la formación de una ampolla o burbuja de líquido en la superficie del ojo.
La cicatrización puede ocurrir alrededor o sobre la abertura del colgajo, haciendo que se vuelva menos eficaz o que pierda su eficacia por completo. Tradicionalmente, los adyuvantes quimioterapéuticos, como la mitomicina C (MMC) o el 5-fluorouracilo (5-FU), se aplican con esponjas empapadas en el lecho de la herida para evitar que las ampollas filtrantes cicatricen al inhibir la proliferación de fibroblastos. Las alternativas contemporáneas para prevenir la cicatrización de la abertura de la malla incluyen la implementación única o combinada de adyuvantes no quimioterapéuticos como la matriz de colágeno Ologen, que ha demostrado clínicamente que aumenta las tasas de éxito del tratamiento quirúrgico. [82] [83] [84] [85]
La matriz de colágeno previene la formación de cicatrices al aleatorizar y modular la proliferación de fibroblastos, además de prevenir mecánicamente la contracción y la adhesión de la herida.
El primer implante de drenaje para glaucoma se desarrolló en 1966. [86] Desde entonces, varios tipos de implantes han seguido al original: el tubo de derivación de Baerveldt o los implantes con válvula, como el implante de válvula de glaucoma de Ahmed o el Mini Shunt ExPress y los implantes Molteno de cresta de presión de última generación. Estos están indicados para pacientes con glaucoma que no responden a la terapia médica máxima, con cirugía filtrante protegida fallida previa (trabeculectomía). El tubo de flujo se inserta en la cámara anterior del ojo y la placa se implanta debajo de la conjuntiva para permitir un flujo de líquido acuoso fuera del ojo hacia una cámara llamada bleb .
La cicatrización continua sobre el segmento de disipación conjuntival de la derivación puede volverse demasiado gruesa para que el humor acuoso se filtre a través de ella. Esto puede requerir medidas preventivas utilizando medicamentos antifibróticos, como 5-fluorouracilo o mitomicina-C (durante el procedimiento), u otros métodos de medicación no antifibrótica, como implante de matriz de colágeno, [92] [93] o espaciador biodegradable, o más adelante crear una necesidad de cirugía de revisión con el uso único o combinado de injertos de parche de donante o implante de matriz de colágeno. [93]
El abordaje quirúrgico más común utilizado actualmente para el tratamiento del glaucoma es la trabeculectomía, en la que se punza la esclerótica para aliviar la presión intraocular.
La esclerectomía profunda no penetrante (NPDS) es un procedimiento similar, pero modificado, en el que en lugar de perforar el lecho escleral y la malla trabecular debajo de un colgajo escleral, se crea un segundo colgajo escleral profundo, se extirpa y se realizan otros procedimientos para destechar el canal de Schlemm, con lo que se logra la percolación de líquido desde el interior del ojo y, por lo tanto, se alivia la presión intraocular sin penetrar el ojo. Se ha demostrado que la NPDS tiene significativamente menos efectos secundarios que la trabeculectomía. [94] Sin embargo, la NPDS se realiza manualmente y requiere un mayor nivel de habilidades que pueden ser asistidas con instrumentos. [ cita requerida ] Para evitar la adhesión de la herida después de una escisión escleral profunda y mantener buenos resultados de filtrado, la NPDS, al igual que otros procedimientos no penetrantes, a veces se realiza con una variedad de espaciadores o dispositivos biocompatibles, como la mecha de colágeno Aquaflow, [95] la matriz de colágeno ologen, [84] [96] [97] o el implante de glaucoma Xenoplast. [98]
La NPDS asistida por láser se realiza con el uso de un sistema láser de CO2 . El sistema basado en láser se autodetiene una vez que se ha alcanzado el espesor escleral requerido y el drenaje adecuado del líquido intraocular. Este efecto de autorregulación se logra ya que el láser de CO2 básicamente deja de realizar la ablación tan pronto como entra en contacto con el líquido percolado intraocular, lo que ocurre tan pronto como el láser alcanza el espesor óptimo de la capa intacta residual.
En el caso de las personas con glaucoma crónico de ángulo cerrado, la extracción del cristalino puede aliviar el bloqueo creado por la pupila y ayudar a regular la presión intraocular. [99] Un estudio descubrió que la CLE es incluso más eficaz que la iridotomía periférica con láser en pacientes con glaucoma de ángulo cerrado. [100] Una revisión sistemática que compara la extracción del cristalino y la iridotomía periférica con láser para el tratamiento del cierre angular primario agudo descubrió que la extracción del cristalino potencialmente proporciona un mejor control de la presión intraocular y reduce las necesidades de medicación con el tiempo. Sin embargo, sigue sin estar claro si reduce significativamente el riesgo de episodios recurrentes o reduce la necesidad de operaciones adicionales . [101]
Glaucoma primario de ángulo cerrado: una vez controlados los síntomas, el tratamiento de primera línea (y a menudo definitivo) es la iridotomía láser . Puede realizarse con láseres Nd:YAG o argón o, en algunos casos, con cirugía incisional convencional. El objetivo del tratamiento es revertir y prevenir el contacto entre el iris y la malla trabecular. En casos tempranos o moderadamente avanzados, la iridotomía logra abrir el ángulo en alrededor del 75 % de los casos. En el 25 % restante, puede ser necesaria la iridoplastia láser, la medicación (pilocarpina) o la cirugía incisional.
Glaucoma primario de ángulo abierto: los agonistas de prostaglandinas actúan abriendo los conductos uveoesclerales. Los betabloqueantes, como el timolol, actúan disminuyendo la formación acuosa. Los inhibidores de la anhidrasa carbónica disminuyen la formación de bicarbonato a partir de los procesos ciliares del ojo, disminuyendo así la formación de humor acuoso. Los análogos parasimpáticos son fármacos que actúan sobre el flujo de salida trabecular abriendo el conducto y contrayendo la pupila. Los agonistas alfa 2 ( brimonidina , apraclonidina ) disminuyen la producción de líquido (mediante la inhibición de la CA) y aumentan el drenaje. Una revisión de personas con glaucoma primario de ángulo abierto e hipertensión ocular concluyó que el tratamiento médico para reducir la PIO ralentizó la progresión de la pérdida del campo visual. [9]
Los agentes anti-VEGF como medicamentos inyectables, junto con otros tratamientos estándar para disminuir la presión intraocular, pueden mejorar la presión en personas con glaucoma neovascular durante períodos cortos de tiempo. [102] La evidencia sugiere que esta mejora puede durar de 4 a 6 semanas. [102] No hay evidencia suficiente para sugerir que los medicamentos anti-VEGF sean efectivos para el tratamiento a corto o largo plazo. [102] La seguridad a corto, mediano y largo plazo del tratamiento anti-VEGF no ha sido bien investigada. [102]
En el glaucoma de ángulo abierto, la progresión típica de la visión normal a la ceguera total demora entre 25 y 70 años sin tratamiento, dependiendo del método de estimación utilizado. [105]
La asociación de la presión intraocular (PIO) elevada y el glaucoma fue descrita por primera vez por el inglés Richard Banister en 1622: "...que el ojo se vuelva más sólido y duro de lo que naturalmente debería ser...". [106] El glaucoma de ángulo cerrado fue tratado con extracción de cataratas por John Collins Warren en Boston ya en 1806. [107] La invención del oftalmoscopio por Hermann Helmholtz en 1851 permitió a los oftalmólogos identificar por primera vez el sello patológico del glaucoma, la excavación de la cabeza del nervio óptico debido a la pérdida de células ganglionares de la retina. El primer instrumento confiable para medir la presión intraocular fue inventado por el oftalmólogo noruego Hjalmar August Schiøtz en 1905. Aproximadamente medio siglo después, Hans Goldmann en Berna, Suiza, desarrolló su tonómetro de aplanación que todavía hoy, a pesar de numerosas innovaciones nuevas en diagnóstico, se considera el estándar de oro para determinar este factor patogénico crucial. A finales del siglo XX, se descubrieron otros mecanismos patológicos más allá de la PIO elevada y se convirtieron en tema de investigación, como el suministro insuficiente de sangre (a menudo asociado con presión arterial baja o irregular) a la retina y la cabeza del nervio óptico. [108] El primer fármaco para reducir la PIO, la pilocarpina , se introdujo en la década de 1870; otras innovaciones importantes en la terapia farmacológica del glaucoma fueron la introducción de gotas oftálmicas betabloqueantes en la década de 1970 y de análogos de prostaglandinas e inhibidores tópicos (administrados localmente) de la anhidrasa carbónica a mediados de la década de 1990. Las primeras técnicas quirúrgicas, como la iridectomía y los métodos fistulizantes, se han complementado recientemente con procedimientos menos invasivos, como pequeños implantes, una gama de opciones ahora ampliamente denominadas MIGS (cirugía microinvasiva del glaucoma).
La palabra "glaucoma" proviene del griego antiguo γλαύκωμα , [109] un derivado de γλαυκός (glaukos), [110] que comúnmente describía el color de los ojos que no eran oscuros (es decir, azul, verde, gris claro). Los ojos descritos como γλαυκός debido a una enfermedad podrían haber tenido una catarata gris en la era hipocrática o, en la era común temprana, el tono pupilar verdoso que a veces se ve en el glaucoma de ángulo cerrado. [111] [112] Este color se refleja en la palabra china para glaucoma, 青光眼(qīngguāngyǎn), literalmente " ojo cian claro ". Una hipótesis alternativa conecta el nombre con el sustantivo griego antiguo para 'búho', [113] γλαύξ o γλαῦξ (ambos glaux ).
El ensayo controlado aleatorizado TAGS investigó si las gotas oftálmicas o la trabeculectomía son más eficaces para tratar el glaucoma primario avanzado de ángulo abierto. Después de dos años, los investigadores descubrieron que la visión y la calidad de vida son similares en ambos tratamientos. Al mismo tiempo, la presión ocular fue menor en las personas que se sometieron a cirugía y, a largo plazo, la cirugía es más rentable. [114] [115]
El ensayo LiGHT comparó la eficacia de las gotas oftálmicas y la trabeculoplastia láser selectiva para el glaucoma de ángulo abierto. Ambas contribuyeron a una calidad de vida similar, pero la mayoría de las personas que se sometieron al tratamiento láser pudieron dejar de usar gotas oftálmicas. La trabeculoplastia láser también demostró ser más rentable. [116]
Una revisión sistemática Cochrane de 2013 comparó el efecto de la brimonidina y el timolol en la desaceleración de la progresión del glaucoma de ángulo abierto en participantes adultos. [117] Los resultados mostraron que los participantes asignados a la brimonidina mostraron una menor progresión del campo visual que los asignados al timolol, aunque los resultados no fueron significativos, dada la gran pérdida de seguimiento y la evidencia limitada. [117] Las presiones intraoculares medias de ambos grupos fueron similares. Los participantes del grupo de la brimonidina tuvieron una mayor incidencia de efectos secundarios causados por la medicación que los participantes del grupo del timolol. [117]
Un estudio realizado en el Reino Unido mostró que las personas que viven en zonas de alta pobreza tenían más probabilidades de ser diagnosticadas en una etapa más avanzada de la enfermedad. [118] También mostró que había falta de servicios oftálmicos profesionales en las zonas de alta pobreza.
Un estudio de 2017 muestra que existe una enorme diferencia en el volumen de pruebas de glaucoma según el tipo de seguro en los EE. UU. [119] Los investigadores revisaron a 21 766 personas ≥ 40 años con glaucoma de ángulo abierto (OAG) recién diagnosticado y descubrieron que los beneficiarios de Medicaid tenían un volumen sustancialmente menor de pruebas de glaucoma realizadas en comparación con los pacientes con seguro médico comercial.
Los resultados de un metanálisis de 33 428 participantes con glaucoma primario de ángulo abierto (GPAA) publicado en 2021 sugieren que existen disparidades étnicas y raciales sustanciales en los ensayos clínicos en los EE. UU. [120] Aunque las minorías étnicas y raciales tienen una mayor carga de enfermedad, el 70,7 % de los participantes del estudio eran blancos, en comparación con el 16,8 % de negros y el 3,4 % de hispanos/latinos.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) {{cite journal}}: CS1 maint: DOI inactive as of November 2024 (link){{cite book}}: CS1 maint: location missing publisher (link)"Un procedimiento ocular con láser puede ser eficaz y seguro si se utiliza de forma temprana como tratamiento para el glaucoma". NIHR Evidence . Instituto Nacional de Investigación en Salud y Atención. 4 de junio de 2019. doi :10.3310/signal-000774.