El radón es un elemento químico , de símbolo Rn y número atómico 86. Es un gas noble radiactivo , incoloro e inodoro. De los tres isótopos del radón que se encuentran en la naturaleza, solo el 222 Rn tiene una vida media lo suficientemente larga (3,825 días) como para que se libere del suelo y la roca donde se genera. Los isótopos del radón son los productos de desintegración inmediata de los isótopos del radio . La inestabilidad del 222 Rn, su isótopo más estable, hace del radón uno de los elementos más raros. El radón estará presente en la Tierra durante varios miles de millones de años más a pesar de su corta vida media, porque se produce constantemente como un paso en las cadenas de desintegración del 238 U y el 232 Th , ambos nucleidos radiactivos abundantes con vidas medias de al menos varios miles de millones de años. La desintegración del radón produce muchos otros nucleidos de vida corta , conocidos como "hijas del radón", que terminan en isótopos estables del plomo . [3] El 222 Rn se presenta en cantidades significativas como un paso en la cadena de desintegración radiactiva normal del 238 U, también conocida como la serie del uranio , que se desintegra lentamente en una variedad de nucleidos radiactivos y finalmente se desintegra en el estable 206 Pb . El 220 Rn se presenta en cantidades minúsculas como un paso intermedio en la cadena de desintegración del 232 Th, también conocida como la serie del torio , que finalmente se desintegra en el estable 208 Pb .
El radón fue descubierto en 1899 por Ernest Rutherford y Robert B. Owens en la Universidad McGill de Montreal , y fue el quinto elemento radiactivo en ser descubierto. Conocido primero como "emanación", el gas radiactivo fue identificado durante experimentos con radio, óxido de torio y actinio por Friedrich Ernst Dorn , Rutherford y Owens, y André-Louis Debierne , respectivamente, y la emanación de cada elemento se consideró una sustancia separada: radón, torón y actinón. Sir William Ramsay y Robert Whytlaw-Gray consideraron que las emanaciones radiactivas podían contener un nuevo elemento de la familia de los gases nobles, y aislaron la "emanación de radio" en 1909 para determinar sus propiedades. En 1911, el elemento aislado por Ramsay y Whytlaw-Gray fue aceptado por la Comisión Internacional de Pesos Atómicos , y en 1923, el Comité Internacional de Elementos Químicos y la Unión Internacional de Química Pura y Aplicada eligieron radón como el nombre aceptado para el isótopo más estable del elemento, 222 Rn.
En condiciones normales, el radón es gaseoso y se puede inhalar fácilmente, lo que supone un riesgo para la salud. Sin embargo, el peligro principal no proviene del radón en sí, sino de sus productos de descomposición, conocidos como descendientes del radón. Estos productos de descomposición, que a menudo existen como átomos o iones individuales, pueden adherirse a partículas de polvo en suspensión en el aire. Aunque el radón es un gas noble y no se adhiere al tejido pulmonar (lo que significa que a menudo se exhala antes de descomponerse), los descendientes del radón adheridos al polvo tienen más probabilidades de adherirse a los pulmones. Esto aumenta el riesgo de daño, ya que los descendientes del radón pueden causar daño al tejido pulmonar. [4] El radón y sus descendientes son, en conjunto, a menudo el mayor contribuyente a la dosis de radiación de fondo de una persona , pero debido a las diferencias locales en la geología, [5] el nivel de exposición al gas radón difiere según la ubicación. Una fuente común de radón ambiental son los minerales que contienen uranio en el suelo; por lo tanto, se acumula en áreas subterráneas como los sótanos. El radón también puede estar presente en aguas subterráneas, como aguas de manantial y aguas termales. [6] El radón atrapado en el permafrost puede liberarse por el deshielo del permafrost inducido por el cambio climático , [7] y el radón también puede liberarse en las aguas subterráneas y la atmósfera después de eventos sísmicos que conducen a terremotos , lo que ha llevado a su investigación en el campo de la predicción de terremotos . [8] Es posible realizar pruebas de radón en edificios y utilizar técnicas como la despresurización debajo de la losa para la mitigación . [9] [10]
Los estudios epidemiológicos han demostrado una clara asociación entre respirar altas concentraciones de radón y la incidencia de cáncer de pulmón . [11] El radón es un contaminante que afecta la calidad del aire interior en todo el mundo. Según la Agencia de Protección Ambiental de los Estados Unidos (EPA), el radón es la segunda causa más frecuente de cáncer de pulmón, después del tabaquismo, causando 21.000 muertes por cáncer de pulmón por año en los Estados Unidos. Alrededor de 2.900 de estas muertes ocurren entre personas que nunca han fumado. Si bien el radón es la segunda causa más frecuente de cáncer de pulmón, es la causa número uno entre los no fumadores, según estimaciones orientadas a políticas de la EPA. [12] Existen incertidumbres significativas sobre los efectos sobre la salud de las exposiciones a dosis bajas. [13]
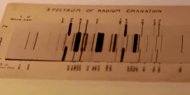
El radón es un gas incoloro, inodoro e insípido [14] y, por lo tanto, no es detectable solo por los sentidos humanos. A temperatura y presión estándar , forma un gas monoatómico con una densidad de 9,73 kg/m 3 , aproximadamente 8 veces la densidad de la atmósfera de la Tierra a nivel del mar, 1,217 kg/m 3 . [15] Es uno de los gases más densos a temperatura ambiente (algunos son más densos, por ejemplo, CF 3 (CF 2 ) 2 CF 3 y WF 6 ) y es el más denso de los gases nobles. Aunque es incoloro a temperatura y presión estándar, cuando se enfría por debajo de su punto de congelación de 202 K (−71 °C; −96 °F), emite una radioluminiscencia brillante que pasa de amarilla a naranja-roja a medida que baja la temperatura. [16] Al condensarse , brilla debido a la intensa radiación que produce. [17] Es poco soluble en agua, pero más soluble que los gases nobles más ligeros. Es apreciablemente más soluble en líquidos orgánicos que en agua. Su ecuación de solubilidad es la siguiente: [18]
donde es la fracción molar del radón, es la temperatura absoluta y y son constantes del disolvente.
El radón es un elemento de valencia cero llamado gas noble y no es muy reactivo desde el punto de vista químico . La vida media de 3,8 días del 222 Rn lo hace útil en las ciencias físicas como trazador natural . Como el radón es un gas en condiciones estándar, a diferencia de sus progenitores de cadena de desintegración, se puede extraer fácilmente de ellos para la investigación. [19]
Es inerte a la mayoría de las reacciones químicas comunes, como la combustión , porque la capa de valencia externa contiene ocho electrones . Esto produce una configuración estable de energía mínima en la que los electrones externos están fuertemente unidos. [20] Su primera energía de ionización —la energía mínima requerida para extraerle un electrón— es 1037 kJ/mol. [21] De acuerdo con las tendencias periódicas , el radón tiene una electronegatividad menor que el elemento un período antes que él, el xenón , y por lo tanto es más reactivo. Los primeros estudios concluyeron que la estabilidad del hidrato de radón debería ser del mismo orden que la de los hidratos de cloro ( Cl
2) o dióxido de azufre ( SO
2), y significativamente mayor que la estabilidad del hidrato de sulfuro de hidrógeno ( H
2S ). [22]
Debido a su costo y radiactividad, rara vez se realizan investigaciones químicas experimentales con radón y, como resultado, hay muy pocos compuestos de radón reportados, todos fluoruros u óxidos . El radón puede oxidarse con agentes oxidantes potentes como el flúor , formando así difluoruro de radón ( RnF
2). [23] Se descompone nuevamente en sus elementos a una temperatura superior a 523 K (250 °C; 482 °F), y se reduce con agua a gas radón y fluoruro de hidrógeno: también puede reducirse nuevamente a sus elementos con gas hidrógeno . [24] Tiene una baja volatilidad y se pensaba que era RnF
2Debido a la corta vida media del radón y a la radiactividad de sus compuestos, no ha sido posible estudiar el compuesto en detalle. Los estudios teóricos sobre esta molécula predicen que debería tener una distancia de enlace Rn-F de 2,08 ångströms (Å), y que el compuesto es termodinámicamente más estable y menos volátil que su homólogo más ligero, el difluoruro de xenón ( XeF
2). [25] La molécula octaédrica RnF6Se predijo que tendría una entalpía de formación incluso menor que el difluoruro. [26] Se cree que el ion [RnF] + se forma mediante la siguiente reacción: [27]
Por esta razón, el pentafluoruro de antimonio junto con el trifluoruro de cloro y el N
2F
2Sb
2F
11Se han considerado para la eliminación de gas radón en minas de uranio debido a la formación de compuestos de radón-flúor. [19] Los compuestos de radón se pueden formar por la descomposición del radio en haluros de radio, una reacción que se ha utilizado para reducir la cantidad de radón que se escapa de los objetivos durante la irradiación . [24] Además, las sales del catión [RnF] + con los aniones SbF−
6, TaF−
6, y BiF−
6Se sabe que el radón también se oxida mediante difluoruro de dioxígeno a RnF
2a 173 K (−100 °C; −148 °F). [24]
Los óxidos de radón se encuentran entre los pocos otros compuestos de radón reportados ; [28] solo el trióxido ( RnO
3) se ha confirmado. [29] Los fluoruros más altos RnF
4y RnF
6Se han afirmado [29] y se calcula que son estables, [30] pero su identificación no está clara. [29] Es posible que se hayan observado en experimentos en los que productos desconocidos que contenían radón se destilaron junto con hexafluoruro de xenón : estos pueden haber sido RnF
4, RnF
6, o ambos. [24] Se afirmó que el calentamiento a escala traza del radón con xenón, flúor, pentafluoruro de bromo y fluoruro de sodio o fluoruro de níquel también producía un fluoruro más alto que se hidrolizaba para formar RnO
3. Si bien se ha sugerido que estas afirmaciones se debían en realidad a que el radón se precipitaba como complejo sólido [RnF]+
2[NiF 6 ] 2− , el hecho de que el radón coprecipita de la solución acuosa con CsXeO
3Se ha tomado F como confirmación de que RnO
3Se formó radón, lo que ha sido respaldado por estudios posteriores de la solución hidrolizada. El hecho de que [RnO 3 F] − no se formara en otros experimentos puede deberse a la alta concentración de fluoruro utilizada. Los estudios de electromigración también sugieren la presencia de formas catiónicas [HRnO 3 ] + y aniónicas [HRnO 4 ] − de radón en solución acuosa débilmente ácida (pH > 5), procedimiento que se había validado previamente mediante el examen del trióxido de xenón homólogo. [29]
También se ha utilizado la técnica de desintegración . Avrorin et al. informaron en 1982 que los compuestos de 212 Fr cocristalizados con sus análogos de cesio parecían retener el radón químicamente unido después de la captura de electrones; las analogías con el xenón sugirieron la formación de RnO 3 , pero esto no pudo confirmarse. [31]
Es probable que la dificultad para identificar fluoruros más altos de radón se deba a que el radón tiene dificultades cinéticas para oxidarse más allá del estado divalente debido a la fuerte ionicidad del difluoruro de radón ( RnF
2) y la alta carga positiva del radón en RnF + ; separación espacial de RnF
2Pueden ser necesarias moléculas para identificar claramente fluoruros de radón más altos, de los cuales RnF
4Se espera que sea más estable que el RnF
6debido a la división de giro-órbita de la capa 6p del radón (Rn IV tendría una capa cerrada 6s2
6p2
1/2configuración). Por lo tanto, mientras RnF
4Debería tener una estabilidad similar al tetrafluoruro de xenón ( XeF
4), RnF
6Probablemente sería mucho menos estable que el hexafluoruro de xenón ( XeF
6): el hexafluoruro de radón probablemente también sería una molécula octaédrica regular , a diferencia de la estructura octaédrica distorsionada del XeF
6, debido al efecto del par inerte . [32] [33] Debido a que el radón es bastante electropositivo para un gas noble, es posible que los fluoruros de radón en realidad adopten estructuras altamente puenteadas con flúor y no sean volátiles. [33] La extrapolación hacia el grupo de los gases nobles sugeriría también la posible existencia de RnO, RnO 2 y RnOF 4 , así como los primeros cloruros de gases nobles químicamente estables RnCl 2 y RnCl 4 , pero ninguno de estos ha sido encontrado todavía. [24]
Se ha predicho que el carbonilo de radón (RnCO) es estable y tiene una geometría molecular lineal . [34] Las moléculas Rn
2y se encontró que RnXe se estabilizaban significativamente mediante acoplamiento de espín-órbita . [35] El radón enjaulado dentro de un fulereno se ha propuesto como un fármaco para los tumores . [36] A pesar de la existencia de Xe(VIII), no se ha afirmado que existan compuestos de Rn(VIII); RnF
8debe ser altamente inestable químicamente (XeF 8 es termodinámicamente inestable). Se predice que el compuesto Rn(VIII) más estable sería el perradonato de bario (Ba 2 RnO 6 ), análogo al perxenato de bario . [30] La inestabilidad de Rn(VIII) se debe a la estabilización relativista de la capa 6s, también conocida como efecto del par inerte . [30]
El radón reacciona con los fluoruros de halógeno líquidos ClF, ClF
3, ClF
5, BrF
3, BrF
5, y SI
7Para formar RnF
2En solución de fluoruro de halógeno, el radón no es volátil y existe como cationes RnF + y Rn2 + ; la adición de aniones fluoruro da como resultado la formación de los complejos RnF−
3y RnF2−
4, en paralelo con la química del berilio (II) y el aluminio (III). [24] El potencial de electrodo estándar del par Rn 2+ /Rn se ha estimado en +2,0 V, [37] aunque no hay evidencia de la formación de iones o compuestos estables de radón en solución acuosa. [24]
El radón no tiene isótopos estables . Se han caracterizado treinta y nueve isótopos radiactivos, con números másicos que van desde 193 a 231. [38] [39] Seis de ellos, desde 217 a 222 inclusive, se producen de forma natural. El isótopo más estable es 222 Rn (vida media de 3,82 días), que es un producto de desintegración de 226 Ra , siendo este último a su vez un producto de desintegración de 238 U. [40] Una cantidad traza del isótopo (altamente inestable) 218 Rn (vida media de unos 35 milisegundos ) también se encuentra entre los descendientes de 222 Rn. El isótopo 216 Rn se produciría por la doble desintegración beta de 216 Po natural ; aunque energéticamente posible, este proceso nunca se ha observado. [41]
Otros tres isótopos del radón tienen una vida media de más de una hora: 211 Rn (aproximadamente 15 horas), 210 Rn (2,4 horas) y 224 Rn (aproximadamente 1,8 horas). Sin embargo, ninguno de estos tres se produce de forma natural. 220 Rn, también llamado torón, es un producto de desintegración natural del isótopo más estable del torio ( 232 Th). Tiene una vida media de 55,6 segundos y también emite radiación alfa . De manera similar, 219 Rn se deriva del isótopo más estable del actinio ( 227 Ac), llamado "actinón", y es un emisor alfa con una vida media de 3,96 segundos. [38]

El 222 Rn pertenece a la cadena de desintegración del radio y el uranio-238, y tiene una vida media de 3,8235 días. Sus primeros cuatro productos (excluyendo los esquemas de desintegración marginal ) tienen una vida muy corta, lo que significa que las desintegraciones correspondientes son indicativas de la distribución inicial del radón. Su desintegración sigue la siguiente secuencia: [38]
El factor de equilibrio del radón [42] es la relación entre la actividad de todas las progenies del radón de período corto (que son responsables de la mayoría de los efectos biológicos del radón) y la actividad que estaría en equilibrio con el progenitor del radón.
Si se suministra radón de forma constante a un volumen cerrado, la concentración de isótopos de vida corta aumentará hasta alcanzar un equilibrio en el que la tasa de desintegración total de los productos de desintegración sea igual a la del propio radón. El factor de equilibrio es 1 cuando ambas actividades son iguales, lo que significa que los productos de desintegración han permanecido cerca del progenitor del radón el tiempo suficiente para que se alcance el equilibrio, en un par de horas. En estas condiciones, cada pCi/L adicional de radón aumentará la exposición en 0,01 niveles de trabajo (WL, una medida de radiactividad que se utiliza habitualmente en la minería). Estas condiciones no siempre se cumplen; en muchos hogares, el factor de equilibrio suele ser del 40%; es decir, habrá 0,004 WL de descendientes por cada pCi/L de radón en el aire. [43] El 210 Pb tarda mucho más en alcanzar el equilibrio con el radón, dependiendo de factores ambientales, [44] pero si el entorno permite la acumulación de polvo durante períodos prolongados de tiempo, el 210 Pb y sus productos de desintegración también pueden contribuir a los niveles generales de radiación. Varios estudios sobre el equilibrio radiactivo de elementos en el medio ambiente consideran que es más útil utilizar la relación de otros productos de desintegración del 222 Rn con el 210 Pb, como el 210 Po, para medir los niveles generales de radiación. [45]
Debido a su carga electrostática , las progenies del radón se adhieren a superficies o partículas de polvo, mientras que el radón gaseoso no lo hace. La adhesión las elimina del aire, lo que generalmente hace que el factor de equilibrio en la atmósfera sea inferior a 1. El factor de equilibrio también se reduce con la circulación del aire o los dispositivos de filtración de aire, y aumenta con las partículas de polvo en suspensión, incluido el humo del cigarrillo. El factor de equilibrio encontrado en estudios epidemiológicos es 0,4. [46]
El radón fue descubierto en 1899 por Ernest Rutherford y Robert B. Owens en la Universidad McGill de Montreal . [47] Fue el quinto elemento radiactivo en ser descubierto, después del uranio, el torio, el radio y el polonio. [48] [49] [50] En 1899, Pierre y Marie Curie observaron que el gas emitido por el radio permanecía radiactivo durante un mes. [51] Más tarde ese año, Rutherford y Owens notaron variaciones al intentar medir la radiación del óxido de torio. [47] Rutherford notó que los compuestos de torio emiten continuamente un gas radiactivo que permanece radiactivo durante varios minutos, y llamó a este gas "emanación" (del latín : emanare , fluir hacia afuera, y emanatio , expiración), [52] y más tarde "emanación de torio" ("Th Em"). En 1900, Friedrich Ernst Dorn informó sobre algunos experimentos en los que notó que los compuestos de radio emanaban un gas radiactivo al que llamó "emanación de radio" ("Ra Em"). [53] En 1901, Rutherford y Harriet Brooks demostraron que las emanaciones son radiactivas, pero atribuyeron a los Curie el descubrimiento del elemento. [54] En 1903, André-Louis Debierne observó emanaciones similares del actinio , a las que llamó "emanación de actinio" ("Ac Em"). [55]
Pronto se sugirieron varios nombres abreviados para las tres emanaciones: exradio , exthorio y exactinio en 1904; [56] radón (Ro), torón (To) y akton o acton (Ao) en 1918; [57] radeón , toreón y actineón en 1919, [58] y finalmente radón , torón y actinón en 1920. [59] (El nombre radón no está relacionado con el del matemático austríaco Johann Radon ). La semejanza de los espectros de estos tres gases con los del argón, el criptón y el xenón, y su inercia química observada llevaron a Sir William Ramsay a sugerir en 1904 que las "emanaciones" podrían contener un nuevo elemento de la familia de los gases nobles. [56]
En 1909, Ramsay y Robert Whytlaw-Gray aislaron el radón y determinaron su temperatura de fusión y densidad aproximada . En 1910, determinaron que era el gas más pesado conocido. [60] Escribieron que " L'expression l'émanation du radium est fort incommode " ("la expresión 'emanación de radio' es muy incómoda") y sugirieron el nuevo nombre niton (Nt) (del latín : nitens , brillante) para enfatizar la propiedad de radioluminiscencia, [61] y en 1912 fue aceptado por la Comisión Internacional de Pesos Atómicos . En 1923, el Comité Internacional de Elementos Químicos y la Unión Internacional de Química Pura y Aplicada (IUPAC) eligieron el nombre del isótopo más estable, el radón, como el nombre del elemento. Los isótopos torón y actinón fueron posteriormente renombrados 220 Rn y 219 Rn. Esto ha causado cierta confusión en la literatura sobre el descubrimiento del elemento, ya que si bien Dorn había descubierto el isótopo radón, no fue el primero en descubrir el elemento radón. [62]
Hasta la década de 1960, el elemento también se conocía simplemente como emanación . [63] El primer compuesto sintetizado de radón, el fluoruro de radón, se obtuvo en 1962. [64] Incluso hoy, la palabra radón puede referirse tanto al elemento como a su isótopo 222 Rn, y el torón sigue utilizándose como nombre corto para 220 Rn para acabar con esta ambigüedad. El nombre actinón para 219 Rn rara vez se encuentra hoy en día, probablemente debido a la corta vida media de ese isótopo. [62]
El peligro de la alta exposición al radón en las minas, donde las exposiciones pueden alcanzar 1.000.000 Bq /m 3 , se conoce desde hace mucho tiempo. En 1530, Paracelso describió una enfermedad debilitante de los mineros, el mala metallorum , y Georg Agricola recomendó la ventilación en las minas para evitar este mal de montaña ( Bergsucht ). [65] En 1879, Harting y Hesse identificaron esta condición como cáncer de pulmón en su investigación de mineros de Schneeberg, Alemania. [66] Los primeros estudios importantes con radón y salud ocurrieron en el contexto de la minería de uranio en la región de Joachimsthal en Bohemia . [67] En los EE. UU., los estudios y la mitigación solo siguieron décadas de efectos sobre la salud en los mineros de uranio del suroeste de los EE. UU. empleados durante la Guerra Fría temprana ; las normas no se implementaron hasta 1971. [68]
A principios del siglo XX, en Estados Unidos, el oro contaminado con el descendiente del radón, el 210 Pb, entró en la industria joyera. Se trataba de semillas de oro para braquiterapia que habían contenido el 222 Rn y que se fundieron después de que el radón se desintegrara. [69]
La presencia de radón en el aire de interiores se documentó ya en 1950. A principios de la década de 1970, se iniciaron investigaciones para abordar las fuentes de radón en interiores, los determinantes de la concentración, los efectos sobre la salud y las estrategias de mitigación. En los EE. UU., el problema del radón en interiores recibió amplia publicidad y se intensificó la investigación después de un incidente ampliamente publicitado en 1984. Durante el control de rutina en una planta de energía nuclear de Pensilvania, se encontró que un trabajador estaba contaminado con radiactividad. Posteriormente, se identificó como responsable una alta concentración de radón en su hogar. [70] [66]

Los análisis de las concentraciones de radón en el medio ambiente hacen referencia al 222 Rn, el producto de la desintegración del uranio y el radio. Si bien la tasa promedio de producción de 220 Rn (de la serie de desintegración del torio) es aproximadamente la misma que la del 222 Rn, la cantidad de 220 Rn en el medio ambiente es mucho menor que la del 222 Rn debido a la corta vida media del 220 Rn (55 segundos, frente a 3,8 días respectivamente). [3]
La concentración de radón en la atmósfera se mide habitualmente en becquerelios por metro cúbico (Bq/m 3 ), la unidad derivada del SI . Otra unidad de medida común en los EE. UU. son los picocurios por litro (pCi/L); 1 pCi/L = 37 Bq/m 3 . [43] La exposición doméstica típica promedia alrededor de 48 Bq/m 3 en interiores, aunque esto varía ampliamente, y 15 Bq/m 3 en exteriores. [72]
En la industria minera, la exposición se mide tradicionalmente en nivel de trabajo (WL), y la exposición acumulada en nivel de trabajo mes (WLM); 1 WL equivale a cualquier combinación de descendientes de corta vida del 222 Rn ( 218 Po, 214 Pb, 214 Bi y 214 Po) en 1 litro de aire que libera 1,3 × 10 5 MeV de energía alfa potencial; [43] 1 WL equivale a 2,08 × 10 −5 julios por metro cúbico de aire (J/m 3 ). [3] La unidad SI de exposición acumulada se expresa en julios-hora por metro cúbico (J·h/m 3 ). Un WLM equivale a 3,6 × 10 −3 J·h/m 3 . Una exposición a 1 WL durante 1 mes de trabajo (170 horas) equivale a una exposición acumulada de 1 WLM. La Comisión Internacional de Protección Radiológica recomienda un límite anual de 4,8 WLM para los mineros. [73] : R5 Suponiendo 2000 horas de trabajo al año, esto corresponde a una concentración de 1500 Bq/m 3 .
El 222 Rn se desintegra en 210 Pb y otros radioisótopos. Los niveles de 210 Pb se pueden medir. La velocidad de deposición de este radioisótopo depende del clima. [74]
Las concentraciones de radón que se encuentran en entornos naturales son demasiado bajas para ser detectadas por medios químicos. Una concentración de 1.000 Bq/m 3 (relativamente alta) corresponde a 0,17 picogramos por metro cúbico (pg/m 3 ). La concentración media de radón en la atmósfera es de aproximadamente 6 × 10−18 por ciento molar , o alrededor de 150 átomos en cada mililitro de aire. [75] La actividad del radón en toda la atmósfera de la Tierra se origina a partir de solo unas pocas decenas de gramos de radón, reemplazados consistentemente por la descomposición de mayores cantidades de radio, torio y uranio. [76]
El radón se produce por la desintegración radiactiva del radio-226, que se encuentra en minerales de uranio, roca fosfórica, pizarras, rocas ígneas y metamórficas como el granito, el gneis y el esquisto, y en menor grado, en rocas comunes como la piedra caliza. [5] [77] Cada milla cuadrada de suelo superficial, hasta una profundidad de 6 pulgadas (2,6 km2 a una profundidad de 15 cm), contiene aproximadamente 1 gramo de radio, que libera radón en pequeñas cantidades a la atmósfera. [3] Se estima que 2.4 mil millones de curios (90 EBq) de radón se liberan del suelo anualmente en todo el mundo. [78] Esto equivale a unos 15,3 kilogramos (34 lb).
La concentración de radón puede variar mucho de un lugar a otro. Al aire libre, oscila entre 1 y 100 Bq/m 3 , e incluso menos (0,1 Bq/m 3 ) por encima del océano. En cuevas o minas ventiladas, o en casas mal ventiladas, su concentración asciende a 20-2.000 Bq/m 3 . [79]
La concentración de radón puede ser mucho mayor en contextos mineros. Las regulaciones de ventilación indican que la concentración de radón en las minas de uranio debe mantenerse por debajo del "nivel de trabajo", con niveles del percentil 95 que van hasta casi 3 WL (546 pCi 222 Rn por litro de aire; 20,2 kBq/m 3 , medidos entre 1976 y 1985). [3] La concentración en el aire en la galería de curación de Gastein (sin ventilación) promedia 43 kBq/m 3 (1,2 nCi/L) con un valor máximo de 160 kBq/m 3 (4,3 nCi/L). [80]
El radón aparece principalmente en la serie radio/ uranio (cadena de desintegración) ( 222 Rn), y marginalmente en la serie torio ( 220 Rn). El elemento emana de forma natural del suelo y de algunos materiales de construcción en todo el mundo, dondequiera que se encuentren trazas de uranio o torio, y particularmente en regiones con suelos que contienen granito o pizarra , que tienen una mayor concentración de uranio. No todas las regiones graníticas son propensas a altas emisiones de radón. Al ser un gas raro, suele migrar libremente a través de fallas y suelos fragmentados, y puede acumularse en cuevas o en el agua. Debido a su vida media muy corta (cuatro días para el 222 Rn), la concentración de radón disminuye muy rápidamente cuando aumenta la distancia desde el área de producción. La concentración de radón varía mucho con la estación y las condiciones atmosféricas. Por ejemplo, se ha demostrado que se acumula en el aire si hay una inversión meteorológica y poco viento. [81]
En algunas aguas de manantial y fuentes termales se pueden encontrar altas concentraciones de radón. [82] Las ciudades de Boulder, Montana ; Misasa ; Bad Kreuznach , Alemania; y el país de Japón tienen manantiales ricos en radio que emiten radón. Para ser clasificada como agua mineral con radón, la concentración de radón debe ser superior a 2 nCi/L (74 kBq/m 3 ). [83] La actividad del agua mineral con radón alcanza los 2 MBq/m 3 en Merano y los 4 MBq/m 3 en Lurisia (Italia). [80]
Las concentraciones naturales de radón en la atmósfera de la Tierra son tan bajas que el agua rica en radón en contacto con la atmósfera perderá continuamente radón por volatilización . Por lo tanto, el agua subterránea tiene una mayor concentración de 222 Rn que el agua superficial , porque el radón se produce continuamente por la desintegración radiactiva del 226 Ra presente en las rocas. Del mismo modo, la zona saturada de un suelo con frecuencia tiene un mayor contenido de radón que la zona no saturada debido a las pérdidas por difusión a la atmósfera. [84]
En 1971, la Apolo 15 pasó a 110 km (68 mi) sobre la meseta de Aristarco en la Luna y detectó un aumento significativo de partículas alfa que se cree que fue causado por la desintegración de 222 Rn. La presencia de 222 Rn se ha deducido más tarde a partir de datos obtenidos del espectrómetro de partículas alfa Lunar Prospector . [85]
El radón se encuentra en algunos tipos de petróleo . Debido a que el radón tiene una curva de presión y temperatura similar a la del propano , y las refinerías de petróleo separan los productos petroquímicos en función de sus puntos de ebullición, las tuberías que transportan el propano recién separado en las refinerías de petróleo pueden contaminarse debido a la descomposición del radón y sus productos. [86]
Los residuos de la industria del petróleo y del gas natural suelen contener radio y sus derivados. Las incrustaciones de sulfato de un pozo petrolero pueden ser ricas en radio, mientras que el agua, el petróleo y el gas de un pozo suelen contener radón. El radón se desintegra para formar radioisótopos sólidos que forman revestimientos en el interior de las tuberías. [86]
En las primeras décadas de su descubrimiento, la medición de los niveles de radón se realizó principalmente para determinar la presencia de radio y uranio en estudios geológicos. En 1956, probablemente se realizó el primer estudio de productos de desintegración del radón en interiores en Suecia [87] , con la intención de estimar la exposición pública al radón y sus productos de desintegración. Desde 1975 hasta 1984, se realizaron pequeños estudios en Suecia, Austria, Estados Unidos y Noruega para medir el radón en interiores y en áreas metropolitanas [66] .
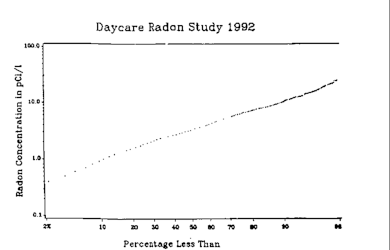

En 1984 se descubrieron por casualidad altas concentraciones de radón en los hogares, después de que las rigurosas pruebas de radiación realizadas en la nueva planta de energía nuclear de la Central Generadora de Limerick en el condado de Montgomery, Pensilvania, Estados Unidos, revelaran que Stanley Watras , un ingeniero de construcción de la planta, estaba contaminado por sustancias radiactivas a pesar de que el reactor nunca había recibido combustible y Watras había sido descontaminado cada noche. Se determinó que los niveles de radón en el sótano de su casa superaban los 100.000 Bq/m 3 (2,7 nCi/L); le dijeron que vivir en la casa equivalía a fumar 135 paquetes de cigarrillos al día, y que él y su familia habían aumentado su riesgo de desarrollar cáncer de pulmón en un 13 o 14 por ciento. [88] El incidente dramatizó el hecho de que los niveles de radón en determinadas viviendas pueden ocasionalmente ser órdenes de magnitud más altos que lo típico. [89] Desde el incidente en Pensilvania, se han tomado millones de mediciones de radón a corto plazo en hogares de los Estados Unidos. Fuera de los Estados Unidos, las mediciones de radón generalmente se realizan a largo plazo. [66]
En los Estados Unidos, la exposición doméstica típica es de aproximadamente 100 Bq/m3 ( 2,7 pCi/L) en interiores. En todos los edificios se encuentra algún nivel de radón. El radón entra en un edificio principalmente directamente desde el suelo a través del nivel más bajo del edificio que está en contacto con el suelo. Los altos niveles de radón en el suministro de agua también pueden aumentar los niveles de radón en el aire interior. Los puntos de entrada típicos del radón en los edificios son grietas en cimientos sólidos y paredes, juntas de construcción, huecos en pisos suspendidos y alrededor de tuberías de servicio, cavidades dentro de las paredes y el suministro de agua. [14] Las concentraciones de radón en el mismo lugar pueden diferir en el doble o la mitad a lo largo de una hora, y la concentración en una habitación de un edificio puede ser significativamente diferente de la concentración en una habitación contigua. [3]
La distribución de las concentraciones de radón suele variar de una habitación a otra, y las lecturas se promedian de acuerdo con los protocolos reglamentarios. Se suele suponer que la concentración de radón en interiores sigue una distribución logarítmica normal en un territorio determinado. [90] Por tanto, se suele utilizar la media geométrica para estimar la concentración "promedio" de radón en una zona. [91] La concentración media varía de menos de 10 Bq/m3 a más de 100 Bq/m3 en algunos países europeos. [92]
Algunos de los mayores peligros de radón en los EE. UU. se encuentran en Iowa y en las áreas de los Montes Apalaches en el sureste de Pensilvania. [93] Iowa tiene las concentraciones promedio más altas de radón en los EE. UU. debido a una glaciación significativa que molió las rocas graníticas del Escudo Canadiense y las depositó como suelos que componen las ricas tierras agrícolas de Iowa. [94] Muchas ciudades dentro del estado, como Iowa City , han aprobado requisitos para la construcción resistente al radón en casas nuevas. Las segundas lecturas más altas en Irlanda se encontraron en edificios de oficinas en la ciudad irlandesa de Mallow, en el condado de Cork , lo que provocó temores locales con respecto al cáncer de pulmón. [95]

Como el radón es un gas incoloro e inodoro, la única forma de saber cuánto hay presente en el aire o el agua es realizar pruebas. En los EE. UU., los kits de prueba de radón están disponibles para el público en tiendas minoristas, como ferreterías, para uso doméstico, y las pruebas están disponibles a través de profesionales autorizados, que a menudo son inspectores de viviendas . Los esfuerzos para reducir los niveles de radón en interiores se denominan mitigación del radón . En los EE. UU., la EPA recomienda que se realicen pruebas de radón en todas las casas. En el Reino Unido, según el Sistema de Clasificación de Salud y Seguridad de la Vivienda, los propietarios tienen la obligación de evaluar los posibles riesgos y peligros para la salud y la seguridad en una propiedad residencial. [96] El monitoreo de la radiación alfa a largo plazo es un método de prueba de radón que es más común en países fuera de los Estados Unidos. [66]
El radón se obtiene como subproducto del procesamiento de minerales uraníferos después de transferirlo a soluciones al 1% de ácidos clorhídrico o bromhídrico . La mezcla de gases extraída de las soluciones contiene H
2, oh
2, Él, Rn, CO
2, yo
2O y los hidrocarburos . La mezcla se purifica pasándola sobre cobre a 993 K (720 °C; 1.328 °F) para eliminar el H
2y la O
2, y luego KOH y P
2Oh
5Se utilizan para eliminar los ácidos y la humedad por sorción . El radón se condensa con nitrógeno líquido y se purifica de los gases residuales por sublimación . [97]
La comercialización del radón está regulada, pero está disponible en pequeñas cantidades para la calibración de los sistemas de medición de 222 Rn. En 2008, su precio era de casi 6.000 dólares (equivalentes a 8.491 dólares en 2023) por mililitro de solución de radio (que sólo contiene unos 15 picogramos de radón real en un momento dado). [98] El radón se produce comercialmente mediante una solución de radio-226 (vida media de 1.600 años). El radio-226 se desintegra por emisión de partículas alfa, produciendo radón que se acumula sobre las muestras de radio-226 a una velocidad de aproximadamente 1 mm3 / día por gramo de radio; el equilibrio se alcanza rápidamente y el radón se produce en un flujo constante, con una actividad igual a la del radio (50 Bq). El 222 Rn gaseoso (vida media de unos cuatro días) escapa de la cápsula a través de la difusión . [99]
Una forma de curanderismo de principios del siglo XX era el tratamiento de enfermedades en un radiotorio . [105] Era una habitación pequeña y sellada para que los pacientes estuvieran expuestos al radón por sus "efectos medicinales". La naturaleza cancerígena del radón debido a su radiación ionizante se hizo evidente más tarde. La radiactividad dañina de las moléculas del radón se ha utilizado para matar células cancerosas, [106] pero no mejora la salud de las células sanas. [ cita requerida ] La radiación ionizante provoca la formación de radicales libres , lo que resulta en daño celular , causando un aumento en las tasas de enfermedad, incluido el cáncer .
Se ha sugerido que la exposición al radón mitiga enfermedades autoinmunes como la artritis en un proceso conocido como hormesis por radiación . [107] [108] Como resultado, a fines del siglo XX y principios del siglo XXI, las "minas de salud" establecidas en Basin, Montana , atrajeron a personas que buscaban alivio de problemas de salud como la artritis mediante una exposición limitada al agua radiactiva de la mina y al radón. La práctica se desaconseja debido a los efectos nocivos bien documentados de las altas dosis de radiación en el cuerpo. [109]
Los baños de agua radiactiva se han aplicado desde 1906 en Jáchymov , República Checa, pero incluso antes del descubrimiento del radón se usaban en Bad Gastein , Austria. Los manantiales ricos en radio también se utilizan en onsen japoneses tradicionales en Misasa , Prefectura de Tottori . La terapia de bebida se aplica en Bad Brambach , Alemania, y durante principios del siglo XX, el agua de manantiales con radón en ellos se embotellaba y vendía (esta agua tenía poco o nada de radón cuando llegaba a los consumidores debido a la corta vida media del radón). [110] La terapia de inhalación se lleva a cabo en Gasteiner-Heilstollen, Austria; Świeradów-Zdrój , Czerniawa-Zdrój, Kowary , Lądek-Zdrój , Polonia; Harghita Băi , Rumania; y Boulder, Montana . En Estados Unidos y Europa hay varios "spa de radón", donde la gente se sienta durante minutos u horas en una atmósfera con alto contenido de radón, como en Bad Schmiedeberg , Alemania. [108] [111]
.jpg/440px-Radioactive_Seeds_(7845754328).jpg)
El radón se ha producido comercialmente para su uso en radioterapia, pero en su mayor parte ha sido reemplazado por radionucleidos fabricados en aceleradores de partículas y reactores nucleares . El radón se ha utilizado en semillas implantables, hechas de oro o vidrio, principalmente utilizadas para tratar cánceres, conocidas como braquiterapia . Las semillas de oro se produjeron llenando un tubo largo con radón bombeado desde una fuente de radio, y luego el tubo se dividió en secciones cortas mediante engarce y corte. La capa de oro mantiene el radón dentro y filtra las radiaciones alfa y beta, al tiempo que permite que escapen los rayos gamma (que matan el tejido enfermo). Las actividades pueden variar de 0,05 a 5 milicurios por semilla (2 a 200 MBq). [106] Los rayos gamma son producidos por el radón y los primeros elementos de vida corta de su cadena de desintegración ( 218 Po, 214 Pb, 214 Bi, 214 Po).
Después de 11 vidas medias (42 días), la radiactividad del radón se encuentra en 1/2048 de su nivel original. En esta etapa, la actividad residual predominante de la semilla se origina del producto de desintegración del radón, el 210 Pb, cuya vida media (22,3 años) es 2000 veces la del radón y sus descendientes, el 210 Bi y el 210 Po. [ cita requerida ]
El 211 Rn se puede utilizar para generar 211 At, que tiene usos en la terapia alfa dirigida . [112]
La emanación de radón del suelo varía según el tipo de suelo y el contenido de uranio en la superficie, por lo que las concentraciones de radón en el exterior se pueden utilizar para rastrear las masas de aire en un grado limitado. [113] [a] Debido a la rápida pérdida de radón en el aire y su descomposición comparativamente rápida, el radón se utiliza en la investigación hidrológica que estudia la interacción entre el agua subterránea y los arroyos . Cualquier concentración significativa de radón en un río puede ser un indicador de que existen entradas locales de agua subterránea. [114]
La concentración de radón en el suelo se ha utilizado para mapear fallas geológicas enterradas cercanas a la superficie porque las concentraciones son generalmente más altas sobre las fallas. [115] De manera similar, ha encontrado un uso limitado en la prospección de gradientes geotérmicos . [116]
Algunos investigadores han estudiado los cambios en las concentraciones de radón en las aguas subterráneas para predecir terremotos . [117] [118] Se observaron aumentos en el radón antes de los terremotos de Tashkent de 1966 [119] y Mindoro de 1994 [118] . El radón tiene una vida media de aproximadamente 3,8 días, lo que significa que solo se puede encontrar poco después de que se haya producido en la cadena de desintegración radiactiva. Por esta razón, se ha planteado la hipótesis de que los aumentos en la concentración de radón se deben a la generación de nuevas grietas subterráneas, lo que permitiría una mayor circulación de las aguas subterráneas, expulsando el radón. No se puede suponer irrazonablemente que la generación de nuevas grietas precede a los grandes terremotos. En los años 1970 y 1980, las mediciones científicas de las emisiones de radón cerca de las fallas descubrieron que los terremotos a menudo ocurrían sin señal de radón, y el radón a menudo se detectaba sin que hubiera un terremoto después. Entonces muchos lo descartaron como un indicador poco fiable. [120] En 2009, la NASA lo estaba investigando como posible precursor de terremotos ; [8] investigaciones posteriores sobre el tema han sugerido que las anomalías en las concentraciones atmosféricas de radón pueden ser un indicador de movimiento sísmico. [121]
El radón es un contaminante conocido que emiten las centrales geotérmicas porque está presente en el material bombeado desde las profundidades del subsuelo. Se dispersa rápidamente y no se ha demostrado ningún peligro radiológico en varias investigaciones. Además, los sistemas típicos reinyectan el material en las profundidades del subsuelo en lugar de liberarlo en la superficie, por lo que su impacto ambiental es mínimo. [122] En 1989, un estudio de la dosis colectiva recibida debido al radón en fluidos geotérmicos midió 2 sieverts- hombre por gigavatio-año de electricidad producida, en comparación con los 2,5 sieverts-hombre por gigavatio-año producidos por las emisiones de 14 C en las centrales nucleares . [123]
En las décadas de 1940 y 1950, el radón producido a partir de una fuente de radio se utilizó para radiografía industrial . [124] Otras fuentes de rayos X , como 60Co y 192Ir , estuvieron disponibles después de la Segunda Guerra Mundial y rápidamente reemplazaron al radio y, por lo tanto, al radón para este propósito, al ser de menor costo y riesgo. [125]
Los productos de desintegración del 222 Rn han sido clasificados por la Agencia Internacional para la Investigación sobre el Cáncer como cancerígenos para los seres humanos, [126] y como un gas que puede ser inhalado, el cáncer de pulmón es una preocupación particular para las personas expuestas a niveles elevados de radón durante períodos prolongados. Durante las décadas de 1940 y 1950, cuando las normas de seguridad que exigían una ventilación costosa en las minas no se implementaron ampliamente, [127] la exposición al radón se relacionó con el cáncer de pulmón entre los mineros no fumadores de uranio y otros materiales de roca dura en lo que ahora es la República Checa, y más tarde entre los mineros del suroeste de los EE. UU. [128] y el sur de Australia . [129] A pesar de que estos peligros se conocían a principios de la década de 1950, [130] este riesgo ocupacional siguió siendo mal gestionado en muchas minas hasta la década de 1970. Durante este período, varios empresarios abrieron antiguas minas de uranio en los EE. UU. al público en general y publicitaron supuestos beneficios para la salud de respirar gas radón bajo tierra. Los supuestos beneficios para la salud incluían alivio del dolor, problemas sinusales, asma y artritis, [131] pero el gobierno prohibió tales anuncios en 1975, [132] y trabajos posteriores han debatido la verdad de tales supuestos efectos para la salud, citando los efectos nocivos documentados de la radiación en el cuerpo. [133]
Desde entonces, se han utilizado sistemas de ventilación y otras medidas para reducir los niveles de radón en la mayoría de las minas afectadas que siguen en funcionamiento. En los últimos años, la exposición anual media de los mineros de uranio ha disminuido a niveles similares a las concentraciones inhaladas en algunos hogares. Esto ha reducido el riesgo de cáncer de origen ocupacional causado por el radón, aunque pueden persistir problemas de salud para quienes trabajan actualmente en las minas afectadas y para quienes han trabajado en ellas en el pasado. [134] A medida que ha disminuido el riesgo relativo para los mineros, también lo ha hecho la capacidad de detectar riesgos excesivos entre esa población. [135]

Los residuos del procesamiento del mineral de uranio también pueden ser una fuente de radón. El radón resultante del alto contenido de radio en los vertederos descubiertos y los estanques de relaves [3] puede liberarse fácilmente a la atmósfera y afectar a las personas que viven en las cercanías. [137] La liberación de radón puede mitigarse cubriendo los relaves con tierra o arcilla, aunque otros productos de descomposición pueden filtrarse a las fuentes de agua subterránea . [136]
Las minas que no contienen uranio pueden presentar mayores riesgos de exposición al radón, ya que no se controla continuamente la radiación de los trabajadores y no se aplican las normas específicas para las minas de uranio. Una revisión de las mediciones del nivel de radón en minas que no contienen uranio encontró que las concentraciones más altas de radón se registraban en minas que no contenían metales, como las minas de fósforo y de sal . [138] Sin embargo, las minas de uranio más antiguas o abandonadas sin ventilación aún pueden tener niveles extremadamente altos de radón. [139]
Además del cáncer de pulmón, los investigadores han teorizado sobre un posible aumento del riesgo de leucemia debido a la exposición al radón. El apoyo empírico de los estudios de la población general es inconsistente; un estudio de mineros de uranio encontró una correlación entre la exposición al radón y la leucemia linfocítica crónica , [140] y la investigación actual apoya un vínculo entre la exposición al radón en interiores y malos resultados de salud (es decir, un mayor riesgo de cáncer de pulmón o leucemia infantil ). [141] Las acciones legales tomadas por los involucrados en las industrias nucleares, incluidos mineros, molineros, transportistas, trabajadores de plantas nucleares y sus respectivos sindicatos han dado como resultado una compensación para los afectados por la exposición al radón y la radiación bajo programas como el plan de compensación para enfermedades relacionadas con la radiación (en el Reino Unido) [142] y la Ley de Compensación por Exposición a la Radiación (en los Estados Unidos). [143]
La EPA ha considerado al radón como la segunda causa principal de cáncer de pulmón en los Estados Unidos y la principal causa ambiental de mortalidad por cáncer [144] , siendo el tabaquismo la primera . [145] Otros han llegado a conclusiones similares para el Reino Unido [134] y Francia. [146] La exposición al radón en los edificios puede surgir de formaciones rocosas subterráneas y ciertos materiales de construcción (por ejemplo, algunos granitos). [147] El mayor riesgo de exposición al radón surge en edificios herméticos, insuficientemente ventilados y con fugas en los cimientos que permiten que el aire del suelo ingrese a los sótanos y las habitaciones. [148] En algunas regiones, como Niška Banja , Serbia y Ullensvang , Noruega, las concentraciones de radón en exteriores pueden ser excepcionalmente altas, aunque en comparación con los interiores, donde las personas pasan más tiempo y el aire no se dispersa ni se intercambia con tanta frecuencia, la exposición al radón en exteriores no se considera un riesgo significativo para la salud. [149]
La exposición al radón (principalmente a sus derivados) se ha relacionado con el cáncer de pulmón en estudios de casos y controles realizados en Estados Unidos, Europa y China. En Estados Unidos se producen aproximadamente 21.000 muertes al año (el 0,0063 % de una población de 333 millones) debido a cánceres de pulmón inducidos por radón. [12] [150] En Europa, el 2 % de todos los cánceres se han atribuido al radón; [151] en Eslovenia en particular, un país con una alta concentración de radón, alrededor de 120 personas (el 0,0057 % de una población de 2,11 millones) mueren anualmente a causa del radón. [152] Uno de los estudios más completos sobre radón realizado en Estados Unidos por el epidemiólogo R. William Field y sus colegas encontró un aumento del 50 % en el riesgo de cáncer de pulmón incluso con exposiciones prolongadas al nivel de acción de la EPA de 4 pCi/L. Los análisis agrupados de América del Norte y Europa respaldan aún más estos hallazgos. [148] Sin embargo, la conclusión de que la exposición a niveles bajos de radón conduce a un riesgo elevado de cáncer de pulmón ha sido cuestionada, [153] y los análisis de la literatura apuntan a un riesgo elevado solo cuando el radón se acumula en interiores [141] y en niveles superiores a 100 Bq/m 3 . [151]
El torón ( 220 Rn) ha sido menos estudiado que el 222 Rn en lo que respecta a la exposición doméstica debido a su vida media más corta. Sin embargo, se ha medido en concentraciones comparativamente altas en edificios con arquitectura de tierra, como casas tradicionales con entramado de madera y casas modernas con paredes de arcilla , [154] y en regiones con suelos y arena ricos en torio y monacita . [155] El torón es un contribuyente menor a la dosis de radiación total recibida debido a la exposición al radón en interiores, [156] y puede interferir con las mediciones de 222 Rn cuando no se tiene en cuenta. [155]
En 2009, la OMS presentó un nivel de referencia recomendado (el nivel de referencia nacional), 100 Bq/m 3 , para el radón en las viviendas. La recomendación también dice que, cuando esto no sea posible, se debe seleccionar 300 Bq/m 3 como el nivel más alto. Un nivel de referencia nacional no debe ser un límite, sino que debe representar la concentración media anual máxima aceptable de radón en una vivienda. [157]
La concentración de radón que se puede tomar como medida en una vivienda varía según la organización que haga la recomendación; por ejemplo, la EPA recomienda que se tomen medidas en concentraciones tan bajas como 74 Bq/m 3 (2 pCi/L), [72] y la Unión Europea recomienda que se tomen medidas cuando las concentraciones alcancen los 400 Bq/m 3 (11 pCi/L) para las casas antiguas y los 200 Bq/m 3 (5 pCi/L) para las nuevas. [158] El 8 de julio de 2010, la Agencia de Protección de la Salud del Reino Unido emitió un nuevo asesoramiento que establecía un "Nivel objetivo" de 100 Bq/m 3 mientras que mantenía un "Nivel de acción" de 200 Bq/m 3 . [159] La Autoridad Noruega de Seguridad Nuclear y Radiológica (DSA) [160] publica niveles similares (como en el Reino Unido), con un límite máximo para escuelas, jardines de infancia y viviendas nuevas de 200 Bq/m 3 , mientras que 100 Bq/m 3 se establecen como el nivel de acción. [161]
Los resultados de estudios epidemiológicos indican que el riesgo de cáncer de pulmón aumenta con la exposición al radón residencial. Un ejemplo bien conocido de fuente de error es el tabaquismo, el principal factor de riesgo del cáncer de pulmón. En los EE. UU., se estima que el tabaquismo causa entre el 80% y el 90% de todos los cánceres de pulmón. [162]
Según la EPA, el riesgo de cáncer de pulmón en los fumadores es significativo debido a los efectos sinérgicos del radón y el tabaquismo. En esta población, aproximadamente 62 personas de un total de 1.000 morirán de cáncer de pulmón, en comparación con 7 personas de un total de 1.000 en el caso de las personas que nunca han fumado. [12] No se puede descartar que el riesgo en los no fumadores se deba principalmente a un efecto del radón.
El radón, al igual que otros factores de riesgo externos conocidos o sospechosos de cáncer de pulmón, es una amenaza para los fumadores y ex fumadores. Así lo demostró el estudio conjunto europeo. [163] En un comentario [163] al estudio conjunto se afirmaba: "no es adecuado hablar simplemente de un riesgo derivado del radón en los hogares. El riesgo es el del tabaco, al que se suma un efecto sinérgico del radón para los fumadores. Sin el tabaco, el efecto parece ser tan pequeño que resulta insignificante".
Según el estudio de agrupación europeo, existe una diferencia en el riesgo para los subtipos histológicos de cáncer de pulmón y la exposición al radón. El carcinoma de pulmón de células pequeñas , que tiene una alta correlación con el tabaquismo, tiene un mayor riesgo después de la exposición al radón. Para otros subtipos histológicos como el adenocarcinoma , el tipo que afecta principalmente a los no fumadores, el riesgo del radón parece ser menor. [163] [164]
Un estudio de la radiación de la radioterapia posterior a la mastectomía muestra que es necesario desarrollar los modelos simples que se utilizaban anteriormente para evaluar los riesgos combinados y separados de la radiación y el tabaquismo. [165] Esto también está respaldado por un nuevo debate sobre el método de cálculo, el modelo lineal sin umbral , que se ha utilizado rutinariamente. [166]
Un estudio de 2001, en el que participaron 436 no fumadores con cáncer de pulmón y un grupo de control de 1.649 no fumadores sin cáncer de pulmón, demostró que la exposición al radón aumentaba el riesgo de cáncer de pulmón en los no fumadores. El grupo que había estado expuesto al humo de tabaco en el hogar parecía tener un riesgo mucho mayor, mientras que los que no habían estado expuestos al tabaquismo pasivo no mostraron ningún aumento del riesgo con el aumento de la exposición al radón. [167]
Se desconocen los efectos del radón si se ingiere, aunque los estudios han descubierto que su vida media biológica varía de 30 a 70 minutos, con una eliminación del 90% a los 100 minutos. En 1999, el Consejo Nacional de Investigación de los EE. UU. investigó la cuestión del radón en el agua potable. El riesgo asociado con la ingestión se consideró casi insignificante; [168] El agua de fuentes subterráneas puede contener cantidades significativas de radón dependiendo de las condiciones de la roca y el suelo circundantes, mientras que las fuentes superficiales generalmente no lo hacen. [169] El radón también se libera del agua cuando aumenta la temperatura, disminuye la presión y cuando se airea el agua. Las condiciones óptimas para la liberación y exposición al radón en la vida doméstica a través del agua se dieron durante la ducha. El agua con una concentración de radón de 10 4 pCi/L puede aumentar la concentración de radón en el aire interior en 1 pCi/L en condiciones normales. [77] Sin embargo, la concentración de radón liberado del agua subterránea contaminada al aire se ha medido en 5 órdenes de magnitud menor que la concentración original en el agua. [170]
Las concentraciones de radón en la superficie del océano se intercambian dentro de la atmósfera, lo que provoca que el 222 Rn aumente a través de la interfaz aire-mar. [171] Aunque las áreas analizadas fueron muy poco profundas, mediciones adicionales en una amplia variedad de regímenes costeros deberían ayudar a definir la naturaleza del 222 Rn observado.


Existen pruebas relativamente sencillas para detectar el gas radón. En algunos países, estas pruebas se realizan metódicamente en áreas de peligros sistemáticos conocidos. Los dispositivos de detección de radón están disponibles comercialmente. Los detectores digitales de radón proporcionan mediciones continuas que brindan lecturas promedio diarias, semanales, a corto y largo plazo a través de una pantalla digital. Los dispositivos de prueba de radón a corto plazo que se utilizan para fines de detección inicial son económicos, en algunos casos gratuitos. Existen protocolos importantes para realizar pruebas de radón a corto plazo y es imperativo seguirlos estrictamente. El kit incluye un colector que el usuario cuelga en el piso habitable más bajo de la casa durante dos a siete días. Luego, el usuario envía el colector a un laboratorio para su análisis. También hay kits a largo plazo, que toman recolecciones durante un año o más. Un kit de prueba en terreno abierto puede probar las emisiones de radón del terreno antes de que comience la construcción. [12] Las concentraciones de radón pueden variar diariamente, y las estimaciones precisas de la exposición al radón requieren mediciones promedio a largo plazo de radón en los espacios donde una persona pasa una cantidad significativa de tiempo. [172]
Los niveles de radón fluctúan naturalmente, debido a factores como las condiciones climáticas transitorias, por lo que una prueba inicial podría no ser una evaluación precisa del nivel promedio de radón de una casa. Los niveles de radón alcanzan un máximo durante la parte más fría del día, cuando los diferenciales de presión son mayores. [77] Por lo tanto, un resultado alto (superior a 4 pCi/L) justifica repetir la prueba antes de emprender proyectos de reducción más costosos. Las mediciones entre 4 y 10 pCi/L justifican una prueba de radón a largo plazo. Las mediciones superiores a 10 pCi/L justifican solo otra prueba a corto plazo para que las medidas de reducción no se retrasen indebidamente. La EPA ha recomendado a los compradores de bienes raíces que retrasen o rechacen una compra si el vendedor no ha reducido con éxito el radón a 4 pCi/L o menos. [12]
Como la vida media del radón es de tan solo 3,8 días, la eliminación o el aislamiento de la fuente reducirá en gran medida el riesgo en unas pocas semanas. Otro método para reducir los niveles de radón es modificar la ventilación del edificio. Por lo general, las concentraciones de radón en interiores aumentan a medida que disminuyen las tasas de ventilación. [3] En un lugar bien ventilado, la concentración de radón tiende a alinearse con los valores exteriores (normalmente 10 Bq/m 3 , con un rango de 1 a 100 Bq/m 3 ). [12]
Las cuatro formas principales de reducir la cantidad de radón que se acumula en una casa son: [12] [173]
Según la EPA, el método para reducir el radón "...utilizado principalmente es un sistema de ventilación con tubos y ventiladores que extraen el radón de debajo de la casa y lo expulsan al exterior", lo que también se denomina despresurización debajo de la losa, despresurización activa del suelo o succión del suelo. [12] En general, el radón en interiores se puede mitigar mediante la despresurización debajo de la losa y la extracción de ese aire cargado de radón al exterior, lejos de las ventanas y otras aberturas del edificio. "[La] EPA generalmente recomienda métodos que evitan la entrada de radón. La succión del suelo, por ejemplo, evita que el radón entre en su casa al extraerlo de debajo de la casa y ventilarlo a través de una tubería o tuberías al aire por encima de la casa, donde se diluye rápidamente" y la "EPA no recomienda el uso del sellado solo para reducir el radón porque, por sí solo, no se ha demostrado que el sellado reduzca los niveles de radón de manera significativa o constante". [174]
Los sistemas de ventilación de presión positiva se pueden combinar con un intercambiador de calor para recuperar energía en el proceso de intercambio de aire con el exterior, y simplemente extraer el aire del sótano al exterior no es necesariamente una solución viable ya que esto puede atraer gas radón a la vivienda. Las casas construidas en un sótano pueden beneficiarse de un colector de radón instalado debajo de una "barrera de radón" (una lámina de plástico que cubre el sótano). [12] [175] Para los sótanos, la EPA afirma que "[u]n método eficaz para reducir los niveles de radón en las casas con sótanos implica cubrir el piso de tierra con una lámina de plástico de alta densidad. Se utilizan un tubo de ventilación y un ventilador para extraer el radón de debajo de la lámina y ventilarlo al exterior. Esta forma de succión del suelo se llama succión submembrana y, cuando se aplica correctamente, es la forma más eficaz de reducir los niveles de radón en las casas con sótanos". [174]
{{cite journal}}: CS1 maint: DOI inactive as of November 2024 (link)