
El radio es un elemento químico ; tiene símbolo Ra y número atómico 88. Es el sexto elemento del grupo 2 de la tabla periódica , también conocidos como metales alcalinotérreos . El radio puro es de color blanco plateado, pero reacciona fácilmente con el nitrógeno (en lugar del oxígeno) al exponerse al aire, formando una capa superficial negra de nitruro de radio (Ra 3 N 2 ). Todos los isótopos del radio son radiactivos , siendo el isótopo más estable el radio-226 con una vida media de 1.600 años. Cuando el radio se desintegra, emite radiación ionizante como subproducto, que puede excitar sustancias químicas fluorescentes y provocar radioluminiscencia .
El radio, en forma de cloruro de radio , fue descubierto por Marie y Pierre Curie en 1898 a partir de un mineral extraído en Jáchymov . Extrajeron el compuesto de radio de la uraninita y publicaron el descubrimiento en la Academia de Ciencias de Francia cinco días después. El radio fue aislado en su estado metálico por Marie Curie y André-Louis Debierne mediante la electrólisis del cloruro de radio en 1911. [2]
En la naturaleza, el radio se encuentra en minerales de uranio y (en menor medida) en minerales de torio en cantidades tan pequeñas como un séptimo de gramo por tonelada de uraninita. El radio no es necesario para los organismos vivos , y su radiactividad y reactividad química hacen probable que se produzcan efectos adversos para la salud cuando se incorpora a procesos bioquímicos debido a su imitación química del calcio . A partir de 2014 [actualizar], aparte de su uso en medicina nuclear , el radio no tiene aplicaciones comerciales. Antiguamente, desde los años 1910 hasta los años 1970, se utilizaba como fuente radiactiva para dispositivos radioluminiscentes y también en charlatanería radiactiva por su supuesto poder curativo. Estas aplicaciones han quedado obsoletas debido a la toxicidad del radio; A partir de 2020 [actualizar], se utilizan isótopos menos peligrosos (de otros elementos) en dispositivos radioluminiscentes.
El radio es el metal alcalinotérreo más pesado conocido y es el único miembro radiactivo de su grupo. Sus propiedades físicas y químicas se parecen mucho a las de su congénere más ligero , el bario . [3] (pág. 112)
El radio puro es un metal volátil de color blanco plateado, aunque sus congéneres más claros , el calcio , el estroncio y el bario, tienen un ligero tinte amarillo. [3] (p. 112) Este tinte desaparece rápidamente al exponerse al aire, produciendo una capa negra de lo que probablemente sea nitruro de radio (Ra 3 N 2 ). [4] (p 4) Su punto de fusión es 700 °C (1292 °F) o 960 °C (1760 °F) [a] y su punto de ebullición es 1737 °C (3159 °F); sin embargo, esto no está bien establecido. [5] Ambos valores son ligeramente más bajos que los del bario, lo que confirma tendencias periódicas hacia la baja en los elementos del grupo 2. [6] Al igual que el bario y los metales alcalinos , el radio cristaliza en la estructura cúbica centrada en el cuerpo a temperatura y presión estándar : la distancia del enlace radio-radio es de 514,8 picómetros . [7] El radio tiene una densidad de 5,5 g/cm 3 , superior a la del bario, lo que confirma nuevamente las tendencias periódicas; la relación de densidad de radio-bario es comparable a la relación de masa atómica de radio-bario, [8] debido a las estructuras cristalinas similares de los dos elementos. [8] [9]
El radio tiene 33 isótopos conocidos, con números de masa de 202 a 234: todos ellos son radiactivos . [1] Cuatro de ellos – 223 Ra ( vida media de 11,4 días), 224 Ra (3,64 días), 226 Ra (1600 años) y 228 Ra (5,75 años) – ocurren naturalmente en las cadenas de desintegración del torio-232 primordial. , uranio-235 y uranio-238 ( 223 Ra de uranio-235, 226 Ra de uranio-238 y los otros dos de torio-232). Sin embargo, estos isótopos todavía tienen vidas medias demasiado cortas para ser radionucleidos primordiales y sólo existen en la naturaleza a partir de estas cadenas de desintegración. [4] (p 3) Junto con el 225 Ra (15 días), en su mayoría artificial , que se produce en la naturaleza sólo como producto de la desintegración de diminutas trazas de neptunio-237 , [10] estos son los cinco isótopos más estables del radio. [1] Los otros 27 isótopos de radio conocidos tienen vidas medias inferiores a dos horas, y la mayoría tienen vidas medias inferiores a un minuto. [1] De estos, 221 Ra (vida media de 28 s) también ocurre como un hijo de 237 Np, y 220 Ra y 222 Ra serían producidos por la doble desintegración beta aún no observada de los isótopos naturales del radón. [11] Se han informado al menos 12 isómeros nucleares ; el más estable de ellos es el radio-205m, con una vida media de entre 130 y 230 milisegundos; esto es todavía más corto que veinticuatro isótopos de radio en estado fundamental . [1]
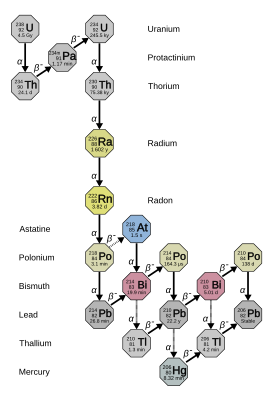
En los inicios de la historia del estudio de la radiactividad, los diferentes isótopos naturales del radio recibían nombres diferentes. En este esquema, 223 Ra se denominó actinio X (AcX), 224 Ra torio X (ThX), 226 Ra radio (Ra) y 228 Ra mesotorio 1 (MsTh 1 ). [4] (p. 3) Cuando se dio cuenta de que todos estos son isótopos del mismo elemento, muchos de estos nombres cayeron en desuso y "radio" pasó a referirse a todos los isótopos, no solo al 226 Ra. Algunos de los productos de desintegración del radio-226 recibieron nombres históricos, incluido "radio", que van desde radio A hasta radio G , y la letra indica aproximadamente qué tan lejos estaban en la cadena de su padre 226 Ra: Emanación de radio = 222 Rn, Ra A = 218 Po, Ra B = 214 Pb, Ra C = 214 Bi, Ra C 1 = 214 Po, Ra C 2 = 210 Tl, Ra D = 210 Pb, Ra E = 210 Bi, Ra F = 210 Po y Ra G = 206 libras. [12]
226 Ra es el isótopo más estable del radio y es el último isótopo de la cadena de desintegración (4 n + 2) del uranio-238 con una vida media de más de un milenio: constituye casi todo el radio natural. Su producto de desintegración inmediata es el denso gas noble radiactivo radón (específicamente el isótopo 222 Rn ), que es responsable de gran parte del peligro del radio ambiental. [13] Es 2,7 millones de veces más radiactivo que la misma cantidad molar de uranio natural (principalmente uranio-238), debido a su vida media proporcionalmente más corta. [14] [15]
Una muestra de radio metálico se mantiene a una temperatura más alta que su entorno debido a la radiación que emite: partículas alfa , partículas beta y rayos gamma . Más concretamente, el radio natural (que es principalmente 226 Ra) emite mayoritariamente partículas alfa, pero otros pasos de su cadena de desintegración (las series del uranio o del radio ) emiten partículas alfa o beta, y casi todas las emisiones de partículas van acompañadas de rayos gamma. [dieciséis]
En 2013, se descubrió en el CERN que el núcleo del radio-224 tiene forma de pera mediante una técnica llamada excitación de culombio . Este fue el primer descubrimiento de un núcleo asimétrico. [17] Esta es una fuerte evidencia circunstancial de que ciertos núcleos atómicos pesados e inestables tienen núcleos distorsionados, en este caso, en forma de pera. [18]
El radio, como el bario, es un metal altamente reactivo y siempre exhibe su estado de oxidación de grupo de +2. [4] (p 4) Forma el catión incoloro Ra 2+ en solución acuosa , que es muy básico y no forma complejos fácilmente. [4] (p 4) Por lo tanto, la mayoría de los compuestos de radio son compuestos iónicos simples, [4] (p 4) aunque se espera la participación de los electrones 6s y 6p (además de los electrones de valencia 7s) debido a efectos relativistas y mejoraría la carácter covalente de compuestos de radio como Ra F 2 y Ra At 2 . [19] Por esta razón, el potencial del electrodo estándar para la semirreacción Ra 2+ (aq) + 2e − → Ra (s) es −2,916 V , incluso ligeramente inferior al valor −2,92 V para el bario, mientras que los valores previamente había aumentado suavemente hacia abajo en el grupo (Ca: −2,84 V; Sr: −2,89 V; Ba: −2,92 V). [3] (p. 111) Los valores de bario y radio son casi exactamente los mismos que los de los metales alcalinos más pesados potasio , rubidio y cesio . [3] (pág. 111)
Los compuestos sólidos de radio son blancos ya que los iones de radio no proporcionan una coloración específica, pero gradualmente se vuelven amarillos y luego se oscurecen con el tiempo debido a la autoradiólisis debido a la desintegración alfa del radio . [4] (p. 4) Los compuestos de radio insolubles coprecipitan con todos los compuestos de bario, la mayoría de los de estroncio y la mayoría de los compuestos de plomo . [4] (pág. 8)
El óxido de radio (RaO) no se ha caracterizado mucho después de su existencia, a pesar de que los óxidos son compuestos comunes para otros metales alcalinotérreos. El hidróxido de radio (Ra(OH) 2 ) es el más fácilmente soluble entre los hidróxidos alcalinotérreos y es una base más fuerte que su congénere de bario, el hidróxido de bario . [4] (págs. 4-8) También es más soluble que el hidróxido de actinio y el hidróxido de torio : estos tres hidróxidos adyacentes pueden separarse precipitándolos con amoníaco . [4] (págs. 4 a 8)
El cloruro de radio (RaCl 2 ) es un compuesto luminoso e incoloro. Se vuelve amarillo después de un tiempo debido al auto daño causado por la radiación alfa emitida por el radio cuando se descompone. Pequeñas cantidades de impurezas de bario dan al compuesto un color rosa. [4] (págs. 4-8) Es soluble en agua, aunque menos que el cloruro de bario , y su solubilidad disminuye al aumentar la concentración de ácido clorhídrico . La cristalización en solución acuosa da el dihidrato RaCl 2 ·2H 2 O, isomorfo con su análogo de bario. [4] (págs. 4 a 8)
El bromuro de radio (RaBr 2 ) también es un compuesto luminoso e incoloro. [4] (págs. 4–8) En agua, es más soluble que el cloruro de radio. Al igual que el cloruro de radio, la cristalización en una solución acuosa da el dihidrato RaBr 2 ·2H 2 O, isomorfo con su análogo de bario. La radiación ionizante emitida por el bromuro de radio excita las moléculas de nitrógeno en el aire, haciéndolo brillar. Las partículas alfa emitidas por el radio ganan rápidamente dos electrones para convertirse en helio neutro , que se acumula en el interior y debilita los cristales de bromuro de radio. Este efecto hace que en ocasiones los cristales se rompan o incluso exploten. [4] (págs. 4 a 8)
El nitrato de radio (Ra(NO 3 ) 2 ) es un compuesto blanco que se puede preparar disolviendo carbonato de radio en ácido nítrico . A medida que aumenta la concentración de ácido nítrico, disminuye la solubilidad del nitrato de radio, una propiedad importante para la purificación química del radio. [4] (págs. 4 a 8)
El radio forma las mismas sales insolubles que su congénere más ligero, el bario: forma sulfato insoluble (RaSO 4 , el sulfato más insoluble conocido), cromato (RaCrO 4 ), carbonato (RaCO 3 ), yodato (Ra(IO 3 ) 2 ). , tetrafluoroberillato (RaBeF 4 ) y nitrato (Ra(NO 3 ) 2 ). Con la excepción del carbonato, todos ellos son menos solubles en agua que las correspondientes sales de bario, pero todos son isoestructurales con respecto a sus homólogos de bario. Además, el fosfato, el oxalato y el sulfito de radio probablemente también sean insolubles, ya que coprecipitan con las correspondientes sales de bario insolubles. [4] (págs. 8-9) La gran insolubilidad del sulfato de radio (a 20 °C, sólo se disolverán 2,1 mg en 1 kg de agua) significa que es uno de los compuestos de radio biológicamente menos peligrosos. [4] (p. 12) El gran radio iónico de Ra 2+ (148 pm) da como resultado una complejación débil y una extracción deficiente de radio de soluciones acuosas cuando no se encuentra a un pH alto. [20]
Todos los isótopos del radio tienen vidas medias mucho más cortas que la edad de la Tierra , de modo que cualquier radio primordial se habría desintegrado hace mucho tiempo. Sin embargo, el radio todavía se encuentra en el medio ambiente , ya que los isótopos 223 Ra, 224 Ra, 226 Ra y 228 Ra forman parte de las cadenas de desintegración de los isótopos naturales de torio y uranio; Dado que el torio y el uranio tienen vidas medias muy largas, estas hijas se regeneran continuamente mediante su desintegración. [4] (p 3) De estos cuatro isótopos, el de vida más larga es el 226 Ra (vida media de 1600 años), un producto de la desintegración del uranio natural. Debido a su relativa longevidad, 226 Ra es el isótopo más común del elemento y constituye aproximadamente una parte por billón de la corteza terrestre; Básicamente, todo el radio natural es 226 Ra. [3] (págs. 109-110) Así, el radio se encuentra en pequeñas cantidades en el mineral de uranio uraninita y en varios otros minerales de uranio , y en cantidades aún más pequeñas en los minerales de torio. Una tonelada de pechblenda normalmente produce aproximadamente una séptima parte de un gramo de radio. [21] Un kilogramo de la corteza terrestre contiene alrededor de 900 picogramos de radio, y un litro de agua de mar contiene alrededor de 89 femtogramos de radio. [22]


El radio fue descubierto por Marie Skłodowska-Curie y su marido Pierre Curie el 21 de diciembre de 1898, en una muestra de uraninita (pechblenda) procedente de Jáchymov . [23] Mientras estudiaban el mineral anteriormente, los Curie extrajeron uranio y descubrieron que el material restante todavía era radiactivo. En julio de 1898, mientras estudiaban la pechblenda, aislaron un elemento similar al bismuto que resultó ser polonio . Luego aislaron una mezcla radiactiva que constaba de dos componentes: compuestos de bario , que daban a la llama un color verde brillante, y compuestos radiactivos desconocidos que daban líneas espectrales de color carmín que nunca antes se habían documentado. Los Curie descubrieron que los compuestos radiactivos eran muy similares a los compuestos de bario, excepto que eran menos solubles. Este descubrimiento permitió a los Curie aislar los compuestos radiactivos y descubrir un nuevo elemento en ellos. Los Curie anunciaron su descubrimiento a la Academia de Ciencias de Francia el 26 de diciembre de 1898. [24] [25] El nombre del radio data aproximadamente de 1899, de la palabra francesa radio , formada en latín moderno a partir de radio ( rayo ): esto fue en reconocimiento del poder del radio para emitir energía en forma de rayos. [26] [27] [28]
En septiembre de 1910, Marie Curie y André-Louis Debierne anunciaron que habían aislado el radio como metal puro mediante la electrólisis de una solución de cloruro de radio puro (RaCl 2 ) utilizando un cátodo de mercurio , produciendo una amalgama de radio-mercurio . [29] Esta amalgama luego se calentó en una atmósfera de gas hidrógeno para eliminar el mercurio, dejando radio metálico puro. [30] Más tarde, ese mismo año, E. Eoler aisló el radio mediante descomposición térmica de su azida , Ra(N 3 ) 2 . [4] (p 3) El radio metálico fue producido industrialmente por primera vez a principios del siglo XX por Biraco , una filial de Union Minière du Haut Katanga (UMHK) en su planta de Olen en Bélgica. [31]
La unidad histórica general para la radiactividad, el curie , se basa en la radiactividad del 226 Ra: originalmente se definió como la radiactividad de un gramo de radio-226, [32] pero la definición se perfeccionó ligeramente más tarde para ser3,7 × 10 10 desintegraciones por segundo .

El radio se utilizaba antiguamente en pinturas autoluminosas para relojes, paneles nucleares, interruptores de aviones, relojes y diales de instrumentos. Un reloj autoluminoso típico que utiliza pintura con radio contiene alrededor de 1 microgramo de radio. [33] A mediados de la década de 1920, cinco " Radium Girls " moribundas, pintoras de esferas que habían pintado pintura luminosa a base de radio en las esferas de relojes, presentaron una demanda contra la United States Radium Corporation . Los pintores de esferas recibieron instrucciones de lamer sus pinceles para darles una punta fina, ingiriendo así radio. [34] Su exposición al radio causó graves efectos en la salud que incluyeron llagas, anemia y cáncer de huesos . [13]
Durante el litigio, se determinó que los científicos y la dirección de la empresa habían tomado precauciones considerables para protegerse de los efectos de la radiación, pero no parecían proteger a sus empleados. Además, durante varios años las empresas habían intentado encubrir los efectos y evitar responsabilidades insistiendo en que las Radium Girls padecían sífilis . Este total desprecio por el bienestar de los empleados tuvo un impacto significativo en la formulación de la legislación laboral sobre enfermedades profesionales . [35]
Como resultado de la demanda, los efectos adversos de la radiactividad se hicieron ampliamente conocidos y los pintores con esferas de radio recibieron instrucciones sobre las precauciones de seguridad adecuadas y se les proporcionó equipo de protección. En particular, los pintores de esferas ya no lamían los pinceles para darles forma (lo que provocaba cierta ingestión de sales de radio). El radio todavía se utilizaba en las esferas hasta la década de 1960, pero los pintores de esferas no sufrieron más lesiones. Esto destacó que el daño a las Radium Girls podría haberse evitado fácilmente. [36]
A partir de la década de 1960 se suspendió el uso de pintura con radio. En muchos casos se implementaron esferas luminosas con materiales fluorescentes no radiactivos excitados por la luz; Estos dispositivos brillan en la oscuridad después de la exposición a la luz, pero el brillo se desvanece. [13] Cuando se requería una luminosidad propia duradera en la oscuridad, se utilizaba pintura radiactiva de prometio -147 (vida media de 2,6 años) o tritio (vida media de 12 años); ambos continúan utilizándose desde 2004. [37] Estos tenían la ventaja adicional de no degradar el fósforo con el tiempo, a diferencia del radio. [38] El tritio emite radiación beta de muy baja energía (incluso de menor energía que la radiación beta emitida por el prometio) [39] que no puede penetrar la piel, [40] en lugar de la radiación gamma penetrante del radio, y se considera más seguro. . [41]
Los relojes, relojes e instrumentos que datan de la primera mitad del siglo XX, a menudo con aplicaciones militares, pueden haber sido pintados con pintura luminosa radiactiva. Generalmente ya no son luminosos; sin embargo, esto no se debe a la desintegración radiactiva del radio (que tiene una vida media de 1600 años), sino a que la fluorescencia del medio fluorescente de sulfuro de zinc se desgasta por la radiación del radio. [42] La aparición de una capa, a menudo gruesa, de pintura verde o marrón amarillenta en los dispositivos de este período sugiere un peligro radiactivo. La dosis de radiación de un dispositivo intacto es relativamente baja y normalmente no representa un riesgo agudo; pero la pintura es peligrosa si se libera y se inhala o ingiere. [5] [43]
El radio alguna vez fue un aditivo en productos como pasta de dientes, cremas para el cabello e incluso alimentos debido a sus supuestos poderes curativos. [44] Estos productos pronto pasaron de moda y fueron prohibidos por las autoridades de muchos países después de que se descubrió que podían tener graves efectos adversos para la salud. (Véase, por ejemplo, los tipos Radithor o Revigator de "agua con radio" o "Solución estándar de radio para beber".) [42] Los spas que ofrecen agua rica en radio todavía se promocionan ocasionalmente como beneficiosos, como los de Misasa, Tottori , Japón. . En los EE. UU., la irradiación nasal con radio también se administró a niños para prevenir problemas del oído medio o agrandamiento de las amígdalas desde finales de los años 1940 hasta principios de los 1970. [45]

El radio (normalmente en forma de cloruro de radio o bromuro de radio ) se utilizaba en medicina para producir gas radón, que a su vez se utilizaba como tratamiento contra el cáncer ; por ejemplo, varias de estas fuentes de radón se utilizaron en Canadá en las décadas de 1920 y 1930. [5] [46] Sin embargo, muchos tratamientos que se usaban a principios de 1900 ya no se usan debido a los efectos nocivos que causaba la exposición al bromuro de radio. Algunos ejemplos de estos efectos son la anemia , el cáncer y las mutaciones genéticas . [47] A partir de 2011 [actualizar], se suelen utilizar emisores gamma más seguros, como el 60 Co , que es menos costoso y está disponible en mayores cantidades, para reemplazar el uso histórico de radio en esta aplicación. [20]
A principios del siglo XX, los biólogos utilizaban el radio para inducir mutaciones y estudiar la genética . Ya en 1904, Daniel MacDougal utilizó radio en un intento de determinar si podía provocar grandes mutaciones repentinas y provocar cambios evolutivos importantes. Thomas Hunt Morgan utilizó radio para inducir cambios que dieron como resultado moscas de la fruta de ojos blancos. El biólogo ganador del Nobel Hermann Muller estudió brevemente los efectos del radio en las mutaciones de la mosca de la fruta antes de recurrir a experimentos de rayos X más asequibles. [48]
Howard Atwood Kelly , uno de los médicos fundadores del Hospital Johns Hopkins , fue un gran pionero en el uso médico del radio para tratar el cáncer. [49] Su primer paciente fue su propia tía en 1904, quien murió poco después de la cirugía. [50] Se sabía que Kelly usaba cantidades excesivas de radio para tratar varios cánceres y tumores. Como resultado, algunos de sus pacientes murieron por exposición al radio. [51] Su método de aplicación de radio consistía en insertar una cápsula de radio cerca del área afectada y luego coser los "puntos" de radio directamente al tumor . [51] Este fue el mismo método utilizado para tratar a Henrietta Lacks , la huésped de las células HeLa originales , para el cáncer de cuello uterino . [52] A partir de 2015, en su lugar se utilizan radioisótopos más seguros y disponibles. [13]

El uranio no tenía aplicaciones a gran escala a finales del siglo XIX y, por tanto, no existían grandes minas de uranio. Al principio, la única fuente importante de mineral de uranio eran las minas de plata de Jáchymov , Austria-Hungría (ahora República Checa ). [23] El mineral de uranio era sólo un subproducto de las actividades mineras. [53]
En la primera extracción de radio, Curie utilizó los residuos de la extracción de uranio de la pechblenda. El uranio se extrajo mediante disolución en ácido sulfúrico , dejando sulfato de radio, que es similar al sulfato de bario pero aún menos soluble en los residuos. Los residuos también contenían cantidades bastante importantes de sulfato de bario que actuaba así como vehículo para el sulfato de radio. Los primeros pasos del proceso de extracción del radio implicaron hervir con hidróxido de sodio, seguido de un tratamiento con ácido clorhídrico para minimizar las impurezas de otros compuestos. Luego, el residuo restante se trató con carbonato de sodio para convertir el sulfato de bario en carbonato de bario (que transporta el radio), haciéndolo así soluble en ácido clorhídrico. Después de la disolución, el bario y el radio se volvieron a precipitar en forma de sulfatos; Luego se repitió esto para purificar aún más el sulfato mixto. Algunas impurezas que forman sulfuros insolubles se eliminaron tratando la solución de cloruro con sulfuro de hidrógeno y luego filtrando. Cuando los sulfatos mixtos estuvieron lo suficientemente puros, se convirtieron una vez más en cloruros mixtos; Posteriormente, el bario y el radio se separaron mediante cristalización fraccionada mientras se controlaba el progreso mediante un espectroscopio (el radio produce líneas rojas características en contraste con las líneas verdes del bario) y el electroscopio . [54]
Después del aislamiento del radio por parte de Marie y Pierre Curie del mineral de uranio de Jáchymov , varios científicos comenzaron a aislar radio en pequeñas cantidades. Posteriormente, pequeñas empresas compraron residuos de las minas de Jáchymov y comenzaron a aislar el radio. En 1904, el gobierno austriaco nacionalizó las minas y dejó de exportar mineral en bruto. Hasta 1912, cuando aumentó la producción de radio, la disponibilidad de radio era baja. [53]
La formación de un monopolio austriaco y la fuerte necesidad de otros países de tener acceso al radio llevaron a una búsqueda mundial de minerales de uranio. Estados Unidos asumió el liderazgo como productor a principios de la década de 1910. Las arenas de carnotita en Colorado proporcionan parte del elemento, pero se encuentran minerales más ricos en el Congo y en el área del Great Bear Lake y el Great Slave Lake en el noroeste de Canadá. Ninguno de los depósitos se explota en busca de radio, pero el contenido de uranio hace que la minería sea rentable. [23] [55]
El proceso de Curie todavía se utilizaba para la extracción industrial de radio en 1940, pero luego se utilizaban bromuros mixtos para el fraccionamiento. Si el contenido de bario del mineral de uranio no es lo suficientemente alto, es fácil añadir algo para transportar el radio. Estos procesos se aplicaron a minerales de uranio de alta ley, pero es posible que no funcionen bien con minerales de baja ley. [56]
Todavía se extraían pequeñas cantidades de radio del mineral de uranio mediante este método de precipitación mixta e intercambio iónico hasta la década de 1990 [3] (págs. 109-110) , pero a partir de 2011, se extraen únicamente del combustible nuclear gastado. [42] (p437) En 1954, el suministro mundial total de radio purificado ascendía a aproximadamente 5 libras (2,3 kg) [33] y todavía se encuentra en este rango en 2015, mientras que la producción anual de compuestos de radio puro es solo de aproximadamente 100 g en total en 1984. [3] (págs. 109-110) Los principales países productores de radio son Bélgica, Canadá, la República Checa, Eslovaquia, el Reino Unido y Rusia. [3] (págs. 109-110) Las cantidades de radio producidas fueron y son siempre relativamente pequeñas; por ejemplo, en 1918 se produjeron en Estados Unidos 13,6 g de radio. [57] El metal se aísla reduciendo óxido de radio con aluminio metálico en el vacío a 1200 °C. [20]
El radio se utiliza cada vez más en el campo de la física atómica, molecular y óptica . Las fuerzas de ruptura de simetría escalan proporcionalmente a [58] [59] , lo que hace que el radio, el elemento alcalinotérreo más pesado, sea muy adecuado para limitar la nueva física más allá del modelo estándar . Algunos isótopos de radio, como el radio-225, tienen dobletes de paridad deformados en octupolo que mejoran la sensibilidad a la paridad de carga, violando la nueva física en dos o tres órdenes de magnitud en comparación con 199 Hg. [60] [61] [62]
El radio también es un candidato prometedor para los relojes ópticos de iones atrapados . El ion radio tiene dos transiciones de ancho de línea de subhercios desde el estado fundamental que podrían servir como transición de reloj en un reloj óptico. [63] Se ha demostrado un reloj atómico de iones atrapados de 226 Ra+ en la transición a . [64] Además, el radio es particularmente adecuado para un reloj óptico transportable, ya que todas las transiciones necesarias para el funcionamiento del reloj pueden abordarse con láseres de diodo directos en longitudes de onda comunes.
Algunos de los pocos usos prácticos del radio se derivan de sus propiedades radiactivas. Los radioisótopos descubiertos más recientemente , como el cobalto-60 y el cesio-137 , están reemplazando al radio incluso en estos usos limitados porque varios de estos isótopos son emisores más potentes, más seguros de manipular y disponibles en forma más concentrada. [65] [66]
El isótopo 223 Ra (el cloruro tiene el nombre comercial Xofigo ) [67] fue aprobado por la Administración de Medicamentos y Alimentos de los Estados Unidos en 2013 para su uso en medicina como tratamiento del cáncer de metástasis ósea . [68] [69] La principal indicación del tratamiento con Xofigo es la terapia de metástasis óseas del cáncer de próstata resistente a la castración debido a las características favorables de este radiofármaco emisor alfa. [70] 225 Ra también se ha utilizado en experimentos relacionados con la irradiación terapéutica, ya que es el único isótopo de radio de vida razonablemente larga que no tiene radón como una de sus hijas. [71]
El radio todavía se utiliza en 2007 como fuente de radiación en algunos dispositivos de radiografía industrial para comprobar si hay piezas metálicas defectuosas, de forma similar a las imágenes de rayos X. [13] Cuando se mezcla con berilio , el radio actúa como fuente de neutrones . [42] [72] A partir de 2004 [actualizar], las fuentes de neutrones de radio-berilio todavía se utilizan a veces, [13] [73] pero otros materiales como el polonio son más comunes: alrededor de 1.500 fuentes de neutrones de polonio-berilio, con una actividad individual de 1.850 Ci (68 TBq), se han utilizado anualmente en Rusia . Estas fuentes de neutrones (α, n) basadas en RaBeF 4 han quedado obsoletas a pesar de la gran cantidad de neutrones que emiten (1,84 × 10 6 neutrones por segundo) en favor de fuentes de 241 Am –Be. [20] A partir de 2011 [actualizar], el isótopo 226 Ra se utiliza principalmente para formar 227 Ac mediante irradiación de neutrones en un reactor nuclear. [20]
El radio es altamente radiactivo, al igual que su producto de desintegración inmediata, el gas radón . Cuando se ingiere, el 80% del radio ingerido sale del cuerpo a través de las heces , mientras que el otro 20% pasa al torrente sanguíneo , acumulándose en su mayor parte en los huesos. Esto se debe a que el cuerpo trata el radio como calcio y lo deposita en los huesos , donde la radioactividad degrada la médula y puede mutar las células óseas . La exposición al radio, interna o externa, puede causar cáncer y otros trastornos, porque el radio y el radón emiten rayos alfa y gamma al descomponerse, que matan y mutan las células. [13] En el momento del Proyecto Manhattan en 1944, la "dosis de tolerancia" para los trabajadores se fijó en 0,1 microgramos de radio ingerido. [74] [75]
Algunos de los efectos biológicos del radio incluyen el primer caso de "dermatitis por radio", informado en 1900, dos años después del descubrimiento del elemento. El físico francés Antoine Becquerel llevó una pequeña ampolla de radio en el bolsillo de su chaleco durante seis horas y informó que su piel se ulceró . Pierre y Marie Curie estaban tan intrigados por la radiación que sacrificaron su propia salud para aprender más sobre ella. Pierre Curie colocó un tubo lleno de radio en su brazo durante diez horas, lo que provocó la aparición de una lesión en la piel, sugiriendo el uso de radio para atacar el tejido canceroso como había atacado el tejido sano. [76] Se ha atribuido la muerte de Marie Curie a la manipulación del radio, debido a una anemia aplásica . Una cantidad significativa del peligro del radio proviene de su hijo el radón: al ser un gas, puede ingresar al cuerpo mucho más fácilmente que su padre, el radio. [13]
A partir de 2015 [actualizar], el 226 Ra se considera el más tóxico de los radioelementos en cantidad y debe manipularse en cajas de guantes herméticas con una circulación de aire significativa que luego se trata para evitar el escape de su hijo 222 Rn al medio ambiente. Las ampollas viejas que contienen soluciones de radio deben abrirse con cuidado porque la descomposición radiolítica del agua puede producir una sobrepresión de hidrógeno y oxígeno. [20] La concentración más grande del mundo de 226 Ra se almacena dentro de la Estructura Provisional de Contención de Residuos , aproximadamente a 9,6 millas (15,4 km) al norte de las Cataratas del Niágara, Nueva York . [77] El nivel máximo de contaminante (MCL) para el radio es 5pCi/L para el agua potable; sin embargo, la OSHA no establece un límite de exposición, ya que ya existe un límite de radiación establecido. [78]
{{cite magazine}}: Mantenimiento CS1: URL no apta ( enlace ){{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace ) Mantenimiento CS1: nombres numéricos: lista de autores ( enlace )