

El control biológico o biocontrol es un método de control de plagas , ya sean animales plaga como insectos y ácaros , malezas o patógenos que afectan a animales o plantas mediante el uso de otros organismos . [1] Se basa en la depredación , el parasitismo , la herbivoría u otros mecanismos naturales, pero normalmente también implica un papel activo de gestión humana. Puede ser un componente importante de los programas de manejo integrado de plagas (MIP).
Existen tres estrategias básicas para el control biológico: clásica (importación), en la que se introduce un enemigo natural de una plaga con la esperanza de lograr su control; inductiva (aumento), en la que se administra una gran población de enemigos naturales para un control rápido de la plaga; e inoculativa (conservación), en la que se toman medidas para mantener a los enemigos naturales mediante el restablecimiento regular. [2]
Los enemigos naturales de los insectos desempeñan un papel importante a la hora de limitar la densidad de plagas potenciales. Entre los agentes de control biológico, se encuentran los depredadores , los parasitoides , los patógenos y los competidores . Los agentes de control biológico de las enfermedades de las plantas se denominan con mayor frecuencia antagonistas. Entre los agentes de control biológico de las malezas se encuentran los depredadores de semillas, los herbívoros y los patógenos de las plantas.
El control biológico puede tener efectos secundarios sobre la biodiversidad a través de ataques a especies no objetivo mediante cualquiera de los mecanismos mencionados anteriormente, especialmente cuando una especie se introduce sin una comprensión profunda de las posibles consecuencias.
El término "control biológico" fue utilizado por primera vez por Harry Scott Smith en la reunión de 1919 de la Pacific Slope Branch de la Asociación Estadounidense de Entomólogos Económicos, en Riverside, California . [3] Su uso fue más generalizado por el entomólogo Paul H. DeBach (1914-1993), quien trabajó en plagas de cultivos de cítricos durante toda su vida. [4] [5] Sin embargo, la práctica ya se ha utilizado durante siglos. El primer informe del uso de una especie de insecto para controlar una plaga de insectos proviene de " Nanfang Caomu Zhuang " (南方草木狀Plantas de las regiones del sur ) ( c. 304 d. C. ), atribuido al botánico de la dinastía Jin occidental Ji Han (嵇含, 263-307), en el que se menciona que " la gente Jiaozhi vende hormigas y sus nidos adheridos a ramitas que parecen sobres finos de algodón, siendo la hormiga de color amarillo rojizo más grande de lo normal. Sin tales hormigas, los frutos cítricos del sur se verán gravemente dañados por los insectos ". [6] Las hormigas utilizadas se conocen como hormigas huang gan ( huang = amarillas, gan = cítricos) ( Oecophylla smaragdina ). La práctica fue reportada posteriormente por Ling Biao Lu Yi (finales de la dinastía Tang o principios de las Cinco Dinastías ), en Ji Le Pian por Zhuang Jisu ( dinastía Song del Sur ), en el Libro de la Plantación de Árboles por Yu Zhen Mu ( dinastía Ming ), en el libro Guangdong Xing Yu (siglo XVII), Lingnan por Wu Zhen Fang (dinastía Qing), en Nanyue Miscellanies por Li Diao Yuan y otros. [6]
Las técnicas de control biológico tal como las conocemos hoy en día comenzaron a surgir en la década de 1870. Durante esta década, en los EE. UU., el entomólogo del estado de Missouri CV Riley y el entomólogo del estado de Illinois W. LeBaron comenzaron la redistribución dentro del estado de parasitoides para controlar las plagas de los cultivos. El primer envío internacional de un insecto como agente de control biológico lo realizó Charles V. Riley en 1873, enviando a Francia los ácaros depredadores Tyroglyphus phylloxera para ayudar a combatir la filoxera de la vid ( Daktulosphaira vitifoliae ) que estaba destruyendo las vides en Francia. El Departamento de Agricultura de los Estados Unidos (USDA) inició la investigación en control biológico clásico luego del establecimiento de la División de Entomología en 1881, con CV Riley como Jefe. La primera importación de una avispa parasitoidal a los Estados Unidos fue la del bracónido Cotesia glomerata en 1883-1884, importado de Europa para controlar la mariposa blanca de la col invasora, Pieris rapae . En 1888-1889, el escarabajo vedalia, Novius cardinalis , una mariquita, fue introducido desde Australia a California para controlar la cochinilla algodonosa, Icerya purchasi . Esto se había convertido en un problema importante para la industria de cítricos recientemente desarrollada en California, pero a fines de 1889, la población de cochinilla algodonosa ya había disminuido. Este gran éxito condujo a más introducciones de insectos beneficiosos en los EE. UU. [7] [8]
En 1905, el USDA inició su primer programa de control biológico a gran escala, enviando entomólogos a Europa y Japón para buscar enemigos naturales de la polilla esponjosa, Lymantria dispar dispar , y la polilla de cola marrón, Euproctis chrysorrhoea , plagas invasoras de árboles y arbustos. Como resultado, nueve parasitoides (avispas solitarias) de la polilla esponjosa, siete de la polilla de cola marrón y dos depredadores de ambas polillas se establecieron en los EE. UU. Aunque la polilla esponjosa no fue controlada completamente por estos enemigos naturales, la frecuencia, duración y gravedad de sus brotes se redujeron y el programa se consideró exitoso. Este programa también condujo al desarrollo de muchos conceptos, principios y procedimientos para la implementación de programas de control biológico. [7] [8] [9]

Los cactus de tuna se introdujeron en Queensland , Australia, como plantas ornamentales, a partir de 1788. Se extendieron rápidamente hasta cubrir más de 25 millones de hectáreas de Australia en 1920, aumentando a un ritmo de 1 millón de hectáreas por año. Cavar, quemar y aplastar resultaron ineficaces. Se introdujeron dos agentes de control para ayudar a controlar la propagación de la planta, la polilla del cactus Cactoblastis cactorum y el insecto escama Dactylopius . Entre 1926 y 1931, se distribuyeron decenas de millones de huevos de polilla del cactus en Queensland con gran éxito y, en 1932, la mayoría de las áreas de tuna habían sido destruidas. [10]
El primer caso de control biológico clásico registrado en Canadá involucra a la avispa parasitoidal Trichogramma minutum . William Saunders, un químico capacitado y primer director de las Granjas Experimentales del Dominio, capturó ejemplares de esta avispa en el estado de Nueva York y los liberó en jardines de Ontario en 1882 para controlar al gusano invasor de la grosella Nematus ribesii . Entre 1884 y 1908, el primer entomólogo del Dominio, James Fletcher, continuó introduciendo otros parasitoides y patógenos para el control de plagas en Canadá. [11]
Existen tres estrategias básicas de control biológico de plagas: importación (control biológico clásico), aumento y conservación. [12]
.jpg/440px-Vedalia_Beetle_(15959056801).jpg)
La importación o control biológico clásico implica la introducción de los enemigos naturales de una plaga en un nuevo lugar donde no están presentes de forma natural. Los primeros casos no solían ser oficiales ni se basaban en investigaciones, y algunas especies introducidas se convirtieron en plagas graves. [13]
Para que un agente de control biológico sea más eficaz en el control de una plaga, debe poseer una capacidad de colonización que le permita seguir el ritmo de los cambios en el hábitat en el espacio y el tiempo. El control es mayor si el agente tiene persistencia temporal, de modo que pueda mantener su población incluso en ausencia temporal de la especie objetivo, y si es un forrajeador oportunista, lo que le permite explotar rápidamente una población de plagas. [14]
Uno de los primeros casos exitosos fue el control de la Icerya purchasi (cochinilla algodonosa) en Australia, utilizando un insecto depredador, Rodolia cardinalis (el escarabajo vedalia). Este éxito se repitió en California utilizando el escarabajo y una mosca parasitoidal, Cryptochaetum iceryae . [15] Otros casos exitosos incluyen el control de Antonina graminis en Texas por Neodusmetia sangwani en la década de 1960. [16]
Los daños causados por Hypera postica , el gorgojo de la alfalfa, una grave plaga introducida del forraje, se redujeron sustancialmente gracias a la introducción de enemigos naturales. 20 años después de su introducción, la población de gorgojos en el área de alfalfa tratada contra el gorgojo de la alfalfa en el noreste de los Estados Unidos permaneció un 75 por ciento reducida. [17]

La maleza caimán se introdujo en los Estados Unidos desde América del Sur . Echa raíces en aguas poco profundas, lo que interfiere con la navegación , el riego y el control de inundaciones . El escarabajo pulga de la maleza caimán y otros dos controles biológicos se liberaron en Florida , lo que redujo en gran medida la cantidad de tierra cubierta por la planta. [18] Otra maleza acuática, la salvinia gigante ( Salvinia molesta ) es una plaga grave que cubre los cursos de agua, reduce el flujo de agua y daña a las especies nativas. El control con el gorgojo de la salvinia ( Cyrtobagous salviniae ) y la polilla barrenadora del tallo de la salvinia ( Samea multiplicalis ) es eficaz en climas cálidos, [19] [20] y en Zimbabwe, se obtuvo un control del 99% de la maleza durante un período de dos años. [21]
Las pequeñas avispas parasitoides criadas comercialmente , [12] Trichogramma ostriniae , proporcionan un control limitado y errático del barrenador europeo del maíz ( Ostrinia nubilalis ), una plaga grave. Las formulaciones cuidadosas de la bacteria Bacillus thuringiensis son más efectivas. El control integrado de O. nubilalis que libera Tricogramma brassicae (parasitoide de huevos) y más tarde Bacillus thuringiensis subs. kurstaki (efecto larvicida) reducen los daños de la plaga más que los tratamientos con insecticidas [22].
La población de Levuana iridescens , la polilla de Levuana, una grave plaga del coco en Fiji , fue controlada mediante un programa de control biológico clásico en la década de 1920. [23]

La multiplicación implica la liberación suplementaria de enemigos naturales que se encuentran en una zona determinada, lo que refuerza las poblaciones que se encuentran allí de forma natural. En la liberación inoculativa, se liberan pequeñas cantidades de los agentes de control a intervalos para permitirles reproducirse, con la esperanza de establecer un control a largo plazo y, de ese modo, mantener la plaga a un nivel bajo, lo que constituye una prevención en lugar de una cura. En la liberación inundativa, en cambio, se liberan grandes cantidades con la esperanza de reducir rápidamente una población de plagas dañinas, corrigiendo un problema que ya ha surgido. La multiplicación puede ser eficaz, pero no se garantiza que funcione y depende de los detalles precisos de las interacciones entre cada plaga y el agente de control. [24]
Un ejemplo de liberación inoculativa se da en la producción hortícola de varios cultivos en invernaderos . Se utilizan liberaciones periódicas de la avispa parasitoidal, Encarsia formosa , para controlar la mosca blanca de invernadero [25] , mientras que el ácaro depredador Phytoseiulus persimilis se utiliza para controlar la araña roja de dos manchas [26] .
El parásito de huevos Trichogramma se libera frecuentemente por inundación para controlar polillas dañinas. Ahora se han introducido nuevas formas de liberación por inundación, es decir, el uso de drones. Los parasitoides de huevos pueden encontrar los huevos del huésped objetivo mediante varias señales. Se encontraron kairomonas en las escamas de las polillas. De manera similar, Bacillus thuringiensis y otros insecticidas microbianos se utilizan en cantidades suficientemente grandes para un efecto rápido. [24] Las tasas de liberación recomendadas para Trichogramma en cultivos de hortalizas o de campo varían de 5.000 a 200.000 por acre (1 a 50 por metro cuadrado) por semana según el nivel de infestación de plagas. [27] De manera similar, los nematodos que matan insectos (que son entomopatógenos) se liberan a tasas de millones e incluso miles de millones por acre para el control de ciertas plagas de insectos que habitan en el suelo. [28]
La conservación de los enemigos naturales existentes en un entorno es el tercer método de control biológico de plagas. [29] Los enemigos naturales ya están adaptados al hábitat y a la plaga objetivo, y su conservación puede ser sencilla y rentable, como cuando se cultivan plantas productoras de néctar en los bordes de los arrozales. Estas plantas proporcionan néctar para sustentar a los parasitoides y depredadores de las plagas de cigarras y se ha demostrado que son tan eficaces (reduciendo la densidad de plagas en 10 o incluso 100 veces) que los agricultores rociaron un 70% menos de insecticidas y disfrutaron de rendimientos aumentados en un 5%. [30] De manera similar, se encontró que los depredadores de pulgones estaban presentes en las gramíneas en los setos de los límites de los campos en Inglaterra, pero se propagaban demasiado lentamente para llegar al centro de los campos. El control se mejoró plantando una franja de un metro de ancho de gramíneas en los centros de los campos, lo que permitió que los depredadores de pulgones pasaran el invierno allí. [29]

Los sistemas de cultivo pueden modificarse para favorecer a los enemigos naturales, una práctica a veces denominada manipulación del hábitat. Proporcionar un hábitat adecuado, como un cinturón de protección , un seto vivo o un banco de escarabajos donde los insectos beneficiosos como las avispas parasitoides puedan vivir y reproducirse, puede ayudar a asegurar la supervivencia de las poblaciones de enemigos naturales. Cosas tan simples como dejar una capa de hojas caídas o mantillo en su lugar proporciona una fuente de alimento adecuada para los gusanos y proporciona un refugio para los insectos, que a su vez es una fuente de alimento para mamíferos beneficiosos como los erizos y las musarañas . Las pilas de abono y las pilas de madera pueden proporcionar refugio a los invertebrados y pequeños mamíferos. La hierba alta y los estanques sustentan a los anfibios. No eliminar las plantas anuales muertas y las plantas no resistentes en el otoño permite que los insectos utilicen sus tallos huecos durante el invierno. [31] En California, a veces se plantan árboles de ciruela en los viñedos de uva para proporcionar un hábitat de hibernación mejorado o refugio para un parasitoide clave de las plagas de la uva. [32] También se suele recurrir a la construcción de refugios artificiales en forma de ataúdes, cajas o macetas de madera, sobre todo en jardines, para hacer que una zona cultivada resulte más atractiva para los enemigos naturales. Por ejemplo, las tijeretas son depredadores naturales que se pueden fomentar en los jardines colgando macetas boca abajo llenas de paja o lana de madera . Las crisopas verdes se pueden fomentar utilizando botellas de plástico con el fondo abierto y un rollo de cartón en su interior. Las pajareras permiten a los pájaros insectívoros anidar; se puede atraer a los pájaros más útiles eligiendo una abertura lo suficientemente grande para la especie deseada. [31]
En la producción de algodón, la sustitución de insecticidas de amplio espectro por medidas de control selectivo como el algodón Bt puede crear un entorno más favorable para los enemigos naturales de las plagas del algodón debido a la reducción del riesgo de exposición a los insecticidas. Dichos depredadores o parasitoides pueden controlar plagas no afectadas por la proteína Bt . La reducción de la calidad y abundancia de las presas asociadas con el aumento del control del algodón Bt también puede reducir indirectamente las poblaciones de enemigos naturales en algunos casos, pero el porcentaje de plagas ingeridas o parasitadas en el algodón Bt y en el no Bt suele ser similar. [33]

Los depredadores son principalmente especies de vida libre que consumen directamente una gran cantidad de presas durante toda su vida. Dado que muchas de las principales plagas de los cultivos son insectos, muchos de los depredadores utilizados en el control biológico son especies insectívoras. Las mariquitas , y en particular sus larvas que están activas entre mayo y julio en el hemisferio norte, son voraces depredadores de pulgones , y también consumen ácaros , cochinillas y pequeñas orugas . La mariquita moteada ( Coleomegilla maculata ) también puede alimentarse de los huevos y larvas del escarabajo de la patata ( Leptinotarsa decemlineata ). [34]
Las larvas de muchas especies de sírfidos se alimentan principalmente de pulgones , y una larva puede devorar hasta 400 de ellos a lo largo de su vida. No se ha estudiado su eficacia en cultivos comerciales. [35]
La araña cangrejo corredora Philodromus cespitum también ataca en gran medida a los pulgones y actúa como agente de control biológico en los huertos frutales europeos. [36]

Varias especies de nematodos entomopatógenos son depredadores importantes de insectos y otras plagas de invertebrados. [37] [38] Los nematodos entomopatógenos forman una etapa resistente al estrés conocida como juvenil infectivo. Estos se propagan en el suelo e infectan a los insectos huéspedes adecuados. Al entrar en el insecto se mueven a la hemolinfa donde se recuperan de su estado estancado de desarrollo y liberan sus simbiontes bacterianos . Los simbiontes bacterianos se reproducen y liberan toxinas, que luego matan al insecto huésped. [38] [39] Phasmarhabditis hermaphrodita es un nematodo microscópico que mata babosas. Su complejo ciclo de vida incluye una etapa infecciosa de vida libre en el suelo donde se asocia con una bacteria patógena como Moraxella osloensis . El nematodo entra en la babosa a través de la región del manto posterior, luego se alimenta y se reproduce en el interior, pero son las bacterias las que matan a la babosa. El nematodo está disponible comercialmente en Europa y se aplica regando sobre suelo húmedo. [40] Los nematodos entomopatógenos tienen una vida útil limitada debido a su resistencia limitada a las altas temperaturas y las condiciones secas. [39] El tipo de suelo al que se aplican también puede limitar su eficacia. [38]
Las especies utilizadas para controlar los ácaros araña incluyen los ácaros depredadores Phytoseiulus persimilis , [41] Neoseilus californicus, [42] y Amblyseius cucumeris , el mosquito depredador Feltiella acarisuga , [42] y una mariquita Stethorus punctillum . [42] La chinche Orius insidiosus se ha utilizado con éxito contra el ácaro araña de dos manchas y los trips occidentales de las flores ( Frankliniella occidentalis ). [43]
Los depredadores, como Cactoblastis cactorum (mencionado anteriormente), también pueden utilizarse para destruir especies vegetales invasoras. Como otro ejemplo, la polilla de la cicuta venenosa ( Agonopterix alstroemeriana) puede utilizarse para controlar la cicuta venenosa ( Conium maculatum ). Durante su etapa larvaria, la polilla consume estrictamente su planta huésped, la cicuta venenosa, y puede haber cientos de larvas por planta huésped individual, destruyendo grandes franjas de la cicuta. [44]

Para las plagas de roedores , los gatos son un control biológico eficaz cuando se utilizan junto con la reducción de los lugares de "refugio"/escondite . [46] [47] [48] Si bien los gatos son eficaces para prevenir las "explosiones de población" de roedores , no son eficaces para eliminar infestaciones graves preexistentes. [48] Las lechuzas comunes también se utilizan a veces como control biológico de roedores. [49] Aunque no hay estudios cuantitativos de la eficacia de las lechuzas comunes para este propósito, [50] son depredadores conocidos de roedores que pueden usarse además de o en lugar de los gatos; [51] [52] se los puede alentar a entrar en un área con cajas nido. [53] [54]
En Honduras, donde el mosquito Aedes aegypti transmitía el dengue y otras enfermedades infecciosas, se intentó un control biológico mediante un plan de acción comunitario; se agregaron copépodos , crías de tortuga y tilapia juvenil a los pozos y tanques donde se reproduce el mosquito y se eliminaron las larvas del mosquito. [55]
Incluso entre los artrópodos que generalmente se consideran depredadores obligados de animales (especialmente otros artrópodos), las fuentes de alimento floral ( néctar y en menor grado polen ) son a menudo fuentes complementarias útiles. [56] Se había observado en un estudio [57] que Adalia bipunctata adulta (depredador y biocontrolador común de Ephestia kuehniella ) podría sobrevivir en flores pero nunca completar su ciclo de vida , por lo que se realizó un metaanálisis [56] para encontrar dicha tendencia general en datos publicados previamente, si existía. En algunos casos, los recursos florales son absolutamente necesarios. [56] En general, los recursos florales (y una imitación, es decir, agua azucarada) aumentan la longevidad y la fecundidad , lo que significa que incluso los números de población depredadora pueden depender de la abundancia de alimento que no sea presa. [56] Por lo tanto, el mantenimiento de la población de biocontrol -y el éxito- pueden depender de las flores cercanas. [56]
Los parasitoides ponen sus huevos sobre o dentro del cuerpo de un insecto huésped, que luego se utiliza como alimento para las larvas en desarrollo. El huésped finalmente muere. La mayoría de los parasitoides de insectos son avispas o moscas , y muchas tienen un rango de hospedadores muy estrecho. Los grupos más importantes son las avispas icneumónidas , que utilizan principalmente orugas como huéspedes; las avispas braconidas , que atacan a las orugas y una amplia gama de otros insectos, incluidos los pulgones; las avispas calcidoideas , que parasitan huevos y larvas de muchas especies de insectos; y las moscas taquínidas , que parasitan una amplia gama de insectos, incluidas orugas, adultos y larvas de escarabajos y chinches verdaderas . [58] Los parasitoides son más eficaces para reducir las poblaciones de plagas cuando sus organismos huéspedes tienen refugios limitados para esconderse de ellos. [59]

Los parasitoides se encuentran entre los agentes de control biológico más utilizados. En el ámbito comercial, existen dos tipos de sistemas de cría: sistemas de producción diaria a corto plazo con una alta producción de parasitoides por día y sistemas de producción diaria baja a largo plazo. [60] En la mayoría de los casos, la producción deberá coincidir con las fechas de liberación adecuadas, cuando las especies hospedantes susceptibles en una fase adecuada de desarrollo estén disponibles. [61] Las instalaciones de producción más grandes producen durante todo el año, mientras que algunas instalaciones producen solo estacionalmente. Las instalaciones de cría suelen estar a una distancia significativa de donde se utilizarán los agentes en el campo, y el transporte de los parasitoides desde el punto de producción hasta el punto de uso puede plantear problemas. [62] Las condiciones de envío pueden ser demasiado altas, e incluso las vibraciones de los aviones o camiones pueden afectar negativamente a los parasitoides. [60]
Encarsia formosa es una pequeña avispa parasitoide que ataca a las moscas blancas , insectos que se alimentan de savia y que pueden causar marchitamiento y moho negro en cultivos ornamentales y vegetales de invernadero. Es más eficaz cuando se trata de infestaciones de bajo nivel, brindando protección durante un largo período de tiempo. La avispa pone sus huevos en las "escamas" de las moscas blancas jóvenes, volviéndolas negras a medida que las larvas del parásito pupan. [25] Gonatocerus ashmeadi ( Hymenoptera : Mymaridae ) se ha introducido para controlar la mosca de alas vidriosas Homalodisca vitripennis (Hemiptera: Cicadellidae ) en la Polinesia Francesa y ha controlado con éxito ~ 95% de la densidad de la plaga. [63]
El gusano cogollero del abeto rojo es un ejemplo de insecto destructor en los bosques de abetos y piceas . Las aves son una forma natural de control biológico, pero se ha investigado a la Trichogramma minutum , una especie de avispa parásita, como alternativa a los controles químicos más controvertidos. [64]
Hay una serie de estudios recientes que buscan métodos sostenibles para controlar las cucarachas urbanas utilizando avispas parásitas. [65] [66] Dado que la mayoría de las cucarachas permanecen en el sistema de alcantarillado y áreas protegidas que son inaccesibles a los insecticidas, el empleo de avispas cazadoras activas es una estrategia para tratar de reducir sus poblaciones.
Los microorganismos patógenos incluyen bacterias , hongos y virus . Matan o debilitan a su huésped y son relativamente específicos de él. Varias enfermedades microbianas de los insectos ocurren de forma natural, pero también pueden usarse como pesticidas biológicos . [67] Cuando ocurren de forma natural, estos brotes dependen de la densidad, ya que generalmente solo ocurren cuando las poblaciones de insectos se vuelven más densas. [68]
El uso de patógenos contra las malas hierbas acuáticas era desconocido hasta una propuesta innovadora de 1972 de Zettler y Freeman. Hasta ese momento no se había utilizado ningún tipo de control biológico contra ninguna mala hierba acuática. En su revisión de las posibilidades, señalaron la falta de interés y de información hasta el momento, y enumeraron lo que se sabía sobre las plagas de plagas, ya fueran patógenos o no. Propusieron que esto debería ser relativamente sencillo de aplicar de la misma manera que otros controles biológicos. [69] Y, de hecho, en las décadas posteriores, los mismos métodos de control biológico que son rutinarios en la tierra se han vuelto comunes en el agua.
Las bacterias utilizadas para el control biológico infectan a los insectos a través de sus tractos digestivos, por lo que ofrecen solo opciones limitadas para controlar insectos con partes bucales chupadoras, como pulgones y cochinillas. [70] Bacillus thuringiensis , una bacteria que habita en el suelo, es la especie de bacteria más ampliamente aplicada para el control biológico, con al menos cuatro subespecies utilizadas contra plagas de insectos lepidópteros ( polillas , mariposas ), coleópteros (escarabajos) y dípteros (moscas verdaderas). La bacteria está disponible para los agricultores orgánicos en bolsitas de esporas secas que se mezclan con agua y se rocían sobre plantas vulnerables como las brasicáceas y los árboles frutales . [71] [72] Los genes de B. thuringiensis también se han incorporado a cultivos transgénicos , lo que hace que las plantas expresen algunas de las toxinas de la bacteria, que son proteínas . Estas confieren resistencia a las plagas de insectos y, por lo tanto, reducen la necesidad del uso de pesticidas. [73] Si las plagas desarrollan resistencia a las toxinas de estos cultivos, B. thuringiensis también se volverá inútil en la agricultura orgánica. [74] [72] La bacteria Paenibacillus popilliae , que causa la enfermedad de las esporas lechosas, ha demostrado ser útil para controlar el escarabajo japonés , matando las larvas. Es muy específica de su especie huésped y es inofensiva para los vertebrados y otros invertebrados. [75]
Bacillus spp., [M 1] Pseudomonas fluorescentes , [M 1] y Streptomycetes son controles de varios hongos patógenos. [M 2]
El mayor despliegue de mosquitos A. aegypti infectados con Wolbachia hasta la fecha redujo la incidencia del dengue entre un 94 y un 97 % en las ciudades colombianas de Bello , Medellín e Itagüí . El proyecto fue ejecutado por el Programa Mundial de Mosquitos (WMP, por sus siglas en inglés), una organización sin fines de lucro. La Wolbachia evita que los mosquitos transmitan virus como el dengue y el zika . Los insectos transmiten la bacteria a sus crías. El proyecto cubrió un área combinada de 135 kilómetros cuadrados (52 millas cuadradas), hogar de 3,3 millones de personas. La mayor parte del área del proyecto alcanzó el objetivo de infectar al 60 % de los mosquitos locales. La técnica no está avalada por la OMS. [76]

Los hongos entomopatógenos , que causan enfermedades en los insectos, incluyen al menos 14 especies que atacan a los pulgones . [77] Beauveria bassiana se produce en masa y se utiliza para controlar una amplia variedad de plagas de insectos, incluidas moscas blancas , trips , pulgones y gorgojos . [78] Lecanicillium spp. se utilizan contra moscas blancas, trips y pulgones. Metarhizium spp. se utilizan contra plagas que incluyen escarabajos, langostas y otros saltamontes, hemípteros y ácaros . Paecilomyces fumosoroseus es eficaz contra moscas blancas, trips y pulgones; Purpureocillium lilacinus se utiliza contra nematodos formadores de nudos en las raíces y 89 especies de Trichoderma contra ciertos patógenos de las plantas. [M 3] Trichoderma viride se ha utilizado contra la enfermedad del olmo holandés y ha mostrado cierto efecto en la supresión de la hoja plateada , una enfermedad de las frutas de hueso causada por el hongo patógeno Chondrostereum purpureum . [79]
Los hongos patógenos pueden ser controlados por otros hongos, bacterias o levaduras, como: Gliocladium spp., Pythium spp. micoparásito , tipos binucleados de Rhizoctonia spp. y Laetisaria spp.
Los hongos Cordyceps y Metacordyceps se utilizan contra un amplio espectro de artrópodos. [80] Entomophaga es eficaz contra plagas como el pulgón verde del duraznero . [81]
Se han explorado varios miembros de Chytridiomycota y Blastocladiomycota como agentes de control biológico. [82] [83] De Chytridiomycota, Synchytrium solstitiale se está considerando como un agente de control del cardo estrellado amarillo ( Centaurea solstitialis ) en los Estados Unidos. [84]
Los baculovirus son específicos de especies individuales de insectos hospedantes y se ha demostrado que son útiles en el control biológico de plagas. Por ejemplo, el virus de la polihedrosis nuclear multicápside de Lymantria dispar se ha utilizado para rociar grandes áreas de bosque en América del Norte donde las larvas de la polilla esponjosa están causando una grave defoliación. Las larvas de la polilla mueren a causa del virus que han comido y los cadáveres se desintegran dejando partículas de virus en el follaje que infectan a otras larvas. [85]
El virus de la enfermedad hemorrágica del conejo, un virus de los mamíferos, se introdujo en Australia para intentar controlar las poblaciones de conejos europeos en ese país. [86] Se escapó de la cuarentena y se propagó por todo el país, matando a un gran número de conejos. Los animales muy jóvenes sobrevivieron, transmitiendo inmunidad a su descendencia a su debido tiempo y produciendo finalmente una población resistente al virus. [87] La introducción en Nueva Zelanda en la década de 1990 tuvo un éxito similar al principio, pero una década después, se había desarrollado la inmunidad y las poblaciones habían vuelto a los niveles previos a la enfermedad hemorrágica del conejo. [88]
Los micovirus de ARN son controles de varios hongos patógenos. [M 2]
El Lagenidium giganteum es un moho que se transmite por el agua y que parasita la fase larvaria de los mosquitos. Cuando se aplica al agua, las esporas móviles evitan las especies hospedadoras inadecuadas y buscan hospedadores larvarios de mosquitos adecuados. Este moho tiene las ventajas de una fase latente, resistente a la desecación y con características de liberación lenta durante varios años. Desafortunadamente, es susceptible a muchos productos químicos utilizados en los programas de control de mosquitos. [89]
La planta leguminosa Mucuna pruriens se utiliza en Benín y Vietnam como control biológico de la problemática hierba Imperata cylindrica : esta planta es extremadamente vigorosa y suprime a las plantas vecinas compitiendo por el espacio y la luz. Se dice que Mucuna pruriens no es invasiva fuera de su área cultivada. [90] Desmodium uncinatum se puede utilizar en la agricultura de empuje y tracción para detener la planta parásita , la Striga ( Striga ). [91]
La mosca australiana, Musca vetustissima , es una plaga molesta importante en Australia, pero los descomponedores nativos que se encuentran en Australia no están adaptados a alimentarse de estiércol de vaca, que es donde se reproducen las moscas australianas. Por lo tanto, el Proyecto Australiano del Escarabajo Pelotero (1965-1985), dirigido por George Bornemissza de la Organización de Investigación Científica e Industrial de la Commonwealth , liberó cuarenta y nueve especies de escarabajo pelotero , para reducir la cantidad de estiércol y, por lo tanto, también los posibles sitios de reproducción de la mosca. [92]
En casos de infección masiva y grave de plagas invasoras, a menudo se utilizan técnicas de control de plagas en combinación. Un ejemplo es el barrenador esmeralda del fresno , Agrilus planipennis , un escarabajo invasor de China , que ha destruido decenas de millones de fresnos en su área de introducción en América del Norte . Como parte de la campaña contra él, a partir de 2003 científicos estadounidenses y la Academia China de Silvicultura buscaron a sus enemigos naturales en la naturaleza, lo que llevó al descubrimiento de varias avispas parasitoides, a saber, Tetrastichus planipennisi , un endoparasitoide larvario gregario, Oobius agrili , un parasitoide solitario y partenogénico de huevos, y Spathius agrili , un ectoparasitoide larvario gregario. Estos han sido introducidos y liberados en los Estados Unidos de América como un posible control biológico del barrenador esmeralda del fresno. Los resultados iniciales para Tetrastichus planipennisi han sido prometedores y ahora se está lanzando junto con Beauveria bassiana , un patógeno fúngico con propiedades insecticidas conocidas. [93] [94] [95]
Además, el control biológico de plagas a veces hace uso de defensas de las plantas para reducir el daño a los cultivos causado por los herbívoros. Las técnicas incluyen el policultivo , la plantación conjunta de dos o más especies, como un cultivo primario y una planta secundaria, que también puede ser un cultivo. Esto puede permitir que las sustancias químicas defensivas de la planta secundaria protejan el cultivo plantado con ella. [96]
Botrytis cinerea en lechuga , por Fusarium spp. y Penicillium claviforme , en uva y fresa por Trichoderma spp., en fresa por Cladosporium herbarum , en repollo chino por Bacillus brevis , y en varios otros cultivos por varias levaduras y bacterias. Sclerotinia sclerotiorum por varios biocontroladores fúngicos. Infección fúngica de la vaina de judía verde por Trichoderma hamatum si es anterior o concurrente con la infección. [M 4] Cryphonectria parasitica , Gaeumannomyces graminis , Sclerotinia spp. y Ophiostoma novo-ulmi por virus. [M 2] Varios mildiú polvoroso y royas por varias especies de Bacillus y Pseudomonas fluorescentes . [M 1] Colletotrichum orbiculare suprimirá una mayor infección por sí solo si se manipula para producir resistencia sistémica inducida por la planta al infectar la hoja más baja. [M5]
Muchas de las plagas más importantes son especies exóticas invasoras que afectan gravemente a la agricultura, la horticultura, la silvicultura y los entornos urbanos. Suelen llegar sin sus parásitos, patógenos y depredadores coevolucionados y, al escapar de ellos, las poblaciones pueden aumentar drásticamente. Importar los enemigos naturales de estas plagas puede parecer una medida lógica, pero esto puede tener consecuencias no deseadas ; las regulaciones pueden ser ineficaces y puede haber efectos imprevistos sobre la biodiversidad, y la adopción de las técnicas puede resultar difícil debido a la falta de conocimiento entre los agricultores y productores. [97]
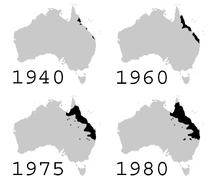
El control biológico puede afectar la biodiversidad [14] a través de la depredación, el parasitismo, la patogenicidad, la competencia u otros ataques a especies no objetivo. [98] Un control introducido no siempre se dirige sólo a las especies plaga previstas; también puede dirigirse a especies nativas. [99] En Hawái, durante la década de 1940, se introdujeron avispas parásitas para controlar una plaga de lepidópteros y aún se encuentran allí hoy en día. Esto puede tener un impacto negativo en el ecosistema nativo; sin embargo, es necesario estudiar el rango de hospedadores y los impactos antes de declarar su impacto en el medio ambiente. [100]
Los animales vertebrados tienden a ser alimentadores generalistas y rara vez son buenos agentes de control biológico; muchos de los casos clásicos de "biocontrol que salió mal" involucran a vertebrados. Por ejemplo, el sapo de caña ( Rhinella marina ) fue introducido intencionalmente en Australia para controlar el escarabajo de caña de lomo gris ( Dermolepida albohirtum ), [101] y otras plagas de la caña de azúcar. 102 Los sapos se obtuvieron de Hawai y se criaron en cautiverio para aumentar su número hasta que fueron liberados en los campos de caña de azúcar del norte tropical en 1935. Más tarde se descubrió que los sapos no podían saltar muy alto y, por lo tanto, no podían comer los escarabajos de caña que permanecían en los tallos superiores de las plantas de caña. Sin embargo, el sapo prosperó alimentándose de otros insectos y pronto se propagó muy rápidamente; se apoderó del hábitat anfibio nativo y trajo enfermedades extranjeras a los sapos y ranas nativos , reduciendo drásticamente sus poblaciones. Además, cuando se lo amenaza o se lo manipula, el sapo de caña libera veneno de las glándulas parótidas que tiene en los hombros; las especies nativas australianas, como las goannas , las serpientes tigre , los dingos y los quolls del norte , que intentaron comer al sapo, resultaron heridas o murieron. Sin embargo, ha habido algunas evidencias recientes de que los depredadores nativos se están adaptando, tanto fisiológicamente como a través de cambios en su comportamiento, por lo que, a largo plazo, sus poblaciones pueden recuperarse. [102]
El gorgojo que se alimenta de semillas, Rhinocyllus conicus , fue introducido en América del Norte para controlar el exótico cardo almizclero ( Carduus nutans ) y el cardo canadiense ( Cirsium arvense ). Sin embargo, el gorgojo también ataca a los cardos nativos, dañando especies como el cardo platte endémico ( Cirsium neomexicanum ) al seleccionar plantas más grandes (lo que redujo el acervo genético), reduciendo la producción de semillas y, en última instancia, amenazando la supervivencia de la especie. [103] De manera similar, el gorgojo Larinus planus también se utilizó para intentar controlar el cardo canadiense , pero también dañó a otros cardos. [104] [105] Esto incluyó una especie clasificada como amenazada. [106]
La pequeña mangosta asiática ( Herpestus javanicus ) fue introducida en Hawái para controlar la población de ratas . Sin embargo, la mangosta era diurna y las ratas salían de noche; por lo tanto, la mangosta se alimentaba de las aves endémicas de Hawái , especialmente de sus huevos , con más frecuencia que de las ratas, y ahora tanto las ratas como las mangostas amenazan a las aves. Esta introducción se llevó a cabo sin comprender las consecuencias de tal acción. No existían regulaciones en ese momento, y una evaluación más cuidadosa debería evitar tales liberaciones ahora. [107]
El robusto y prolífico pez mosquito oriental ( Gambusia holbrooki ) es originario del sureste de los Estados Unidos y fue introducido en todo el mundo en los años 1930 y 1940 para alimentarse de larvas de mosquito y así combatir la malaria . Sin embargo, ha prosperado a expensas de las especies locales, provocando una disminución de los peces y ranas endémicos a través de la competencia por los recursos alimenticios, así como por comer sus huevos y larvas. [108] En Australia, el control del pez mosquito es tema de discusión; en 1989 los investigadores AH Arthington y LL Lloyd afirmaron que "el control biológico de la población está muy por encima de las capacidades actuales". [109]
Un obstáculo potencial para la adopción de medidas de control biológico de plagas es que los productores pueden preferir seguir utilizando los pesticidas con los que están familiarizados. Sin embargo, los pesticidas tienen efectos no deseados, como el desarrollo de resistencia entre las plagas y la destrucción de enemigos naturales; estos efectos pueden, a su vez, favorecer la aparición de plagas de especies distintas a las que se buscaban originalmente y en cultivos alejados de los tratados con pesticidas. [110] Un método para aumentar la adopción de métodos de control biológico por parte de los productores consiste en dejar que aprendan con la práctica, por ejemplo, mostrándoles experimentos de campo sencillos que les permitan observar la depredación en vivo de las plagas, o demostraciones de plagas parasitadas. En Filipinas, las pulverizaciones a principios de temporada contra las orugas de las hojas plegadas eran una práctica común, pero se pidió a los productores que siguieran una "regla general" de no pulverizar contra las orugas plegadoras de las hojas durante los primeros 30 días después del trasplante; la participación en esta práctica dio como resultado una reducción del uso de insecticidas en un tercio y un cambio en la percepción de los productores sobre el uso de insecticidas. [111]
Relacionada con el control biológico de plagas está la técnica de introducir individuos estériles en la población nativa de algún organismo. Esta técnica se practica ampliamente con insectos : una gran cantidad de machos esterilizados por radiación son liberados al ambiente, los cuales proceden a competir con los machos nativos por las hembras. Aquellas hembras que copulan con los machos estériles pondrán huevos infértiles, resultando en una disminución en el tamaño de la población. Con el tiempo, con repetidas introducciones de machos estériles, esto podría resultar en una disminución significativa en el tamaño de la población del organismo. [112] Una técnica similar ha sido aplicada recientemente a las malezas usando polen irradiado, [113] resultando en semillas deformadas que no brotan. [114]
{{cite book}}: |work=ignorado ( ayuda ){{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace ){{cite web}}: CS1 maint: varios nombres: lista de autores ( enlace ){{cite book}}: |journal=ignorado ( ayuda ){{cite book}}: |work=ignorado ( ayuda ){{cite journal}}: Requiere citar revista |journal=( ayuda )