El ozono ( / ˈoʊ z oʊ n / ) (o trioxígeno ) es una molécula inorgánica con la fórmula química O
3Es un gas de color azul pálido con un olor penetrante característico. Es un alótropo del oxígeno mucho menos estable que el alótropo diatómico O
2, descomponiéndose en la atmósfera inferior a O
2( dioxígeno ). El ozono se forma a partir del dioxígeno por la acción de la luz ultravioleta (UV) y las descargas eléctricas dentro de la atmósfera terrestre . Está presente en concentraciones muy bajas en toda la atmósfera, con su concentración más alta en la capa de ozono de la estratosfera , que absorbe la mayor parte de la radiación ultravioleta (UV) del Sol .
El olor del ozono recuerda al cloro y muchas personas lo pueden detectar en concentraciones tan pequeñas como0,1 ppm en el aire. La estructura O 3 del ozono se determinó en 1865. Más tarde se demostró que la molécula tenía una estructura doblada y era débilmente diamagnética . En condiciones estándar , el ozono es un gas azul pálido que se condensa a temperaturas criogénicas en un líquido azul oscuro y finalmente en un sólido violeta-negro . La inestabilidad del ozono con respecto al dioxígeno más común es tal que tanto el ozono gaseoso concentrado como el líquido pueden descomponerse explosivamente a temperaturas elevadas, choque físico o calentamiento rápido hasta el punto de ebullición. [5] [6] Por lo tanto, se utiliza comercialmente solo en bajas concentraciones.
El ozono es un oxidante potente (mucho más que el dioxígeno) y tiene muchas aplicaciones industriales y de consumo relacionadas con la oxidación. Sin embargo, este mismo alto potencial oxidante hace que el ozono dañe los tejidos mucosos y respiratorios de los animales, y también los tejidos de las plantas, en concentraciones superiores a aproximadamente0,1 ppm . Si bien esto convierte al ozono en un potente peligro respiratorio y contaminante cerca del nivel del suelo , una concentración más alta en la capa de ozono (de dos a ocho ppm) es beneficiosa, ya que evita que la dañina luz ultravioleta llegue a la superficie de la Tierra.
El nombre trivial ozono es el nombre IUPAC más comúnmente usado y preferido . Los nombres sistemáticos 2λ 4 -trioxidieno [ dudoso – discutir ] y catena-trioxígeno , nombres IUPAC válidos , se construyen de acuerdo con las nomenclaturas sustitutiva y aditiva , respectivamente. El nombre ozono deriva de ozein (ὄζειν), el participio presente neutro griego para olor, [7] en referencia al olor distintivo del ozono.
En contextos apropiados, el ozono puede considerarse como un trioxidano al que se le han quitado dos átomos de hidrógeno y, como tal, se puede utilizar el trioxidanilideno como nombre sistemático, según la nomenclatura sustitutiva. Por defecto, estos nombres no tienen en cuenta la radicalidad de la molécula de ozono. En un contexto aún más específico, esto también puede nombrar el estado fundamental singlete no radical, mientras que el estado dirradical se denomina trioxidanediilo .
El trioxidanediilo (u ozónido ) se utiliza, de manera no sistemática, para referirse al grupo sustituyente (-OOO-). Se debe tener cuidado de no confundir el nombre del grupo con el nombre específico del contexto para el ozono indicado anteriormente.

.jpg/440px-Smyths_revised_ozonometer,_1865._(9660571191).jpg)
En 1785, el químico holandés Martinus van Marum estaba realizando experimentos que implicaban chispas eléctricas sobre el agua cuando notó un olor inusual, que atribuyó a las reacciones eléctricas, sin darse cuenta de que, de hecho, había creado ozono. [8] [9]
Medio siglo después, Christian Friedrich Schönbein notó el mismo olor penetrante y lo reconoció como el olor que suele seguir a un rayo . En 1839, logró aislar el químico gaseoso y lo llamó "ozono", de la palabra griega ozein ( ὄζειν ) que significa "oler". [10] [11] Por esta razón, a Schönbein generalmente se le atribuye el descubrimiento del ozono. [12] [13] [14] [8] También notó la similitud del olor del ozono con el olor del fósforo, y en 1844 demostró que el producto de la reacción del fósforo blanco con el aire es idéntico. [10] Un esfuerzo posterior para llamar al ozono "oxígeno electrificado" lo ridiculizó al proponer llamar al ozono del fósforo blanco "oxígeno fosforado". [10] La fórmula del ozono, O 3 , no fue determinada hasta 1865 por Jacques-Louis Soret [15] y confirmada por Schönbein en 1867. [10] [16]
Durante gran parte de la segunda mitad del siglo XIX y hasta bien entrado el XX, los naturalistas y los amantes de la salud consideraban que el ozono era un componente saludable del medio ambiente. Beaumont, California , tenía como lema oficial "Beaumont: Zona de ozono", como se evidencia en las postales y en el membrete de la Cámara de Comercio. [17] Los naturalistas que trabajaban al aire libre a menudo consideraban que las elevaciones más altas eran beneficiosas debido a su contenido de ozono. "Hay una atmósfera bastante diferente [a mayor altitud] con suficiente ozono para mantener la energía necesaria [para trabajar]", escribió el naturalista Henry Henshaw , que trabajaba en Hawái. [18] El aire del mar se consideraba saludable debido a su supuesto contenido de ozono. El olor que da lugar a esta creencia es de hecho el de los metabolitos de algas halogenadas [19] y el sulfuro de dimetilo . [20]
Gran parte del atractivo del ozono parece deberse a su olor "fresco", que evocaba asociaciones con propiedades purificadoras. Los científicos observaron sus efectos nocivos. En 1873, James Dewar y John Gray McKendrick documentaron que las ranas se volvían lentas, los pájaros jadeaban y la sangre de los conejos mostraba niveles reducidos de oxígeno después de la exposición al "aire ozonizado", que "ejercía una acción destructiva". [21] [12] El propio Schönbein informó que se produjeron dolores en el pecho, irritación de las membranas mucosas y dificultad para respirar como resultado de la inhalación de ozono, y que pequeños mamíferos murieron. [22] En 1911, Leonard Hill y Martin Flack afirmaron en las Actas de la Royal Society B que los efectos saludables del ozono "se han convertido, por mera iteración, en parte integrante de la creencia común; y sin embargo, hasta ahora ha faltado casi por completo evidencia fisiológica exacta a favor de sus buenos efectos... El único conocimiento completamente comprobado sobre el efecto fisiológico del ozono, alcanzado hasta ahora, es que causa irritación y edema de los pulmones, y la muerte si se inhala en una concentración relativamente fuerte durante cualquier tiempo". [12] [23]
Durante la Primera Guerra Mundial , en el Hospital Militar Queen Alexandra de Londres se probó el ozono como posible desinfectante para heridas. El gas se aplicó directamente sobre las heridas durante 15 minutos, lo que provocó daños tanto en las células bacterianas como en el tejido humano. Se consideraron preferibles otras técnicas de desinfección, como la irrigación con antisépticos . [12] [24]
Hasta la década de 1920, no se sabía con certeza si pequeñas cantidades de oxozono , O
4, también estaban presentes en muestras de ozono debido a la dificultad de aplicar técnicas de química analítica al químico concentrado explosivo. [25] [26] En 1923, Georg-Maria Schwab (trabajando para su tesis doctoral con Ernst Hermann Riesenfeld ) fue el primero en solidificar con éxito el ozono y realizar un análisis preciso que refutó de manera concluyente la hipótesis del oxozono. [25] [26] El grupo Riesenfeld determinó otras propiedades físicas no medidas hasta entonces del ozono concentrado puro en la década de 1920. [25]

El ozono es un gas incoloro o azul pálido, ligeramente soluble en agua y mucho más soluble en disolventes no polares inertes como el tetracloruro de carbono o los fluorocarbonos, en los que forma una solución azul. A 161 K (−112 °C; −170 °F), se condensa para formar un líquido azul oscuro . Es peligroso dejar que este líquido se caliente hasta su punto de ebullición, porque tanto el ozono gaseoso concentrado como el ozono líquido pueden detonar. A temperaturas inferiores a 80 K (−193,2 °C; −315,7 °F), forma un sólido de color violeta-negro . [27]
La mayoría de las personas pueden detectar alrededor de 0,01 μmol/mol de ozono en el aire, donde tiene un olor muy específico y penetrante que se parece un poco al del blanqueador con cloro . La exposición a concentraciones de 0,1 a 1 μmol/mol produce dolores de cabeza, ardor en los ojos e irritación de las vías respiratorias. [28] Incluso concentraciones bajas de ozono en el aire son muy destructivas para materiales orgánicos como el látex, los plásticos y el tejido pulmonar de los animales.
La molécula de ozono es diamagnética. [29]
Según la evidencia experimental de la espectroscopia de microondas , el ozono es una molécula doblada, con simetría C 2v (similar a la molécula de agua ). [30] Las distancias O–O son 127,2 pm (1,272 Å ). El ángulo O–O–O es 116,78°. [31] El átomo central está hibridado sp ² con un par solitario. El ozono es una molécula polar con un momento dipolar de 0,53 D . [32] La molécula se puede representar como un híbrido de resonancia con dos estructuras contribuyentes, cada una con un enlace simple en un lado y un enlace doble en el otro. La disposición posee un orden de enlace general de 1,5 para ambos lados. Es isoelectrónico con el anión nitrito . El ozono natural puede estar compuesto de isótopos sustituidos ( 16 O, 17 O, 18 O). Se ha predicho una forma cíclica , pero no se ha observado.

El ozono es uno de los agentes oxidantes más potentes que se conocen, mucho más fuerte que el O 2 . También es inestable en altas concentraciones, descomponiéndose en oxígeno diatómico ordinario. Su vida media varía con las condiciones atmosféricas, como la temperatura, la humedad y el movimiento del aire. En condiciones de laboratorio, la vida media será de unos 1500 minutos (25 horas) en aire en calma a temperatura ambiente (24 °C), humedad cero y cero cambios de aire por hora. [33]
Esta reacción se produce más rápidamente a medida que aumenta la temperatura. La deflagración del ozono puede ser provocada por una chispa y puede ocurrir en concentraciones de ozono del 10 % en peso o superiores. [34]
El ozono también se puede producir a partir del oxígeno en el ánodo de una celda electroquímica. Esta reacción puede crear cantidades más pequeñas de ozono para fines de investigación. [35]
Esto se puede observar como una reacción no deseada en un aparato de gas Hoffman durante la electrólisis del agua cuando el voltaje se ajusta por encima del voltaje necesario.
El ozono oxida la mayoría de los metales (excepto el oro , el platino y el iridio ) y los convierte en óxidos de los metales en su estado de oxidación más alto . Por ejemplo:
El ozono también oxida el óxido nítrico a dióxido de nitrógeno :
Esta reacción va acompañada de quimioluminiscencia . El NO2 puede oxidarse aún más hasta convertirse en radical nitrato :
El NO3 formado puede reaccionar con NO2 para formar pentóxido de dinitrógeno ( N2O5 ) .
El perclorato de nitronio sólido se puede fabricar a partir de gases NO 2 , ClO 2 y O 3 :
El ozono no reacciona con las sales de amonio , pero oxida el amoniaco a nitrato de amonio :
El ozono reacciona con el carbono para formar dióxido de carbono , incluso a temperatura ambiente:
El ozono oxida los sulfuros y los convierte en sulfatos . Por ejemplo, el sulfuro de plomo (II) se oxida y se convierte en sulfato de plomo (II) :
El ácido sulfúrico se puede producir a partir de ozono, agua y azufre elemental o dióxido de azufre :
En la fase gaseosa , el ozono reacciona con el sulfuro de hidrógeno para formar dióxido de azufre:
Sin embargo, en una solución acuosa ocurren dos reacciones simultáneas que compiten entre sí: una para producir azufre elemental y otra para producir ácido sulfúrico :
Los alquenos pueden escindirse oxidativamente mediante ozono, en un proceso llamado ozonólisis , dando lugar a alcoholes, aldehídos, cetonas y ácidos carboxílicos, dependiendo del segundo paso del tratamiento.
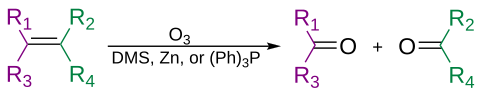
El ozono también puede escindir alquinos para formar un anhídrido ácido o un producto dicetona . [37] Si la reacción se realiza en presencia de agua, el anhídrido se hidroliza para dar dos ácidos carboxílicos .
Por lo general, la ozonólisis se lleva a cabo en una solución de diclorometano , a una temperatura de -78 °C. Después de una secuencia de escisión y reordenamiento, se forma un ozónido orgánico. Con el tratamiento reductor (por ejemplo, zinc en ácido acético o sulfuro de dimetilo ), se formarán cetonas y aldehídos, con el tratamiento oxidativo (por ejemplo, peróxido de hidrógeno acuoso o alcohólico ), se formarán ácidos carboxílicos. [38]
Los tres átomos de ozono también pueden reaccionar, como en la reacción del cloruro de estaño (II) con ácido clorhídrico y ozono:
El perclorato de yodo se puede fabricar tratando el yodo disuelto en ácido perclórico anhidro frío con ozono:
El ozono también podría reaccionar con yoduro de potasio para producir oxígeno y gas yodo que pueden titularse para su determinación cuantitativa: [39]
El ozono se puede utilizar para reacciones de combustión y gases combustibles; el ozono proporciona temperaturas más altas que la combustión en dioxígeno ( O2 ) . La siguiente es una reacción para la combustión del subnitruro de carbono que también puede provocar temperaturas más altas:
El ozono puede reaccionar a temperaturas criogénicas. A 77 K (−196,2 °C; −321,1 °F), el hidrógeno atómico reacciona con el ozono líquido para formar un radical superóxido de hidrógeno , que se dimeriza : [40]
El ozono es una sustancia tóxica, [41] [42] que se encuentra o genera habitualmente en entornos humanos (cabina de avión, oficinas con fotocopiadoras, impresoras láser, esterilizadores...) y su descomposición catalítica es muy importante para reducir la contaminación. Este tipo de descomposición es la más utilizada, sobre todo con catalizadores sólidos, y presenta muchas ventajas como una mayor conversión con una temperatura más baja. Además, el producto y el catalizador se pueden separar instantáneamente, y de esta manera el catalizador se puede recuperar fácilmente sin utilizar ninguna operación de separación. Además, los materiales más utilizados en la descomposición catalítica del ozono en fase gaseosa son metales nobles como Pt, Rh o Pd y metales de transición como Mn, Co, Cu, Fe, Ni o Ag.
Existen otras dos posibilidades para la descomposición del ozono en fase gaseosa:
La primera es la descomposición térmica, donde el ozono se puede descomponer utilizando únicamente la acción del calor. El problema es que este tipo de descomposición es muy lenta con temperaturas inferiores a 250 °C. Sin embargo, la velocidad de descomposición se puede aumentar trabajando con temperaturas más altas, pero esto implicaría un alto coste energético.
La segunda es una descomposición fotoquímica, que consiste en irradiar ozono con radiación ultravioleta (UV) y da lugar a oxígeno y peróxido radical. [43]
El proceso de descomposición del ozono es una reacción compleja que involucra dos reacciones elementales que finalmente conducen al oxígeno molecular, y esto significa que el orden de reacción y la ley de velocidad no se pueden determinar mediante la estequiometría de la ecuación ajustada.
Reacción general:
Ley de velocidad (observada):
Se ha determinado que la descomposición del ozono sigue una cinética de primer orden, y a partir de la ley de velocidad anterior se puede determinar que el orden parcial con respecto al oxígeno molecular es -1 y con respecto al ozono es 2, por lo tanto, el orden de reacción global es 1.
La descomposición del ozono consta de dos pasos elementales: El primero corresponde a una reacción unimolecular porque una única molécula de ozono se descompone en dos productos (oxígeno molecular y oxígeno). Luego, el oxígeno del primer paso es un intermediario porque participa como reactante en el segundo paso, que es una reacción bimolecular porque hay dos reactantes diferentes (ozono y oxígeno) que dan lugar a un solo producto, que corresponde al oxígeno molecular en fase gaseosa.
Paso 1: Reacción unimolecular
Paso 2: Reacción bimolecular
Estos dos pasos tienen diferentes velocidades de reacción, el primero es reversible y más rápido que la segunda reacción, que es más lenta, por lo que esto significa que el paso determinante es la segunda reacción y se utiliza para determinar la velocidad de reacción observada. Las leyes de velocidad de reacción para cada paso son las que se muestran a continuación:
El siguiente mecanismo permite explicar la ley de velocidad de la descomposición del ozono observada experimentalmente, y además permite determinar los órdenes de reacción con respecto al ozono y al oxígeno, con lo que se determinará el orden de reacción global. El paso más lento, la reacción bimolecular, es el que determina la velocidad de formación del producto, y considerando que este paso da lugar a dos moléculas de oxígeno la ley de velocidad tiene esta forma:
Sin embargo, esta ecuación depende de la concentración de oxígeno (intermedio), que se puede determinar considerando el primer paso. Dado que el primer paso es más rápido y reversible y el segundo paso es más lento, los reactivos y productos del primer paso están en equilibrio, por lo que la concentración del intermedio se puede determinar de la siguiente manera:
Luego, utilizando estas ecuaciones, la tasa de formación de oxígeno molecular es la que se muestra a continuación:
Finalmente, el mecanismo presentado permite establecer la velocidad observada experimentalmente, con una constante de velocidad ( K obs ) y correspondiente a una cinética de primer orden, como sigue: [44]
dónde
La reducción del ozono produce el anión ozónido , O−3Los derivados de este anión son explosivos y deben almacenarse a temperaturas criogénicas. Se conocen ozónidos para todos los metales alcalinos . KO 3 , RbO 3 y CsO 3 pueden prepararse a partir de sus respectivos superóxidos:
Aunque el KO3 se puede formar como se indicó anteriormente, también se puede formar a partir de hidróxido de potasio y ozono: [45]
El NaO 3 y el LiO 3 deben prepararse mediante la acción del CsO 3 en NH 3 líquido sobre una resina de intercambio iónico que contenga iones Na + o Li + : [46]
Una solución de calcio en amoniaco reacciona con el ozono para dar ozónido de amonio y no ozónido de calcio: [40]
El ozono se puede utilizar para eliminar el hierro y el manganeso del agua , formando un precipitado que se puede filtrar:
El ozono también oxidará el sulfuro de hidrógeno disuelto en agua a ácido sulfuroso :
Estas tres reacciones son fundamentales en el uso del tratamiento de agua de pozo basado en ozono.
El ozono también desintoxicará los cianuros convirtiéndolos en cianatos .
El ozono también descompondrá completamente la urea : [47]
El ozono es una molécula triatómica doblada con tres modos vibracionales: el estiramiento simétrico (1103,157 cm −1 ), la flexión (701,42 cm −1 ) y el estiramiento antisimétrico (1042,096 cm −1 ). [48] El estiramiento y la flexión simétricos son absorbentes débiles, pero el estiramiento antisimétrico es fuerte y responsable de que el ozono sea un importante gas de efecto invernadero menor . Esta banda IR también se utiliza para detectar el ozono ambiental y atmosférico, aunque las mediciones basadas en UV son más comunes. [49]
El espectro electromagnético del ozono es bastante complejo. Se puede consultar una descripción general en el Atlas espectral UV/VIS de moléculas gaseosas de interés atmosférico del MPI Mainz. [50]
Todas las bandas son disociativas, lo que significa que la molécula se desintegra en O + O 2 después de absorber un fotón. La banda de absorción más importante es la banda Hartley, que se extiende desde un poco más de 300 nm hasta un poco más de 200 nm. Esta banda es la responsable de la absorción de la radiación UV C en la estratosfera.
En el lado de las longitudes de onda altas, la banda Hartley pasa a la llamada banda Huggins, que cae rápidamente hasta desaparecer a unos 360 nm. Por encima de los 400 nm, extendiéndose hasta el infrarrojo cercano, se encuentran las bandas Chappius y Wulf. Allí, las bandas de absorción no estructuradas son útiles para detectar altas concentraciones ambientales de ozono, pero son tan débiles que no tienen mucho efecto práctico.
Hay bandas de absorción adicionales en el UV lejano, que aumentan lentamente desde 200 nm hasta alcanzar un máximo en ~120 nm.



La forma estándar de expresar los niveles totales de ozono (la cantidad de ozono en una columna vertical dada) en la atmósfera es mediante unidades Dobson . Las mediciones puntuales se informan como fracciones molares en nmol/mol (partes por mil millones, ppb) o como concentraciones en μg/m 3 . El estudio de la concentración de ozono en la atmósfera comenzó en la década de 1920. [51]
Los niveles más altos de ozono en la atmósfera se encuentran en la estratosfera , en una región también conocida como la capa de ozono, entre unos 10 y 50 km por encima de la superficie (o entre unas 6 y 31 millas). Sin embargo, incluso en esta "capa", las concentraciones de ozono son de sólo dos a ocho partes por millón, por lo que la mayor parte del oxígeno allí es dioxígeno, O 2 , a unas 210.000 partes por millón en volumen. [52]
El ozono en la estratosfera se produce principalmente a partir de rayos ultravioleta de onda corta entre 240 y 160 nm. El oxígeno comienza a absorberse débilmente a 240 nm en las bandas de Herzberg, pero la mayor parte del oxígeno se disocia por absorción en las fuertes bandas de Schumann-Runge entre 200 y 160 nm, donde el ozono no absorbe. Si bien la luz de longitud de onda más corta, que se extiende incluso hasta el límite de rayos X, es lo suficientemente energética como para disociar el oxígeno molecular, hay relativamente poco de él y la fuerte emisión solar en Lyman-alfa, 121 nm, cae en un punto donde la absorción de oxígeno molecular es mínima. [53]
El proceso de creación y destrucción del ozono se denomina ciclo Chapman y comienza con la fotólisis del oxígeno molecular.
seguido de la reacción del átomo de oxígeno con otra molécula de oxígeno para formar ozono.
donde "M" denota el tercer cuerpo que se lleva el exceso de energía de la reacción. La molécula de ozono puede entonces absorber un fotón UV-C y disociarse.
El exceso de energía cinética calienta la estratosfera cuando los átomos de O y el oxígeno molecular se separan y chocan con otras moléculas. Esta conversión de luz ultravioleta en energía cinética calienta la estratosfera. Los átomos de oxígeno producidos en la fotólisis del ozono reaccionan entonces con otras moléculas de oxígeno como en el paso anterior para formar más ozono. En la atmósfera clara, con solo nitrógeno y oxígeno, el ozono puede reaccionar con el oxígeno atómico para formar dos moléculas de O 2 :
Se puede calcular la velocidad de este paso de terminación para el ciclo del oxígeno atómico de nuevo a ozono simplemente tomando las proporciones de la concentración de O 2 a O 3 . La reacción de terminación está catalizada por la presencia de ciertos radicales libres, de los cuales los más importantes son el hidroxilo (OH), el óxido nítrico (NO) y el cloro atómico (Cl) y el bromo (Br). En la segunda mitad del siglo XX, se descubrió que la cantidad de ozono en la estratosfera estaba disminuyendo, principalmente debido al aumento de las concentraciones de clorofluorocarbonos (CFC) y moléculas orgánicas cloradas y bromadas similares . La preocupación por los efectos de la disminución sobre la salud condujo al Protocolo de Montreal de 1987 , la prohibición de la producción de muchos productos químicos que agotan la capa de ozono y, en la primera y segunda década del siglo XXI, el comienzo de la recuperación de las concentraciones de ozono estratosférico.

El ozono en la capa de ozono filtra las longitudes de onda de la luz solar desde los rayos UV de aproximadamente 200 nm hasta los 315 nm, con una absorción máxima de ozono a aproximadamente 250 nm. [54] Esta absorción de UV por ozono es importante para la vida, ya que extiende la absorción de UV por el oxígeno y el nitrógeno ordinarios en el aire (que absorben todas las longitudes de onda < 200 nm) a través de la banda UV-C inferior (200-280 nm) y toda la banda UV-B (280-315 nm). La pequeña parte no absorbida que queda de UV-B después de pasar a través del ozono causa quemaduras solares en humanos y daño directo al ADN en tejidos vivos tanto en plantas como en animales. El efecto del ozono sobre los rayos UV-B de rango medio se ilustra por su efecto sobre UV-B a 290 nm, que tiene una intensidad de radiación 350 millones de veces más potente en la parte superior de la atmósfera que en la superficie. Sin embargo, una cantidad suficiente de radiación UV-B en una frecuencia similar llega al suelo como para causar algunas quemaduras solares, y estas mismas longitudes de onda también se encuentran entre las responsables de la producción de vitamina D en los seres humanos.
La capa de ozono tiene poco efecto sobre las longitudes de onda más largas de los rayos ultravioleta, llamadas UV-A (315–400 nm), pero esta radiación no causa quemaduras solares ni daños directos al ADN. Si bien los rayos UV-A probablemente causan daños a largo plazo en la piel de ciertos seres humanos, no son tan peligrosos para las plantas ni para la salud de los organismos que habitan en la superficie de la Tierra en general (consulte la sección ultravioleta para obtener más información sobre el ultravioleta cercano).
El ozono de bajo nivel (u ozono troposférico) es un contaminante atmosférico. [55] No es emitido directamente por los motores de los automóviles ni por las operaciones industriales, sino que se forma por la reacción de la luz solar sobre el aire que contiene hidrocarburos y óxidos de nitrógeno que reaccionan para formar ozono directamente en la fuente de la contaminación o a muchos kilómetros a favor del viento.
El ozono reacciona directamente con algunos hidrocarburos como los aldehídos y comienza así su eliminación del aire, pero los productos son en sí mismos componentes clave del smog . La fotólisis del ozono por la luz ultravioleta conduce a la producción del radical hidroxilo HO• y esto juega un papel en la eliminación de hidrocarburos del aire, pero también es el primer paso en la creación de componentes del smog como los nitratos de peroxiacilo , que pueden ser potentes irritantes oculares. La vida atmosférica del ozono troposférico es de unos 22 días; sus principales mecanismos de eliminación son depositándose en el suelo, la reacción mencionada anteriormente dando HO•, y por reacciones con OH y el radical peróxido HO 2 •. [56]
Hay evidencia de una reducción significativa en los rendimientos agrícolas debido al aumento del ozono a nivel del suelo y la contaminación que interfiere con la fotosíntesis y atrofia el crecimiento general de algunas especies de plantas. [57] [58] La Agencia de Protección Ambiental de los Estados Unidos (EPA) ha propuesto una regulación secundaria para reducir el daño a los cultivos, además de la regulación primaria diseñada para la protección de la salud humana.
Algunos ejemplos de ciudades con niveles elevados de ozono son Denver, Colorado ; Houston, Texas ; y Ciudad de México , México . Houston tiene un nivel de alrededor de 41 nmol/mol, mientras que Ciudad de México es mucho más peligrosa, con un nivel de alrededor de 125 nmol/mol. [58]
El ozono de bajo nivel, u ozono troposférico, es el tipo de contaminación por ozono más preocupante en las áreas urbanas y está aumentando en general. [59] La contaminación por ozono en áreas urbanas afecta a poblaciones más densas y se agrava por las altas poblaciones de vehículos, que emiten contaminantes NO2 y COV , los principales contribuyentes a los niveles problemáticos de ozono. [60] La contaminación por ozono en áreas urbanas es especialmente preocupante con el aumento de las temperaturas, lo que aumenta la mortalidad relacionada con el calor durante las olas de calor . [61] Durante las olas de calor en áreas urbanas, la contaminación por ozono a nivel del suelo puede ser un 20% más alta de lo habitual. [62] La contaminación por ozono en áreas urbanas alcanza niveles más altos de excedencia en verano y otoño, lo que puede explicarse por los patrones climáticos y los patrones de tráfico. [60] Las personas que viven en la pobreza se ven más afectadas por la contaminación en general, aunque es menos probable que estas poblaciones contribuyan a los niveles de contaminación. [63]
Como se mencionó anteriormente, Denver, Colorado, es una de las muchas ciudades de los EE. UU. que tienen altas cantidades de ozono. Según la Asociación Estadounidense del Pulmón , el área de Denver-Aurora es la 14.ª área más contaminada por ozono en los EE. UU. [64]. El problema de los altos niveles de ozono no es nuevo en esta área. En 2004, la EPA asignó a Denver Metro / North Front Range [b] como áreas de incumplimiento según el estándar de ozono de 8 horas de 1997, [65] pero luego aplazó este estado hasta 2007. El estándar de incumplimiento indica que un área no cumple con los estándares de calidad del aire de la EPA. El Plan de Acción de Ozono de Colorado se creó en respuesta, y se implementaron numerosos cambios a partir de este plan. El primer cambio importante fue que las pruebas de emisiones de los automóviles se expandieron en todo el estado a más condados que anteriormente no exigían pruebas de emisiones, como áreas de Larimer y el condado de Weld. También se han realizado cambios para reducir las emisiones de óxidos de nitrógeno (NOx) y compuestos orgánicos volátiles (COV), lo que debería ayudar a reducir los niveles de ozono.
Un importante contribuyente a los altos niveles de ozono en la zona es la industria del petróleo y el gas natural situada en la Cuenca de Denver-Julesburg (DJB), que se superpone con la mayoría de las áreas metropolitanas de Colorado. El ozono se crea de forma natural en la estratosfera de la Tierra, pero también se crea en la troposfera a causa de la actividad humana. Como se mencionó brevemente anteriormente, los NOx y los COV reaccionan con la luz solar para crear ozono a través de un proceso llamado fotoquímica. Los eventos de ozono elevados de una hora (<75 ppb) "ocurren durante junio y agosto, lo que indica que los niveles elevados de ozono son impulsados por la fotoquímica regional". [66] Según un artículo de la Universidad de Colorado-Boulder, "las emisiones de COV de petróleo y gas natural tienen un papel importante en la producción de ozono y tienen el potencial de contribuir a los niveles elevados de O 3 en la Cordillera Frontal del Norte de Colorado (NCFR)". [66] Mediante análisis complejos para investigar los patrones de viento y las emisiones de las grandes operaciones de petróleo y gas natural, los autores concluyeron que "los niveles elevados de O 3 en la NCFR están predominantemente correlacionados con el transporte aéreo desde el N–ESE, que son los sectores de barlovento donde se ubican las operaciones de O&NG en el área del campo Wattenberg del DJB". [66]
En el Plan de Acción de Ozono de Colorado, creado en 2008, se incluyen planes para evaluar "controles de emisiones para grandes fuentes industriales de NOx" y "requisitos de control a nivel estatal para nuevos tanques de condensado de petróleo y gas y válvulas neumáticas". [67] En 2011, se publicó el Plan Regional de Neblina que incluía un plan más específico para ayudar a reducir las emisiones de NOx. Estos esfuerzos son cada vez más difíciles de implementar y tardan muchos años en concretarse. Por supuesto, también hay otras razones por las que los niveles de ozono siguen siendo altos. Entre ellas se incluyen: una población en aumento que significa más emisiones de automóviles y las montañas a lo largo de la NCFR que pueden atrapar emisiones. Si está interesado, puede encontrar lecturas diarias de la calidad del aire en el sitio web del Departamento de Salud Pública y Medio Ambiente de Colorado. [68] Como se señaló anteriormente, Denver continúa experimentando altos niveles de ozono hasta el día de hoy. Se necesitarán muchos años y un enfoque de pensamiento sistémico para combatir este problema de los altos niveles de ozono en la Cordillera Frontal de Colorado.

El gas ozono ataca a cualquier polímero que posea enlaces olefínicos o dobles dentro de su estructura de cadena, como el caucho natural , el caucho de nitrilo y el caucho de estireno-butadieno . Los productos fabricados con estos polímeros son especialmente susceptibles al ataque, lo que hace que las grietas se hagan más largas y profundas con el tiempo, y la velocidad de crecimiento de las grietas depende de la carga soportada por el componente de caucho y de la concentración de ozono en la atmósfera. Dichos materiales se pueden proteger añadiendo antiozonantes , como ceras, que se adhieren a la superficie para crear una película protectora o se mezclan con el material y proporcionan protección a largo plazo. El agrietamiento por ozono solía ser un problema grave en los neumáticos de los automóviles, [69] por ejemplo, pero no es un problema con los neumáticos modernos. Por otro lado, muchos productos críticos, como las juntas y los anillos tóricos , pueden ser atacados por el ozono producido dentro de los sistemas de aire comprimido. Las líneas de combustible hechas de caucho reforzado también son susceptibles al ataque, especialmente dentro del compartimiento del motor, donde los componentes eléctricos producen algo de ozono. Almacenar productos de caucho cerca de un motor eléctrico de CC puede acelerar el agrietamiento por ozono. El conmutador del motor genera chispas que a su vez producen ozono.

Aunque el ozono estaba presente a nivel del suelo antes de la Revolución Industrial , las concentraciones máximas son ahora mucho más altas que los niveles preindustriales, e incluso las concentraciones de fondo muy alejadas de las fuentes de contaminación son sustancialmente más altas. [71] [72] El ozono actúa como un gas de efecto invernadero , absorbiendo parte de la energía infrarroja emitida por la tierra. Cuantificar la potencia del ozono como gas de efecto invernadero es difícil porque no está presente en concentraciones uniformes en todo el mundo. Sin embargo, las evaluaciones científicas más ampliamente aceptadas relacionadas con el cambio climático (por ejemplo, el Tercer Informe de Evaluación del Grupo Intergubernamental de Expertos sobre el Cambio Climático ) [73] sugieren que el forzamiento radiativo del ozono troposférico es aproximadamente el 25% del del dióxido de carbono .
El potencial de calentamiento global anual del ozono troposférico es de entre 918 y 1022 toneladas de dióxido de carbono equivalente /tonelada de ozono troposférico. Esto significa que, en términos de moléculas, el ozono en la troposfera tiene un efecto de forzamiento radiativo aproximadamente 1000 veces más fuerte que el dióxido de carbono . Sin embargo, el ozono troposférico es un gas de efecto invernadero de corta duración, que se desintegra en la atmósfera mucho más rápidamente que el dióxido de carbono . Esto significa que, en un período de 20 años, el potencial de calentamiento global del ozono troposférico es mucho menor, aproximadamente de 62 a 69 toneladas de dióxido de carbono equivalente /tonelada de ozono troposférico. [74]
Debido a su naturaleza efímera, el ozono troposférico no tiene efectos globales fuertes, pero sí efectos de forzamiento radiativo muy fuertes a escala regional. De hecho, hay regiones del mundo donde el ozono troposférico tiene un forzamiento radiativo de hasta el 150% del dióxido de carbono . [75] Por ejemplo, se ha demostrado que el aumento del ozono en la troposfera es responsable de aproximadamente el 30% del calentamiento del interior de la parte superior del Océano Austral entre 1955 y 2000. [76]
Durante las últimas décadas, los científicos han estudiado los efectos de la exposición aguda y crónica al ozono en la salud humana. Cientos de estudios sugieren que el ozono es nocivo para las personas en los niveles que se encuentran actualmente en las zonas urbanas. [77] [78] Se ha demostrado que el ozono afecta al sistema respiratorio, cardiovascular y nervioso central. También se ha demostrado que la exposición al ozono está asociada a la muerte prematura y a problemas de salud y desarrollo reproductivos. [79]
La Asociación Estadounidense del Pulmón ha identificado cinco poblaciones que son especialmente vulnerables a los efectos de respirar ozono: [80]
Evidencias adicionales sugieren que las mujeres, las personas obesas y las poblaciones de bajos ingresos también pueden enfrentar un mayor riesgo por el ozono, aunque se necesita más investigación. [80]
La exposición aguda al ozono varía de horas a unos pocos días. Debido a que el ozono es un gas, afecta directamente a los pulmones y a todo el sistema respiratorio. El ozono inhalado causa inflamación y cambios agudos, pero reversibles, en la función pulmonar, así como hiperreactividad de las vías respiratorias. [81] Estos cambios provocan dificultad para respirar, sibilancia y tos que pueden exacerbar enfermedades pulmonares, como el asma o la enfermedad pulmonar obstructiva crónica (EPOC), lo que resulta en la necesidad de recibir tratamiento médico. [82] [83] Se ha demostrado que la exposición aguda y crónica al ozono causa un mayor riesgo de infecciones respiratorias, debido al siguiente mecanismo. [84]
Se han realizado múltiples estudios para determinar el mecanismo que se esconde detrás de los efectos nocivos del ozono, en particular en los pulmones. Estos estudios han demostrado que la exposición al ozono provoca cambios en la respuesta inmunitaria dentro del tejido pulmonar, lo que da lugar a la alteración de la respuesta inmunitaria innata y adaptativa, así como a la alteración de la función protectora de las células epiteliales pulmonares. [85] Se cree que estos cambios en la respuesta inmunitaria y la respuesta inflamatoria relacionada son factores que probablemente contribuyen al aumento del riesgo de infecciones pulmonares y al empeoramiento o desencadenamiento del asma y de las vías respiratorias reactivas tras la exposición a la contaminación por ozono troposférico. [85] [86]
El sistema inmunológico innato (celular) consta de varias señales químicas y tipos de células que funcionan ampliamente y contra múltiples tipos de patógenos, típicamente bacterias o cuerpos/sustancias extrañas en el huésped. [86] [87] Las células del sistema innato incluyen fagocitos, neutrófilos, [87] ambos se cree que contribuyen al mecanismo de la patología del ozono en los pulmones, ya que se ha demostrado que el funcionamiento de estos tipos de células cambia después de la exposición al ozono. [86] Se ha demostrado que los macrófagos, células que sirven para eliminar patógenos o material extraño a través del proceso de "fagocitosis", [87] cambian el nivel de señales inflamatorias que liberan en respuesta al ozono, ya sea regulando al alza y dando como resultado una respuesta inflamatoria en el pulmón, o regulando a la baja y reduciendo la protección inmunológica. [85] Los neutrófilos, otro tipo de célula importante del sistema inmunológico innato que se dirige principalmente a los patógenos bacterianos, [87] se encuentran presentes en las vías respiratorias dentro de las 6 horas posteriores a la exposición a altos niveles de ozono. Sin embargo, a pesar de los altos niveles en los tejidos pulmonares, su capacidad para eliminar bacterias parece verse afectada por la exposición al ozono. [85]
El sistema inmunológico adaptativo es la rama de la inmunidad que brinda protección a largo plazo a través del desarrollo de anticuerpos dirigidos a patógenos específicos y también se ve afectado por la alta exposición al ozono. [86] [87] Los linfocitos, un componente celular de la respuesta inmune adaptativa, producen una mayor cantidad de sustancias químicas inflamatorias llamadas "citocinas" después de la exposición al ozono, lo que puede contribuir a la hiperreactividad de las vías respiratorias y al empeoramiento de los síntomas del asma. [85]
Las células epiteliales de las vías respiratorias también desempeñan un papel importante en la protección de las personas frente a los patógenos. En el tejido normal, la capa epitelial forma una barrera protectora y también contiene estructuras ciliares especializadas que trabajan para eliminar cuerpos extraños, moco y patógenos de los pulmones. Cuando se exponen al ozono, los cilios se dañan y se reduce la eliminación mucociliar de patógenos. Además, la barrera epitelial se debilita, lo que permite que los patógenos la crucen, proliferen y se propaguen a tejidos más profundos. En conjunto, estos cambios en la barrera epitelial contribuyen a que las personas sean más susceptibles a las infecciones pulmonares. [85]
La inhalación de ozono no solo afecta al sistema inmunológico y a los pulmones, sino que también puede afectar al corazón. El ozono provoca un desequilibrio autonómico a corto plazo que conduce a cambios en la frecuencia cardíaca y a una reducción de la variabilidad de la frecuencia cardíaca; [88] y la exposición a niveles elevados durante tan solo una hora da lugar a una arritmia supraventricular en los ancianos, [89] ambos aumentan el riesgo de muerte prematura y accidente cerebrovascular. El ozono también puede provocar vasoconstricción que da lugar a un aumento de la presión arterial sistémica, lo que contribuye a un mayor riesgo de morbilidad y mortalidad cardíacas en pacientes con enfermedades cardíacas preexistentes. [90] [91]
Respirar ozono durante períodos superiores a ocho horas seguidas durante semanas, meses o años define la exposición crónica. Numerosos estudios sugieren que esta exposición tiene graves consecuencias para la salud de diversas poblaciones.
Un estudio encontró asociaciones positivas significativas entre el ozono crónico y la mortalidad por todas las causas, circulatoria y respiratoria con aumentos del 2%, 3% y 12% en el riesgo por cada 10 ppb [92] e informó una asociación (IC del 95%) entre el ozono anual y la mortalidad por todas las causas con un cociente de riesgo de 1,02 (1,01-1,04), y con la mortalidad cardiovascular de 1,03 (1,01-1,05). Un estudio similar encontró asociaciones similares con la mortalidad por todas las causas e incluso efectos mayores para la mortalidad cardiovascular. [93] Un mayor riesgo de mortalidad por causas respiratorias está asociado con la exposición crónica a largo plazo al ozono. [94]
La exposición crónica al ozono tiene efectos perjudiciales para los niños, especialmente para los que padecen asma. El riesgo de hospitalización en niños asmáticos aumenta con la exposición crónica al ozono; los niños más pequeños y aquellos con bajos ingresos corren un riesgo aún mayor. [95]
Los adultos que padecen enfermedades respiratorias (asma, [96] EPOC, [97] cáncer de pulmón [98] ) tienen un mayor riesgo de mortalidad y morbilidad y los pacientes gravemente enfermos también tienen un mayor riesgo de desarrollar síndrome de dificultad respiratoria aguda con la exposición crónica al ozono. [99]
Los generadores de ozono que se venden como purificadores de aire producen intencionalmente el gas ozono. [42] A menudo se comercializan para controlar la contaminación del aire en interiores y utilizan términos engañosos para describir el ozono. Algunos ejemplos lo describen como "oxígeno energizado" o "aire puro", lo que sugiere que el ozono es un tipo de oxígeno saludable o "mejor". [42] Sin embargo, según la EPA , "hay evidencia que demuestra que en concentraciones que no exceden los estándares de salud pública, el ozono no es eficaz para eliminar muchos productos químicos que causan olores", y "si se usa en concentraciones que no exceden los estándares de salud pública, el ozono aplicado al aire interior no elimina eficazmente virus, bacterias, moho u otros contaminantes biológicos". [42] Además, otro informe afirma que "los resultados de algunos estudios controlados muestran que son posibles concentraciones de ozono considerablemente más altas que estos estándares [de seguridad humana] incluso cuando un usuario sigue las instrucciones de funcionamiento del fabricante". [100]
La Junta de Recursos del Aire de California tiene una página que enumera los purificadores de aire (muchos de ellos con ionizadores ) que cumplen con su límite de ozono en interiores de 0,050 partes por millón. [101] De ese artículo:
Todos los dispositivos portátiles de purificación de aire en interiores que se vendan en California deben estar certificados por la Junta de Recursos del Aire de California (CARB). Para obtener la certificación, los purificadores de aire deben someterse a pruebas de seguridad eléctrica y emisiones de ozono, y cumplir con un límite de concentración de emisiones de ozono de 0,050 partes por millón. Para obtener más información sobre la normativa, visite la normativa sobre purificadores de aire.


Los precursores del ozono son un grupo de contaminantes, predominantemente los emitidos durante la combustión de combustibles fósiles . La contaminación por ozono troposférico se crea cerca de la superficie de la Tierra por la acción de los rayos ultravioleta de la luz del día sobre estos precursores. El ozono a nivel del suelo proviene principalmente de precursores de combustibles fósiles, pero el metano es un precursor natural y el nivel de fondo natural muy bajo de ozono a nivel del suelo se considera seguro. En esta sección se examinan los impactos en la salud de la quema de combustibles fósiles, que eleva el ozono a nivel del suelo muy por encima de los niveles de fondo.
Hay una gran cantidad de evidencia que demuestra que el ozono troposférico puede dañar la función pulmonar e irritar el sistema respiratorio . [55] [103] La exposición al ozono (y los contaminantes que lo producen) está vinculada a muerte prematura , asma , bronquitis , ataque cardíaco y otros problemas cardiopulmonares. [104] [105]
Se ha demostrado que la exposición prolongada al ozono aumenta el riesgo de muerte por enfermedad respiratoria . [42] Un estudio de 450.000 personas que vivían en ciudades de EE. UU. observó una correlación significativa entre los niveles de ozono y las enfermedades respiratorias durante el período de seguimiento de 18 años. El estudio reveló que las personas que vivían en ciudades con altos niveles de ozono, como Houston o Los Ángeles, tenían un riesgo un 30% mayor de morir por enfermedad pulmonar. [106] [107]
Las directrices de calidad del aire, como las de la Organización Mundial de la Salud , la Agencia de Protección Ambiental de Estados Unidos (EPA) y la Unión Europea , se basan en estudios detallados diseñados para identificar los niveles que pueden causar efectos nocivos para la salud mensurables .
Según los científicos de la EPA, las personas susceptibles pueden verse afectadas negativamente por niveles de ozono tan bajos como 40 nmol/mol. [105] [108] [109] En la UE, el valor objetivo actual para las concentraciones de ozono es de 120 μg/m 3, lo que equivale a unos 60 nmol/mol. Este objetivo se aplica a todos los estados miembros de conformidad con la Directiva 2008/50/CE. [110] La concentración de ozono se mide como una media diaria máxima de promedios de 8 horas y el objetivo no debe superarse en más de 25 días naturales al año, a partir de enero de 2010. Si bien la directiva exige en el futuro un estricto cumplimiento del límite de 120 μg/m 3 (es decir, que la concentración media de ozono no se supere en ningún día del año), no hay una fecha fijada para este requisito y se trata como un objetivo a largo plazo. [111]
En los Estados Unidos, la Ley de Aire Limpio ordena a la EPA que establezca estándares nacionales de calidad del aire ambiental para varios contaminantes, incluido el ozono troposférico, y los condados que no cumplan con estos estándares deben tomar medidas para reducir sus niveles. En mayo de 2008, en virtud de una orden judicial, la EPA redujo su estándar de ozono de 80 nmol/mol a 75 nmol/mol. La medida resultó controvertida, ya que los propios científicos y el consejo asesor de la Agencia habían recomendado reducir el estándar a 60 nmol/mol. [105] Muchos grupos de salud pública y ambientales también apoyaron el estándar de 60 nmol/mol, [112] y la Organización Mundial de la Salud recomienda 100 μg/m 3 (51 nmol/mol). [113]
El 7 de enero de 2010, la Agencia de Protección Ambiental de Estados Unidos (EPA) anunció las revisiones propuestas al Estándar Nacional de Calidad del Aire Ambiental (NAAQS) para el contaminante ozono, el componente principal del smog:
... La EPA propone que el nivel del estándar primario de 8 horas, que se estableció en 0,075 μmol/mol en la norma final de 2008, se establezca en un nivel inferior dentro del rango de 0,060 a 0,070 μmol/mol, para proporcionar una mayor protección a los niños y otras poblaciones en riesgo contra una variedad de O
3– efectos adversos para la salud relacionados que van desde una disminución de la función pulmonar y un aumento de los síntomas respiratorios hasta indicadores graves de morbilidad respiratoria, incluidas visitas a servicios de urgencias y admisiones hospitalarias por causas respiratorias, y posiblemente morbilidad relacionada con enfermedades cardiovasculares, así como mortalidad total no accidental y cardiopulmonar... [114]
El 26 de octubre de 2015, la EPA publicó una norma final con fecha de vigencia el 28 de diciembre de 2015, que revisó el NAAQS primario de 8 horas de 0,075 ppm a 0,070 ppm. [115]
La EPA ha desarrollado un índice de calidad del aire (ICA) para ayudar a explicar los niveles de contaminación del aire al público en general. Según las normas actuales, las fracciones molares de ozono promedio de ocho horas de 85 a 104 nmol/mol se describen como "insalubres para grupos sensibles", de 105 nmol/mol a 124 nmol/mol como "insalubres" y de 125 nmol/mol a 404 nmol/mol como "muy insalubres". [116]
El ozono también puede estar presente en la contaminación del aire en interiores , en parte como resultado de equipos electrónicos como las fotocopiadoras. También se sabe que existe una conexión entre el aumento de polen, esporas de hongos y ozono causado por tormentas eléctricas y los ingresos hospitalarios de pacientes con asma . [117]
En la época victoriana , un mito popular británico sostenía que el olor del mar era causado por el ozono. De hecho, el característico "olor del mar" es causado por el sulfuro de dimetilo , una sustancia química generada por el fitoplancton . Los británicos victorianos consideraban que el olor resultante era "vigorizante". [118]
Una investigación para evaluar los efectos conjuntos del ozono y el calor sobre la mortalidad durante las olas de calor europeas de 2003 concluyó que estos parecen ser aditivos. [119]
El ozono, junto con formas reactivas de oxígeno como el superóxido , el oxígeno singlete , el peróxido de hidrógeno y los iones de hipoclorito , es producido por los glóbulos blancos y otros sistemas biológicos (como las raíces de las caléndulas ) como un medio para destruir cuerpos extraños. El ozono reacciona directamente con los dobles enlaces orgánicos. Además, cuando el ozono se descompone en dioxígeno da lugar a radicales libres de oxígeno , que son altamente reactivos y capaces de dañar muchas moléculas orgánicas . Además, se cree que las poderosas propiedades oxidantes del ozono pueden ser un factor que contribuye a la inflamación . La relación de causa y efecto de cómo se crea el ozono en el cuerpo y qué hace todavía está bajo consideración y todavía está sujeta a varias interpretaciones, ya que otros procesos químicos corporales pueden desencadenar algunas de las mismas reacciones. Existe evidencia que vincula la vía de oxidación del agua catalizada por anticuerpos de la respuesta inmune humana con la producción de ozono. En este sistema, el ozono se produce por la producción catalizada por anticuerpos de trioxidano a partir de agua y oxígeno singlete producido por neutrófilos. [120]
Cuando se inhala, el ozono reacciona con los compuestos que recubren los pulmones para formar metabolitos específicos derivados del colesterol que se cree que facilitan la acumulación y patogénesis de las placas ateroscleróticas (una forma de enfermedad cardíaca ). Se ha confirmado que estos metabolitos se producen de forma natural en las arterias ateroscleróticas humanas y se clasifican en una clase de secoesteroles denominados ateronales , generados por la ozonólisis del doble enlace del colesterol para formar un 5,6 secosterol [121] así como un producto de condensación secundaria a través de la aldolización. [122]
Se ha implicado al ozono como un factor adverso en el crecimiento de las plantas: "... el ozono redujo la concentración total de clorofilas, carotenoides y carbohidratos, y aumentó el contenido de ácido 1-aminociclopropano-1-carboxílico (ACC) y la producción de etileno. En las plantas tratadas, el acervo de ascorbato en las hojas disminuyó, mientras que la peroxidación lipídica y la pérdida de solutos fueron significativamente mayores que en los controles sin ozono. Los datos indicaron que el ozono desencadenó mecanismos de protección contra el estrés oxidativo en los cítricos". [123] Los estudios que han utilizado plantas de pimiento como modelo han demostrado que el ozono disminuyó el rendimiento de la fruta y cambió la calidad de la fruta. [124] [125] Además, también se observó una disminución en los niveles de clorofilas y defensas antioxidantes en las hojas, así como un aumento de los niveles de especies reactivas de oxígeno (ROS) y daños en lípidos y proteínas. [124] [125]
Un estudio de 2022 concluye que Asia Oriental pierde 63.000 millones de dólares en cultivos al año debido a la contaminación por ozono, un subproducto de la quema de combustibles fósiles. China pierde alrededor de un tercio de su producción potencial de trigo y una cuarta parte de su producción de arroz. [126] [127]
Debido a sus propiedades altamente oxidantes, el ozono es un irritante primario que afecta especialmente a los ojos y al sistema respiratorio y puede resultar peligroso incluso en concentraciones bajas. El Centro Canadiense para la Seguridad y la Salud en el Trabajo informa que:
Incluso concentraciones muy bajas de ozono pueden ser nocivas para las vías respiratorias superiores y los pulmones. La gravedad de las lesiones depende tanto de la concentración de ozono como de la duración de la exposición. Una exposición a concentraciones relativamente bajas, incluso durante un período muy breve, puede provocar lesiones pulmonares graves y permanentes o la muerte. [128]
Para proteger a los trabajadores potencialmente expuestos al ozono, la Administración de Seguridad y Salud Ocupacional de los Estados Unidos ha establecido un límite de exposición permisible (PEL) de 0,1 μmol/mol (29 CFR 1910.1000 tabla Z-1), calculado como un promedio ponderado en el tiempo de 8 horas. Las concentraciones más altas son especialmente peligrosas y el NIOSH ha establecido un límite de peligro inmediato para la vida y la salud (IDLH) de 5 μmol/mol. [129] Los entornos de trabajo donde se utiliza ozono o donde es probable que se produzca deben tener una ventilación adecuada y es prudente tener un monitor de ozono que emita una alarma si la concentración excede el PEL de OSHA. Hay monitores continuos de ozono disponibles de varios proveedores.
En los aviones de pasajeros puede producirse una exposición elevada al ozono , con niveles que dependen de la altitud y la turbulencia atmosférica. [130] Las regulaciones de la Administración Federal de Aviación de los EE. UU. establecen un límite de 250 nmol/mol con un promedio máximo de cuatro horas de 100 nmol/mol. [131] Algunos aviones están equipados con convertidores de ozono en el sistema de ventilación para reducir la exposición de los pasajeros. [130]

Los generadores de ozono , u ozonizadores , [132] se utilizan para producir ozono para limpiar el aire o eliminar olores de humo en habitaciones desocupadas. Estos generadores de ozono pueden producir más de 3 g de ozono por hora. El ozono a menudo se forma en la naturaleza en condiciones en las que el O 2 no reacciona. [28] El ozono utilizado en la industria se mide en μmol/mol (ppm, partes por millón), nmol/mol (ppb, partes por mil millones), μg/m 3 , mg/h (miligramos por hora) o porcentaje en peso. El régimen de concentraciones aplicadas varía del 1% al 5% (en aire) y del 6% al 14% (en oxígeno) para los métodos de generación más antigua. Los nuevos métodos electrolíticos pueden lograr concentraciones de ozono disuelto de hasta el 20% al 30% en el agua de salida.
La temperatura y la humedad juegan un papel importante en la cantidad de ozono que se produce con los métodos de generación tradicionales (como la descarga de corona y la luz ultravioleta). Los métodos de generación antiguos producirán menos del 50% de la capacidad nominal si funcionan con aire ambiente húmedo, en lugar de aire muy seco. Los nuevos generadores, que utilizan métodos electrolíticos, pueden lograr una mayor pureza y disolución mediante el uso de moléculas de agua como fuente de producción de ozono.

Este es el tipo más común de generador de ozono para la mayoría de los usos industriales y personales. Si bien existen variaciones del método de descarga coronal de "chispa caliente" para la producción de ozono, incluidos los generadores de ozono de grado médico e industrial, estas unidades generalmente funcionan por medio de un tubo de descarga corona o una placa de ozono. [133] [134] Por lo general, son rentables y no requieren una fuente de oxígeno distinta del aire ambiente para producir concentraciones de ozono del 3 al 6 %. Las fluctuaciones en el aire ambiente, debido al clima u otras condiciones ambientales, causan variabilidad en la producción de ozono. Sin embargo, también producen óxidos de nitrógeno como subproducto. El uso de un secador de aire puede reducir o eliminar la formación de ácido nítrico al eliminar el vapor de agua y aumentar la producción de ozono. A temperatura ambiente, el ácido nítrico se formará en un vapor que es peligroso si se inhala. Los síntomas pueden incluir dolor en el pecho, dificultad para respirar, dolores de cabeza y sequedad de nariz y garganta que causa una sensación de ardor. El uso de un concentrador de oxígeno puede aumentar aún más la producción de ozono y reducir aún más el riesgo de formación de ácido nítrico al eliminar no sólo el vapor de agua, sino también la mayor parte del nitrógeno.
Los generadores de ozono ultravioleta, o generadores de ozono ultravioleta al vacío (VUV), emplean una fuente de luz que genera una luz ultravioleta de banda estrecha, un subconjunto de la producida por el Sol. La radiación ultravioleta del Sol sustenta la capa de ozono en la estratosfera de la Tierra. [135]
Los generadores de ozono UV utilizan aire ambiente para la producción de ozono, no se utilizan sistemas de preparación de aire (secador de aire o concentrador de oxígeno), por lo tanto, estos generadores tienden a ser menos costosos. Sin embargo, los generadores de ozono UV suelen producir ozono con una concentración de aproximadamente 0,5% o menos, lo que limita la tasa potencial de producción de ozono. Otra desventaja de este método es que requiere que el aire ambiente (oxígeno) esté expuesto a la fuente UV durante un período de tiempo más largo, y cualquier gas que no esté expuesto a la fuente UV no será tratado. Esto hace que los generadores UV no sean prácticos para su uso en situaciones que tratan con corrientes de aire o agua que se mueven rápidamente ( esterilización de aire en conductos , por ejemplo). La producción de ozono es uno de los peligros potenciales de la irradiación germicida ultravioleta . Los generadores de ozono VUV se utilizan en piscinas y spas que van desde millones de galones de agua. Los generadores de ozono VUV, a diferencia de los generadores de descarga de corona, no producen subproductos de nitrógeno dañinos y también a diferencia de los sistemas de descarga de corona, los generadores de ozono VUV funcionan extremadamente bien en entornos de aire húmedo. Normalmente tampoco se necesitan costosos mecanismos de evacuación de gases, ni tampoco secadores de aire ni concentradores de oxígeno que requieren costes y mantenimiento adicionales.
En el método de plasma frío, el gas de oxígeno puro se expone a un plasma creado por DBD . El oxígeno diatómico se divide en átomos individuales, que luego se recombinan en tripletes para formar ozono. Es común en la industria etiquetar incorrectamente algunos generadores de ozono DBD como generadores de descarga de corona de CD. Por lo general, todos los generadores de ozono de electrodos de metal planos sólidos producen ozono utilizando el método de descarga de barrera dieléctrica. Las máquinas de plasma frío utilizan oxígeno puro como fuente de entrada y producen una concentración máxima de aproximadamente el 24% de ozono. Producen cantidades mucho mayores de ozono en un tiempo determinado en comparación con la producción ultravioleta que tiene aproximadamente un 2% de eficiencia. Las descargas se manifiestan como transferencia filamentosa de electrones (microdescargas) en un espacio entre dos electrodos. Para distribuir uniformemente las microdescargas, se debe utilizar un aislante dieléctrico para separar los electrodos metálicos y evitar la formación de arcos eléctricos.
La generación de ozono electrolítico (EOG) divide las moléculas de agua en H2 , O2 y O3 . En la mayoría de los métodos de EOG, se eliminará el gas hidrógeno para dejar oxígeno y ozono como los únicos productos de reacción. Por lo tanto, la EOG puede lograr una mayor disolución en agua sin otros gases competitivos que se encuentran en el método de descarga de corona, como los gases de nitrógeno presentes en el aire ambiente. Este método de generación puede lograr concentraciones de 20-30% y es independiente de la calidad del aire porque se utiliza agua como material de origen. La producción de ozono electrolíticamente suele ser desfavorable debido al alto sobrepotencial requerido para producir ozono en comparación con el oxígeno. Esta es la razón por la que no se produce ozono durante la electrólisis de agua típica. Sin embargo, es posible aumentar el sobrepotencial del oxígeno mediante una cuidadosa selección del catalizador de modo que el ozono se produzca preferentemente bajo electrólisis. Los catalizadores elegidos típicamente para este enfoque son dióxido de plomo [136] o diamante dopado con boro. [137]
La relación ozono-oxígeno se mejora aumentando la densidad de corriente en el ánodo, enfriando el electrolito alrededor del ánodo cerca de 0 °C, utilizando un electrolito ácido (como ácido sulfúrico diluido) en lugar de una solución básica y aplicando corriente pulsada en lugar de CC. [138]
El ozono no se puede almacenar ni transportar como otros gases industriales (porque se desintegra rápidamente en oxígeno diatómico) y, por lo tanto, debe producirse en el lugar. Los generadores de ozono disponibles varían en la disposición y el diseño de los electrodos de alto voltaje. En capacidades de producción superiores a 20 kg por hora, se puede utilizar un intercambiador de calor de tubo de gas/agua como electrodo de tierra y ensamblarlo con electrodos tubulares de alto voltaje en el lado del gas. El régimen de presiones de gas típicas es de alrededor de 2 bares (200 kPa ) absolutos en oxígeno y 3 bares (300 kPa) absolutos en aire. Se pueden instalar varios megavatios de energía eléctrica en grandes instalaciones, aplicados como corriente alterna monofásica a 50 a 8000 Hz y voltajes pico entre 3000 y 20 000 voltios. El voltaje aplicado suele estar inversamente relacionado con la frecuencia aplicada.
El parámetro dominante que influye en la eficiencia de la generación de ozono es la temperatura del gas, que se controla mediante la temperatura del agua de refrigeración o la velocidad del gas. Cuanto más fría esté el agua, mejor será la síntesis de ozono. Cuanto menor sea la velocidad del gas, mayor será la concentración (pero menor será el ozono neto producido). En condiciones industriales típicas, casi el 90% de la potencia efectiva se disipa en forma de calor y debe eliminarse mediante un flujo de agua de refrigeración suficiente.
Debido a la alta reactividad del ozono, solo se pueden utilizar unos pocos materiales como acero inoxidable (calidad 316L), titanio , aluminio (siempre que no haya humedad presente), vidrio , politetrafluoroetileno o fluoruro de polivinilideno . Viton se puede utilizar con la restricción de fuerzas mecánicas constantes y ausencia de humedad (se aplican limitaciones de humedad según la formulación). Hypalon se puede utilizar con la restricción de que no entre agua en contacto con él, excepto a niveles atmosféricos normales. La fragilización o contracción es el modo común de falla de los elastómeros con exposición al ozono. El agrietamiento por ozono es el modo común de falla de los sellos de elastómero como las juntas tóricas .
Los cauchos de silicona suelen ser adecuados para su uso como juntas en concentraciones de ozono inferiores al 1 % en peso, como en equipos para el envejecimiento acelerado de muestras de caucho.
El ozono puede formarse a partir de O
2por descargas eléctricas y por la acción de la radiación electromagnética de alta energía . Los arcos eléctricos no suprimidos en contactos eléctricos, escobillas de motor o interruptores mecánicos rompen los enlaces químicos del oxígeno atmosférico que rodea los contactos [ O
2→ 2O]. Los radicales libres de oxígeno dentro y alrededor del arco se recombinan para crear ozono [ O
3]. [139] Ciertos equipos eléctricos generan niveles significativos de ozono. Esto es especialmente cierto en el caso de los dispositivos que utilizan altos voltajes , como los purificadores de aire iónicos , las impresoras láser , las fotocopiadoras , las pistolas eléctricas y los soldadores de arco . Los motores eléctricos que utilizan escobillas pueden generar ozono a partir de chispas repetidas en el interior de la unidad. Los motores grandes que utilizan escobillas, como los que se utilizan en ascensores o bombas hidráulicas, generarán más ozono que los motores más pequeños.
El ozono se forma de manera similar en el fenómeno de las tormentas eléctricas del Catatumbo en el río Catatumbo en Venezuela , aunque la inestabilidad del ozono hace dudoso que tenga algún efecto sobre la ozonosfera. [140] Es el generador natural de ozono más grande del mundo, lo que hace que se lo designe Patrimonio de la Humanidad por la UNESCO . [141]

En el laboratorio, el ozono se puede producir por electrólisis utilizando una batería de 9 voltios , un cátodo de varilla de grafito de lápiz , un ánodo de alambre de platino y un electrolito de ácido sulfúrico 3 molar . [142] Las reacciones de semicelda que tienen lugar son:
donde E° representa el potencial de electrodo estándar .
En la reacción neta, tres equivalentes de agua se convierten en un equivalente de ozono y tres equivalentes de hidrógeno . La formación de oxígeno es una reacción competitiva.
También puede generarse mediante un arco de alto voltaje . En su forma más simple, la corriente alterna de alto voltaje, como la salida de un transformador de un letrero de neón, se conecta a dos varillas de metal con los extremos colocados lo suficientemente cerca uno del otro para permitir que se forme un arco. El arco resultante convertirá el oxígeno atmosférico en ozono.
A menudo es deseable contener el ozono. Esto se puede hacer con un aparato que consta de dos tubos de vidrio concéntricos sellados juntos en la parte superior con puertos de gas en la parte superior e inferior del tubo exterior. El núcleo interior debe tener una longitud de papel de aluminio insertado en él conectado a un lado de la fuente de energía. El otro lado de la fuente de energía debe estar conectado a otra pieza de papel de aluminio envuelta alrededor del tubo exterior. Una fuente de O seco
2Se aplica al puerto inferior. Cuando se aplica alto voltaje a los cables de aluminio, la electricidad se descargará entre el dioxígeno seco en el medio y formará O
3y O
2que saldrá por el puerto superior. Esto se llama ozonizador de Siemens. La reacción se puede resumir de la siguiente manera: [28]
El uso más importante del ozono es en la preparación de productos farmacéuticos , lubricantes sintéticos y muchos otros compuestos orgánicos comercialmente útiles , donde se utiliza para cortar enlaces carbono -carbono. [28] También se puede utilizar para blanquear sustancias y para matar microorganismos en fuentes de aire y agua. [143] Muchos sistemas de agua potable municipales matan bacterias con ozono en lugar del cloro más común . [144] El ozono tiene un potencial de oxidación muy alto . [145] El ozono no forma compuestos organoclorados , ni permanece en el agua después del tratamiento. El ozono puede formar el presunto carcinógeno bromato en el agua de origen con altas concentraciones de bromuro . La Ley de Agua Potable Segura de los EE. UU. exige que estos sistemas introduzcan una cantidad de cloro para mantener un mínimo de 0,2 μmol/mol de cloro libre residual en las tuberías, según los resultados de pruebas regulares. Donde la energía eléctrica es abundante, el ozono es un método rentable para tratar el agua, ya que se produce a demanda y no requiere transporte y almacenamiento de productos químicos peligrosos. Una vez descompuesto, no deja sabor ni olor en el agua potable.
Aunque se ha anunciado que los niveles bajos de ozono tienen algún uso desinfectante en hogares residenciales, la concentración de ozono en el aire seco necesaria para tener un efecto rápido y sustancial sobre los patógenos transportados por el aire supera los niveles seguros recomendados por la Administración de Seguridad y Salud Ocupacional y la Agencia de Protección Ambiental de los EE. UU . El control de la humedad puede mejorar enormemente tanto el poder destructor del ozono como la velocidad a la que se descompone nuevamente en oxígeno (más humedad permite una mayor efectividad). Las formas de esporas de la mayoría de los patógenos son muy tolerantes al ozono atmosférico en concentraciones en las que los pacientes con asma comienzan a tener problemas.
En 1908 se introdujo la ozonización artificial de la línea central del metro de Londres para la desinfección aérea. El proceso resultó ser rentable, pero se abandonó en 1956. Sin embargo, el efecto beneficioso se mantuvo gracias al ozono creado de forma incidental a partir de las descargas eléctricas de los motores del tren (véase más arriba: Producción incidental). [146]
Se pusieron a disposición de las escuelas y universidades de Gales generadores de ozono para el semestre de otoño de 2021, para desinfectar las aulas después de los brotes de COVID-19 . [147]
Industrialmente, el ozono se utiliza para:
El ozono es un reactivo en muchas reacciones orgánicas en el laboratorio y en la industria. La ozonólisis es la descomposición de un alqueno en compuestos carbonílicos .
Muchos hospitales de todo el mundo utilizan grandes generadores de ozono para descontaminar los quirófanos entre cirugías. Las salas se limpian y luego se sellan herméticamente antes de llenarlas con ozono, que mata o neutraliza eficazmente todas las bacterias restantes. [153]
El ozono se utiliza como alternativa al cloro o al dióxido de cloro en el blanqueo de pulpa de madera . [154] A menudo se utiliza junto con oxígeno y peróxido de hidrógeno para eliminar la necesidad de compuestos que contienen cloro en la fabricación de papel blanco de alta calidad . [155]
El ozono se puede utilizar para desintoxicar los desechos de cianuro (por ejemplo, de la minería de oro y plata ) oxidando el cianuro a cianato y, finalmente, a dióxido de carbono . [156]
Desde la invención de los reactores de plasma de descarga de barrera dieléctrica (DBD), se ha empleado para el tratamiento de agua con ozono. [157] Sin embargo, con desinfectantes alternativos más baratos como el cloro, tales aplicaciones de descontaminación de agua con ozono DBD se han visto limitadas por el alto consumo de energía y el equipo voluminoso. [158] [159] A pesar de esto, con la investigación que revela los impactos negativos de los desinfectantes comunes como el cloro con respecto a los residuos tóxicos y la ineficacia para matar ciertos microorganismos, [160] la descontaminación con ozono basada en plasma DBD es de interés en las tecnologías disponibles actuales. Aunque la ozonización del agua con una alta concentración de bromuro conduce a la formación de subproductos de desinfección bromados indeseables, a menos que el agua potable se produzca por desalinización, la ozonización generalmente se puede aplicar sin preocuparse por estos subproductos. [159] [161] [162] [163] Las ventajas del ozono incluyen un alto potencial de oxidación termodinámica, menor sensibilidad al material orgánico y mejor tolerancia a las variaciones de pH, manteniendo al mismo tiempo la capacidad de matar bacterias, hongos, virus, así como esporas y quistes. [164] [165] [166] Aunque el ozono ha sido ampliamente aceptado en Europa durante décadas, se utiliza con moderación para la descontaminación en los EE. UU. debido a las limitaciones del alto consumo de energía, la instalación voluminosa y el estigma asociado con la toxicidad del ozono. [158] [167] Considerando esto, los esfuerzos de investigación recientes se han dirigido hacia el estudio de sistemas efectivos de tratamiento de agua con ozono. [168] Los investigadores han analizado reactores DBD de superficie de bajo consumo ligeros y compactos, [169] [170] reactores DBD de volumen energéticamente eficientes [171] y reactores DBD de microescala de bajo consumo. [172] [173] Estos estudios pueden ayudar a allanar el camino hacia la reaceptación de la descontaminación del agua con ozono basada en plasma DBD, especialmente en los EE. UU.
Los niveles de ozono que son seguros para las personas son ineficaces para matar hongos y bacterias. [174] Algunos productos cosméticos y de desinfección de consumo emiten ozono en niveles nocivos para la salud humana. [174]
Los dispositivos que generan altos niveles de ozono, algunos de los cuales utilizan ionización, se utilizan para desinfectar y desodorizar edificios deshabitados, habitaciones, conductos, cobertizos, barcos y otros vehículos.
El agua ozonizada se utiliza para lavar ropa y desinfectar alimentos, agua potable y superficies del hogar. Según la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA), está "modificando las regulaciones sobre aditivos alimentarios para permitir el uso seguro del ozono en fases gaseosas y acuosas como agente antimicrobiano en alimentos, incluidas la carne y las aves de corral". Estudios realizados en la Universidad Politécnica de California demostraron que niveles de 0,3 μmol/mol de ozono disuelto en agua del grifo filtrada pueden producir una reducción de más del 99,99% en microorganismos transmitidos por los alimentos como la salmonela, E. coli 0157:H7 y Campylobacter . Esta cantidad es 20.000 veces los límites recomendados por la OMS indicados anteriormente. [149] [175] El ozono se puede utilizar para eliminar residuos de pesticidas de frutas y verduras . [176] [177]
El ozono se utiliza en los hogares y en los jacuzzis para matar las bacterias del agua y reducir la cantidad de cloro o bromo necesaria reactivándolos a su estado libre. Como el ozono no permanece en el agua el tiempo suficiente, por sí solo no es eficaz para prevenir la contaminación cruzada entre los bañistas y debe utilizarse junto con halógenos . El ozono gaseoso creado por luz ultravioleta o por descarga de corona se inyecta en el agua. [178]
El ozono también se utiliza ampliamente en el tratamiento del agua de acuarios y estanques de peces. Su uso puede minimizar el crecimiento bacteriano, controlar los parásitos, eliminar la transmisión de algunas enfermedades y reducir o eliminar el "amarillento" del agua. El ozono no debe entrar en contacto con las estructuras branquiales de los peces. El agua salada natural (con formas de vida) proporciona suficiente "demanda instantánea" para que cantidades controladas de ozono activen los iones de bromuro en ácido hipobromoso , y el ozono se descomponga por completo en unos pocos segundos o minutos. Si se utiliza ozono alimentado con oxígeno, el agua tendrá un mayor contenido de oxígeno disuelto y las estructuras branquiales de los peces se atrofiarán, haciéndolos dependientes del agua enriquecida con oxígeno.
La ozonización, un proceso de infusión de ozono en el agua, se puede utilizar en la acuicultura para facilitar la descomposición orgánica. También se añade ozono a los sistemas de recirculación para reducir los niveles de nitrito [179] mediante la conversión en nitrato . Si los niveles de nitrito en el agua son altos, los nitritos también se acumularán en la sangre y los tejidos de los peces, donde interfieren con el transporte de oxígeno (provoca la oxidación del grupo hemo de la hemoglobina a partir de ferrosos ( Fe2+
) a férrico ( Fe3+
), lo que hace que la hemoglobina no pueda unirse al O
2). [180] A pesar de estos aparentes efectos positivos, el uso de ozono en sistemas de recirculación se ha relacionado con la reducción del nivel de yodo biodisponible en sistemas de agua salada, lo que resulta en síntomas de deficiencia de yodo como bocio y disminución del crecimiento de las larvas del lenguado senegalés ( Solea senegalensis ). [181]
El agua de mar ozonizada se utiliza para la desinfección de la superficie de los huevos de eglefino y fletán del Atlántico contra el nodavirus. El nodavirus es un virus letal y de transmisión vertical que causa una grave mortalidad en los peces. Los huevos de eglefino no deben tratarse con un alto nivel de ozono, ya que los huevos tratados de esta manera no eclosionan y mueren después de 3 o 4 días. [182]
La aplicación de ozono en piña y plátano recién cortados muestra un aumento en los contenidos de flavonoides y fenoles totales cuando la exposición es de hasta 20 minutos. Se observa una disminución en el contenido de ácido ascórbico (una forma de vitamina C ), pero el efecto positivo en el contenido de fenoles totales y flavonoides puede superar el efecto negativo. [183] Los tomates tratados con ozono muestran un aumento en β-caroteno, luteína y licopeno. [184] Sin embargo, la aplicación de ozono en fresas en el período previo a la cosecha muestra una disminución en el contenido de ácido ascórbico. [185]
El ozono facilita la extracción de algunos metales pesados del suelo utilizando EDTA . El EDTA forma compuestos de coordinación fuertes y solubles en agua con algunos metales pesados ( Pb , Zn ), lo que permite disolverlos del suelo contaminado. Si el suelo contaminado se trata previamente con ozono, la eficacia de extracción de Pb , Am y Pu aumenta entre un 11,0 y un 28,9 %, [186] , un 43,5 % [187] y un 50,7 % [187] respectivamente.
La polinización de los cultivos es una parte esencial de un ecosistema. El ozono puede tener efectos perjudiciales en las interacciones entre plantas y polinizadores. [188] Los polinizadores transportan polen de una planta a otra. Este es un ciclo esencial dentro de un ecosistema. Provocar cambios en ciertas condiciones atmosféricas alrededor de los sitios de polinización o con xenobióticos podría causar cambios desconocidos en los ciclos naturales de los polinizadores y las plantas con flores. En un estudio realizado en el noroeste de Europa, los polinizadores de cultivos se vieron afectados negativamente más cuando los niveles de ozono eran más altos. [189]
El uso de ozono para el tratamiento de enfermedades no está respaldado por evidencia de alta calidad y generalmente se considera medicina alternativa . [190]
Notas al pie
Citas
Ozono. Molécula triatómica diamagnética...
{{cite web}}: CS1 maint: unfit URL (link)