El carbono (del latín carbo 'carbón') es un elemento químico ; tiene símbolo C y número atómico 6. Es no metálico y tetravalente , lo que significa que sus átomos pueden formar hasta cuatro enlaces covalentes debido a que su capa de valencia exhibe 4 electrones. Pertenece al grupo 14 de la tabla periódica . [14] El carbono constituye aproximadamente el 0,025 por ciento de la corteza terrestre. [15] Tres isótopos ocurren naturalmente, 12 C y 13 C son estables, mientras que 14 C es un radionúclido , que se desintegra con una vida media de 5.700 años. [16] El carbono es uno de los pocos elementos conocidos desde la antigüedad . [17]
El carbono es el decimoquinto elemento más abundante en la corteza terrestre y el cuarto elemento más abundante en el universo en términos de masa, después del hidrógeno , el helio y el oxígeno . La abundancia del carbono, su diversidad única de compuestos orgánicos y su capacidad inusual para formar polímeros a las temperaturas que se encuentran comúnmente en la Tierra, permiten que este elemento sirva como un elemento común de toda la vida conocida . Es el segundo elemento más abundante en el cuerpo humano en términos de masa (alrededor del 18,5 %) después del oxígeno. [18]
Los átomos de carbono pueden unirse entre sí de diversas formas, lo que da lugar a varios alótropos del carbono . Los alótropos conocidos incluyen grafito , diamante , carbono amorfo y fulerenos . Las propiedades físicas del carbono varían ampliamente con la forma alotrópica. Por ejemplo, el grafito es opaco y negro, mientras que el diamante es muy transparente . El grafito es lo suficientemente blando como para formar una raya en el papel (de ahí su nombre, del verbo griego "γράφειν" que significa "escribir"), mientras que el diamante es el material natural más duro conocido. El grafito es un buen conductor eléctrico , mientras que el diamante tiene una conductividad eléctrica baja . En condiciones normales, el diamante, los nanotubos de carbono y el grafeno tienen las conductividades térmicas más altas de todos los materiales conocidos. Todos los alótropos del carbono son sólidos en condiciones normales, siendo el grafito la forma más estable termodinámicamente a temperatura y presión estándar. Son químicamente resistentes y requieren altas temperaturas para reaccionar incluso con oxígeno.
El estado de oxidación más común del carbono en compuestos inorgánicos es +4, mientras que +2 se encuentra en el monóxido de carbono y en los complejos carbonílicos de metales de transición . Las mayores fuentes de carbono inorgánico son las calizas , las dolomitas y el dióxido de carbono , pero se encuentran cantidades significativas en depósitos orgánicos de carbón , turba , petróleo y clatratos de metano . El carbono forma una gran cantidad de compuestos , de los cuales se han descrito e indexado alrededor de doscientos millones; [19] y, sin embargo, ese número es solo una fracción del número de compuestos teóricamente posibles en condiciones estándar.

Los alótropos del carbono incluyen el grafito , una de las sustancias más blandas conocidas, y el diamante , la sustancia más dura que se encuentra en la naturaleza. Se une fácilmente con otros átomos pequeños, incluidos otros átomos de carbono, y es capaz de formar múltiples enlaces covalentes estables con átomos multivalentes adecuados. El carbono es un elemento componente en la gran mayoría de todos los compuestos químicos , con alrededor de doscientos millones de ejemplos descritos en la literatura química publicada. [19] El carbono también tiene el punto de sublimación más alto de todos los elementos. A presión atmosférica no tiene punto de fusión, ya que su punto triple está a 10,8 ± 0,2 megapascales (106,6 ± 2,0 atm; 1.566 ± 29 psi) y 4.600 ± 300 K (4.330 ± 300 °C; 7.820 ± 540 °F), [5] [6] por lo que sublima a unos 3.900 K (3.630 °C; 6.560 °F). [21] [22] El grafito es mucho más reactivo que el diamante en condiciones estándar, a pesar de ser más estable termodinámicamente, ya que su sistema pi deslocalizado es mucho más vulnerable al ataque. Por ejemplo, el grafito puede oxidarse con ácido nítrico concentrado caliente en condiciones estándar a ácido melítico , C 6 (CO 2 H) 6 , que conserva las unidades hexagonales del grafito al tiempo que rompe la estructura más grande. [23]
El carbono se sublima en un arco de carbono, que tiene una temperatura de aproximadamente 5800 K (5530 °C o 9980 °F). Por lo tanto, independientemente de su forma alotrópica, el carbono permanece sólido a temperaturas más altas que los metales con el punto de fusión más alto, como el tungsteno o el renio . Aunque termodinámicamente es propenso a la oxidación, el carbono resiste la oxidación con mayor eficacia que elementos como el hierro y el cobre, que son agentes reductores más débiles a temperatura ambiente.
El carbono es el sexto elemento, con una configuración electrónica fundamental de 1s 2 2s 2 2p 2 , de la cual los cuatro electrones externos son electrones de valencia . Sus primeras cuatro energías de ionización, 1086,5, 2352,6, 4620,5 y 6222,7 kJ/mol, son mucho más altas que las de los elementos más pesados del grupo 14. La electronegatividad del carbono es 2,5, significativamente más alta que los elementos más pesados del grupo 14 (1,8-1,9), pero cercana a la mayoría de los no metales cercanos, así como a algunos de los metales de transición de segunda y tercera fila . Los radios covalentes del carbono normalmente se toman como 77,2 pm (C−C), 66,7 pm (C=C) y 60,3 pm (C≡C), aunque estos pueden variar dependiendo del número de coordinación y a qué está unido el carbono. En general, el radio covalente disminuye con un número de coordinación más bajo y un orden de enlace más alto. [24]
Los compuestos a base de carbono forman la base de toda la vida conocida en la Tierra, y el ciclo carbono-nitrógeno-oxígeno proporciona una pequeña parte de la energía producida por el Sol, y la mayor parte de la energía en estrellas más grandes (por ejemplo, Sirio ). Aunque forma una extraordinaria variedad de compuestos, la mayoría de las formas de carbono son comparativamente poco reactivas en condiciones normales. A temperatura y presión estándar, resiste todos los oxidantes excepto los más fuertes. No reacciona con ácido sulfúrico , ácido clorhídrico , cloro o cualquier álcali . A temperaturas elevadas, el carbono reacciona con el oxígeno para formar óxidos de carbono y robará oxígeno de los óxidos metálicos para dejar el metal elemental. Esta reacción exotérmica se utiliza en la industria del hierro y el acero para fundir el hierro y controlar el contenido de carbono del acero :
El carbono reacciona con el azufre para formar disulfuro de carbono y reacciona con el vapor en la reacción de gas de carbón utilizada en la gasificación del carbón :
El carbono se combina con algunos metales a altas temperaturas para formar carburos metálicos, como el carburo de hierro cementita en acero y el carburo de tungsteno , ampliamente utilizado como abrasivo y para fabricar puntas duras para herramientas de corte.
El sistema de alótropos del carbono abarca una gama de extremos:
El carbono atómico es una especie de vida muy corta y, por lo tanto, el carbono se estabiliza en varias estructuras multiatómicas con diversas configuraciones moleculares llamadas alótropos . Los tres alótropos relativamente conocidos del carbono son el carbono amorfo , el grafito y el diamante. Los fulerenos , que alguna vez se consideraron exóticos, hoy en día se sintetizan y utilizan comúnmente en la investigación; incluyen buckyballs , [30] [31] nanotubos de carbono , [32] nanobuds de carbono [33] y nanofibras . [34] [35] También se han descubierto varios otros alótropos exóticos, como la lonsdaleíta , [36] el carbono vítreo , [37] la nanoespuma de carbono [38] y el carbono acetilénico lineal (carbino). [39]
El grafeno es una lámina bidimensional de carbono con átomos dispuestos en una red hexagonal. A fecha de 2009, el grafeno parece ser el material más resistente jamás probado. [40] El proceso de separación del grafeno requerirá un mayor desarrollo tecnológico antes de que resulte económico para los procesos industriales. [41] Si tiene éxito, el grafeno podría utilizarse en la construcción de un ascensor espacial . También podría utilizarse para almacenar hidrógeno de forma segura para su uso en un motor basado en hidrógeno en los automóviles. [42]

La forma amorfa es una variedad de átomos de carbono en un estado no cristalino, irregular y vítreo, no mantenido en una macroestructura cristalina. Está presente como un polvo y es el componente principal de sustancias como el carbón vegetal, el negro de humo (hollín) y el carbón activado . A presiones normales, el carbono toma la forma de grafito, en el que cada átomo está unido trigonalmente a otros tres en un plano compuesto de anillos hexagonales fusionados , al igual que los de los hidrocarburos aromáticos . [43] La red resultante es bidimensional y las láminas planas resultantes se apilan y se unen de forma flexible a través de fuerzas débiles de van der Waals . Esto le da al grafito su suavidad y sus propiedades de escisión (las láminas se deslizan fácilmente unas sobre otras). Debido a la deslocalización de uno de los electrones externos de cada átomo para formar una nube π , el grafito conduce electricidad , pero solo en el plano de cada lámina unida covalentemente . Esto da como resultado una conductividad eléctrica en masa menor para el carbono que para la mayoría de los metales. La deslocalización también explica la estabilidad energética del grafito sobre el diamante a temperatura ambiente.

A presiones muy altas, el carbono forma el alótropo más compacto, el diamante, que tiene casi el doble de densidad que el grafito. Aquí, cada átomo está unido tetraédricamente a otros cuatro, formando una red tridimensional de anillos de átomos de seis miembros fruncidos. El diamante tiene la misma estructura cúbica que el silicio y el germanio , y debido a la fuerza de los enlaces carbono-carbono , es la sustancia natural más dura medida por la resistencia al rayado . Contrariamente a la creencia popular de que "los diamantes son para siempre" , son termodinámicamente inestables ( Δ f G ° (diamante, 298 K) = 2,9 kJ/mol [44] ) en condiciones normales (298 K, 10 5 Pa) y teóricamente deberían transformarse en grafito. [45] Pero debido a una alta barrera de energía de activación , la transición a grafito es tan lenta a temperatura normal que es imperceptible. Sin embargo, a temperaturas muy altas, el diamante se convertirá en grafito y los diamantes pueden quemarse en un incendio doméstico. La esquina inferior izquierda del diagrama de fases del carbono no ha sido examinada experimentalmente. Aunque un estudio computacional que emplea métodos de teoría funcional de la densidad llegó a la conclusión de que a medida que T → 0 K y p → 0 Pa , el diamante se vuelve más estable que el grafito en aproximadamente 1,1 kJ/mol, [46] estudios experimentales y computacionales más recientes y definitivos muestran que el grafito es más estable que el diamante para T < 400 K , sin presión aplicada, en 2,7 kJ/mol a T = 0 K y 3,2 kJ/mol a T = 298,15 K. [47] En algunas condiciones, el carbono cristaliza como lonsdaleíta , una red cristalina hexagonal con todos los átomos unidos covalentemente y propiedades similares a las del diamante. [36]
Los fulerenos son una formación cristalina sintética con una estructura similar al grafito, pero en lugar de celdas hexagonales planas solamente, algunas de las celdas de las que se forman los fulerenos pueden ser pentágonos, hexágonos no planos o incluso heptágonos de átomos de carbono. Las láminas se deforman así en esferas, elipses o cilindros. Las propiedades de los fulerenos (divididos en buckyballs, buckytubes y nanobuds) aún no se han analizado por completo y representan un área intensa de investigación en nanomateriales . Los nombres fullereno y buckyball se dan en honor a Richard Buckminster Fuller , divulgador de las cúpulas geodésicas , que se asemejan a la estructura de los fulerenos. Las buckyballs son moléculas bastante grandes formadas completamente de carbono unido trigonalmente, formando esferoides (el más conocido y simple es el buckminsterfullereno C 60 con forma de balón de fútbol ). [30] Los nanotubos de carbono (buckytubes) son estructuralmente similares a las buckyballs, excepto que cada átomo está unido trigonalmente en una lámina curva que forma un cilindro hueco . [31] [32] Los nanobuds se informaron por primera vez en 2007 y son materiales híbridos buckytube/buckyball (buckyballs están unidos covalentemente a la pared exterior de un nanotubo) que combinan las propiedades de ambos en una sola estructura. [33]

De los otros alótropos descubiertos, la nanoespuma de carbono es un alótropo ferromagnético descubierto en 1997. Consiste en un conjunto de grupos de átomos de carbono de baja densidad unidos en una red tridimensional suelta, en la que los átomos están unidos trigonalmente en anillos de seis y siete miembros. Es uno de los sólidos más ligeros conocidos, con una densidad de aproximadamente 2 kg/m 3 . [48] De manera similar, el carbono vítreo contiene una alta proporción de porosidad cerrada , [37] pero, a diferencia del grafito normal, las capas grafíticas no están apiladas como las páginas de un libro, sino que tienen una disposición más aleatoria. El carbono acetilénico lineal [39] tiene la estructura química [39] −(C≡C) n − . El carbono en esta modificación es lineal con hibridación orbital sp , y es un polímero con enlaces simples y triples alternados. Este carbino es de considerable interés para la nanotecnología ya que su módulo de Young es 40 veces el del material más duro conocido: el diamante. [49]
En 2015, un equipo de la Universidad Estatal de Carolina del Norte anunció el desarrollo de otro alótropo al que denominaron carbono Q , creado mediante un pulso láser de alta energía y baja duración sobre polvo de carbono amorfo. Se informa que el carbono Q presenta ferromagnetismo, fluorescencia y una dureza superior a los diamantes. [50]
En la fase de vapor, parte del carbono se encuentra en forma de dicarbonato diatómico altamente reactivo ( C2 ). Cuando se excita, este gas brilla de color verde.


El carbono es el cuarto elemento químico más abundante en el universo observable por masa después del hidrógeno, el helio y el oxígeno. El carbono es abundante en el Sol, las estrellas, los cometas y en las atmósferas de la mayoría de los planetas. [51] Algunos meteoritos contienen diamantes microscópicos que se formaron cuando el Sistema Solar todavía era un disco protoplanetario . [52] Los diamantes microscópicos también pueden formarse por la intensa presión y la alta temperatura en los lugares de impacto de meteoritos. [53]
En 2014, la NASA anunció una base de datos muy mejorada para rastrear los hidrocarburos aromáticos policíclicos (HAP) en el universo. Más del 20% del carbono en el universo puede estar asociado con los HAP, compuestos complejos de carbono e hidrógeno sin oxígeno. [54] Estos compuestos figuran en la hipótesis del mundo de los HAP , donde se plantea la hipótesis de que tienen un papel en la abiogénesis y la formación de la vida. Los HAP parecen haberse formado "un par de miles de millones de años" después del Big Bang , están ampliamente distribuidos por todo el universo y están asociados con nuevas estrellas y exoplanetas . [51]
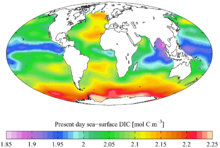
Se ha estimado que la Tierra sólida en su conjunto contiene 730 ppm de carbono, con 2000 ppm en el núcleo y 120 ppm en el manto y la corteza combinados. [55] Dado que la masa de la Tierra es5,972 × 10 24 kg , lo que implicaría 4360 millones de gigatoneladas de carbono, una cantidad mucho mayor que la que hay en los océanos o en la atmósfera (ver abajo).
En combinación con el oxígeno en el dióxido de carbono, el carbono se encuentra en la atmósfera de la Tierra (aproximadamente 900 gigatoneladas de carbono, cada ppm corresponde a 2,13 Gt) y disuelto en todos los cuerpos de agua (aproximadamente 36.000 gigatoneladas de carbono). El carbono en la biosfera se ha estimado en 550 gigatoneladas, pero con una gran incertidumbre, debido principalmente a una enorme incertidumbre en la cantidad de bacterias terrestres del subsuelo profundo . [56] Los hidrocarburos (como el carbón, el petróleo y el gas natural) también contienen carbono. Las "reservas" (no los "recursos") de carbón ascienden a alrededor de 900 gigatoneladas con quizás 18.000 Gt de recursos. [57] Las reservas de petróleo son de alrededor de 150 gigatoneladas. Las fuentes probadas de gas natural son de aproximadamente175 × 10 12 metros cúbicos (que contienen alrededor de 105 gigatoneladas de carbono), pero los estudios estiman otras900 × 10 12 metros cúbicos de depósitos “no convencionales” como el gas de esquisto , que representan alrededor de 540 gigatoneladas de carbono. [58]
También se encuentra carbono en los hidratos de metano de las regiones polares y bajo los mares. Según diversas estimaciones, este carbono se encuentra entre 500, 2500 [59] o 3000 Gt. [60]
Según una fuente, en el período de 1751 a 2008 se liberaron alrededor de 347 gigatoneladas de carbono en forma de dióxido de carbono a la atmósfera a partir de la quema de combustibles fósiles. [61] Otra fuente estima que la cantidad añadida a la atmósfera durante el período desde 1750 fue de 879 Gt, y el total que llegó a la atmósfera, el mar y la tierra (como las turberas ) fue de casi 2000 Gt. [62]
El carbono es un componente (alrededor del 12% en masa) de las grandes masas de roca carbonatada ( caliza , dolomita , mármol y otras). El carbón es muy rico en carbono ( la antracita contiene entre el 92 y el 98%) [63] y es la mayor fuente comercial de carbono mineral, representando 4.000 gigatoneladas o el 80% del combustible fósil . [64]
En cuanto a los alótropos de carbono individuales, el grafito se encuentra en grandes cantidades en los Estados Unidos (principalmente en Nueva York y Texas ), Rusia, México, Groenlandia y la India. Los diamantes naturales se encuentran en la roca kimberlita , que se encuentra en antiguos "cuellos" o "tuberías" volcánicas. La mayoría de los depósitos de diamantes se encuentran en África, especialmente en Sudáfrica, Namibia, Botsuana, la República del Congo y Sierra Leona. También se han encontrado depósitos de diamantes en Arkansas , Canadá, el Ártico ruso, Brasil y en el norte y oeste de Australia. Ahora también se están recuperando diamantes del fondo del océano frente al Cabo de Buena Esperanza . Los diamantes se encuentran de forma natural, pero aproximadamente el 30% de todos los diamantes industriales utilizados en los EE. UU. ahora son manufacturados.
El carbono-14 se forma en las capas superiores de la troposfera y la estratosfera a altitudes de 9 a 15 km mediante una reacción que se precipita por los rayos cósmicos . [65] Se producen neutrones térmicos que chocan con los núcleos del nitrógeno-14, formando carbono-14 y un protón. Como tal,El 1,5% × 10 −10 del dióxido de carbono atmosférico contiene carbono-14. [66]
Los asteroides ricos en carbono son relativamente preponderantes en las partes externas del cinturón de asteroides del Sistema Solar. Estos asteroides aún no han sido muestreados directamente por los científicos. Los asteroides podrían usarse en una hipotética minería de carbono basada en el espacio , lo que podría ser posible en el futuro, pero que actualmente es tecnológicamente imposible. [67]
Los isótopos del carbono son núcleos atómicos que contienen seis protones más un número de neutrones (que varía de 2 a 16). El carbono tiene dos isótopos estables que se producen de forma natural. [68] El isótopo carbono-12 ( 12 C) forma el 98,93% del carbono en la Tierra, mientras que el carbono-13 ( 13 C) forma el 1,07% restante. [68] La concentración de 12 C aumenta aún más en los materiales biológicos porque las reacciones bioquímicas discriminan al 13 C. [69] En 1961, la Unión Internacional de Química Pura y Aplicada (IUPAC) adoptó el isótopo carbono-12 como base para los pesos atómicos . [70] La identificación del carbono en experimentos de resonancia magnética nuclear (RMN) se realiza con el isótopo 13 C.
El carbono-14 ( 14 C) es un radioisótopo natural , creado en la atmósfera superior ( estratosfera inferior y troposfera superior ) por la interacción del nitrógeno con los rayos cósmicos. [71] Se encuentra en cantidades traza en la Tierra de 1 parte por billón (0,0000000001%) o más, principalmente confinado a la atmósfera y depósitos superficiales, particularmente de turba y otros materiales orgánicos. [72] Este isótopo se desintegra por emisión β − de 0,158 MeV . Debido a su vida media relativamente corta ,5700 ± 30 años, [16] El 14 C está prácticamente ausente en las rocas antiguas. La cantidad de 14 C en la atmósfera y en los organismos vivos es casi constante, pero disminuye de manera predecible en sus cuerpos después de la muerte. Este principio se utiliza en la datación por radiocarbono , inventada en 1949, que se ha utilizado ampliamente para determinar la edad de materiales carbonosos con edades de hasta aproximadamente 40.000 años. [73] [74]
Hay 15 isótopos conocidos de carbono y el de vida más corta de ellos es el 8 C, que se desintegra por emisión de protones y tiene una vida media de 3,5 × 10 −21 s. [16] El exótico 19 C exhibe un halo nuclear , lo que significa que su radio es apreciablemente mayor de lo que se esperaría si el núcleo fuera una esfera de densidad constante. [75]
La formación del núcleo atómico de carbono ocurre dentro de una estrella gigante o supergigante a través del proceso triple alfa . Esto requiere una colisión casi simultánea de tres partículas alfa (núcleos de helio), ya que los productos de posteriores reacciones de fusión nuclear de helio con hidrógeno u otro núcleo de helio producen litio-5 y berilio-8 respectivamente, los cuales son altamente inestables y se desintegran casi instantáneamente en núcleos más pequeños. [76] El proceso triple alfa ocurre en condiciones de temperaturas superiores a 100 megakelvins y concentración de helio que la rápida expansión y enfriamiento del universo primitivo prohibió, y por lo tanto no se creó carbono significativo durante el Big Bang.
Según la teoría actual de la cosmología física, el carbono se forma en el interior de las estrellas de la rama horizontal . [77] Cuando las estrellas masivas mueren como supernovas, el carbono se dispersa en el espacio en forma de polvo. Este polvo se convierte en material componente para la formación de los sistemas estelares de próxima generación con planetas acrecionados. [51] [78] El Sistema Solar es uno de esos sistemas estelares con una abundancia de carbono, lo que permite la existencia de vida tal como la conocemos. La opinión de la mayoría de los estudiosos es que todo el carbono del Sistema Solar y la Vía Láctea proviene de estrellas moribundas. [79] [80] [81]
El ciclo CNO es un mecanismo adicional de fusión de hidrógeno que alimenta a las estrellas, en el que el carbono actúa como catalizador.
Las transiciones rotacionales de varias formas isotópicas de monóxido de carbono (por ejemplo, 12 CO, 13 CO y 18 CO) son detectables en el rango de longitud de onda submilimétrica y se utilizan en el estudio de estrellas recién formadas en nubes moleculares . [82]
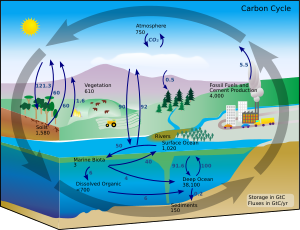
En condiciones terrestres, la conversión de un elemento en otro es muy rara. Por lo tanto, la cantidad de carbono en la Tierra es efectivamente constante. Por lo tanto, los procesos que utilizan carbono deben obtenerlo de algún lugar y desecharlo en otro. Las rutas del carbono en el medio ambiente forman el ciclo del carbono . [83] Por ejemplo, las plantas fotosintéticas extraen dióxido de carbono de la atmósfera (o del agua de mar) y lo convierten en biomasa, como en el ciclo de Calvin , un proceso de fijación del carbono . [84] Los animales comen parte de esta biomasa, mientras que los animales exhalan parte del carbono en forma de dióxido de carbono. El ciclo del carbono es considerablemente más complicado que este corto bucle; por ejemplo, parte del dióxido de carbono se disuelve en los océanos; si las bacterias no lo consumen, la materia vegetal o animal muerta puede convertirse en petróleo o carbón, que libera carbono cuando se quema. [85] [86]


El carbono puede formar cadenas muy largas de enlaces carbono-carbono interconectados , una propiedad que se denomina concatenación . Los enlaces carbono-carbono son fuertes y estables. A través de la concatenación, el carbono forma una incontable cantidad de compuestos. Un recuento de compuestos únicos muestra que más contienen carbono que los que no lo contienen. [87] Se puede hacer una afirmación similar para el hidrógeno porque la mayoría de los compuestos orgánicos contienen hidrógeno unido químicamente al carbono u otro elemento común como el oxígeno o el nitrógeno.
La forma más simple de una molécula orgánica es el hidrocarburo, una gran familia de moléculas orgánicas que se componen de átomos de hidrógeno unidos a una cadena de átomos de carbono. Una cadena principal de hidrocarburos puede ser sustituida por otros átomos, conocidos como heteroátomos . Los heteroátomos comunes que aparecen en los compuestos orgánicos incluyen oxígeno, nitrógeno, azufre, fósforo y los halógenos no radiactivos, así como los metales litio y magnesio. Los compuestos orgánicos que contienen enlaces a metales se conocen como compuestos organometálicos ( ver más abajo ). Ciertas agrupaciones de átomos, que a menudo incluyen heteroátomos, se repiten en un gran número de compuestos orgánicos. Estas colecciones, conocidas como grupos funcionales , confieren patrones de reactividad comunes y permiten el estudio sistemático y la categorización de los compuestos orgánicos. La longitud de la cadena, la forma y los grupos funcionales afectan las propiedades de las moléculas orgánicas. [88]
En la mayoría de los compuestos estables de carbono (y en casi todos los compuestos orgánicos estables ), el carbono obedece la regla del octeto y es tetravalente , lo que significa que un átomo de carbono forma un total de cuatro enlaces covalentes (que pueden incluir enlaces dobles y triples). Las excepciones incluyen una pequeña cantidad de carbocationes estabilizados (tres enlaces, carga positiva), radicales (tres enlaces, neutros), carbaniones (tres enlaces, carga negativa) y carbenos (dos enlaces, neutros), aunque es mucho más probable que estas especies se encuentren como intermediarios inestables y reactivos.
El carbono está presente en todos los seres vivos orgánicos conocidos y es la base de la química orgánica . Cuando se combina con el hidrógeno, forma diversos hidrocarburos que son importantes para la industria como refrigerantes, lubricantes, disolventes, materia prima química para la fabricación de plásticos y petroquímicos y como combustibles fósiles.
Cuando se combina con oxígeno e hidrógeno, el carbono puede formar muchos grupos de compuestos biológicos importantes, incluyendo azúcares, lignanos , quitinas , alcoholes, grasas, ésteres aromáticos , carotenoides y terpenos . Con nitrógeno, forma alcaloides , y con la adición de azufre también forma antibióticos, aminoácidos y productos de caucho. Con la adición de fósforo a estos otros elementos, forma ADN y ARN , los portadores del código químico de la vida, y trifosfato de adenosina (ATP), la molécula de transferencia de energía más importante en todas las células vivas. [89] Norman Horowitz , jefe de las misiones Mariner y Viking a Marte (1965-1976), consideró que las características únicas del carbono hacían improbable que cualquier otro elemento pudiera reemplazar al carbono, incluso en otro planeta, para generar la bioquímica necesaria para la vida. [90]
Comúnmente, los compuestos que contienen carbono que están asociados con minerales o que no contienen enlaces con otros átomos de carbono, halógenos o hidrógeno, se tratan por separado de los compuestos orgánicos clásicos; la definición no es rígida y la clasificación de algunos compuestos puede variar de un autor a otro (ver artículos de referencia anteriores). Entre estos se encuentran los óxidos simples de carbono. El óxido más destacado es el dióxido de carbono (CO 2 ). Este fue alguna vez el principal constituyente de la paleoatmósfera , pero hoy es un componente menor de la atmósfera de la Tierra . [91] Disuelto en agua, forma ácido carbónico ( H
2CO
3), pero como la mayoría de los compuestos con múltiples oxígenos unidos por enlaces simples en un solo carbono, es inestable. [92] Sin embargo, a través de este intermediario se producen iones carbonato estabilizados por resonancia. Algunos minerales importantes son carbonatos, en particular la calcita . El disulfuro de carbono ( CS
2) es similar. [23] Sin embargo, debido a sus propiedades físicas y su asociación con la síntesis orgánica, el disulfuro de carbono a veces se clasifica como un solvente orgánico .
El otro óxido común es el monóxido de carbono (CO). Se forma por combustión incompleta y es un gas incoloro e inodoro. Cada molécula contiene un triple enlace y es bastante polar , lo que da como resultado una tendencia a unirse permanentemente a las moléculas de hemoglobina, desplazando al oxígeno, que tiene una menor afinidad de unión. [93] [94] El cianuro (CN − ), tiene una estructura similar, pero se comporta de manera muy similar a un ion haluro ( pseudohalógeno ). Por ejemplo, puede formar la molécula de cianógeno nitruro ((CN) 2 ), similar a los haluros diatómicos. Asimismo, el análogo más pesado del cianuro, el ciafuro (CP − ), también se considera inorgánico, aunque la mayoría de los derivados simples son altamente inestables. Otros óxidos poco comunes son el subóxido de carbono ( C
3Oh
2), [95] el inestable monóxido de dicarbono (C 2 O), [96] [97] trióxido de carbono (CO 3 ), [98] [99] ciclopentanopentona (C 5 O 5 ), [100] ciclohexanohexona (C 6 O 6 ), [100] y anhídrido melítico (C 12 O 9 ). Sin embargo, el anhídrido melítico es el anhídrido triple de acilo del ácido melítico; además, contiene un anillo de benceno. Por lo tanto, muchos químicos lo consideran orgánico.
Con metales reactivos, como el tungsteno , el carbono forma carburos (C 4− ) o acetiluros ( C2−
2) para formar aleaciones con puntos de fusión altos. Estos aniones también están asociados con el metano y el acetileno , ambos ácidos muy débiles. Con una electronegatividad de 2,5, [101] el carbono prefiere formar enlaces covalentes . Algunos carburos son redes covalentes, como el carborundo (SiC), que se parece al diamante. Sin embargo, incluso los carburos más polares y similares a las sales no son compuestos completamente iónicos. [102]
Los compuestos organometálicos contienen por definición al menos un enlace covalente carbono-metal. Existe una amplia gama de tales compuestos; las clases principales incluyen compuestos de alquilo-metal simples (por ejemplo, tetraetilo de plomo ), compuestos de η 2 -alqueno (por ejemplo, sal de Zeise ) y compuestos de η 3 -alilo (por ejemplo, dímero de cloruro de alilpaladio ); metalocenos que contienen ligandos de ciclopentadienilo (por ejemplo, ferroceno ); y complejos de carbeno de metales de transición . Existen muchos carbonilos metálicos y cianuros metálicos (por ejemplo, tetracarbonilníquel y ferricianuro de potasio ); algunos trabajadores consideran que los complejos de carbonilo y cianuro metálicos sin otros ligandos de carbono son puramente inorgánicos y no organometálicos. Sin embargo, la mayoría de los químicos organometálicos consideran que los complejos metálicos con cualquier ligando de carbono, incluso el "carbono inorgánico" (por ejemplo, carbonilos, cianuros y ciertos tipos de carburos y acetiluros) son de naturaleza organometálica. Los complejos metálicos que contienen ligandos orgánicos sin un enlace covalente carbono-metal (por ejemplo, carboxilatos metálicos) se denominan compuestos metalorgánicos .
Si bien se entiende que el carbono prefiere fuertemente la formación de cuatro enlaces covalentes, también se conocen otros esquemas de enlace exóticos. Los carboranos son derivados dodecaédricos altamente estables de la unidad [B 12 H 12 ] 2- , con un BH reemplazado por un CH + . Por lo tanto, el carbono está unido a cinco átomos de boro y un átomo de hidrógeno. El catión [(Ph 3 PAu) 6 C] 2+ contiene un carbono octaédrico unido a seis fragmentos de fosfina-oro. Este fenómeno se ha atribuido a la aurofilicidad de los ligandos de oro, que proporcionan una estabilización adicional de una especie que de otro modo sería lábil. [103] En la naturaleza, el cofactor de hierro-molibdeno ( FeMoco ) responsable de la fijación microbiana del nitrógeno también tiene un centro de carbono octaédrico (formalmente un carburo, C(-IV)) unido a seis átomos de hierro. En 2016, se confirmó que, de acuerdo con predicciones teóricas anteriores, el dicatión hexametilbenceno contiene un átomo de carbono con seis enlaces. Más específicamente, el dicatión podría describirse estructuralmente mediante la formulación [MeC(η 5 -C 5 Me 5 )] 2+ , lo que lo convierte en un " metaloceno orgánico " en el que un fragmento MeC 3+ está unido a un fragmento η 5 -C 5 Me 5 − a través de los cinco carbonos del anillo. [104]
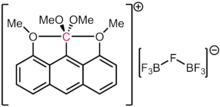
Es importante señalar que en los casos anteriores, cada uno de los enlaces al carbono contiene menos de dos pares de electrones formales. Por lo tanto, el recuento de electrones formales de estas especies no supera un octeto. Esto las hace hipercoordinadas pero no hipervalentes. Incluso en casos de supuestas especies 10-C-5 (es decir, un carbono con cinco ligandos y un recuento de electrones formales de diez), como informaron Akiba y colaboradores, [105] los cálculos de la estructura electrónica concluyen que la población de electrones alrededor del carbono sigue siendo inferior a ocho, como es cierto para otros compuestos que presentan enlaces de tres centros con cuatro electrones .

El nombre inglés carbono proviene del latín carbo , que significa carbón y carbón vegetal, [106] de donde también proviene el francés charbon , que significa carbón vegetal. En alemán, holandés y danés, los nombres para el carbono son Kohlenstoff , koolstof y kulstof respectivamente, todos los cuales significan literalmente sustancia de carbón.
El carbono fue descubierto en la prehistoria y las primeras civilizaciones lo conocían en forma de hollín y carbón vegetal. Los diamantes se conocían probablemente ya en el año 2500 a. C. en China, mientras que el carbono en forma de carbón vegetal se fabricaba con la misma química que hoy, calentando madera en una pirámide cubierta de arcilla para excluir el aire. [107] [108]

En 1722, René Antoine Ferchault de Réaumur demostró que el hierro se transformaba en acero mediante la absorción de alguna sustancia, ahora conocida como carbono. [109] En 1772, Antoine Lavoisier demostró que los diamantes son una forma de carbono; cuando quemó muestras de carbón y diamante y descubrió que ninguno producía agua y que ambos liberaban la misma cantidad de dióxido de carbono por gramo. En 1779, [110] Carl Wilhelm Scheele demostró que el grafito, que se había considerado una forma de plomo, era en cambio idéntico al carbón pero con una pequeña mezcla de hierro, y que daba "ácido aéreo" (su nombre para el dióxido de carbono) cuando se oxidaba con ácido nítrico. [111] En 1786, los científicos franceses Claude Louis Berthollet , Gaspard Monge y CA Vandermonde confirmaron que el grafito era principalmente carbono al oxidarlo en oxígeno de la misma manera que Lavoisier había hecho con el diamante. [112] Quedó algo de hierro, que los científicos franceses consideraron necesario para la estructura del grafito. En su publicación propusieron el nombre de carbono (del latín carbonum ) para el elemento del grafito que se desprendía en forma de gas al quemarse. Antoine Lavoisier incluyó entonces al carbono como elemento en su libro de texto de 1789. [111]
Un nuevo alótropo del carbono, el fulereno , que se descubrió en 1985 [113] incluye formas nanoestructuradas como buckyballs y nanotubos . [30] Sus descubridores – Robert Curl , Harold Kroto y Richard Smalley – recibieron el Premio Nobel de Química en 1996. [114] El renovado interés resultante en nuevas formas condujo al descubrimiento de otros alótropos exóticos, incluido el carbono vítreo , y a la comprensión de que el " carbono amorfo " no es estrictamente amorfo . [37]
Existen yacimientos naturales de grafito comercialmente viables en muchas partes del mundo, pero las fuentes más importantes desde el punto de vista económico se encuentran en China, India, Brasil y Corea del Norte. [ cita requerida ] [115] Los yacimientos de grafito son de origen metamórfico y se encuentran asociados con cuarzo , mica y feldespatos en esquistos, gneises y areniscas y calizas metamorfoseadas en forma de lentes o vetas , a veces de un metro o más de espesor. Los yacimientos de grafito en Borrowdale , Cumberland , Inglaterra, al principio tenían el tamaño y la pureza suficientes para que, hasta el siglo XIX, los lápices se fabricaran aserrando bloques de grafito natural en tiras antes de revestirlas con madera. Hoy en día, se obtienen yacimientos más pequeños de grafito triturando la roca madre y dejando flotar el grafito más ligero en el agua. [116]
Existen tres tipos de grafito natural: amorfo, en escamas o copos cristalinos y en vetas o terrones. El grafito amorfo es el de peor calidad y el más abundante. Contrariamente a lo que dice la ciencia, en la industria, "amorfo" se refiere a un tamaño de cristal muy pequeño en lugar de a una falta total de estructura cristalina. El amorfo se utiliza para productos de grafito de menor valor y es el grafito de menor precio. Se encuentran grandes depósitos de grafito amorfo en China, Europa, México y Estados Unidos. El grafito en escamas es menos común y de mayor calidad que el amorfo; se presenta en forma de placas separadas que cristalizan en rocas metamórficas. El grafito en escamas puede costar cuatro veces más que el amorfo. Las escamas de buena calidad se pueden procesar para obtener grafito expandible para muchos usos, como retardantes de llama . Los principales depósitos se encuentran en Austria, Brasil, Canadá, China, Alemania y Madagascar. El grafito en vetas o terrones es el tipo de grafito natural más raro, más valioso y de mayor calidad. Se presenta en vetas a lo largo de contactos intrusivos en trozos sólidos y sólo se extrae comercialmente en Sri Lanka. [116]
Según el Servicio Geológico de los Estados Unidos (USGS) , la producción mundial de grafito natural fue de 1,1 millones de toneladas en 2010, de las cuales China contribuyó con 800.000 t, India con 130.000 t, Brasil con 76.000 t, Corea del Norte con 30.000 t y Canadá con 25.000 t. No se informó de la extracción de grafito natural en los Estados Unidos, pero en 2009 se produjeron 118.000 t de grafito sintético con un valor estimado de 998 millones de dólares. [116]

La cadena de suministro de diamantes está controlada por un número limitado de empresas poderosas y también está altamente concentrada en un pequeño número de lugares alrededor del mundo (ver figura).
Sólo una fracción muy pequeña del mineral de diamante está formada por diamantes reales. El mineral se tritura, durante el cual se debe tener cuidado para evitar que los diamantes más grandes se destruyan en este proceso y, posteriormente, las partículas se clasifican por densidad. Hoy en día, los diamantes se ubican en la fracción de densidad rica en diamantes con la ayuda de fluorescencia de rayos X , después de lo cual los pasos finales de clasificación se realizan a mano. Antes de que el uso de rayos X se volviera común, la separación se realizaba con cintas de grasa; los diamantes tienen una mayor tendencia a adherirse a la grasa que los otros minerales en el mineral. [117]
Históricamente, se sabía que los diamantes se encontraban solo en depósitos aluviales en el sur de la India. [118] India lideró el mundo en la producción de diamantes desde el momento de su descubrimiento en aproximadamente el siglo IX a. C. [119] hasta mediados del siglo XVIII d. C., pero el potencial comercial de estas fuentes se había agotado a fines del siglo XVIII y en ese momento India fue eclipsada por Brasil, donde se encontraron los primeros diamantes no indios en 1725. [120]
La producción de diamantes de depósitos primarios (kimberlitas y lamproitas) recién comenzó en la década de 1870 después del descubrimiento de los campos de diamantes en Sudáfrica. La producción ha aumentado con el tiempo y desde esa fecha se ha extraído un total acumulado de más de 4.500 millones de quilates. [121] La mayoría de los depósitos de diamantes comercialmente viables estaban en Rusia, Botsuana, Australia y la República Democrática del Congo. [122] Para 2005, Rusia producía casi una quinta parte de la producción mundial de diamantes (principalmente en el territorio de Yakutia ; por ejemplo, la tubería Mir y la tubería Udachnaya ), pero la mina Argyle en Australia se convirtió en la fuente más grande, produciendo 14 millones de quilates en 2018. [123] [124] Se espera que los nuevos hallazgos, las minas canadienses de Diavik y Ekati , se vuelvan aún más valiosos debido a su producción de piedras de calidad gema. [125]
En Estados Unidos, se han encontrado diamantes en Arkansas, Colorado y Montana. [126] En 2004, un descubrimiento sorprendente de un diamante microscópico en Estados Unidos [127] condujo al muestreo masivo en enero de 2008 de chimeneas de kimberlita en una parte remota de Montana. [128]






El carbono es esencial para todos los sistemas vivos conocidos y sin él la vida tal como la conocemos no podría existir (véase bioquímica alternativa ). El principal uso económico del carbono, aparte de los alimentos y la madera, es en forma de hidrocarburos, sobre todo el gas metano, combustible fósil, y el petróleo crudo (petróleo). El petróleo crudo se destila en refinerías por la industria petroquímica para producir gasolina, queroseno y otros productos. La celulosa es un polímero natural que contiene carbono producido por las plantas en forma de madera, algodón, lino y cáñamo . La celulosa se utiliza principalmente para mantener la estructura de las plantas. Los polímeros de carbono de origen animal con valor comercial incluyen la lana, la cachemira y la seda. Los plásticos están hechos de polímeros de carbono sintéticos, a menudo con átomos de oxígeno y nitrógeno incluidos a intervalos regulares en la cadena principal del polímero. Las materias primas para muchas de estas sustancias sintéticas provienen del petróleo crudo.
Los usos del carbono y sus compuestos son muy variados. Puede formar aleaciones con el hierro, de las cuales la más común es el acero al carbono . El grafito se combina con arcillas para formar la "mina" que se utiliza en los lápices que se usan para escribir y dibujar. También se utiliza como lubricante y pigmento, como material de moldeo en la fabricación de vidrio, en electrodos para baterías secas y en galvanoplastia y electroconformado , en escobillas para motores eléctricos y como moderador de neutrones en reactores nucleares .
El carbón vegetal se utiliza como material de dibujo en obras de arte, para asar a la parrilla, para fundir hierro y en muchas otras aplicaciones. La madera, el carbón y el petróleo se utilizan como combustible para la producción de energía y calefacción. Los diamantes de calidad gema se utilizan en joyería y los diamantes industriales se utilizan en herramientas de perforación, corte y pulido para mecanizar metales y piedras. Los plásticos se fabrican a partir de hidrocarburos fósiles y la fibra de carbono , hecha por pirólisis de fibras de poliéster sintéticas, se utiliza para reforzar los plásticos y formar materiales compuestos avanzados y ligeros.
La fibra de carbono se fabrica mediante pirólisis de filamentos extruidos y estirados de poliacrilonitrilo (PAN) y otras sustancias orgánicas. La estructura cristalográfica y las propiedades mecánicas de la fibra dependen del tipo de material de partida y del procesamiento posterior. Las fibras de carbono fabricadas a partir de PAN tienen una estructura que se asemeja a los filamentos estrechos de grafito, pero el procesamiento térmico puede reordenar la estructura en una lámina laminada continua. El resultado son fibras con una resistencia a la tracción específica mayor que el acero. [129]
El negro de carbón se utiliza como pigmento negro en tintas de imprenta, pinturas al óleo para artistas y acuarelas, papel carbón , acabados para automóviles, tinta china y tóner para impresoras láser . El negro de carbón también se utiliza como relleno en productos de caucho como neumáticos y en compuestos plásticos. El carbón activado se utiliza como absorbente y adsorbente en material de filtrado en aplicaciones tan diversas como máscaras de gas, purificación de agua y campanas extractoras de cocina , y en medicina para absorber toxinas, venenos o gases del sistema digestivo. El carbón se utiliza en la reducción química a altas temperaturas. El coque se utiliza para reducir el mineral de hierro en hierro (fundición). El endurecimiento superficial del acero se logra calentando los componentes de acero terminados en polvo de carbón. Los carburos de silicio , tungsteno , boro y titanio se encuentran entre los materiales más duros conocidos y se utilizan como abrasivos en herramientas de corte y rectificado. Los compuestos de carbono constituyen la mayoría de los materiales utilizados en la ropa, como los textiles naturales y sintéticos y el cuero, y casi todas las superficies interiores del entorno construido, excepto el vidrio, la piedra, los paneles de yeso y el metal.
La industria del diamante se divide en dos categorías: una que se ocupa de los diamantes de calidad gema y la otra, de los diamantes de calidad industrial. Si bien existe un gran comercio de ambos tipos de diamantes, los dos mercados funcionan de manera radicalmente diferente.
A diferencia de los metales preciosos, como el oro o el platino, los diamantes no se comercializan como mercancía. La venta de diamantes tiene un margen sustancial y no existe un mercado muy activo para su reventa.
Los diamantes industriales se valoran principalmente por su dureza y conductividad térmica, siendo las cualidades gemológicas de claridad y color en su mayoría irrelevantes. Alrededor del 80% de los diamantes extraídos (equivalentes a unos 100 millones de quilates o 20 toneladas anuales) no son adecuados para su uso como piedras preciosas y se relegan al uso industrial (conocido como bort ) . [130] Los diamantes sintéticos , inventados en la década de 1950, encontraron aplicaciones industriales casi inmediatas; se producen 3 mil millones de quilates (600 toneladas ) de diamantes sintéticos anualmente. [131]
El uso industrial dominante del diamante es en el corte, perforación, esmerilado y pulido. La mayoría de estas aplicaciones no requieren diamantes grandes; de hecho, la mayoría de los diamantes de calidad gema, excepto por su pequeño tamaño, se pueden utilizar industrialmente. Los diamantes se incrustan en puntas de taladro o hojas de sierra, o se muelen hasta convertirlos en polvo para su uso en aplicaciones de esmerilado y pulido. [132] Las aplicaciones especializadas incluyen el uso en laboratorios como contención para experimentos de alta presión (ver celda de yunque de diamante ), cojinetes de alto rendimiento y uso limitado en ventanas especializadas. [133] [134] Con los continuos avances en la producción de diamantes sintéticos, se están volviendo factibles nuevas aplicaciones. Lo que genera mucho entusiasmo es el posible uso del diamante como semiconductor adecuado para microchips y, debido a su excepcional propiedad de conductancia térmica, como disipador de calor en la electrónica. [135]


El carbón puro tiene una toxicidad extremadamente baja para los humanos y se puede manipular de forma segura en forma de grafito o carbón vegetal. Es resistente a la disolución o al ataque químico, incluso en los contenidos ácidos del tracto digestivo. En consecuencia, una vez que entra en los tejidos del cuerpo, es probable que permanezca allí indefinidamente. El negro de carbón fue probablemente uno de los primeros pigmentos que se utilizaron para los tatuajes, y se descubrió que Ötzi el Hombre de Hielo tenía tatuajes de carbón que sobrevivieron durante su vida y durante 5200 años después de su muerte. [136] La inhalación de polvo de carbón u hollín (negro de carbón) en grandes cantidades puede ser peligrosa, irritando los tejidos pulmonares y causando la enfermedad pulmonar congestiva, neumoconiosis del minero . El polvo de diamante utilizado como abrasivo puede ser dañino si se ingiere o inhala. Las micropartículas de carbono se producen en los gases de escape de los motores diésel y pueden acumularse en los pulmones. [137] En estos ejemplos, el daño puede resultar de contaminantes (por ejemplo, productos químicos orgánicos, metales pesados) más que del carbono en sí.
El carbono generalmente tiene baja toxicidad para la vida en la Tierra; pero las nanopartículas de carbono son mortales para la Drosophila . [138]
El carbón puede arder con fuerza y brillantez en presencia de aire a altas temperaturas. Grandes acumulaciones de carbón, que han permanecido inertes durante cientos de millones de años en ausencia de oxígeno, pueden arder espontáneamente cuando se exponen al aire en vertederos de desechos de minas de carbón, bodegas de carga de barcos y búnkeres de carbón, [139] [140] y vertederos de almacenamiento.
En aplicaciones nucleares en las que se utiliza grafito como moderador de neutrones , puede producirse una acumulación de energía de Wigner seguida de una liberación repentina y espontánea. El recocido a al menos 250 °C puede liberar la energía de forma segura, aunque en el incendio de Windscale el procedimiento salió mal y provocó la combustión de otros materiales del reactor.
La gran variedad de compuestos de carbono incluye venenos letales como la tetrodotoxina , la lectina ricina de las semillas de la planta de ricino Ricinus communis , el cianuro (CN − ) y el monóxido de carbono; y elementos esenciales para la vida como la glucosa y las proteínas.