En los organismos multicelulares , las células madre son células indiferenciadas o parcialmente diferenciadas que pueden transformarse en varios tipos de células y proliferar indefinidamente para producir más de la misma célula madre. Son el tipo de célula más antiguo de un linaje celular . [1] Se encuentran tanto en organismos embrionarios como adultos, pero tienen propiedades ligeramente diferentes en cada uno. Por lo general, se distinguen de las células progenitoras , que no pueden dividirse indefinidamente, y las células precursoras o blásticas, que generalmente se dedican a diferenciarse en un tipo de célula.
En los mamíferos , aproximadamente de 50 a 150 células componen la masa celular interna durante la etapa de blastocisto del desarrollo embrionario , alrededor de los días 5 a 14. Estas tienen capacidad de células madre. In vivo , eventualmente se diferencian en todos los tipos de células del cuerpo (lo que las hace pluripotentes ). Este proceso comienza con la diferenciación en las tres capas germinales : el ectodermo , el mesodermo y el endodermo , en la etapa de gastrulación . Sin embargo, cuando se aíslan y se cultivan in vitro , se pueden mantener en la etapa de célula madre y se conocen como células madre embrionarias (ESC).
Las células madre adultas se encuentran en unas pocas ubicaciones seleccionadas en el cuerpo, conocidas como nichos , como los de la médula ósea o las gónadas . Existen para reponer los tipos de células que se pierden rápidamente y son multipotentes o unipotentes, lo que significa que solo se diferencian en unos pocos tipos de células o en un tipo de célula. En los mamíferos, incluyen, entre otras, las células madre hematopoyéticas , que reponen las células sanguíneas e inmunes, las células basales , que mantienen el epitelio de la piel , y las células madre mesenquimales , que mantienen las células óseas, cartilaginosas , musculares y grasas. Las células madre adultas son una pequeña minoría de células; son ampliamente superadas en número por las células progenitoras y las células terminalmente diferenciadas en las que se diferencian. [1]
La investigación sobre células madre surgió de los hallazgos de los biólogos canadienses Ernest McCulloch , James Till y Andrew J. Becker en la Universidad de Toronto y el Instituto del Cáncer de Ontario en la década de 1960. [2] [3] A partir de 2016 [actualizar], la única terapia médica establecida que utiliza células madre es el trasplante de células madre hematopoyéticas , [4] realizado por primera vez en 1958 por el oncólogo francés Georges Mathé . Sin embargo, desde 1998, ha sido posible cultivar y diferenciar células madre embrionarias humanas (en líneas de células madre ). El proceso de aislamiento de estas células ha sido controvertido , porque generalmente resulta en la destrucción del embrión. Las fuentes para aislar ESC han sido restringidas en algunos países europeos y Canadá, pero otros como el Reino Unido y China han promovido la investigación. [5] La transferencia nuclear de células somáticas es un método de clonación que se puede utilizar para crear un embrión clonado para el uso de sus células madre embrionarias en la terapia con células madre. [6] En 2006, un equipo japonés dirigido por Shinya Yamanaka descubrió un método para convertir células corporales maduras en células madre, llamadas células madre pluripotentes inducidas (iPSC). [7]
El término célula madre fue acuñado por Theodor Boveri y Valentin Haecker a finales del siglo XIX. [8] Los trabajos pioneros en la teoría de las células madre sanguíneas fueron realizados a principios del siglo XX por Artur Pappenheim , Alexander Maximow y Franz Ernst Christian Neumann . [8]
Las propiedades clave de una célula madre fueron definidas por primera vez por Ernest McCulloch y James Till en la Universidad de Toronto y el Instituto del Cáncer de Ontario a principios de la década de 1960. Descubrieron la célula madre formadora de sangre, la célula madre hematopoyética (HSC), a través de su trabajo pionero en ratones. McCulloch y Till comenzaron una serie de experimentos en los que se inyectaron células de la médula ósea en ratones irradiados. Observaron bultos en los bazos de los ratones que eran linealmente proporcionales al número de células de la médula ósea inyectadas. Plantearon la hipótesis de que cada bulto (colonia) era un clon que surgía de una sola célula de la médula (célula madre). En un trabajo posterior, McCulloch y Till, junto con el estudiante de posgrado Andrew John Becker y el científico senior Louis Siminovitch , confirmaron que cada bulto, de hecho, surgía de una sola célula. Sus resultados fueron publicados en Nature en 1963. Ese mismo año, Siminovitch fue el investigador principal de estudios que descubrieron que las células formadoras de colonias eran capaces de autorenovarse, una propiedad clave de las células madre que Till y McCulloch habían teorizado. [9]
La primera terapia con células madre fue un trasplante de médula ósea realizado por el oncólogo francés Georges Mathé en 1956 a cinco trabajadores del Instituto Nuclear de Vinča en Yugoslavia que habían sido afectados por un accidente de gravedad . Todos los trabajadores sobrevivieron. [10]
En 1981, las células madre embrionarias (ES) fueron aisladas por primera vez y cultivadas con éxito utilizando blastocistos de ratón por los biólogos británicos Martin Evans y Matthew Kaufman . Esto permitió la formación de modelos genéticos murinos, un sistema en el que se eliminan o alteran los genes de los ratones con el fin de estudiar su función en la patología. En 1991, un proceso que permitió aislar la célula madre humana fue patentado por Ann Tsukamoto. Para 1998, las células madre embrionarias humanas fueron aisladas por primera vez por el biólogo estadounidense James Thomson , lo que hizo posible tener nuevos métodos de trasplante o varios tipos de células para probar nuevos tratamientos. En 2006, el equipo de Shinya Yamanaka en Kioto, Japón, convirtió fibroblastos en células madre pluripotentes modificando la expresión de solo cuatro genes. La hazaña representa el origen de las células madre pluripotentes inducidas, conocidas como células iPS. [7]
En 2011, una hembra de lobo de crin , atropellada por un camión, fue sometida a un tratamiento con células madre en el Zoológico de Brasilia, siendo este el primer caso registrado del uso de células madre para curar heridas en un animal salvaje. [11] [12]
La definición clásica de una célula madre requiere que posea dos propiedades:
Dos mecanismos garantizan que una población de células madre se mantenga (no disminuya su tamaño):
1. División celular asimétrica : una célula madre se divide en una célula madre, que es idéntica a la célula madre original, y otra célula hija, que está diferenciada.
Cuando una célula madre se autorenueva, se divide y altera el estado indiferenciado. Esta autorrenovación exige el control del ciclo celular, así como el mantenimiento de la multipotencia o pluripotencia, todo lo cual depende de la célula madre. [13]
yo
Las células madre utilizan la telomerasa , una proteína que restaura los telómeros , para proteger su ADN y extender su límite de división celular (el límite de Hayflick ). [14]
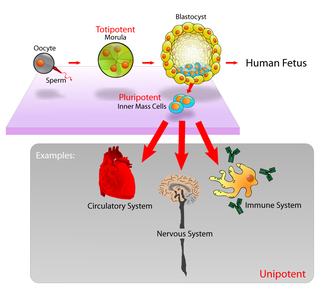

La potencia especifica el potencial de diferenciación (el potencial de diferenciarse en diferentes tipos de células) de la célula madre. [15]
En la práctica, las células madre se identifican por su capacidad de regenerar tejido. Por ejemplo, la prueba definitoria para las células madre de la médula ósea o hematopoyéticas (CMH) es la capacidad de trasplantarlas y salvar a un individuo sin CMH. Esto demuestra que las células pueden producir nuevas células sanguíneas a largo plazo. También debería ser posible aislar células madre del individuo trasplantado, que a su vez puedan trasplantarse a otro individuo sin CMH, lo que demuestra que la célula madre es capaz de autorenovarse.
Las propiedades de las células madre pueden ilustrarse in vitro , utilizando métodos como ensayos clonogénicos , en los que se evalúa la capacidad de las células individuales para diferenciarse y autorenovarse. [18] [19] Las células madre también pueden aislarse por su posesión de un conjunto distintivo de marcadores de superficie celular. Sin embargo, las condiciones de cultivo in vitro pueden alterar el comportamiento de las células, lo que hace que no esté claro si las células se comportarán de manera similar in vivo . Existe un debate considerable sobre si algunas poblaciones de células adultas propuestas son realmente células madre. [20]
Las células madre embrionarias (CME) son las células de la masa celular interna de un blastocisto , formadas antes de la implantación en el útero. [21] En el desarrollo embrionario humano, la etapa de blastocisto se alcanza 4-5 días después de la fecundación , momento en el que consta de 50-150 células. Las CME son pluripotentes y dan lugar durante el desarrollo a todos los derivados de las tres capas germinales : ectodermo , endodermo y mesodermo . En otras palabras, pueden desarrollarse en cada uno de los más de 200 tipos de células del cuerpo adulto cuando se les da la estimulación suficiente y necesaria para un tipo celular específico. No contribuyen a las membranas extraembrionarias ni a la placenta .
Durante el desarrollo embrionario, las células de la masa celular interna se dividen continuamente y se vuelven más especializadas. Por ejemplo, una porción del ectodermo en la parte dorsal del embrión se especializa como " neurectodermo ", que se convertirá en el futuro sistema nervioso central . [22] Más adelante en el desarrollo, la neurulación hace que el neurectodermo forme el tubo neural . En la etapa del tubo neural, la porción anterior sufre encefalización para generar o "modelar" la forma básica del cerebro. En esta etapa del desarrollo, el principal tipo de célula del SNC se considera una célula madre neural .
Las células madre neurales se auto-renuevan y en algún momento pasan a ser células progenitoras gliales radiales (RGP). Las RGP formadas tempranamente se auto-renuevan por división simétrica para formar un grupo reservorio de células progenitoras . Estas células pasan a un estado neurogénico y comienzan a dividirse asimétricamente para producir una gran diversidad de muchos tipos diferentes de neuronas, cada una con expresión genética, características morfológicas y funcionales únicas. El proceso de generación de neuronas a partir de células gliales radiales se llama neurogénesis . La célula glial radial tiene una morfología bipolar distintiva con procesos altamente alargados que abarcan el espesor de la pared del tubo neural. Comparte algunas características gliales , más notablemente la expresión de la proteína ácida fibrilar glial (GFAP). [23] [24] La célula glial radial es la célula madre neural primaria del SNC vertebrado en desarrollo , y su cuerpo celular reside en la zona ventricular , adyacente al sistema ventricular en desarrollo . Las células madre neurales están comprometidas con los linajes neuronales ( neuronas , astrocitos y oligodendrocitos ) y, por lo tanto, su potencia está restringida. [22]
Casi todas las investigaciones realizadas hasta la fecha han hecho uso de células madre embrionarias de ratón (mES) o células madre embrionarias humanas (hES) derivadas de la masa celular interna temprana. Ambas tienen las características esenciales de las células madre, pero requieren entornos muy diferentes para mantener un estado indiferenciado. Las células madre embrionarias de ratón se cultivan en una capa de gelatina como matriz extracelular (para soporte) y requieren la presencia de factor inhibidor de leucemia (LIF) en medios séricos. También se ha demostrado que un cóctel de fármacos que contiene inhibidores de GSK3B y de la vía MAPK/ERK , llamado 2i, mantiene la pluripotencia en el cultivo de células madre. [25] Las células madre embrionarias humanas se cultivan en una capa alimentadora de fibroblastos embrionarios de ratón y requieren la presencia de factor de crecimiento básico de fibroblastos (bFGF o FGF-2). [26] Sin condiciones de cultivo óptimas o manipulación genética, [27] las células madre embrionarias se diferenciarán rápidamente.
Una célula madre embrionaria humana también se define por la expresión de varios factores de transcripción y proteínas de la superficie celular. Los factores de transcripción Oct-4 , Nanog y Sox2 forman la red reguladora central que asegura la supresión de los genes que conducen a la diferenciación y el mantenimiento de la pluripotencia. [28] Los antígenos de la superficie celular que se utilizan con más frecuencia para identificar células madre embrionarias humanas son los antígenos embrionarios específicos de la etapa de glucolípidos 3 y 4, y los antígenos de queratán sulfato Tra-1-60 y Tra-1-81. La definición molecular de una célula madre incluye muchas más proteínas y sigue siendo un tema de investigación. [29]
Al utilizar células madre embrionarias humanas para producir células especializadas, como células nerviosas o cardíacas, en el laboratorio, los científicos pueden acceder a células humanas adultas sin tomar tejido de los pacientes. Luego pueden estudiar estas células adultas especializadas en detalle para intentar discernir complicaciones de enfermedades o para estudiar las reacciones celulares a nuevos medicamentos propuestos.
Debido a sus capacidades combinadas de expansión ilimitada y pluripotencia, las células madre embrionarias siguen siendo una fuente teóricamente potencial para la medicina regenerativa y el reemplazo de tejidos después de una lesión o enfermedad. [30] Sin embargo, actualmente no hay tratamientos aprobados que utilicen células madre embrionarias. El primer ensayo en humanos fue aprobado por la Administración de Alimentos y Medicamentos de los EE. UU. en enero de 2009. [31] Sin embargo, el ensayo en humanos no se inició hasta el 13 de octubre de 2010 en Atlanta para la investigación de lesiones de la médula espinal . El 14 de noviembre de 2011, la empresa que realiza el ensayo ( Geron Corporation ) anunció que descontinuará el desarrollo de sus programas de células madre. [32] Diferenciar las células madre embrionarias en células utilizables mientras se evita el rechazo del trasplante son solo algunos de los obstáculos que aún enfrentan los investigadores de células madre embrionarias. [33] Las células madre embrionarias, al ser pluripotentes, requieren señales específicas para una diferenciación correcta: si se inyectan directamente en otro cuerpo, las células madre embrionarias se diferenciarán en muchos tipos diferentes de células, causando un teratoma . Las consideraciones éticas sobre el uso de tejido humano no nacido son otra razón para la falta de tratamientos aprobados que utilicen células madre embrionarias. En la actualidad, muchos países tienen moratorias o limitaciones sobre la investigación con células madre embrionarias humanas o la producción de nuevas líneas de células madre embrionarias humanas.

Las células madre mesenquimales (MSC) o células estromales mesenquimales, también conocidas como células de señalización médica, son conocidas por ser multipotentes y pueden encontrarse en tejidos adultos, por ejemplo, en el músculo, el hígado, la médula ósea y el tejido adiposo. Las células madre mesenquimales suelen funcionar como soporte estructural en varios órganos, como se mencionó anteriormente, y controlan el movimiento de sustancias. Las MSC pueden diferenciarse en numerosas categorías celulares, como adipocitos, osteocitos y condrocitos, derivados de la capa mesodérmica. [34] Donde la capa de mesodermo proporciona un aumento de los elementos esqueléticos del cuerpo, como los relacionados con el cartílago o el hueso. El término "meso" significa medio, infusión se originó del griego, lo que significa que las células mesenquimales pueden extenderse y viajar en el crecimiento embrionario temprano entre las capas ectodérmica y endodérmica. Este mecanismo ayuda a rellenar espacios, por lo que es clave para reparar heridas en organismos adultos que tienen que ver con células mesenquimales en la dermis (piel), el hueso o el músculo. [35]
Las células madre mesenquimales son conocidas por ser esenciales para la medicina regenerativa. Se estudian ampliamente en ensayos clínicos . Dado que se aíslan fácilmente y obtienen un alto rendimiento, alta plasticidad, lo que las hace capaces de facilitar la inflamación y estimular el crecimiento celular, la diferenciación celular y la restauración de tejido derivado de la inmunomodulación y la inmunosupresión. Las MSC provienen de la médula ósea, lo que requiere un procedimiento agresivo cuando se trata de aislar la cantidad y calidad de la célula aislada, y varía según la edad del donante. Al comparar las tasas de MSC en los aspirados de médula ósea y el estroma de la médula ósea, los aspirados tienden a tener tasas más bajas de MSC que el estroma. Se sabe que las MSC son heterogéneas y expresan un alto nivel de marcadores pluripotentes en comparación con otros tipos de células madre, como las células madre embrionarias. [34] La inyección de MSC conduce a la cicatrización de heridas principalmente a través de la estimulación de la angiogénesis. [36]
Las células madre embrionarias (CME) tienen la capacidad de dividirse indefinidamente manteniendo su pluripotencia , lo que es posible gracias a mecanismos especializados de control del ciclo celular . [37] En comparación con las células somáticas proliferantes , las CME tienen características únicas del ciclo celular, como la división celular rápida causada por la fase G1 acortada, la fase G0 ausente y las modificaciones en los puntos de control del ciclo celular , lo que deja a las células principalmente en la fase S en un momento dado. [37] [38] La división rápida de las CME se demuestra por su corto tiempo de duplicación, que varía de 8 a 10 horas, mientras que las células somáticas tienen un tiempo de duplicación de aproximadamente 20 horas o más. [39] A medida que las células se diferencian, estas propiedades cambian: las fases G1 y G2 se alargan, lo que lleva a ciclos de división celular más largos. Esto sugiere que una estructura específica del ciclo celular puede contribuir al establecimiento de la pluripotencia. [37]
En particular, debido a que la fase G1 es la fase en la que las células tienen una mayor sensibilidad a la diferenciación, la G1 acortada es una de las características clave de las células madre embrionarias y desempeña un papel importante en el mantenimiento del fenotipo indiferenciado . Aunque el mecanismo molecular exacto sigue siendo solo parcialmente comprendido, varios estudios han demostrado cómo las células madre embrionarias progresan a través de la G1 (y potencialmente otras fases) tan rápidamente. [38]
El ciclo celular está regulado por una red compleja de ciclinas , quinasas dependientes de ciclina (Cdk), inhibidores de quinasas dependientes de ciclina (Cdkn), proteínas de bolsillo de la familia del retinoblastoma (Rb) y otros factores accesorios. [39] Los estudios sobre células madre embrionarias de ratón (mESC) obtuvieron conocimientos fundamentales sobre la regulación distintiva del ciclo celular. [38] Las mESC mostraron un ciclo celular con una fase G1 altamente abreviada, que permitió a las células alternar rápidamente entre la fase M y la fase S. En un ciclo celular somático, se observa actividad oscilatoria de complejos Ciclina-Cdk en acción secuencial, que controla reguladores cruciales del ciclo celular para inducir transiciones unidireccionales entre fases: la ciclina D y Cdk4/6 están activas en la fase G1, mientras que la ciclina E y Cdk2 están activas durante la fase G1 tardía y la fase S; y la ciclina A y Cdk2 son activas en la fase S y G2, mientras que la ciclina B y Cdk1 son activas en la fase G2 y M. [39] Sin embargo, en las mESC, esta actividad típicamente ordenada y oscilatoria de los complejos ciclina-Cdk está ausente. En cambio, el complejo ciclina E/Cdk2 es constitutivamente activo durante todo el ciclo, manteniendo la proteína del retinoblastoma (pRb) hiperfosforilada y, por lo tanto, inactiva. Esto permite una transición directa de la fase M a la fase G1 tardía, lo que conduce a la ausencia de ciclinas de tipo D y, por lo tanto, a una fase G1 acortada. [38] La actividad de Cdk2 es crucial tanto para la regulación del ciclo celular como para las decisiones sobre el destino celular en las mESC; la regulación negativa de la actividad de Cdk2 prolonga la progresión de la fase G1, establece un ciclo celular similar al de las células somáticas e induce la expresión de marcadores de diferenciación. [40]
En las células madre embrionarias humanas (hESC), la duración de G1 se acorta drásticamente. Esto se ha atribuido a altos niveles de ARNm de los genes Ciclina D2 y Cdk4 relacionados con G1 y bajos niveles de proteínas reguladoras del ciclo celular que inhiben la progresión del ciclo celular en G1, como p21 CipP1 , p27 Kip1 y p57 Kip2 . [37] [41] Además, los reguladores de la actividad de Cdk4 y Cdk6, como los miembros de la familia de inhibidores Ink (p15, p16, p18 y p19), se expresan en niveles bajos o no se expresan en absoluto. Por lo tanto, de manera similar a las mESC, las hESC muestran una alta actividad de Cdk, y Cdk2 exhibe la actividad quinasa más alta. También similares a las mESC, las hESC demuestran la importancia de Cdk2 en la regulación de la fase G1 al mostrar que la transición de G1 a S se retrasa cuando se inhibe la actividad de Cdk2 y G1 se detiene cuando se inhibe Cdk2. [37] Sin embargo, a diferencia de las mESC, las hESC tienen una fase G1 funcional. Las hESC muestran que las actividades de los complejos Ciclina E/Cdk2 y Ciclina A/Cdk2 dependen del ciclo celular y el punto de control Rb en G1 es funcional. [39]
Las células madre embrionarias también se caracterizan por la falta de funcionalidad del punto de control G1, a pesar de que el punto de control G1 es crucial para mantener la estabilidad genómica. En respuesta al daño del ADN , las células madre embrionarias no se detienen en G1 para reparar los daños del ADN, sino que dependen de los puntos de control S y G2/M o experimentan apoptosis. La ausencia del punto de control G1 en las células madre embrionarias permite la eliminación de células con ADN dañado, evitando así posibles mutaciones por una reparación incorrecta del ADN. [37] En consonancia con esta idea, las células madre embrionarias son hipersensibles al daño del ADN para minimizar las mutaciones que se transmiten a la siguiente generación. [39]
Las células madre primitivas ubicadas en los órganos de los fetos se denominan células madre fetales. [42]
Hay dos tipos de células madre fetales:

Las células madre adultas, también llamadas células madre somáticas (del griego σωματικóς, "del cuerpo"), son células madre que mantienen y reparan el tejido en el que se encuentran. [44]
Existen tres fuentes conocidas y accesibles de células madre adultas autólogas en humanos:
Las células madre también pueden extraerse de la sangre del cordón umbilical justo después del nacimiento. De todos los tipos de células madre, la recolección autóloga es la que implica menos riesgo. Por definición, las células autólogas se obtienen del propio cuerpo, de la misma manera que uno puede almacenar su propia sangre para procedimientos quirúrgicos electivos. [ cita requerida ]
Las células madre adultas pluripotentes son raras y generalmente pequeñas en número, pero se pueden encontrar en la sangre del cordón umbilical y otros tejidos. [48] La médula ósea es una fuente rica de células madre adultas, [49] que se han utilizado en el tratamiento de varias enfermedades, entre ellas la cirrosis hepática, [50] la isquemia crónica de las extremidades , [51] y la insuficiencia cardíaca terminal. [52] La cantidad de células madre de la médula ósea disminuye con la edad y es mayor en los hombres que en las mujeres durante los años reproductivos. [53] Hasta la fecha, gran parte de la investigación sobre células madre adultas ha tenido como objetivo caracterizar su potencia y sus capacidades de autorrenovación. [54] El daño del ADN se acumula con la edad tanto en las células madre como en las células que componen el entorno de las células madre. Se considera que esta acumulación es responsable, al menos en parte, del aumento de la disfunción de las células madre con el envejecimiento (véase la teoría del daño del ADN del envejecimiento ). [55]
La mayoría de las células madre adultas están restringidas por linaje ( multipotentes ) y generalmente se hace referencia a ellas por su origen tisular ( célula madre mesenquimal , célula madre derivada de tejido adiposo, célula madre endotelial , célula madre de pulpa dental , etc.). [56] [57] Las células musa (células resistentes al estrés diferenciadoras de múltiples linajes) son un tipo de célula madre pluripotente recientemente descubierto que se encuentra en múltiples tejidos adultos, incluidos el tejido adiposo, los fibroblastos dérmicos y la médula ósea. Si bien son raras, las células musa se identifican por su expresión de SSEA-3 , un marcador de células madre indiferenciadas, y marcadores generales de células madre mesenquimales como CD90, CD105 . Cuando se someten a un cultivo en suspensión de células individuales, las células generarán grupos que son similares a los cuerpos embrionarios en morfología y expresión genética, incluidos los marcadores de pluripotencia canónicos Oct4 , Sox2 y Nanog . [58]
Los tratamientos con células madre adultas se han utilizado con éxito durante muchos años para tratar la leucemia y otros cánceres relacionados con los huesos y la sangre mediante trasplantes de médula ósea. [59] Las células madre adultas también se utilizan en medicina veterinaria para tratar lesiones de tendones y ligamentos en caballos. [60]
El uso de células madre adultas en la investigación y la terapia no es tan controvertido como el uso de células madre embrionarias , porque la producción de células madre adultas no requiere la destrucción de un embrión . Además, en los casos en que las células madre adultas se obtienen del receptor previsto (un autoinjerto ), el riesgo de rechazo es esencialmente inexistente. En consecuencia, se está proporcionando más financiación del gobierno de los EE. UU. para la investigación con células madre adultas. [61]
Con la creciente demanda de células madre adultas humanas tanto para fines de investigación como clínicos (normalmente se requieren entre 1 y 5 millones de células por kg de peso corporal por tratamiento), resulta de suma importancia salvar la brecha entre la necesidad de expandir las células in vitro y la capacidad de aprovechar los factores que subyacen a la senescencia replicativa. Se sabe que las células madre adultas tienen una vida útil limitada in vitro y entran en la senescencia replicativa de forma casi indetectable al iniciar el cultivo in vitro. [62]
Las células madre hematopoyéticas (CMH) son vulnerables a los daños en el ADN y a las mutaciones que aumentan con la edad. [63] Esta vulnerabilidad puede explicar el mayor riesgo de cánceres de sangre de crecimiento lento (neoplasias mieloides) en los ancianos. [63] Varios factores parecen influir en el envejecimiento de las CMH, incluidas las respuestas a la producción de especies reactivas de oxígeno que pueden causar daños en el ADN y mutaciones genéticas, así como un perfil epigenético alterado . [64]
También llamadas células madre perinatales, estas células madre multipotentes se encuentran en el líquido amniótico y en la sangre del cordón umbilical. Estas células madre son muy activas, se expanden ampliamente sin necesidad de nutricionistas y no son tumorígenas. Las células madre amnióticas son multipotentes y pueden diferenciarse en células de líneas adipogénicas, osteogénicas, miogénicas, endoteliales, hepáticas y también neuronales. [65] Las células madre amnióticas son un tema de investigación activa.
El uso de células madre del líquido amniótico supera las objeciones éticas al uso de embriones humanos como fuente de células. La enseñanza católica romana prohíbe el uso de células madre embrionarias en la experimentación; por ello, el periódico vaticano " Osservatore Romano " calificó a las células madre amnióticas como "el futuro de la medicina". [66]
Es posible recolectar células madre amnióticas para donantes o para uso autólogo: el primer banco de células madre amnióticas de EE. UU. [67] [68] fue inaugurado en 2009 en Medford, MA, por Biocell Center Corporation [69] [70] [71] y colabora con varios hospitales y universidades de todo el mundo. [72]
Las células madre adultas tienen limitaciones en cuanto a su potencia; a diferencia de las células madre embrionarias (CME), no pueden diferenciarse en células de las tres capas germinales . Por ello, se las considera multipotentes .
Sin embargo, la reprogramación permite la creación de células pluripotentes, células madre pluripotentes inducidas (iPSC), a partir de células adultas. Estas no son células madre adultas, sino células somáticas (por ejemplo, células epiteliales) reprogramadas para dar lugar a células con capacidades pluripotentes. Utilizando la reprogramación genética con factores de transcripción de proteínas , se han derivado células madre pluripotentes con capacidades similares a las ESC. [73] [74] [75] La primera demostración de células madre pluripotentes inducidas fue realizada por Shinya Yamanaka y sus colegas en la Universidad de Kioto . [76] Utilizaron los factores de transcripción Oct3/4 , Sox2 , c-Myc y Klf4 para reprogramar células de fibroblastos de ratón en células pluripotentes. [73] [77] El trabajo posterior utilizó estos factores para inducir la pluripotencia en células de fibroblastos humanos. [78] Junying Yu , James Thomson y sus colegas de la Universidad de Wisconsin-Madison utilizaron un conjunto diferente de factores, Oct4, Sox2, Nanog y Lin28, y llevaron a cabo sus experimentos utilizando células de prepucio humano . [73] [79] Sin embargo, pudieron replicar el hallazgo de Yamanaka de que era posible inducir pluripotencia en células humanas.
Las células madre pluripotentes inducidas difieren de las células madre embrionarias. Comparten muchas propiedades similares, como la pluripotencia y el potencial de diferenciación, la expresión de genes de pluripotencia , patrones epigenéticos , formación de cuerpos embrionarios y teratomas , y formación de quimeras viables , [76] [77] pero existen muchas diferencias dentro de estas propiedades. La cromatina de las iPSC parece ser más "cerrada" o metilada que la de las ESC. [76] [77] De manera similar, el patrón de expresión génica entre ESC y iPSC, o incluso iPSC de diferentes orígenes. [76] Por lo tanto, existen preguntas sobre la "completitud" de la reprogramación y la memoria somática de las células madre pluripotentes inducidas. A pesar de esto, inducir a las células somáticas a ser pluripotentes parece ser viable.
Como resultado del éxito de estos experimentos, Ian Wilmut , quien ayudó a crear el primer animal clonado, la oveja Dolly , ha anunciado que abandonará la transferencia nuclear de células somáticas como vía de investigación. [80]
La capacidad de inducir pluripotencia beneficia los avances en ingeniería de tejidos . Al proporcionar un andamiaje y un microambiente adecuados, las iPSC pueden diferenciarse en células de aplicación terapéutica y en modelos in vitro para estudiar toxinas y patogénesis. [81]
Las células madre pluripotentes inducidas ofrecen varias ventajas terapéuticas. Al igual que las células madre embrionarias, son pluripotentes . Por lo tanto, tienen un gran potencial de diferenciación; teóricamente, podrían producir cualquier célula dentro del cuerpo humano (si la reprogramación a la pluripotencia fuera "completa"). [76] Además, a diferencia de las células madre embrionarias, podrían permitir potencialmente a los médicos crear una línea de células madre pluripotentes para cada paciente individual. [82] Las muestras de sangre congeladas se pueden utilizar como una valiosa fuente de células madre pluripotentes inducidas. [83] Las células madre específicas del paciente permiten la detección de efectos secundarios antes del tratamiento farmacológico, así como el riesgo reducido de rechazo del trasplante. [82] A pesar de su uso terapéutico limitado actual, las iPSC tienen un gran potencial para su uso futuro en el tratamiento y la investigación médica.
Los factores clave que controlan el ciclo celular también regulan la pluripotencia . Por lo tanto, la manipulación de genes relevantes puede mantener la pluripotencia y reprogramar las células somáticas a un estado de pluripotencia inducida. [39] Sin embargo, la reprogramación de células somáticas suele ser de baja eficiencia y se considera estocástica . [84]
Con la idea de que un ciclo celular más rápido es un componente clave de la pluripotencia, se puede mejorar la eficiencia de la reprogramación. Los métodos para mejorar la pluripotencia a través de la manipulación de los reguladores del ciclo celular incluyen: sobreexpresión de Ciclina D/Cdk4, fosforilación de Sox2 en S39 y S253, sobreexpresión de Ciclina A y Ciclina E, supresión de Rb y supresión de miembros de la familia Cip/Kip o de la familia Ink. [39] Además, la eficiencia de la reprogramación está correlacionada con el número de divisiones celulares ocurridas durante la fase estocástica, lo que se sugiere por la creciente ineficiencia de la reprogramación de células más viejas o de buceo lento. [85]
El linaje es un procedimiento importante para analizar embriones en desarrollo, ya que los linajes celulares muestran la relación entre las células en cada división. Esto ayuda a analizar los linajes de células madre a lo largo del camino, lo que ayuda a reconocer la eficacia, la esperanza de vida y otros factores de las células madre. Con la técnica del linaje celular, se pueden analizar genes mutantes en clones de células madre, lo que puede ayudar en las vías genéticas. Estas vías pueden regular el funcionamiento de las células madre. [86]
Para garantizar la autorrenovación, las células madre experimentan dos tipos de división celular (véase el diagrama de división y diferenciación de células madre ). La división simétrica da lugar a dos células hija idénticas, ambas dotadas de propiedades de células madre. La división asimétrica, por otro lado, produce solo una célula madre y una célula progenitora con un potencial de autorrenovación limitado. Las células progenitoras pueden pasar por varias rondas de división celular antes de diferenciarse terminalmente en una célula madura. Es posible que la distinción molecular entre divisiones simétricas y asimétricas resida en la segregación diferencial de proteínas de la membrana celular (como los receptores ) entre las células hijas. [87]
Una teoría alternativa es que las células madre permanecen indiferenciadas debido a señales ambientales en su nicho particular . Las células madre se diferencian cuando abandonan ese nicho o ya no reciben esas señales. Estudios en Drosophila germarium han identificado las señales decapentapléjicas y las uniones adherentes que impiden que las células madre del germarium se diferencien. [88] [89]
En los Estados Unidos, la Orden Ejecutiva 13505 estableció que el dinero federal puede utilizarse para investigaciones en las que se utilicen líneas de células madre embrionarias humanas (hESC) aprobadas, pero no puede utilizarse para derivar nuevas líneas. [90] Las Directrices de los Institutos Nacionales de Salud (NIH) sobre la investigación con células madre humanas, vigentes a partir del 7 de julio de 2009, implementaron la Orden Ejecutiva 13505 al establecer criterios que deben cumplir las líneas de hESC para ser aprobadas para su financiación. [91] Se puede acceder en línea al Registro de células madre embrionarias humanas de los NIH y tiene información actualizada sobre las líneas celulares elegibles para la financiación de los NIH. [92] Hay 486 líneas aprobadas a enero de 2022. [93]
La terapia con células madre es el uso de células madre para tratar o prevenir una enfermedad o afección. El trasplante de médula ósea es una forma de terapia con células madre que se ha utilizado durante muchos años porque ha demostrado ser eficaz en ensayos clínicos. [94] [95] La implantación de células madre puede ayudar a fortalecer el ventrículo izquierdo del corazón, así como a conservar el tejido cardíaco en pacientes que han sufrido ataques cardíacos en el pasado. [96]
Durante más de 90 años, el trasplante de células madre hematopoyéticas (TCMH) se ha utilizado para tratar a personas con enfermedades como leucemia y linfoma ; esta es la única forma ampliamente practicada de terapia con células madre. [94] [97] [98] A partir de 2016 [actualizar], la única terapia establecida que utiliza células madre es el trasplante de células madre hematopoyéticas . [99] Esto generalmente toma la forma de un trasplante de médula ósea , pero las células también pueden derivarse de la sangre del cordón umbilical . Se están realizando investigaciones para desarrollar varias fuentes de células madre, así como para aplicar tratamientos con células madre para enfermedades neurodegenerativas [100] [101] [102] y afecciones como diabetes y enfermedades cardíacas .
Los tratamientos con células madre pueden reducir los síntomas de la enfermedad o afección que se está tratando. La reducción de los síntomas puede permitir a los pacientes reducir la ingesta de medicamentos para la enfermedad o afección. El tratamiento con células madre también puede proporcionar conocimiento a la sociedad para promover la comprensión de las células madre y los tratamientos futuros. [103] El credo de los médicos sería no hacer daño, y las células madre hacen que esto sea más simple que nunca. Los procesos quirúrgicos por su naturaleza son dañinos. Se debe eliminar tejido como una forma de alcanzar un resultado exitoso. Se pueden prevenir los peligros de las intervenciones quirúrgicas utilizando células madre. Además, existe la posibilidad de enfermedad, y si el procedimiento falla, puede ser necesaria una cirugía adicional. Los riesgos asociados con la anestesia también se pueden eliminar con células madre. [104] Además de eso, las células madre se han extraído del cuerpo del paciente y se han redistribuido en el lugar donde se necesitan. Dado que provienen del propio cuerpo del paciente, esto se conoce como un tratamiento autólogo. Se cree que los remedios autólogos son los más seguros porque es probable que haya cero probabilidades de rechazo de la sustancia del donante.
Los tratamientos con células madre pueden requerir inmunosupresión debido a que se requiere radiación antes del trasplante para eliminar las células anteriores de la persona o porque el sistema inmunológico del paciente puede atacar a las células madre. Una estrategia para evitar la segunda posibilidad es utilizar células madre del mismo paciente que está siendo tratado.
La pluripotencia de ciertas células madre también podría dificultar la obtención de un tipo celular específico. También es difícil obtener el tipo celular exacto que se necesita, porque no todas las células de una población se diferencian de manera uniforme. Las células indiferenciadas pueden crear tejidos distintos a los tipos deseados. [105]
Algunas células madre forman tumores después del trasplante; [106] la pluripotencia está vinculada a la formación de tumores, especialmente en células madre embrionarias, células madre fetales propias y células madre pluripotentes inducidas. Las células madre fetales propias forman tumores a pesar de su multipotencia. [107]
También se plantean cuestiones éticas sobre la práctica de utilizar o investigar células madre embrionarias. La extracción de células del blastocisto da como resultado la muerte de este. La preocupación es si el blastocisto debe considerarse o no como una vida humana. [108] El debate sobre esta cuestión es principalmente filosófico, no científico.
El turismo con células madre es la parte de la industria del turismo médico en la que los pacientes viajan para obtener procedimientos con células madre. [109]
En Estados Unidos se ha producido una explosión de "clínicas de células madre". [110] Los procedimientos con células madre son muy rentables para las clínicas. La publicidad parece autoritaria, pero la eficacia y la seguridad de los procedimientos no están probadas. A veces, los pacientes sufren complicaciones, como tumores espinales [111] y la muerte. El elevado coste también puede acarrear problemas financieros. [111] Según los investigadores, es necesario educar al público, a los pacientes y a los médicos sobre este tema. [112]
Según la Sociedad Internacional para la Investigación de Células Madre , la organización académica más grande que aboga por la investigación con células madre, las terapias con células madre están en desarrollo y aún no se puede decir que estén probadas. [113] [114] Los médicos deben informar a los pacientes que los ensayos clínicos continúan investigando si estas terapias son seguras y efectivas, pero que las clínicas poco éticas las presentan como probadas. [115]
Algunas de las patentes fundamentales que cubren las células madre embrionarias humanas son propiedad de la Wisconsin Alumni Research Foundation (WARF): son las patentes 5.843.780, 6.200.806 y 7.029.913, inventadas por James A. Thomson . La WARF no hace valer estas patentes contra los científicos académicos, pero sí contra las empresas. [116]
En 2006, la Public Patent Foundation presentó una solicitud para que la Oficina de Patentes y Marcas de los Estados Unidos (USPTO) volviera a examinar las tres patentes en nombre de su cliente, el grupo de vigilancia de patentes sin fines de lucro Consumer Watchdog (anteriormente la Fundación para los Derechos del Consumidor y del Contribuyente). [116] En el proceso de reexamen, que implica varias rondas de discusión entre la USPTO y las partes, la USPTO inicialmente estuvo de acuerdo con Consumer Watchdog y rechazó todas las reivindicaciones de las tres patentes, [117] sin embargo, en respuesta, WARF modificó las reivindicaciones de las tres patentes para hacerlas más limitadas, y en 2008 la USPTO determinó que las reivindicaciones modificadas en las tres patentes eran patentables. La decisión sobre una de las patentes (7.029.913) era apelable, mientras que las decisiones sobre las otras dos no lo eran. [118] [119] Consumer Watchdog apeló la concesión de la patente '913 ante la Junta de Apelaciones e Interferencias de Patentes (BPAI) de la USPTO, que concedió la apelación y en 2010 la BPAI decidió que las reivindicaciones modificadas de la patente '913 no eran patentables. [120] Sin embargo, WARF pudo reabrir el proceso del caso y lo hizo, modificando nuevamente las reivindicaciones de la patente '913 para hacerlas más limitadas y en enero de 2013 se permitieron las reivindicaciones modificadas. [121]
En julio de 2013, Consumer Watchdog anunció que apelaría la decisión de permitir las reclamaciones de la patente '913 ante el Tribunal de Apelaciones de los Estados Unidos para el Circuito Federal (CAFC), el tribunal de apelaciones federal que escucha casos de patentes. [122] En una audiencia en diciembre de 2013, el CAFC planteó la cuestión de si Consumer Watchdog tenía legitimidad legal para apelar; el caso no podía continuar hasta que se resolviera esa cuestión. [123]

Las enfermedades y afecciones en las que se está investigando el tratamiento con células madre incluyen:
Se están realizando investigaciones para desarrollar varias fuentes de células madre y aplicar tratamientos con células madre para enfermedades y afecciones neurodegenerativas , diabetes , enfermedades cardíacas y otras afecciones. [144] También se están realizando investigaciones para generar organoides utilizando células madre, lo que permitiría una mayor comprensión del desarrollo humano, la organogénesis y el modelado de enfermedades humanas. [145]
En años más recientes, con la capacidad de los científicos para aislar y cultivar células madre embrionarias , y con la creciente capacidad de los científicos para crear células madre utilizando la transferencia nuclear de células somáticas y técnicas para crear células madre pluripotentes inducidas , ha surgido la controversia , tanto relacionada con las políticas del aborto como con la clonación humana .
La hepatotoxicidad y las lesiones hepáticas inducidas por fármacos son la causa de un número importante de fracasos de nuevos fármacos en el desarrollo y de su retirada del mercado, lo que pone de relieve la necesidad de realizar ensayos de detección, como las células similares a los hepatocitos derivadas de células madre, que son capaces de detectar la toxicidad en una etapa temprana del proceso de desarrollo del fármaco . [146]
En agosto de 2021, investigadores del Centro Oncológico Princesa Margarita de la Red de Salud Universitaria publicaron su descubrimiento de un mecanismo de latencia en células madre clave que podría ayudar a desarrollar tratamientos contra el cáncer en el futuro. [147]