Los anfibios son animales vertebrados ectotérmicos , anamnióticos y de cuatro extremidades que constituyen la clase Amphibia . En su sentido amplio, es un grupo parafilético que engloba a todos los tetrápodos excluyendo a los amniotas (tetrápodos con membrana amniótica , como los reptiles , aves y mamíferos modernos ). Todos los anfibios existentes (vivos) pertenecen a la subclase monofilética Lissamphibia , con tres órdenes vivientes : Anura ( ranas ), Urodela ( salamandras ) y Gymnophiona ( cecilias ). Evolucionados para ser en su mayoría semiacuáticos , los anfibios se han adaptado para habitar una amplia variedad de hábitats , y la mayoría de las especies viven en ecosistemas de agua dulce , humedales o terrestres (como bosques ribereños , hábitats fosoriales e incluso arbóreos ). Su ciclo de vida generalmente comienza como larvas acuáticas con branquias conocidas como renacuajos , pero algunas especies han desarrollado adaptaciones de comportamiento para evitar esto.
Las crías generalmente sufren una metamorfosis de larva con branquias a una forma adulta que respira aire y tiene pulmones . Los anfibios utilizan su piel como superficie respiratoria secundaria y algunas pequeñas salamandras y ranas terrestres carecen de pulmones y dependen exclusivamente de su piel. Son superficialmente similares a reptiles como los lagartos , pero a diferencia de los reptiles y otros amniotas , requieren cuerpos de agua en los que reproducirse. Con sus complejas necesidades reproductivas y su piel permeable, los anfibios suelen ser indicadores ecológicos ; En las últimas décadas ha habido una disminución dramática en las poblaciones de anfibios de muchas especies en todo el mundo.
Los primeros anfibios evolucionaron en el período Devónico a partir de peces sarcopterigios con pulmones y aletas con extremidades óseas, características que fueron útiles para adaptarse a la tierra seca. Se diversificaron y se volvieron ecológicamente dominantes durante los períodos Carbonífero y Pérmico , pero luego fueron desplazados en ambientes terrestres por los primeros reptiles y sinápsidos basales (mamíferos predecesores). El origen de los anfibios modernos pertenecientes a Lissamphibia, que apareció por primera vez durante el Triásico Inferior, hace unos 250 millones de años, ha sido durante mucho tiempo polémico. Sin embargo, el consenso emergente es que probablemente se originaron a partir de temnospóndilos , el grupo más diverso de anfibios prehistóricos, durante el período Pérmico. [4] [5]
Un cuarto grupo de lisanfibios, los Albanerpetontidae , se extinguieron hace unos 2 millones de años. El número de especies de anfibios conocidas es de aproximadamente 8.000, de las cuales casi el 90% son ranas. El anfibio (y vertebrado) más pequeño del mundo es una rana de Nueva Guinea ( Paedophryne amauensis ) con una longitud de sólo 7,7 mm (0,30 pulgadas). El anfibio vivo más grande es la salamandra gigante del sur de China ( Andrias sligoi ), de 1,8 m (5 pies 11 pulgadas) , pero queda eclipsado por los temnospóndilos prehistóricos como el Mastodonsaurus , que podría alcanzar hasta 6 m (20 pies) de longitud. [6] El estudio de los anfibios se denomina batracología , mientras que el estudio tanto de los reptiles como de los anfibios se denomina herpetología .

La palabra anfibio se deriva del término griego antiguo ἀμφίβιος ( amphíbios ), que significa "ambos tipos de vida", ἀμφί que significa "de ambos tipos" y βιος que significa "vida". El término se utilizó inicialmente como adjetivo general para los animales que podían vivir en la tierra o en el agua, incluidas las focas y las nutrias. [7] Tradicionalmente, la clase Amphibia incluye todos los vertebrados tetrápodos que no son amniotas. Los anfibios en su sentido más amplio ( sensu lato ) se dividieron en tres subclases , dos de las cuales están extintas: [8]
Estas tres subclases no incluyen a todos los anfibios extintos. Otros grupos de anfibios extintos incluyen Embolomeri (grandes depredadores acuáticos del Paleozoico tardío), Seymouriamorpha (formas semiacuáticas a terrestres del Pérmico relacionadas con los amniotas), entre otros. Nombres como Tetrapoda y Stegocephalia abarcan la totalidad de los tetrápodos de grado anfibio, mientras que Reptiliomorpha o Antracosauria se utilizan de forma variable para describir anfibios extintos más estrechamente relacionados con los amniotas que con los lisanfibios.

El número real de especies de cada grupo depende de la clasificación taxonómica seguida. Los dos sistemas más comunes son la clasificación adoptada por el sitio web AmphibiaWeb, de la Universidad de California, Berkeley , y la clasificación del herpetólogo Darrel Frost y el Museo Americano de Historia Natural , disponible como base de datos de referencia en línea "Amphibian Species of the World". [10] El número de especies citado anteriormente sigue a Frost y el número total de especies de anfibios (vivos) conocidas al 31 de marzo de 2019 es exactamente 8000, [11] de las cuales casi el 90% son ranas. [12]
Con la clasificación filogenética , el taxón Labyrinthodontia ha sido descartado por ser un grupo poliparafilético sin rasgos definitorios únicos aparte de características primitivas compartidas . La clasificación varía según la filogenia preferida del autor y si utiliza una clasificación basada en tallos o en nodos . Tradicionalmente, los anfibios como clase se definen como todos los tetrápodos con estadio larvario, mientras que el grupo que incluye a los ancestros comunes de todos los anfibios vivos (ranas, salamandras y cecilias) y todos sus descendientes se denomina Lissamphibia. La filogenia de los anfibios del Paleozoico es incierta, y Lissamphibia posiblemente pertenezca a grupos extintos, como los Temnospondyli (tradicionalmente ubicados en la subclase Labyrinthodontia) o los Lepospondyli, y en algunos análisis incluso en los amniotas. Esto significa que los defensores de la nomenclatura filogenética han eliminado un gran número de grupos basales de tetrápodos de tipo anfibio del Devónico y del Carbonífero que anteriormente se ubicaban en Amphibia en la taxonomía de Linneo , y los han incluido en otros lugares bajo la taxonomía cladística . [2] Si el ancestro común de los anfibios y los amniotas se incluye en Amphibia, se convierte en un grupo parafilético. [13]
Todos los anfibios modernos están incluidos en la subclase Lissamphibia, que suele considerarse un clado , un grupo de especies que han evolucionado a partir de un ancestro común. Los tres órdenes modernos son Anura (las ranas), Caudata (o Urodela, las salamandras) y Gymnophiona (o Apoda, las cecilias). [14] Se ha sugerido que las salamandras surgieron por separado de un ancestro similar al temnospondilo, e incluso que las cecilias son el grupo hermano de los anfibios reptiliomorfos avanzados y, por tanto, de los amniotas. [15] Aunque se conocen los fósiles de varias proto-ranas más antiguas con características primitivas, la "rana verdadera" más antigua, con adaptaciones de salto es Prosalirus bitis , de la Formación Kayenta del Jurásico Temprano de Arizona. Es anatómicamente muy similar a las ranas modernas. [16] Las cecilias más antiguas conocidas son Funcusvermis gilmorei (del Triásico Tardío) y Eocaecilia micropodia (del Jurásico Temprano), ambas de Arizona. [17] La salamandra más antigua es Beiyanerpeton jianpingensis del Jurásico tardío del noreste de China. [18]
Las autoridades no están de acuerdo sobre si Salientia es un superorden que incluye el orden Anura, o si Anura es un suborden del orden Salientia. Los Lissamphibia se dividen tradicionalmente en tres órdenes , pero una familia extinta parecida a las salamandras, los Albanerpetontidae, ahora se considera parte de Lissamphibia junto con el superorden Salientia. Además, Salientia incluye los tres órdenes recientes más la proto-rana del Triásico, Triadobatrachus . [19]
Los primeros grupos importantes de anfibios se desarrollaron en el período Devónico , hace unos 370 millones de años, a partir de peces con aletas lobuladas que eran similares al celacanto y al pez pulmonado modernos . [20] Estos antiguos peces con aletas lobuladas habían desarrollado aletas multiarticuladas en forma de patas con dedos que les permitían arrastrarse por el fondo del mar. Algunos peces habían desarrollado pulmones primitivos que les ayudaban a respirar aire cuando los estanques estancados de los pantanos del Devónico tenían poco oxígeno. También podrían usar sus fuertes aletas para izarse fuera del agua y llegar a tierra firme si las circunstancias así lo requirieran. Con el tiempo, sus aletas óseas evolucionarían hasta convertirse en extremidades y se convertirían en los antepasados de todos los tetrápodos , incluidos los anfibios, reptiles, aves y mamíferos modernos . A pesar de poder arrastrarse por la tierra, muchos de estos peces tetrapodomorfos prehistóricos todavía pasaban la mayor parte del tiempo en el agua. Habían comenzado a desarrollar pulmones, pero todavía respiraban predominantemente con branquias. [21]
Se han descubierto muchos ejemplos de especies que muestran características de transición . Ichthyostega fue uno de los primeros anfibios primitivos, con fosas nasales y pulmones más eficientes. Tenía cuatro extremidades robustas, un cuello, una cola con aletas y un cráneo muy similar al del pez de aletas lobuladas, Eusthenopteron . [20] Los anfibios desarrollaron adaptaciones que les permitieron permanecer fuera del agua durante períodos más largos. Sus pulmones mejoraron y sus esqueletos se volvieron más pesados y fuertes, más capaces de soportar el peso de sus cuerpos en tierra. Desarrollaron "manos" y "pies" con cinco o más dígitos; [22] la piel se volvió más capaz de retener fluidos corporales y resistir la desecación. [21] El hueso hiomandibular del pez en la región hioides detrás de las branquias disminuyó de tamaño y se convirtió en el estribo del oído de los anfibios, una adaptación necesaria para oír en tierra firme. [23] Una afinidad entre los anfibios y los peces teleósteos es la estructura múltiple de los dientes y los huesos supraoccipital emparejados en la parte posterior de la cabeza, ninguna de estas características se encuentra en otras partes del reino animal. [24]

Al final del período Devónico (hace 360 millones de años), los mares, ríos y lagos estaban llenos de vida mientras que la tierra era el reino de las primeras plantas y carecía de vertebrados, [24] aunque algunos, como Ichthyostega , pueden haber A veces salían del agua. Se cree que se impulsaban con las extremidades anteriores, arrastrando los cuartos traseros de forma similar a la que utiliza el elefante marino . [22] A principios del Carbonífero (hace 360 a 323 millones de años), el clima era relativamente húmedo y cálido. Se desarrollaron extensos pantanos con musgos , helechos , colas de caballo y calamitas . Los artrópodos que respiran aire evolucionaron e invadieron la tierra donde proporcionaron alimento a los anfibios carnívoros que comenzaron a adaptarse al medio terrestre. No había otros tetrápodos en la tierra y los anfibios estaban en la cima de la cadena alimentaria, y algunos ocupaban posiciones ecológicas que actualmente ocupan los cocodrilos. Aunque estaban equipados con extremidades y la capacidad de respirar aire, la mayoría todavía tenía un cuerpo largo y afilado y una cola fuerte. [24] Otros eran los principales depredadores terrestres, que a veces alcanzaban varios metros de longitud, y se alimentaban de los grandes insectos de la época y de los numerosos tipos de peces que había en el agua. Todavía necesitaban regresar al agua para poner sus huevos sin cáscara, e incluso la mayoría de los anfibios modernos tienen una etapa larvaria completamente acuática con branquias como sus ancestros peces. Fue el desarrollo del huevo amniótico , que evita que el embrión en desarrollo se seque, lo que permitió a los reptiles reproducirse en la tierra y lo que llevó a su dominio en el período siguiente. [20]
Después del colapso de la selva tropical del Carbonífero, el dominio de los anfibios dio paso a los reptiles, [25] y los anfibios fueron aún más devastados por el evento de extinción del Pérmico-Triásico . [26] Durante el período Triásico (hace 252 a 201 millones de años), los reptiles continuaron superando a los anfibios, lo que llevó a una reducción tanto en el tamaño de los anfibios como en su importancia en la biosfera . Según el registro fósil, Lissamphibia , que incluye a todos los anfibios modernos y es el único linaje superviviente, puede haberse separado de los grupos extintos Temnospondyli y Lepospondyli en algún período entre el Carbonífero Superior y el Triásico Temprano. La relativa escasez de evidencia fósil impide una datación precisa, [21] pero el estudio molecular más reciente, basado en la tipificación de secuencias multilocus , sugiere un origen del Carbonífero Tardío/ Pérmico Temprano para los anfibios existentes. [27]

Los orígenes y las relaciones evolutivas entre los tres grupos principales de anfibios son un tema de debate. Una filogenia molecular de 2005, basada en análisis de ADNr , sugiere que las salamandras y las cecilias están más estrechamente relacionadas entre sí que con las ranas. También parece que la divergencia de los tres grupos tuvo lugar en el Paleozoico o Mesozoico temprano (hace unos 250 millones de años), antes de la desintegración del supercontinente Pangea y poco después de su divergencia de los peces de aletas lobuladas. La brevedad de este período y la rapidez con la que se produjo la radiación ayudarían a explicar la relativa escasez de fósiles de anfibios primitivos. [28] Hay grandes lagunas en el registro fósil ; el descubrimiento del temnospondil disorofoide Gerobatrachus del Pérmico Temprano en Texas en 2008 proporcionó un eslabón perdido con muchas de las características de las ranas modernas. [15] El análisis molecular sugiere que la divergencia rana-salamandra tuvo lugar considerablemente antes de lo que indica la evidencia paleontológica . [15] Un estudio sugirió que el último ancestro común de todos los anfibios modernos vivió hace unos 315 millones de años, y que los temnospondilos estereospondilos son los parientes más cercanos de las cecilias. [29] Sin embargo, la mayoría de los estudios apoyan un origen monofilético único de todos los anfibios modernos dentro de los temnospóndilos disorofoideos. [4]
A medida que evolucionaron a partir de peces, los anfibios tuvieron que hacer ciertas adaptaciones para vivir en tierra, incluida la necesidad de desarrollar nuevos medios de locomoción. En el agua, los movimientos laterales de sus colas los habían impulsado hacia adelante, pero en tierra se requerían mecanismos bastante diferentes. Sus columnas vertebrales, extremidades, cinturas de extremidades y musculatura debían ser lo suficientemente fuertes como para elevarlos del suelo para la locomoción y la alimentación. Los adultos terrestres descartaron sus sistemas de líneas laterales y adaptaron sus sistemas sensoriales para recibir estímulos a través del aire. Necesitaban desarrollar nuevos métodos para regular el calor corporal y hacer frente a las fluctuaciones de la temperatura ambiente. Desarrollaron comportamientos adecuados para la reproducción en un ambiente terrestre. Sus pieles quedaron expuestas a los dañinos rayos ultravioleta que previamente habían sido absorbidos por el agua. La piel cambió para volverse más protectora y evitar la pérdida excesiva de agua. [30]
La superclase Tetrapoda se divide en cuatro clases de animales vertebrados con cuatro extremidades. [31] Los reptiles, aves y mamíferos son amniotas, cuyos huevos son puestos o transportados por la hembra y están rodeados por varias membranas, algunas de las cuales son impermeables. [32] Al carecer de estas membranas, los anfibios necesitan cuerpos de agua para reproducirse, aunque algunas especies han desarrollado varias estrategias para proteger o evitar la vulnerable etapa larval acuática. [30] No se encuentran en el mar con la excepción de una o dos ranas que viven en aguas salobres en manglares ; [33] Mientras tanto , la salamandra de Anderson se encuentra en lagos de agua salobre o salada. [34] En tierra, los anfibios están restringidos a hábitats húmedos debido a la necesidad de mantener su piel húmeda. [30]
Los anfibios modernos tienen una anatomía simplificada en comparación con sus ancestros debido a la pedomorfosis , provocada por dos tendencias evolutivas: la miniaturización y un genoma inusualmente grande, que resultan en una tasa de crecimiento y desarrollo más lenta en comparación con otros vertebrados. [35] [36] Otra razón de su tamaño está asociada con su rápida metamorfosis, que parece haber evolucionado sólo en los antepasados de la lisanfibia; en todas las demás líneas conocidas el desarrollo fue mucho más gradual. Debido a que una remodelación del aparato alimentario hace que no coman durante la metamorfosis, la metamorfosis tiene que ser más rápida cuanto más pequeño es el individuo, por lo que ocurre en una etapa temprana cuando las larvas aún son pequeñas. (Las especies más grandes de salamandras no pasan por una metamorfosis). [37] Los anfibios que ponen huevos en la tierra a menudo pasan por toda la metamorfosis dentro del huevo. Un huevo terrestre anamniótico tiene menos de 1 cm de diámetro debido a problemas de difusión, tamaño que pone un límite a la cantidad de crecimiento posterior a la eclosión. [38]
El anfibio (y vertebrado) más pequeño del mundo es una rana microhílida de Nueva Guinea ( Paedophryne amauensis ) descubierta por primera vez en 2012. Tiene una longitud promedio de 7,7 mm (0,30 pulgadas) y es parte de un género que contiene cuatro de las ranas del mundo. diez especies de ranas más pequeñas. [39] El anfibio vivo más grande es la salamandra gigante china ( Andrias davidianus ) , de 1,8 m (5 pies 11 pulgadas), [40] pero es mucho más pequeño que el anfibio más grande que jamás haya existido: el extinto 9 m (30 pies) Prionosuchus , un temnospondilo parecido a un cocodrilo que data de hace 270 millones de años del Pérmico medio de Brasil. [41] La rana más grande es la rana Goliat africana ( Conraua goliath ), que puede alcanzar los 32 cm (13 pulgadas) y pesar 3 kg (6,6 libras). [40]
Los anfibios son vertebrados ectotérmicos (de sangre fría) que no mantienen su temperatura corporal mediante procesos fisiológicos internos . Su tasa metabólica es baja y, como resultado, sus necesidades de alimentos y energía son limitadas. En estado adulto, tienen conductos lagrimales y párpados móviles, y la mayoría de las especies tienen oídos que pueden detectar vibraciones en el aire o en el suelo. Tienen lenguas musculosas, que en muchas especies pueden sobresalir. Los anfibios modernos tienen vértebras completamente osificadas con apófisis articulares . Sus costillas suelen ser cortas y pueden estar fusionadas con las vértebras. Sus cráneos son en su mayoría anchos y cortos y, a menudo, no están completamente osificados. Su piel contiene poca queratina y carece de escamas, salvo algunas escamas parecidas a las de un pez en algunas cecilias. La piel contiene muchas glándulas mucosas y, en algunas especies, glándulas venenosas (un tipo de glándula granular). El corazón de los anfibios tiene tres cámaras, dos aurículas y un ventrículo . Tienen vejiga urinaria y los productos de desecho nitrogenados se excretan principalmente en forma de urea . La mayoría de los anfibios ponen sus huevos en el agua y tienen larvas acuáticas que sufren metamorfosis para convertirse en adultos terrestres. Los anfibios respiran mediante una acción de bomba en la que primero se aspira aire hacia la región bucofaríngea a través de las fosas nasales. Luego se cierran y el aire ingresa a los pulmones mediante la contracción de la garganta. [42] Complementan esto con el intercambio de gases a través de la piel. [30]

El orden Anura (del griego antiguo a(n) - que significa "sin" y oura que significa "cola") comprende las ranas y los sapos. Por lo general, tienen extremidades traseras largas que se pliegan debajo de ellas, extremidades anteriores más cortas, dedos palmeados sin garras, sin cola, ojos grandes y piel glandular húmeda. [14] Los miembros de este orden con piel suave se conocen comúnmente como ranas, mientras que aquellos con piel verrugosa se conocen como sapos. La diferencia no es taxonómicamente formal y existen numerosas excepciones a esta regla. Los miembros de la familia Bufonidae son conocidos como los "verdaderos sapos". [43] Las ranas varían en tamaño desde la rana Goliat ( Conraua goliath ) de 30 centímetros (12 pulgadas) de África occidental [44] hasta la Paedophryne amauensis de 7,7 milímetros (0,30 pulgadas) , descrita por primera vez en Papúa Nueva Guinea en 2012, que Es también el vertebrado más pequeño conocido. [45] Aunque la mayoría de las especies están asociadas con el agua y los hábitats húmedos, algunas están especializadas en vivir en árboles o desiertos. Se encuentran en todo el mundo excepto en las zonas polares. [46]
Anura se divide en tres subórdenes que son ampliamente aceptados por la comunidad científica, pero las relaciones entre algunas familias siguen sin estar claras. Los futuros estudios moleculares deberían proporcionar más información sobre sus relaciones evolutivas. [47] El suborden Archaeobatrachia contiene cuatro familias de ranas primitivas. Se trata de Ascaphidae , Bombinatoridae , Discoglossidae y Leiopelmatidae que tienen pocas características derivadas y probablemente sean parafiléticas con respecto a otros linajes de ranas. [48] Las seis familias en el suborden Mesobatrachia , más avanzado evolutivamente, son los fosoriales Megophryidae , Pelobatidae , Pelodytidae , Scaphiopodidae y Rhinophrynidae y los Pipidae obligatoriamente acuáticos . Estos tienen ciertas características que son intermedias entre los otros dos subórdenes. [48] Neobatrachia es, con diferencia, el suborden más grande e incluye las familias restantes de ranas modernas, incluidas las especies más comunes. El noventa y seis por ciento de las más de 5.000 especies de ranas existentes son neobatracios. [49]

El orden Caudata (del latín cauda que significa "cola") está formado por salamandras, animales alargados y bajos que en su mayoría se parecen a los lagartos en su forma. Este es un rasgo simplesiomórfico y no están más estrechamente relacionados con los lagartos que con los mamíferos. [50] Las salamandras carecen de garras, tienen piel sin escamas, ya sea lisa o cubierta de tubérculos , y colas que generalmente son aplanadas de lado a lado y, a menudo, con aletas. Varían en tamaño desde la salamandra gigante china ( Andrias davidianus ), de la que se ha informado que crece hasta una longitud de 1,8 metros (5 pies 11 pulgadas), [51] hasta el diminuto Thorius pennatulus de México, que rara vez supera los 20 mm (0,8 en) de longitud. [52] Las salamandras tienen una distribución mayoritariamente laurasiática y están presentes en gran parte de la región holártica del hemisferio norte. La familia Plethodontidae también se encuentra en Centroamérica y Sudamérica al norte de la cuenca del Amazonas ; [46] Sudamérica aparentemente fue invadida desde Centroamérica aproximadamente a principios del Mioceno , hace 23 millones de años. [53] Urodela es un nombre que a veces se utiliza para todas las especies existentes de salamandras. [54] Los miembros de varias familias de salamandras se han vuelto pedomórficos y no logran completar su metamorfosis o conservan algunas características larvarias cuando son adultos. [55] La mayoría de las salamandras miden menos de 15 cm (6 pulgadas) de largo. Pueden ser terrestres o acuáticos y muchos pasan parte del año en cada hábitat. Cuando están en tierra, pasan el día escondidos bajo piedras o troncos o entre una densa vegetación, emergiendo por la tarde y por la noche para buscar gusanos, insectos y otros invertebrados. [46]

El suborden Cryptobranchoidea contiene las primitivas salamandras. Se han encontrado varios criptobranquidos fósiles, pero solo quedan tres especies vivas: la salamandra gigante china ( Andrias davidianus ), la salamandra gigante japonesa ( Andrias japonicus ) y el maestro infierno ( Cryptobranchus alleganiensis ) de América del Norte. Estos grandes anfibios conservan varias características larvarias en su estado adulto; Hay hendiduras branquiales y los ojos no tienen párpados. Una característica única es su capacidad para alimentarse mediante succión, presionando el lado izquierdo de la mandíbula inferior o el derecho. [56] Los machos excavan nidos, persuaden a las hembras para que pongan sus hilos de huevos dentro de ellos y los protegen. Además de respirar con los pulmones, respiran a través de los numerosos pliegues de su fina piel, que tiene capilares cerca de la superficie. [57]
El suborden Salamandroidea contiene las salamandras avanzadas. Se diferencian de los criptobranquidos por tener huesos prearticulares fusionados en la mandíbula inferior y por utilizar fertilización interna. En las salamandridas, el macho deposita un haz de espermatozoides, el espermatóforo , y la hembra lo recoge y lo introduce en su cloaca donde se almacena el esperma hasta la puesta de los huevos. [58] La familia más grande de este grupo es Plethodontidae, las salamandras sin pulmones, que incluye el 60% de todas las especies de salamandras. La familia Salamandridae incluye las verdaderas salamandras y el nombre " tritón " se da a los miembros de su subfamilia Pleurodelinae . [14]
El tercer suborden, Sirenoidea , contiene las cuatro especies de sirenas, que se encuentran en una sola familia, Sirenidae . Los miembros de este orden son salamandras acuáticas parecidas a anguilas con extremidades anteriores muy reducidas y sin extremidades traseras. Algunas de sus características son primitivas mientras que otras son derivadas. [59] Es probable que la fertilización sea externa ya que los sirenidos carecen de las glándulas cloacales utilizadas por los salamandridos machos para producir espermatóforos y las hembras carecen de espermatecas para almacenar esperma. A pesar de ello, los huevos se ponen individualmente, un comportamiento que no favorece la fecundación externa. [58]

El orden Gymnophiona (del griego gymnos que significa "desnudo" y ophis que significa "serpiente") o Apoda comprende a las cecilias. Se trata de animales largos, cilíndricos, sin extremidades y con forma de serpiente o gusano . Los adultos varían en longitud de 8 a 75 centímetros (3 a 30 pulgadas) con la excepción de la cecilia de Thomson ( Caecilia thompsoni ), que puede alcanzar los 150 centímetros (4,9 pies). La piel de una cecilia tiene una gran cantidad de pliegues transversales y en algunas especies contiene pequeñas escamas dérmicas incrustadas. Tiene ojos rudimentarios cubiertos de piel, que probablemente se limitan a discernir diferencias en la intensidad de la luz. También tiene un par de tentáculos cortos cerca del ojo que pueden extenderse y que tienen funciones táctiles y olfativas . La mayoría de las cecilias viven bajo tierra en madrigueras en suelo húmedo, en madera podrida y debajo de restos de plantas, pero algunas son acuáticas. [60] La mayoría de las especies ponen sus huevos bajo tierra y cuando las larvas eclosionan, se dirigen a cuerpos de agua adyacentes. Otros incuban sus huevos y las larvas sufren una metamorfosis antes de que los huevos eclosionen. Algunas especies dan a luz crías vivas, alimentándolas con secreciones glandulares mientras están en el oviducto. [61] Las cecilias tienen una distribución mayoritariamente gondwana y se encuentran en regiones tropicales de África, Asia y América Central y del Sur. [62]

La estructura tegumentaria contiene algunas características típicas comunes a los vertebrados terrestres, como la presencia de capas externas altamente cornificadas , renovadas periódicamente mediante un proceso de muda controlado por las glándulas pituitaria y tiroides . Los engrosamientos locales (a menudo llamados verrugas) son comunes, como los que se encuentran en los sapos. La parte exterior de la piel se muda periódicamente principalmente en una sola pieza, a diferencia de los mamíferos y las aves, donde se muda en escamas. Los anfibios suelen comer la piel descamada. [46] Las cecilias son únicas entre los anfibios por tener escamas dérmicas mineralizadas incrustadas en la dermis entre los surcos de la piel. La similitud de éstas con las escamas de los peces óseos es en gran medida superficial. Los lagartos y algunas ranas tienen osteodermos algo similares que forman depósitos óseos en la dermis, pero este es un ejemplo de evolución convergente con estructuras similares que surgieron de forma independiente en diversos linajes de vertebrados. [63]
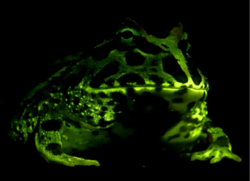
La piel de los anfibios es permeable al agua. El intercambio de gases puede tener lugar a través de la piel ( respiración cutánea ) y esto permite a los anfibios adultos respirar sin subir a la superficie del agua e hibernar en el fondo de los estanques. [46] Para compensar su piel fina y delicada, los anfibios han desarrollado glándulas mucosas, principalmente en la cabeza, la espalda y la cola. Las secreciones producidas por estos ayudan a mantener la piel húmeda. Además, la mayoría de las especies de anfibios tienen glándulas granulares que secretan sustancias desagradables o venenosas. Algunas toxinas de los anfibios pueden ser letales para los humanos, mientras que otras tienen poco efecto. [64] Las principales glándulas productoras de veneno, las parotoides , producen la neurotoxina bufotoxina y están ubicadas detrás de las orejas de los sapos, a lo largo del lomo de las ranas, detrás de los ojos de las salamandras y en la superficie superior de las cecilias. [sesenta y cinco]
El color de la piel de los anfibios es producido por tres capas de células pigmentarias llamadas cromatóforos . Estas tres capas celulares están formadas por los melanóforos (que ocupan la capa más profunda), los guanóforos (que forman una capa intermedia y contienen muchos gránulos, produciendo un color azul verdoso) y los lipóforos (amarillo, la capa más superficial). El cambio de color que muestran muchas especies es iniciado por hormonas secretadas por la glándula pituitaria. A diferencia de los peces óseos, el sistema nervioso no controla directamente las células pigmentarias, por lo que el cambio de color se produce más lentamente que en los peces. Una piel de colores vivos suele indicar que la especie es tóxica y es una señal de advertencia para los depredadores. [66]
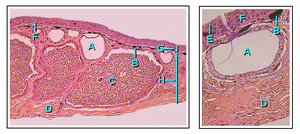
Los anfibios tienen un sistema esquelético estructuralmente homólogo al de otros tetrápodos, aunque con numerosas variaciones. Todos tienen cuatro extremidades, excepto las cecilias sin patas y algunas especies de salamandras con extremidades reducidas o sin extremidades. Los huesos son huecos y livianos. El sistema musculoesquelético es fuerte para permitirle sostener la cabeza y el cuerpo. Los huesos están completamente osificados y las vértebras se entrelazan entre sí mediante procesos superpuestos. La cintura pectoral está sostenida por músculos y la cintura pélvica bien desarrollada está unida a la columna vertebral mediante un par de costillas sacras. El ilion se inclina hacia adelante y el cuerpo se mantiene más cerca del suelo que en el caso de los mamíferos. [67]

En la mayoría de los anfibios, hay cuatro dedos en la pata delantera y cinco en la trasera, pero no tienen garras. Algunas salamandras tienen menos dígitos y los anfiumas tienen apariencia de anguila con patas pequeñas y rechonchas. Las sirenas son salamandras acuáticas con extremidades anteriores rechonchas y sin extremidades traseras. Las cecilias no tienen extremidades. Excavan a la manera de las lombrices de tierra con zonas de contracciones musculares que se mueven a lo largo del cuerpo. En la superficie del suelo o en el agua se mueven ondulando su cuerpo de lado a lado. [68]
En las ranas, las patas traseras son más grandes que las delanteras, especialmente en aquellas especies que se mueven principalmente saltando o nadando. En los caminantes y corredores las extremidades traseras no son tan grandes, y los excavadores en su mayoría tienen extremidades cortas y cuerpos anchos. Los pies tienen adaptaciones para la forma de vida, con membranas entre los dedos para nadar, amplias almohadillas adhesivas para trepar y tubérculos queratinizados en las patas traseras para cavar (las ranas generalmente cavan hacia atrás en el suelo). En la mayoría de las salamandras, las extremidades son cortas y más o menos de la misma longitud y se proyectan en ángulo recto desde el cuerpo. La locomoción en tierra se realiza caminando y la cola a menudo se balancea de un lado a otro o se utiliza como apoyo, especialmente al trepar. En su marcha normal, sólo avanza una pierna a la vez, de la manera adoptada por sus antepasados, los peces con aletas lobuladas. [67] Algunas salamandras del género Aneides y ciertos pletododóntidos trepan a los árboles y tienen extremidades largas, almohadillas grandes en los dedos de los pies y colas prensiles. [58] En las salamandras acuáticas y en los renacuajos de rana, la cola tiene aletas dorsal y ventral y se mueve de un lado a otro como medio de propulsión. Las ranas adultas no tienen cola y las cecilias sólo la tienen muy corta. [68]

Las salamandras usan sus colas como defensa y algunas están dispuestas a deshacerse de ellas para salvar sus vidas en un proceso conocido como autotomía . Ciertas especies de Plethodontidae tienen una zona débil en la base de la cola y utilizan esta estrategia fácilmente. La cola a menudo continúa moviéndose después de la separación, lo que puede distraer al atacante y permitir que la salamandra escape. Tanto la cola como las extremidades se pueden regenerar. [69] Las ranas adultas no pueden recuperar extremidades, pero los renacuajos sí pueden hacerlo. [68]

Los anfibios tienen una etapa juvenil y una etapa adulta, y los sistemas circulatorios de los dos son distintos. En la etapa juvenil (o renacuajo), la circulación es similar a la de un pez; El corazón de dos cámaras bombea la sangre a través de las branquias donde se oxigena y se distribuye por todo el cuerpo y de regreso al corazón en un solo circuito. En la etapa adulta, los anfibios (especialmente las ranas) pierden las branquias y desarrollan pulmones. Tienen un corazón que consta de un solo ventrículo y dos aurículas. Cuando el ventrículo comienza a contraerse, la sangre desoxigenada se bombea a través de la arteria pulmonar hacia los pulmones. La contracción continua bombea sangre oxigenada al resto del cuerpo. La anatomía de las cámaras minimiza la mezcla de los dos torrentes sanguíneos. [70]
El sistema nervioso es básicamente el mismo que el de otros vertebrados, con un cerebro central, una médula espinal y nervios por todo el cuerpo. El cerebro de los anfibios es relativamente simple pero estructuralmente igual al de los reptiles, aves y mamíferos. Sus cerebros son alargados, excepto en las cecilias, y contienen las áreas motoras y sensoriales habituales de los tetrápodos. [71] Se cree que el cuerpo pineal , conocido por regular los patrones de sueño en los humanos, produce las hormonas involucradas en la hibernación y la estivación en los anfibios. [72]
Los renacuajos conservan el sistema de líneas laterales de sus peces ancestrales, pero este se pierde en los anfibios adultos terrestres. Algunas cecilias poseen electrorreceptores que les permiten localizar objetos a su alrededor cuando se sumergen en agua. Las orejas de las ranas están bien desarrolladas. No hay oído externo, pero el tímpano circular grande se encuentra en la superficie de la cabeza, justo detrás del ojo. Éste vibra y el sonido se transmite a través de un único hueso, el estribo , hasta el oído interno. De esta manera sólo se escuchan sonidos de alta frecuencia, como llamadas de apareamiento, pero los ruidos de baja frecuencia se pueden detectar mediante otro mecanismo. [67] Hay un parche de células ciliadas especializadas, llamada papila anfibiorum , en el oído interno capaz de detectar sonidos más profundos. Otra característica, exclusiva de las ranas y las salamandras, es el complejo columela-opérculo contiguo a la cápsula auditiva, que participa en la transmisión de señales sísmicas y aéreas. [73] Los oídos de las salamandras y las cecilias están menos desarrollados que los de las ranas, ya que normalmente no se comunican entre sí a través del sonido. [74]
Los ojos de los renacuajos carecen de párpados, pero en la metamorfosis, la córnea adquiere una forma más abovedada, el cristalino se vuelve más plano y se desarrollan los párpados y las glándulas y conductos asociados. [67] Los ojos de los adultos son una mejora con respecto a los ojos de los invertebrados y fueron un primer paso en el desarrollo de ojos de vertebrados más avanzados. Permiten visión del color y profundidad de enfoque. En las retinas hay bastones verdes que son receptivos a una amplia gama de longitudes de onda. [74]
Muchos anfibios atrapan a sus presas sacando una lengua alargada con una punta pegajosa y metiéndola nuevamente en la boca antes de agarrar el objeto con sus mandíbulas. Algunos utilizan la alimentación inercial para ayudarles a tragar a la presa, empujando repetidamente la cabeza hacia adelante con fuerza, lo que hace que la comida se mueva hacia atrás en la boca por inercia . La mayoría de los anfibios tragan a sus presas enteras sin masticarlas mucho, por lo que poseen estómagos voluminosos. El esófago corto está revestido de cilios que ayudan a llevar los alimentos al estómago y el moco producido por las glándulas de la boca y la faringe facilita su paso. La enzima quitinasa producida en el estómago ayuda a digerir la cutícula quitinosa de las presas artrópodas. [75]
Los anfibios poseen páncreas , hígado y vesícula biliar . El hígado suele ser grande y tener dos lóbulos. Su tamaño está determinado por su función como unidad de almacenamiento de glucógeno y grasa, y puede cambiar con las estaciones a medida que estas reservas se acumulan o se agotan. El tejido adiposo es otro medio importante para almacenar energía y esto ocurre en el abdomen (en estructuras internas llamadas cuerpos grasos), debajo de la piel y, en algunas salamandras, en la cola. [76]
Hay dos riñones ubicados dorsalmente, cerca del techo de la cavidad corporal. Su trabajo es filtrar la sangre de los desechos metabólicos y transportar la orina a través de los uréteres a la vejiga urinaria, donde se almacena antes de salir periódicamente a través del respiradero cloacal. Las larvas y la mayoría de los anfibios adultos acuáticos excretan el nitrógeno en forma de amoníaco en grandes cantidades de orina diluida, mientras que las especies terrestres, con una mayor necesidad de conservar agua, excretan el producto menos tóxico urea. Algunas ranas arborícolas con acceso limitado al agua excretan la mayor parte de sus desechos metabólicos en forma de ácido úrico. [77]
La mayoría de los anfibios acuáticos y semiacuáticos tienen una piel membranosa que les permite absorber agua directamente a través de ella. Algunos animales semiacuáticos también tienen una membrana de vejiga igualmente permeable. [78] Como resultado, tienden a tener altas tasas de producción de orina para compensar esta alta ingesta de agua, y tienen una orina baja en sales disueltas. La vejiga urinaria ayuda a estos animales a retener sales. Algunos anfibios acuáticos como Xenopus no reabsorben agua para evitar una entrada excesiva de agua. [79] Para los anfibios terrestres, la deshidratación da como resultado una reducción de la producción de orina. [80]
La vejiga de los anfibios suele ser muy distensible y, entre algunas especies terrestres de ranas y salamandras, puede representar entre el 20% y el 50% de su peso corporal total. [80]
Los pulmones de los anfibios son primitivos en comparación con los de los amniotas, poseen pocos septos internos y alvéolos grandes y, en consecuencia, tienen una tasa de difusión comparativamente lenta del oxígeno que ingresa a la sangre. La ventilación se logra mediante bombeo bucal . [81] La mayoría de los anfibios, sin embargo, son capaces de intercambiar gases con el agua o el aire a través de su piel. Para permitir una respiración cutánea suficiente , la superficie de su piel altamente vascularizada debe permanecer húmeda para permitir que el oxígeno se difunda a un ritmo suficientemente alto. [75] Debido a que la concentración de oxígeno en el agua aumenta tanto a bajas temperaturas como a altos caudales, los anfibios acuáticos en estas situaciones pueden depender principalmente de la respiración cutánea, como en la rana acuática del Titicaca y la salamandra Hellbender . En el aire, donde el oxígeno está más concentrado, algunas especies pequeñas pueden depender únicamente del intercambio de gases cutáneos, como las salamandras pletododóntidas , que no tienen pulmones ni branquias. Muchas salamandras acuáticas y todos los renacuajos tienen branquias en su etapa larvaria, y algunas (como el ajolote ) las conservan cuando son adultos acuáticos. [75]

Para reproducirse, la mayoría de los anfibios necesitan agua dulce , aunque algunos ponen sus huevos en la tierra y han desarrollado diversos medios para mantenerlos húmedos. Unos pocos (por ejemplo, Fejervarya raja ) pueden habitar en aguas salobres, pero no existen verdaderos anfibios marinos . [82] Hay informes, sin embargo, de poblaciones de anfibios particulares que invadieron inesperadamente aguas marinas. Tal fue el caso de la invasión del híbrido natural Pelophylax esculentus en el Mar Negro , reportada en 2010. [83]
Sin embargo , varios cientos de especies de ranas en radiaciones adaptativas (por ejemplo, Eleutherodactylus , Platymantis del Pacífico , microhílidos australo-papúes y muchas otras ranas tropicales) no necesitan agua para reproducirse en la naturaleza . Se reproducen mediante desarrollo directo, una adaptación ecológica y evolutiva que les ha permitido ser completamente independientes del agua estancada. Casi todas estas ranas viven en bosques tropicales húmedos y de sus huevos eclosionan directamente en versiones en miniatura del adulto, pasando por la etapa de renacuajo dentro del huevo. El éxito reproductivo de muchos anfibios depende no sólo de la cantidad de lluvia, sino también del momento estacional. [84]
En los trópicos, muchos anfibios se reproducen de forma continua o en cualquier época del año. En las regiones templadas, la reproducción es principalmente estacional, generalmente en la primavera, y se desencadena por el aumento de la duración del día, el aumento de las temperaturas o las precipitaciones. Los experimentos han demostrado la importancia de la temperatura, pero el acontecimiento desencadenante, especialmente en las regiones áridas, suele ser una tormenta. En los anuros, los machos suelen llegar a los lugares de reproducción antes que las hembras y el coro vocal que producen puede estimular la ovulación en las hembras y la actividad endocrina de los machos que aún no están reproductivamente activos. [85]
En las cecilias, la fertilización es interna, el macho extruye un órgano intromitente , elfalodeo , e introduciéndolo en la cloaca femenina. Las glándulas müllerianas emparejadas dentro de la cloaca masculina secretan un líquido que se asemeja al producido por las glándulas prostáticas de los mamíferos y que puede transportar y nutrir los espermatozoides. La fertilización probablemente se produce en el oviducto. [86]
La mayoría de las salamandras también practican la fertilización interna . En la mayoría de ellos, el macho deposita un espermatóforo, un pequeño paquete de espermatozoides encima de un cono gelatinoso, sobre el sustrato , ya sea en la tierra o en el agua. La hembra toma el paquete de esperma agarrándolo con los labios de la cloaca y empujándolo hacia el respiradero. Los espermatozoides se trasladan a la espermateca en el techo de la cloaca, donde permanecen hasta la ovulación, que puede ocurrir muchos meses después. Los rituales de cortejo y los métodos de transferencia del espermatóforo varían entre especies. En algunos, el espermatóforo puede colocarse directamente en la cloaca femenina, mientras que en otros, la hembra puede ser guiada al espermatóforo o sujetada con un abrazo llamado amplexus . Ciertas salamandras primitivas de las familias Sirenidae, Hynobiidae y Cryptobranchidae practican la fertilización externa de manera similar a las ranas: la hembra pone los huevos en el agua y el macho libera esperma sobre la masa de huevos. [86]
Con algunas excepciones, las ranas utilizan fertilización externa. El macho agarra fuertemente a la hembra con sus extremidades anteriores ya sea detrás de los brazos o delante de las patas traseras, o en el caso de Epipedobates tricolor , alrededor del cuello. Permanecen en amplexo con sus cloacas colocadas muy juntas mientras la hembra pone los huevos y el macho los cubre con esperma. Las almohadillas nupciales rugosas de las manos del macho ayudan a retener el agarre. A menudo el macho recoge y retiene la masa de huevos, formando con las patas traseras una especie de cesta. Una excepción es la rana venenosa granular ( Oophaga granulifera ), donde el macho y la hembra colocan sus cloacas muy cerca mientras miran en direcciones opuestas y luego liberan óvulos y espermatozoides simultáneamente. La rana de cola ( Ascaphus truei ) presenta fertilización interna. La "cola" sólo la posee el macho y es una extensión de la cloaca y se utiliza para inseminar a la hembra. Esta rana vive en arroyos de corriente rápida y la fertilización interna evita que el esperma sea arrastrado antes de que ocurra la fertilización. [87] Los espermatozoides pueden retenerse en tubos de almacenamiento conectados al oviducto hasta la primavera siguiente. [88]
La mayoría de las ranas pueden clasificarse como reproductoras prolongadas o explosivas. Por lo general, los reproductores prolongados se congregan en un sitio de reproducción y los machos suelen llegar primero, llamar y establecer territorios. Otros machos satélites permanecen tranquilamente cerca, esperando su oportunidad de apoderarse de un territorio. Las hembras llegan esporádicamente, se realiza la selección de pareja y se ponen los huevos. Las hembras se marchan y los territorios pueden cambiar de manos. Aparecen más hembras y, a su debido tiempo, la temporada de reproducción llega a su fin. Los criadores explosivos, por otro lado, se encuentran donde aparecen estanques temporales en regiones secas después de las lluvias. Estas ranas son especies típicamente fosoriales que emergen después de fuertes lluvias y se congregan en un lugar de reproducción. Son atraídos allí por el llamado del primer macho para encontrar un lugar adecuado, tal vez un estanque que se forma en el mismo lugar cada temporada de lluvias. Las ranas reunidas pueden llamar al unísono y se produce una actividad frenética, en la que los machos luchan por aparearse con un número normalmente menor de hembras. [87]

Existe una competencia directa entre los machos para ganarse la atención de las hembras en las salamandras y los tritones, con elaboradas exhibiciones de cortejo para mantener la atención de la hembra el tiempo suficiente para que se interese en elegirlo con quien aparearse . [89] Algunas especies almacenan esperma durante largas temporadas de reproducción, ya que el tiempo adicional puede permitir interacciones con espermatozoides rivales. [90]
La mayoría de los anfibios pasan por una metamorfosis , un proceso de cambio morfológico significativo después del nacimiento. En el desarrollo típico de los anfibios, los huevos se ponen en el agua y las larvas se adaptan a un estilo de vida acuático. Las ranas, los sapos y las salamandras nacen del huevo como larvas con branquias externas. La metamorfosis en los anfibios está regulada por la concentración de tiroxina en la sangre, que estimula la metamorfosis, y la prolactina , que contrarresta el efecto de la tiroxina. Los eventos específicos dependen de valores umbral para diferentes tejidos. [91] Debido a que la mayor parte del desarrollo embrionario se produce fuera del cuerpo parental, está sujeto a muchas adaptaciones debido a circunstancias ambientales específicas. Por esta razón los renacuajos pueden tener crestas córneas en lugar de dientes , extensiones de piel en forma de bigotes o aletas. También utilizan un órgano sensorial de la línea lateral similar al de los peces. Después de la metamorfosis, estos órganos se vuelven redundantes y serán reabsorbidos mediante muerte celular controlada, llamada apoptosis . La variedad de adaptaciones a circunstancias ambientales específicas entre los anfibios es amplia y aún se están realizando muchos descubrimientos. [92]

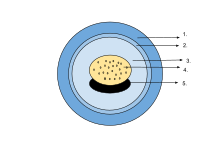
En el huevo, el embrión está suspendido en líquido perivitelino y rodeado por cápsulas gelatinosas semipermeables, mientras que la masa de yema proporciona nutrientes. A medida que las larvas eclosionan, las cápsulas se disuelven mediante enzimas secretadas por una glándula en la punta del hocico. [74] Los huevos de algunas salamandras y ranas contienen algas verdes unicelulares. Estos penetran la envoltura gelatinosa después de que se ponen los huevos y pueden aumentar el suministro de oxígeno al embrión a través de la fotosíntesis. Parecen acelerar el desarrollo de las larvas y reducir la mortalidad. [93] En la rana de bosque ( Rana sylvatica ), se ha descubierto que el interior del cúmulo globular de huevos es hasta 6 °C (11 °F) más cálido que su entorno, lo cual es una ventaja en su fresco hábitat del norte. [94]
Los huevos pueden depositarse solos, en racimos o en largas hebras. Los sitios para poner huevos incluyen agua, barro, madrigueras, escombros y plantas o debajo de troncos o piedras. [95] La rana de invernadero ( Eleutherodactylus planirostris ) pone huevos en pequeños grupos en el suelo donde se desarrollan en aproximadamente dos semanas directamente hasta convertirse en ranas juveniles sin una etapa larvaria intermedia. [96] La rana tungara ( Physalaemus pustulosus ) construye un nido flotante con espuma para proteger sus huevos. Primero se construye una balsa, luego se ponen huevos en el centro y finalmente se cubre una capa de espuma. La espuma tiene propiedades antimicrobianas. No contiene detergentes, sino que se crea batiendo proteínas y lectinas secretadas por la hembra. [97] [98]

Los huevos de los anfibios generalmente se ponen en el agua y eclosionan en larvas de vida libre que completan su desarrollo en el agua y luego se transforman en adultos acuáticos o terrestres. En muchas especies de ranas y en la mayoría de las salamandras sin pulmones (Plethodontidae), tiene lugar un desarrollo directo: las larvas crecen dentro de los huevos y emergen como adultos en miniatura. Muchas cecilias y algunos otros anfibios ponen sus huevos en la tierra y las larvas recién nacidas se retuercen o son transportadas a cuerpos de agua. Algunas cecilias, la salamandra alpina ( Salamandra atra ) y algunos de los sapos vivíparos africanos ( Nectophrynoides spp. ) son vivíparos . Sus larvas se alimentan de secreciones glandulares y se desarrollan dentro del oviducto de la hembra, a menudo durante largos períodos. Otros anfibios, pero no las cecilias, son ovovivíparos . Los huevos se retienen dentro o sobre el cuerpo de los padres, pero las larvas subsisten con las yemas de sus huevos y no reciben alimento del adulto. Las larvas emergen en distintas etapas de su crecimiento, ya sea antes o después de la metamorfosis, según su especie. [99] El género de sapos Nectophrynoides exhibe todos estos patrones de desarrollo entre su docena de miembros. [12] Las larvas de anfibios se conocen como renacuajos . Tienen cuerpos gruesos y redondeados con colas poderosas y musculosas. [77]
A diferencia de otros anfibios, los renacuajos de rana no se parecen a los adultos. [100] Las larvas de vida libre normalmente son completamente acuáticas, pero los renacuajos de algunas especies (como Nannophrys ceylonensis ) son semiterrestres y viven entre rocas húmedas. [101] Los renacuajos tienen esqueletos cartilaginosos, branquias para respirar (branquias externas al principio, branquias internas después), sistemas de líneas laterales y colas grandes que utilizan para nadar. [102] Los renacuajos recién nacidos pronto desarrollan bolsas branquiales que cubren las branquias. Los pulmones se desarrollan temprano y se utilizan como órganos respiratorios accesorios; los renacuajos suben a la superficie del agua para tragar aire. Algunas especies completan su desarrollo dentro del huevo y eclosionan directamente en pequeñas ranas. Estas larvas no tienen branquias, sino áreas especializadas de piel a través de las cuales se realiza la respiración. Si bien los renacuajos no tienen dientes verdaderos, en la mayoría de las especies las mandíbulas tienen filas largas y paralelas de pequeñas estructuras queratinizadas llamadas queradontes rodeadas por un pico córneo. [103] Las patas delanteras se forman debajo del saco branquial y las patas traseras se vuelven visibles unos días después.
El yodo y la T4 (sobreestimulan la espectacular apoptosis [muerte celular programada] de las células de las branquias, cola y aletas de las larvas) también estimulan la evolución del sistema nervioso transformando al renacuajo acuático y vegetariano en la rana terrestre y carnívora con mejores condiciones neurológicas y visuoespaciales. Habilidades , olfativas y cognitivas para la caza. [104] [105]
De hecho, los renacuajos que se desarrollan en estanques y arroyos son típicamente herbívoros . Los renacuajos de estanque tienden a tener cuerpos profundos, aletas caudales grandes y bocas pequeñas; nadan en aguas tranquilas y se alimentan de fragmentos de vegetación sueltos o en crecimiento. Los habitantes de los arroyos en su mayoría tienen bocas más grandes, cuerpos poco profundos y aletas caudales; se adhieren a plantas y piedras y se alimentan de las películas superficiales de algas y bacterias. [106] También se alimentan de diatomeas , filtradas del agua a través de las branquias , y agitan el sedimento en el fondo del estanque, ingiriendo fragmentos comestibles. Tienen un intestino relativamente largo en forma de espiral que les permite digerir esta dieta. [106] Algunas especies son carnívoras en la etapa de renacuajo y comen insectos, renacuajos más pequeños y peces. Las crías de la rana arborícola cubana ( Osteopilus septentrionalis ) ocasionalmente pueden ser caníbales ; los renacuajos más jóvenes atacan a un renacuajo más grande y desarrollado cuando está sufriendo una metamorfosis. [107]
En la metamorfosis, se producen cambios rápidos en el cuerpo a medida que el estilo de vida de la rana cambia por completo. La boca en forma de espiral con crestas dentales córneas se reabsorbe junto con el intestino en espiral. El animal desarrolla una mandíbula grande y sus branquias desaparecen junto con su saco branquial. Los ojos y las piernas crecen rápidamente y se forma la lengua. Hay cambios asociados en las redes neuronales, como el desarrollo de la visión estereoscópica y la pérdida del sistema de líneas laterales. Todo esto puede suceder en aproximadamente un día. Unos días después, la cola se reabsorbe, debido a la mayor concentración de tiroxina necesaria para que esto se produzca. [106]



Al nacer, una larva de salamandra típica tiene ojos sin párpados, dientes en la mandíbula superior e inferior, tres pares de branquias externas plumosas y una cola larga con aletas dorsal y ventral . Las extremidades anteriores pueden estar parcialmente desarrolladas y las traseras son rudimentarias en las especies que viven en estanques, pero pueden estar bastante más desarrolladas en las especies que se reproducen en agua en movimiento. Las larvas de estanque suelen tener un par de equilibradores, estructuras en forma de varillas a cada lado de la cabeza que pueden evitar que las branquias se obstruyan con sedimentos. [108] [109] Ambos pueden reproducirse. [110] Algunos tienen larvas que nunca se desarrollan completamente hasta la forma adulta, una condición conocida como neotenia . [111] La neotenia ocurre cuando la tasa de crecimiento del animal es muy baja y generalmente está relacionada con condiciones adversas como las bajas temperaturas del agua que pueden cambiar la respuesta de los tejidos a la hormona tiroxina. [112] así como la falta de alimentos. Hay quince especies de salamandras neoténicas obligadas, incluidas especies de Necturus , Proteus y Amphiuma , y muchos ejemplos de facultativas, como la salamandra noroccidental ( Ambystoma gracile ) y la salamandra tigre ( A. tigrinum ) que adoptan esta estrategia en condiciones ambientales apropiadas. circunstancias. [111]
Las salamandras sin pulmones de la familia Plethodontidae son terrestres y ponen una pequeña cantidad de huevos no pigmentados en un grupo entre la hojarasca húmeda. Cada huevo tiene un gran saco vitelino y la larva se alimenta de este mientras se desarrolla dentro del huevo, emergiendo completamente formado como una salamandra juvenil. La salamandra hembra a menudo empolla los huevos. En el género Ensatinas , se ha observado que la hembra se enrosca alrededor de ellos y presiona el área de su garganta contra ellos, masajeándolos efectivamente con una secreción mucosa. [113]
En los tritones y las salamandras, la metamorfosis es menos dramática que en las ranas. Esto se debe a que las larvas ya son carnívoras y continúan alimentándose como depredadoras cuando son adultas, por lo que se necesitan pocos cambios en sus sistemas digestivos. Sus pulmones son funcionales temprano, pero las larvas no los utilizan tanto como los renacuajos. Sus branquias nunca están cubiertas por sacos branquiales y se reabsorben justo antes de que los animales abandonen el agua. Otros cambios incluyen la reducción del tamaño o pérdida de las aletas caudales, el cierre de las hendiduras branquiales, el engrosamiento de la piel, el desarrollo de los párpados y ciertos cambios en la dentición y la estructura de la lengua. Las salamandras son más vulnerables durante la metamorfosis, ya que la velocidad de natación se reduce y las colas en transformación son un obstáculo en la tierra. [114] Las salamandras adultas suelen tener una fase acuática en primavera y verano, y una fase terrestre en invierno. Para la adaptación a la fase acuosa, la hormona necesaria es la prolactina y para la adaptación a la fase terrestre, la tiroxina. Las branquias externas no regresan en fases acuáticas posteriores porque estas se absorben por completo al salir del agua por primera vez. [108]

La mayoría de las cecilias terrestres que ponen huevos lo hacen en madrigueras o lugares húmedos en la tierra cerca de cuerpos de agua. Se ha estudiado mucho el desarrollo de las crías de Ichthyophis glutinosus , una especie originaria de Sri Lanka. Las larvas parecidas a anguilas salen de los huevos y se dirigen al agua. Tienen tres pares de branquias externas plumosas de color rojo, una cabeza roma con dos ojos rudimentarios, un sistema de líneas laterales y una cola corta con aletas. Nadan ondulando su cuerpo de lado a lado. Son mayoritariamente activos durante la noche, pronto pierden las branquias y realizan incursiones en tierra. La metamorfosis es gradual. A la edad de unos diez meses han desarrollado una cabeza puntiaguda con tentáculos sensoriales cerca de la boca y han perdido los ojos, el sistema de líneas laterales y la cola. La piel se espesa, se desarrollan escamas incrustadas y el cuerpo se divide en segmentos. Para entonces, la cecilia ha construido una madriguera y vive en la tierra. [115]

En la mayoría de las especies de cecilias, las crías se producen por viviparidad. De estos es típico Typhlonectes compressicauda , una especie procedente de América del Sur. En el oviducto pueden desarrollarse hasta nueve larvas a la vez. Son alargados y tienen branquias en forma de saco, ojos pequeños y dientes raspadores especializados. Al principio, se alimentan de las yemas de los huevos, pero a medida que esta fuente de alimento disminuye, comienzan a raspar las células epiteliales ciliadas que recubren el oviducto. Esto estimula la secreción de líquidos ricos en lípidos y mucoproteínas de los que se alimentan junto con los raspados de la pared del oviducto. Pueden multiplicar por seis su longitud y medir dos quintas partes de la longitud de su madre antes de nacer. En ese momento ya habían sufrido una metamorfosis, perdieron los ojos y las branquias, desarrollaron una piel y tentáculos bucales más gruesos y reabsorbieron los dientes. Una dentadura permanente crece poco después del nacimiento. [116] [117]
La cecilia anillada ( Siphonops annulatus ) ha desarrollado una adaptación única con fines de reproducción. La progenie se alimenta de una capa de piel especialmente desarrollada por el adulto en un fenómeno conocido como dermatofagia materna. Las crías se alimentan en lotes durante unos siete minutos a intervalos de aproximadamente tres días, lo que le da a la piel la oportunidad de regenerarse. Mientras tanto, se ha observado que ingieren el líquido exudado de la cloaca materna. [118]

El cuidado de las crías entre los anfibios ha sido poco estudiado pero, en general, cuanto mayor es el número de huevos en un lote, menos probable es que se lleve a cabo algún grado de cuidado parental. Sin embargo, se estima que hasta en un 20% de las especies de anfibios uno o ambos adultos desempeñan algún papel en el cuidado de las crías. [119] Aquellas especies que se reproducen en cuerpos de agua más pequeños u otros hábitats especializados tienden a tener patrones complejos de comportamiento en el cuidado de sus crías. [120]
Muchas salamandras del bosque ponen huevos debajo de troncos muertos o piedras en la tierra. La salamandra negra de montaña ( Desmognathus welteri ) hace esto: la madre incuba los huevos y los protege de la depredación mientras los embriones se alimentan de las yemas de sus huevos. Cuando están completamente desarrollados, salen de las cápsulas de huevos y se dispersan como salamandras juveniles. [121] El macho Hellbender, una salamandra primitiva, excava un nido submarino y anima a las hembras a tumbarse allí. Luego, el macho protege el sitio durante dos o tres meses antes de que los huevos eclosionen, utilizando ondulaciones corporales para abanicar los huevos y aumentar su suministro de oxígeno. [57]

El macho Colostethus subpunctatus , una pequeña rana, protege el racimo de huevos que se esconde debajo de una piedra o un tronco. Cuando los huevos eclosionan, el macho transporta los renacuajos sobre su espalda, adheridos allí por una secreción mucosa, a una piscina temporal donde se sumerge en el agua y los renacuajos caen. [122] El sapo partero macho ( Alytes obstetricans ) enrolla hilos de huevos alrededor de sus muslos y transporta los huevos durante hasta ocho semanas. Los mantiene húmedos y cuando están listos para nacer, visita un estanque o zanja y suelta los renacuajos. [123] La hembra de rana incubadora gástrica ( Rheobatrachus spp. ) criaba larvas en su estómago después de tragar los huevos o las crías; sin embargo, esta etapa nunca se observó antes de que la especie se extinguiera. Los renacuajos secretan una hormona que inhibe la digestión en la madre mientras se desarrollan consumiendo su gran suministro de yema. [124] La rana de bolsa ( Assa darlingtoni ) pone huevos en el suelo. Cuando nacen, el macho lleva a los renacuajos en bolsas de cría en sus patas traseras. [125] El sapo acuático de Surinam ( Pipa pipa ) cría a sus crías en los poros de su espalda, donde permanecen hasta la metamorfosis. [126] La rana venenosa granular ( Oophaga granulifera ) es típica de varias ranas arbóreas de la familia de las ranas dardo venenosas Dendrobatidae . Sus huevos se ponen en el suelo del bosque y cuando eclosionan, los renacuajos son transportados uno a uno en la espalda de un adulto hasta una grieta adecuada llena de agua, como la axila de una hoja o la roseta de una bromelia . La hembra visita periódicamente los lugares de cría y deposita huevos no fertilizados en el agua que son consumidos por los renacuajos. [127]
Los anfibios se destacan entre los vertebrados por su diversidad de cromosomas y genomas. Se han determinado los cariotipos ( cromosomas ) de al menos 1.193 (14,5%) de las ≈8.200 especies ( diploides ) conocidas, incluidos 963 anuros , 209 salamandras y 21 cecilias . Generalmente, los cariotipos de los anfibios diploides se caracterizan por tener entre 20 y 26 cromosomas de dos brazos. Los anfibios también tienen genomas muy grandes en comparación con otros taxones de vertebrados y la correspondiente variación en el tamaño del genoma ( valor C : picogramos de ADN en núcleos haploides ). Los tamaños del genoma varían de 0,95 a 11,5 pg en las ranas, de 13,89 a 120,56 pg en las salamandras y de 2,94 a 11,78 pg en las cecilias. [128]
Los grandes tamaños del genoma han impedido la secuenciación del genoma completo de los anfibios, aunque recientemente se han publicado varios genomas. El borrador del genoma de 1,7 GB de Xenopus tropicalis fue el primero en ser reportado para anfibios en 2010. [128] En comparación con algunas salamandras, el genoma de esta rana es diminuto. Por ejemplo, el genoma del ajolote mexicano resultó tener 32 Gb, que es más de 10 veces más grande que el genoma humano (3 GB). [129]

Con algunas excepciones, los anfibios adultos son depredadores y se alimentan de prácticamente cualquier cosa que se mueva y que puedan tragar. La dieta se compone principalmente de presas pequeñas que no se mueven demasiado rápido, como escarabajos, orugas, lombrices y arañas. Las sirenas ( Siren spp. ) suelen ingerir material vegetal acuático junto con los invertebrados de los que se alimentan [130] y una rana arborícola brasileña ( Xenohyla truncata ) incluye una gran cantidad de fruta en su dieta. [131] El sapo excavador mexicano ( Rhinophrynus dorsalis ) tiene una lengua especialmente adaptada para atrapar hormigas y termitas. Lo proyecta con la punta hacia adelante, mientras que otras ranas sacan primero la parte trasera y sus lenguas están articuladas hacia el frente. [132]
La comida se selecciona principalmente con la vista, incluso en condiciones de poca luz. El movimiento de la presa desencadena una respuesta de alimentación. Se han capturado ranas en anzuelos cebados con franela roja y se han encontrado ranas verdes ( Rana clamitans ) con el estómago lleno de semillas de olmo que habían visto flotando. [133] Los sapos, salamandras y cecilias también utilizan el olfato para detectar presas. Esta respuesta es principalmente secundaria porque se ha observado que las salamandras permanecen estacionarias cerca de presas olorosas pero solo se alimentan si éstas se mueven. Los anfibios que viven en cavernas normalmente cazan por el olfato. Algunas salamandras parecen haber aprendido a reconocer presas inmóviles cuando éstas no huelen, incluso en completa oscuridad. [134]
Los anfibios generalmente tragan los alimentos enteros, pero primero pueden masticarlos ligeramente para dominarlos. [46] Por lo general, tienen pequeños dientes pedicelados con bisagras , una característica exclusiva de los anfibios. La base y corona de estos están compuestas por dentina separada por una capa no calcificada y se reemplazan a intervalos. Las salamandras, las cecilias y algunas ranas tienen una o dos filas de dientes en ambas mandíbulas, pero algunas ranas ( Rana spp. ) carecen de dientes en la mandíbula inferior y los sapos ( Bufo spp. ) no tienen dientes. En muchos anfibios también hay dientes vomerinos adheridos a un hueso facial en el paladar. [135]

La salamandra tigre ( Ambystoma tigrinum ) es típica de las ranas y salamandras que se esconden bajo techo listas para tender una emboscada a los invertebrados desprevenidos. Otros anfibios, como el Bufo spp. Los sapos buscan activamente sus presas, mientras que la rana cornuda argentina ( Ceratophrys ornata ) atrae a sus presas curiosas levantando sus patas traseras sobre su espalda y haciendo vibrar sus dedos amarillos. [136] Entre las ranas de hojarasca en Panamá, las ranas que cazan activamente a sus presas tienen bocas estrechas y son delgadas, a menudo de colores brillantes y tóxicas, mientras que las emboscadas tienen bocas anchas y son amplias y están bien camufladas. [137] Las cecilias no mueven la lengua, sino que atrapan a sus presas agarrándolas con sus dientes ligeramente apuntados hacia atrás. Las luchas de la presa y otros movimientos de la mandíbula la empujan hacia adentro y la cecilia generalmente se retira a su madriguera. La presa sometida es devorada entera. [138]
Cuando recién nacen, las larvas de rana se alimentan de la yema del huevo. Cuando se agota, algunos pasan a alimentarse de bacterias, costras de algas, detritos y raspaduras de plantas sumergidas. El agua ingresa a través de la boca, que generalmente está en la parte inferior de la cabeza, y pasa a través de trampas de alimentos branquiales entre la boca y las branquias, donde las partículas finas quedan atrapadas en el moco y se filtran. Otros tienen piezas bucales especializadas que consisten en un pico córneo bordeado por varias filas de dientes labiales. Raspan y muerden alimentos de muchos tipos, además de remover el sedimento del fondo, filtrando partículas más grandes con las papilas alrededor de la boca. Algunos, como los sapos patas de espada, tienen fuertes mandíbulas para morder y son carnívoros o incluso caníbales. [139]
.jpg/440px-Dendropsophus_microcephalus_-_calling_male_(Cope,_1886).jpg)
Las llamadas de las cecilias y salamandras se limitan a suaves chirridos, gruñidos o silbidos ocasionales y no han sido muy estudiadas. Un chasquido producido a veces por las cecilias puede ser un medio de orientación, como en los murciélagos, o una forma de comunicación. La mayoría de las salamandras se consideran sordas, pero la salamandra gigante de California ( Dicamptodon ensatus ) tiene cuerdas vocales y puede producir un sonido de traqueteo o ladrido. Algunas especies de salamandra emiten un chillido o aullido silencioso si son atacadas. [140]

Las ranas son mucho más vocales, especialmente durante la temporada de reproducción, cuando usan sus voces para atraer parejas. La presencia de una especie particular en un área puede discernirse más fácilmente por su llamado característico que por una visión fugaz del animal en sí. En la mayoría de las especies, el sonido se produce expulsando aire de los pulmones a través de las cuerdas vocales hacia uno o varios sacos de aire en la garganta o en la comisura de la boca. Éste puede dilatarse como un globo y actúa como resonador, ayudando a transferir el sonido a la atmósfera o al agua en los momentos en que el animal está sumergido. [140] La vocalización principal es la fuerte llamada publicitaria del macho que busca alentar a la hembra a acercarse y disuadir a otros machos de invadir su territorio. Esta llamada se modifica a una llamada de cortejo más tranquila cuando se acerca una hembra o a una versión más agresiva si se acerca un intruso macho. Llamar conlleva el riesgo de atraer depredadores e implica un gasto de mucha energía. [141] Otras llamadas incluyen las realizadas por una mujer en respuesta a la llamada publicitaria y una llamada de liberación dada por un hombre o una mujer durante intentos no deseados de amplexo. Cuando una rana es atacada, se emite una llamada de angustia o miedo, que a menudo se asemeja a un grito. [142] La rana arbórea cubana ( Osteopilus septentrionalis ) , generalmente nocturna, produce una llamada de lluvia cuando llueve durante las horas del día. [143]
Se sabe poco sobre el comportamiento territorial de las cecilias, pero algunas ranas y salamandras defienden sus áreas de distribución. Suelen ser lugares de alimentación, reproducción o refugio. Los machos normalmente exhiben este comportamiento, aunque en algunas especies también participan hembras e incluso juveniles. Aunque en muchas especies de ranas las hembras son más grandes que los machos, este no es el caso en la mayoría de las especies donde los machos participan activamente en la defensa territorial. Algunos de ellos tienen adaptaciones específicas, como dientes agrandados para morder o espinas en el pecho, los brazos o los pulgares. [144]

En las salamandras, la defensa de un territorio implica adoptar una postura agresiva y si es necesario atacar al intruso. Esto puede implicar morder, perseguir y, a veces, morder, lo que en ocasiones provoca la pérdida de una cola. El comportamiento de las salamandras de lomo rojo ( Plethodon cinereus ) ha sido muy estudiado. El 91% de los individuos marcados que luego fueron recapturados se encontraban a menos de un metro (yarda) de su refugio diurno original debajo de un tronco o una roca. [145] Una proporción similar, cuando se movió experimentalmente una distancia de 30 metros (98 pies), encontró el camino de regreso a su base de operaciones. [145] Las salamandras dejaban marcas de olor alrededor de sus territorios que tenían un tamaño promedio de 0,16 a 0,33 metros cuadrados (1,7 a 3,6 pies cuadrados) y, a veces, estaban habitadas por una pareja de machos y hembras. [146] Estos disuadieron la intrusión de otros y delinearon los límites entre áreas vecinas. Gran parte de su comportamiento parecía estereotipado y no implicaba ningún contacto real entre individuos. Una postura agresiva implicaba levantar el cuerpo del suelo y mirar al oponente, que a menudo se giraba sumisamente. Si el intruso persistía, normalmente se lanzaba una estocada mordaz en la región de la cola o en los surcos nasolabiales. El daño en cualquiera de estas zonas puede reducir la aptitud del rival, ya sea por la necesidad de regenerar tejido o porque perjudica su capacidad para detectar comida. [145]
En las ranas, el comportamiento territorial de los machos se observa a menudo en los lugares de reproducción; La llamada es a la vez un anuncio de propiedad de parte de este recurso y una llamada publicitaria a posibles parejas. En general, una voz más grave representa un individuo más pesado y poderoso, y esto puede ser suficiente para evitar la intrusión de machos más pequeños. Se utiliza mucha energía en la vocalización y esto pasa factura al poseedor del territorio, que puede ser desplazado por un rival más en forma si se cansa. Existe una tendencia entre los machos a tolerar a los poseedores de territorios vecinos mientras atacan vigorosamente a intrusos desconocidos. Los poseedores de territorios tienen la "ventaja de jugar en casa" y normalmente salen mejor librados en un encuentro entre dos ranas de tamaño similar. Si las amenazas son insuficientes, pueden producirse peleas pecho contra pecho. Los métodos de lucha incluyen empujar y empujar, desinflar el saco vocal del oponente, agarrarlo por la cabeza, saltar sobre su espalda, morderlo, perseguirlo, salpicarlo y agacharlo bajo el agua. [147]

Los anfibios tienen cuerpos blandos con piel fina y carecen de garras, armadura defensiva o espinas. Sin embargo, han desarrollado varios mecanismos de defensa para mantenerse con vida. La primera línea de defensa de las salamandras y las ranas es la secreción mucosa que producen. Esto mantiene su piel húmeda y los hace resbaladizos y difíciles de agarrar. La secreción suele ser pegajosa y desagradable o tóxica. [148] Se han observado serpientes bostezando y boquiabiertas cuando intentan tragar ranas africanas con garras ( Xenopus laevis ), lo que les da a las ranas la oportunidad de escapar. [148] [149] Las cecilias han sido poco estudiadas a este respecto, pero la cecilia de Cayena ( Typhlonectes compressicauda ) produce moco tóxico que ha matado a peces depredadores en un experimento de alimentación en Brasil. [150] En algunas salamandras, la piel es venenosa. El tritón de piel rugosa ( Taricha granulosa ) de Norteamérica y otros miembros de su género contienen la neurotoxina tetrodotoxina (TTX), la sustancia no proteica más tóxica conocida y casi idéntica a la producida por el pez globo . Manipular los tritones no causa daño, pero la ingestión incluso de las cantidades más pequeñas de piel es mortal. En las pruebas de alimentación, se encontró que todos los peces, ranas, reptiles, aves y mamíferos eran susceptibles. [151] [152] Los únicos depredadores con cierta tolerancia al veneno son ciertas poblaciones de culebra común ( Thamnophis sirtalis ). En lugares donde coexisten serpientes y salamandras, las serpientes han desarrollado inmunidad a través de cambios genéticos y se alimentan de los anfibios con impunidad. [153] La coevolución se produce cuando el tritón aumenta sus capacidades tóxicas al mismo ritmo que la serpiente desarrolla aún más su inmunidad. [152] Algunas ranas y sapos son tóxicos, y las principales glándulas venenosas se encuentran a los lados del cuello y debajo de las verrugas en la espalda. Estas regiones se presentan al animal atacante y sus secreciones pueden tener mal sabor o provocar diversos síntomas físicos o neurológicos. En total, se han aislado más de 200 toxinas del limitado número de especies de anfibios que se han investigado. [154]


Las especies venenosas suelen utilizar colores brillantes para advertir a los depredadores potenciales de su toxicidad. Estos colores de advertencia suelen ser el rojo o el amarillo combinados con el negro, siendo la salamandra ( Salamandra salamandra ) un ejemplo. Una vez que un depredador ha probado uno de estos, es probable que recuerde la coloración la próxima vez que se encuentre con un animal similar. En algunas especies, como el sapo vientre de fuego ( Bombina spp. ), la coloración de advertencia es en el vientre y estos animales adoptan una postura defensiva al ser atacados, exhibiendo sus colores brillantes ante el depredador. La rana Allobates zaparo no es venenosa, pero imita la apariencia de otras especies tóxicas de su localidad, estrategia que puede engañar a los depredadores. [156]
Muchos anfibios son nocturnos y se esconden durante el día, evitando así a los depredadores diurnos que cazan con la vista. Otros anfibios utilizan camuflaje para evitar ser detectados. Tienen varios colores, como marrones moteados, grises y olivas, para mezclarse con el fondo. Algunas salamandras adoptan posturas defensivas cuando se enfrentan a un depredador potencial como la musaraña norteamericana de cola corta ( Blarina brevicauda ). Sus cuerpos se retuercen y levantan y azotan sus colas, lo que dificulta que el depredador evite el contacto con sus glándulas granulares productoras de veneno. [157] Algunas salamandras autotomizarán sus colas cuando sean atacadas, sacrificando esta parte de su anatomía para permitirles escapar. La cola puede tener una constricción en su base para permitir que se desprenda fácilmente. La cola se regenera más tarde, pero el coste energético que supone para el animal reemplazarla es significativo. [69] Algunas ranas y sapos se inflan para parecer grandes y feroces, y algunos sapos patas de espada ( Pelobates spp ) gritan y saltan hacia el atacante. [46] Las salamandras gigantes del género Andrias , así como las ranas Ceratophrine y Pyxicephalus , poseen dientes afilados y son capaces de extraer sangre con una mordida defensiva. La salamandra de vientre negro ( Desmognathus quadramaculatus ) puede morder en la cabeza a una culebra común ( Thamnophis sirtalis ) dos o tres veces su tamaño y, a menudo, logra escapar. [158]
En los anfibios, hay evidencia de habituación , aprendizaje asociativo a través del aprendizaje tanto clásico como instrumental , y habilidades de discriminación. [159] Se considera ampliamente que los anfibios son sensibles , capaces de sentir emociones como ansiedad y miedo . [160]
En un experimento, cuando se les ofrecieron moscas de la fruta vivas ( Drosophila virilis ), las salamandras eligieron la más grande entre 1 contra 2 y 2 contra 3. Las ranas pueden distinguir entre números bajos (1 contra 2, 2 contra 3, pero no 3 contra 4) y grandes. números (3 vs 6, 4 vs 8, pero no 4 vs 6) de presas. Esto es independiente de otras características, es decir, área de superficie, volumen, peso y movimiento, aunque la discriminación entre grandes cantidades puede basarse en el área de superficie. [161]

Desde finales de la década de 1980 se han observado disminuciones dramáticas en las poblaciones de anfibios, incluyendo caídas demográficas y extinciones localizadas masivas , en lugares de todo el mundo, y por lo tanto se percibe que la disminución de los anfibios es una de las amenazas más críticas a la biodiversidad global . [162] En 2004, la Unión Internacional para la Conservación de la Naturaleza (UICN) informó que en la actualidad las tasas de extinción de aves, [163] mamíferos y anfibios eran como mínimo 48 veces mayores que las tasas de extinción natural, posiblemente 1.024 veces mayores. En 2006, se creía que había 4.035 especies de anfibios que dependían del agua en algún momento de su ciclo de vida. De ellas, 1.356 (33,6%) se consideraron amenazadas y es probable que esta cifra sea una subestimación porque excluye 1.427 especies para las cuales no había datos suficientes para evaluar su estado. [164] Se cree que están involucradas varias causas, incluida la destrucción y modificación del hábitat , la sobreexplotación , la contaminación, las especies introducidas , el calentamiento global , los contaminantes que alteran el sistema endocrino , la destrucción de la capa de ozono ( se ha demostrado que la radiación ultravioleta es especialmente dañina). a la piel, los ojos y los huevos de los anfibios) y enfermedades como la quitridiomicosis . Sin embargo, muchas de las causas de la disminución de los anfibios aún no se comprenden bien y son un tema de debate continuo. [165]

Cualquier disminución en el número de anfibios afectará los patrones de depredación. La pérdida de especies carnívoras cerca de la cima de la cadena alimentaria alterará el delicado equilibrio del ecosistema y puede provocar un aumento espectacular de especies oportunistas.
Los depredadores que se alimentan de anfibios se ven afectados por su declive. La culebra terrestre occidental ( Thamnophis elegans ) de California es en gran medida acuática y depende en gran medida de dos especies de ranas cuyo número está disminuyendo, el sapo de Yosemite ( Bufo canorus ) y la rana montañesa de patas amarillas ( Rana muscosa ), lo que pone a la serpiente en peligro de extinción. futuro en riesgo. Si la serpiente escaseara, esto afectaría a las aves rapaces y otros depredadores que se alimentan de ella. [166] Mientras tanto, en los estanques y lagos, menos ranas significa menos renacuajos. Estos normalmente juegan un papel importante en el control del crecimiento de algas y también se alimentan de los detritos que se acumulan como sedimento en el fondo. Una reducción en el número de renacuajos puede provocar un crecimiento excesivo de algas, lo que resulta en el agotamiento del oxígeno en el agua cuando las algas luego mueren y se descomponen. Entonces los invertebrados acuáticos y los peces podrían morir y las consecuencias ecológicas serían impredecibles. [167]
La disminución de las poblaciones de anfibios y reptiles ha llevado a una mayor conciencia sobre los efectos de los pesticidas en los reptiles y anfibios. [168] En el pasado, el argumento de que los anfibios o reptiles eran más susceptibles a cualquier contaminación química que cualquier vertebrado acuático terrestre no fue respaldado por investigaciones hasta hace poco. [168] Los anfibios y reptiles tienen ciclos de vida complejos, viven en diferentes zonas climáticas y ecológicas y son más vulnerables a la exposición química. Ciertos pesticidas, como los organofosforados, los neonicotinoides y los carbamatos, reaccionan mediante la inhibición de la colinesterasa. La colinesterasa es una enzima que provoca la hidrólisis de la acetilcolina, un neurotransmisor excitador que abunda en el sistema nervioso. Los inhibidores de la AChE son reversibles o irreversibles y los carbamatos son más seguros que los insecticidas organofosforados, que tienen más probabilidades de causar intoxicación colinérgica. La exposición de reptiles a un pesticida inhibidor de la AChE puede provocar una alteración de la función neuronal en los reptiles. La acumulación de estos efectos inhibidores sobre el rendimiento motor, como el consumo de alimentos y otras actividades.
El Grupo de Especialistas en Anfibios de la UICN está encabezando los esfuerzos para implementar una estrategia global integral para la conservación de los anfibios. [169] Amphibian Ark es una organización que se formó para implementar las recomendaciones de conservación ex situ de este plan, y ha estado trabajando con zoológicos y acuarios de todo el mundo, animándolos a crear colonias seguras de anfibios amenazados. [169] Uno de esos proyectos es el Proyecto de Conservación y Rescate de Anfibios de Panamá, que se basó en los esfuerzos de conservación existentes en Panamá para crear una respuesta a nivel nacional a la amenaza de la quitridiomicosis. [170]
Otra medida sería detener la explotación de ranas para consumo humano. En Oriente Medio, el creciente apetito por comer ancas de rana y su consiguiente recolección como alimento ya estaba relacionado con un aumento de mosquitos y, por tanto, tiene consecuencias directas para la salud humana. [171]
... ha habido un consenso creciente de que los lisanfibios son un conjunto monofilético derivado de Temnospondyli, y más específicamente de los anfibámidos dissorofoides.
Color de piel de anfibio.
{{cite journal}}: Mantenimiento CS1: DOI inactivo a partir de enero de 2024 ( enlace ){{cite book}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace )