
La descarboxilación es una reacción química que elimina un grupo carboxilo y libera dióxido de carbono (CO 2 ). Por lo general, la descarboxilación se refiere a una reacción de ácidos carboxílicos , eliminando un átomo de carbono de una cadena de carbono. El proceso inverso, que es el primer paso químico de la fotosíntesis , se llama carboxilación , la adición de CO 2 a un compuesto. Las enzimas que catalizan las descarboxilaciones se denominan descarboxilasas o, el término más formal, carboxiliasas ( número CE 4.1.1).
El término "descarboxilación" generalmente significa sustitución de un grupo carboxilo ( -C(O)OH ) por un átomo de hidrógeno :
La descarboxilación es una de las reacciones orgánicas más antiguas que se conocen. Es uno de los procesos que se supone acompaña a la pirólisis y la destilación destructiva .
En general, la descarboxilación depende de la estabilidad del carbanión sintón R.−
, [1] [2] aunque el anión puede no ser un verdadero intermediario químico . [3] [4] Normalmente, los ácidos carboxílicos se descarboxilan lentamente, pero los ácidos carboxílicos con un grupo aceptor de electrones α (por ejemplo, β- cetoácidos , β-nitrilos, α- nitroácidos o ácidos arilcarboxílicos ) se descarboxilan fácilmente. La descarboxilación del clorodifluoroacetato de sodio genera difluorocarbeno :
Las descarboxilaciones son importantes en la síntesis de ésteres malónicos y acetoacéticos . La condensación de Knoevenagel y los cetoácidos permiten que sirvan como grupo protector estabilizante para los enoles de ácidos carboxílicos . [6] [ página necesaria ] [4]
Para los ácidos libres, las condiciones que desprotonan el grupo carboxilo (posiblemente protonando el grupo aceptor de electrones para formar un tautómero zwitteriónico ) aceleran la descarboxilación. [7] Una base fuerte es clave para la cetonización , en la que un par de ácidos carboxílicos se combinan para formar el grupo funcional del mismo nombre : [8] [3]
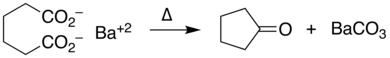
Las sales de metales de transición , especialmente los compuestos de cobre , [9] facilitan la descarboxilación a través de intermediarios complejos de carboxilato . Los metales que catalizan reacciones de acoplamiento cruzado tratan así a los carboxilatos de arilo como un sintón de anión arilo; esta estrategia sintética es la reacción de acoplamiento cruzado descarboxilativa . [10]
Al calentar en ciclohexanona , los aminoácidos se descarboxilan. En la reacción de Hammick relacionada , la descarboxilación no catalizada de un ácido picolínico da un carbeno estable que ataca a un electrófilo carbonilo .
Las descarboxilaciones oxidativas son generalmente reacciones radicalarias. Éstas incluyen la electrólisis de Kolbe y las reacciones de Hunsdiecker - Kochi . La descarboxilación de Barton es una descarboxilación reductiva radical inusual.
Como se describió anteriormente, la mayoría de las descarboxilaciones comienzan con un ácido carboxílico o su sal de metal alcalino, pero la descarboxilación de Krapcho comienza con ésteres metílicos . En este caso, la reacción comienza con la escisión del éster mediada por haluro , formando el carboxilato.
Las descarboxilaciones son omnipresentes en biología. A menudo se clasifican según los cofactores que catalizan las transformaciones. [11] Los procesos acoplados a biotina efectúan la descarboxilación de malonil-CoA a acetil-CoA . La tiamina (T:) es el componente activo para la descarboxilación de los alfa-cetoácidos , incluido el piruvato:
El fosfato de piridoxal promueve la descarboxilación de aminoácidos. Las descarboxilasas dependientes de flavina participan en las transformaciones de la cisteína. Las hidroxilasas a base de hierro operan mediante activación reductora de O 2 utilizando la descarboxilación del alfa-cetoglutarato como donante de electrones. La descarboxilación se puede representar como tal:
Las descarboxilaciones oxidativas biosintéticas comunes de aminoácidos a aminas son:
Otras reacciones de descarboxilación del ciclo del ácido cítrico incluyen:

La síntesis de ácidos grasos de cadena lineal se produce mediante reacciones recurrentes que implican la descarboxilación de malonil-CoA . [12]

Al calentarse, el ácido Δ9-tetrahidrocannabinólico se descarboxila para dar el compuesto psicoactivo Δ9- tetrahidrocannabinol . [13] Cuando el cannabis se calienta al vacío, la descarboxilación del ácido tetrahidrocannabinólico (THCA) parece seguir una cinética de primer orden . La fracción logarítmica de THCA presente disminuye constantemente con el tiempo y la tasa de disminución varía según la temperatura. En incrementos de 10 grados de 100 a 140 °C, la mitad del THCA se consume en 30, 11, 6, 3 y 2 minutos; por lo tanto, la constante de velocidad sigue la ley de Arrhenius , oscilando entre 10 −8 y 10 −5 en una relación lineal log-log con temperatura inversa. Sin embargo, el modelado de la descarboxilación del ácido salicílico con una molécula de agua había sugerido una barrera de activación de 150 kJ/mol para una sola molécula en disolvente, demasiado alta para la velocidad observada. Por lo tanto, se concluyó que esta reacción, realizada en fase sólida en material vegetal con una alta fracción de ácidos carboxílicos, sigue una cinética de pseudo primer orden en la que un ácido carboxílico cercano precipita sin afectar la constante de velocidad observada. Son posibles dos estados de transición correspondientes a rutas cetoenólicas directa e indirecta, con energías de 93 y 104 kJ/mol. Ambos intermediarios implican la protonación del carbono alfa , rompiendo uno de los dobles enlaces del anillo aromático y permitiendo que el grupo beta-ceto (que toma la forma de un enol en THCA y THC) participe en la descarboxilación. [14]
En bebidas almacenadas durante largos períodos, se pueden formar cantidades muy pequeñas de benceno a partir del ácido benzoico por descarboxilación catalizada por la presencia de ácido ascórbico . [15]
Se ha informado que la adición de cantidades catalíticas de ciclohexenona cataliza la descarboxilación de aminoácidos . [16] Sin embargo, el uso de tales catalizadores también puede producir una cantidad de subproductos no deseados.