El azufre (también escrito sulphur en inglés británico ) es un elemento químico ; tiene símbolo S y número atómico 16. Es abundante , multivalente y no metálico . En condiciones normales , los átomos de azufre forman moléculas octatómicas cíclicas con la fórmula química S8 . El azufre elemental es un sólido cristalino de color amarillo brillante a temperatura ambiente .
El azufre es el décimo elemento más abundante por masa en el universo y el quinto más común en la Tierra. Aunque a veces se encuentra en forma pura y nativa , el azufre en la Tierra generalmente se presenta como minerales de sulfuro y sulfato . Al ser abundante en forma nativa, el azufre era conocido en la antigüedad, siendo mencionado por sus usos en la antigua India , la antigua Grecia , China y el antiguo Egipto . Históricamente y en la literatura, el azufre también se llama azufre , [7] que significa "piedra ardiente". [8] Hoy en día, casi todo el azufre elemental se produce como un subproducto de la eliminación de contaminantes que contienen azufre del gas natural y el petróleo . [9] [10] El mayor uso comercial del elemento es la producción de ácido sulfúrico para fertilizantes de sulfato y fosfato , y otros procesos químicos. El azufre se usa en fósforos , insecticidas y fungicidas . Muchos compuestos de azufre son olorosos, y los olores de gas natural olorizado, olor a zorrillo , mal aliento , pomelo y ajo se deben a compuestos organosulfurados . El sulfuro de hidrógeno da el olor característico a los huevos podridos y a otros procesos biológicos.
El azufre es un elemento esencial para toda la vida, casi siempre en forma de compuestos organosulfurados o sulfuros metálicos. Los aminoácidos (dos proteinogénicos : cisteína y metionina , y muchos otros no codificados : cistina , taurina , etc.) y dos vitaminas ( biotina y tiamina ) son compuestos organosulfurados cruciales para la vida. Muchos cofactores también contienen azufre, incluido el glutatión y las proteínas de hierro-azufre . Los disulfuros , enlaces S–S, confieren resistencia mecánica e insolubilidad a la proteína (entre otras) queratina , que se encuentra en la piel exterior, el pelo y las plumas. El azufre es uno de los elementos químicos básicos necesarios para el funcionamiento bioquímico y es un macronutriente elemental para todos los organismos vivos.

El azufre forma varias moléculas poliatómicas. El alótropo más conocido es el octaazufre , ciclo-S 8 . El grupo puntual del ciclo-S 8 es D 4d y su momento dipolar es 0 D. [11] El octaazufre es un sólido blando, de color amarillo brillante e inodoro. [a] Se funde a 115,21 °C (239,38 °F), [b] hierve a 444,6 °C (832,3 °F). [7] A 95,2 °C (203,4 °F), por debajo de su temperatura de fusión, el ciclo-octasazufre comienza a cambiar lentamente de α-octasazufre al polimorfo β- . [13] La estructura del anillo S 8 prácticamente no cambia por este cambio de fase, que afecta a las interacciones intermoleculares. El enfriamiento del azufre fundido da un punto de congelación de 119,6 °C (247,3 °F), [14] ya que se compone predominantemente de moléculas β-S 8 . [c] Entre sus temperaturas de fusión y ebullición, el octaazufre cambia de nuevo su alótropo, pasando de β-octasazufre a γ-azufre, acompañado de nuevo por una menor densidad pero una mayor viscosidad debido a la formación de polímeros . [13] A temperaturas más altas, la viscosidad disminuye a medida que se produce la despolimerización. El azufre fundido asume un color rojo oscuro por encima de los 200 °C (392 °F). La densidad del azufre es de unos 2 g/cm 3 , dependiendo del alótropo; todos los alótropos estables son excelentes aislantes eléctricos.
El azufre sublima más o menos entre 20 °C (68 °F) y 50 °C (122 °F). [18]
El azufre es insoluble en agua, pero soluble en disulfuro de carbono y, en menor medida, en otros disolventes orgánicos no polares , como el benceno y el tolueno .
En condiciones normales, el azufre se hidroliza muy lentamente para formar principalmente sulfuro de hidrógeno y ácido sulfúrico :
La reacción implica la adsorción de protones en S
8racimos, seguidos de desproporción en los productos de reacción. [19]
Las energías de ionización segunda, cuarta y sexta del azufre son 2252 kJ/mol, 4556 kJ/mol y 8495,8 kJ/mol, respectivamente. La composición de los productos de las reacciones del azufre con oxidantes (y su estado de oxidación) depende de si la liberación de energía de la reacción supera estos umbrales. La aplicación de catalizadores y/o el suministro de energía externa pueden variar el estado de oxidación del azufre y la composición de los productos de la reacción. Mientras que la reacción entre el azufre y el oxígeno en condiciones normales produce dióxido de azufre (estado de oxidación +4), la formación de trióxido de azufre (estado de oxidación +6) requiere una temperatura de 400–600 °C (750–1100 °F) y la presencia de un catalizador.
En reacciones con elementos de menor electronegatividad , reacciona como oxidante y forma sulfuros, donde tiene estado de oxidación -2.
El azufre reacciona con casi todos los demás elementos, con excepción de los gases nobles, incluso con el iridio, un metal notoriamente poco reactivo (lo que produce disulfuro de iridio ). [20] Algunas de esas reacciones necesitan temperaturas elevadas. [21]

El azufre forma más de 30 alótropos sólidos , más que cualquier otro elemento. [22] Además de S 8 , se conocen varios otros anillos. [23] Al eliminar un átomo de la corona se obtiene S 7 , que es de un amarillo más oscuro que S 8 . El análisis por HPLC del "azufre elemental" revela una mezcla en equilibrio principalmente de S 8 , pero con S 7 y pequeñas cantidades de S 6 . [24] Se han preparado anillos más grandes, incluidos S 12 y S 18 . [25] [26]
El azufre amorfo o "plástico" se produce mediante el enfriamiento rápido del azufre fundido, por ejemplo, vertiéndolo en agua fría. Los estudios de cristalografía de rayos X muestran que la forma amorfa puede tener una estructura helicoidal con ocho átomos por vuelta. Las moléculas poliméricas largas y enrolladas hacen que la sustancia de color marrón sea elástica y, en masa, esta forma tiene la textura del caucho crudo. Esta forma es metaestable a temperatura ambiente y gradualmente vuelve al alótropo molecular cristalino, que ya no es elástico. Este proceso ocurre en cuestión de horas o días, pero puede catalizarse rápidamente.
El azufre tiene 23 isótopos conocidos , cuatro de los cuales son estables: 32 S (94,99% ± 0,26% ), 33 S (0,75% ± 0,02% ), 34 S (4,25% ± 0,24% ) y 36 S (0,01% ± 0,01% ). [27] [28] Aparte del 35 S, con una vida media de 87 días, los isótopos radiactivos del azufre tienen vidas medias inferiores a 3 horas.
La preponderancia del 32S se explica por su producción en el llamado proceso alfa (una de las principales clases de reacciones de fusión nuclear) en las estrellas en explosión. Otros isótopos estables de azufre se producen en los procesos de derivación relacionados con el 34Ar , y su composición depende del tipo de explosión estelar. Por ejemplo, proporcionalmente, más 33S proviene de las novas que de las supernovas . [29]
En el planeta Tierra la composición isotópica del azufre fue determinada por el Sol. Aunque se supone que la distribución de los diferentes isótopos de azufre debería ser más o menos igual, se ha encontrado que las proporciones de los dos isótopos de azufre más abundantes, 32 S y 34 S, varían en diferentes muestras. El análisis de la proporción de estos isótopos (δ 34 S) en las muestras permite hacer sugerencias sobre su historia química y, con la ayuda de otros métodos, permite datar las muestras, estimar la temperatura de equilibrio entre el mineral y el agua, determinar el pH y la fugacidad del oxígeno, identificar la actividad de las bacterias reductoras de sulfato en el momento de la formación de la muestra o sugerir las principales fuentes de azufre en los ecosistemas. [30] Sin embargo, hay discusiones en curso sobre cuál es la razón real de los cambios de δ 34 S, la actividad biológica o la alteración postdeposital. [31]
Por ejemplo, cuando se precipitan minerales de sulfuro , el equilibrio isotópico entre sólidos y líquidos puede causar pequeñas diferencias en los valores de δ 34 S de los minerales cogenéticos. Las diferencias entre minerales se pueden utilizar para estimar la temperatura de equilibrio. Los valores de δ 13 C y δ 34 S de minerales de carbonato y sulfuros coexistentes se pueden utilizar para determinar el pH y la fugacidad de oxígeno del fluido que contiene el mineral durante la formación del mineral.
Los científicos miden los isótopos de azufre de los minerales en rocas y sedimentos para estudiar las condiciones redox en los océanos en el pasado. Las bacterias reductoras de sulfato en sedimentos marinos fraccionan los isótopos de azufre a medida que absorben sulfato y producen sulfuro . Antes de la década de 2010, se pensaba que la reducción de sulfato podía fraccionar los isótopos de azufre hasta 46 permil [32] y el fraccionamiento mayor a 46 permil registrado en sedimentos debe deberse a la desproporción de compuestos de azufre en el sedimento. Esta visión ha cambiado desde la década de 2010 a medida que los experimentos muestran que las bacterias reductoras de sulfato pueden fraccionar hasta 66 permil. [33] Como los sustratos para la desproporción están limitados por el producto de la reducción de sulfato , el efecto isotópico de la desproporción debería ser menor a 16 permil en la mayoría de los entornos sedimentarios. [34]
En la mayoría de los ecosistemas forestales , el sulfato se deriva principalmente de la atmósfera; la erosión de los minerales y las evaporitas aportan algo de azufre. El azufre con una composición isotópica distintiva se ha utilizado para identificar fuentes de contaminación, y el azufre enriquecido se ha añadido como trazador en estudios hidrológicos . Las diferencias en las abundancias naturales se pueden utilizar en sistemas donde hay suficiente variación en el 34 S de los componentes del ecosistema. Se ha descubierto que los lagos de las Montañas Rocosas que se cree que están dominados por fuentes atmosféricas de sulfato tienen valores de 34 S mensurablemente diferentes a los lagos que se cree que están dominados por fuentes de sulfato de cuencas hidrográficas.
El radioactivo 35 S se forma en la espalación de rayos cósmicos del 40 Ar atmosférico . Este hecho puede usarse para probar la presencia de sedimentos atmosféricos recientes (no más de 1 año) en varias cosas. Este isótopo puede obtenerse artificialmente por diferentes métodos. En la práctica, la reacción 35 Cl + n → 35 S + p se usa irradiando cloruro de potasio con neutrones. [35] El isótopo 35 S se usa en varios compuestos que contienen azufre como un trazador radioactivo para muchos estudios biológicos, por ejemplo, el experimento de Hershey-Chase .
Debido a la débil actividad beta del 35 S, sus compuestos son relativamente seguros siempre que no sean ingeridos o absorbidos por el cuerpo. [36]




El 32 S se crea en el interior de estrellas masivas, a una profundidad donde la temperatura supera los 2,5×10 9 K, por la fusión de un núcleo de silicio más un núcleo de helio. [37] Como esta reacción nuclear es parte del proceso alfa que produce elementos en abundancia, el azufre es el décimo elemento más común en el universo .
El azufre, generalmente como sulfuro, está presente en muchos tipos de meteoritos . Las condritas ordinarias contienen en promedio un 2,1% de azufre, y las condritas carbonosas pueden contener hasta un 6,6%. Normalmente está presente como troilita (FeS), pero hay excepciones, con condritas carbonosas que contienen azufre libre, sulfatos y otros compuestos de azufre. [38] Los colores distintivos de la luna volcánica de Júpiter , Ío, se atribuyen a varias formas de azufre fundido, sólido y gaseoso. [39] En julio de 2024, se confirmó por sorpresa la existencia de azufre elemental en Marte , después de que el rover Curiosity pasara por encima y aplastara una roca revelando cristales de azufre en su interior. [40]
El azufre es el quinto elemento más común por masa en la Tierra. El azufre elemental se puede encontrar cerca de fuentes termales y regiones volcánicas en muchas partes del mundo, especialmente a lo largo del Cinturón de Fuego del Pacífico ; dichos depósitos volcánicos se extraen actualmente en Indonesia, Chile y Japón. Estos depósitos son policristalinos, y el monocristal más grande documentado mide 22 cm × 16 cm × 11 cm (8,7 pulgadas × 6,3 pulgadas × 4,3 pulgadas). [41] Históricamente, Sicilia fue una fuente importante de azufre en la Revolución Industrial . [42] Se han encontrado lagos de azufre fundido de hasta unos 200 m (660 pies) de diámetro en el fondo del mar, asociados con volcanes submarinos , a profundidades donde el punto de ebullición del agua es más alto que el punto de fusión del azufre. [43]
El azufre nativo es sintetizado por bacterias anaeróbicas que actúan sobre minerales de sulfato como el yeso en domos de sal . [44] [45] Se encuentran depósitos significativos en domos de sal a lo largo de la costa del Golfo de México y en evaporitas en Europa del Este y Asia Occidental. El azufre nativo puede producirse solo por procesos geológicos. Los depósitos de azufre de origen fósil de los domos de sal alguna vez fueron la base de la producción comercial en los Estados Unidos, Rusia, Turkmenistán y Ucrania. [46] Actualmente, la producción comercial todavía se lleva a cabo en la mina Osiek en Polonia. Dichas fuentes ahora tienen una importancia comercial secundaria y la mayoría ya no se explotan.
Entre los compuestos de azufre que se encuentran de forma natural se encuentran los minerales de sulfuro , como la pirita (sulfuro de hierro), el cinabrio (sulfuro de mercurio), la galena (sulfuro de plomo), la esfalrita (sulfuro de cinc) y la estibina (sulfuro de antimonio); y los minerales de sulfato , como el yeso (sulfato de calcio), la alunita (sulfato de potasio y aluminio) y la barita (sulfato de bario). En la Tierra, al igual que en la luna Ío de Júpiter, el azufre elemental se encuentra de forma natural en las emisiones volcánicas, incluidas las emisiones de los respiraderos hidrotermales .
La principal fuente industrial de azufre es actualmente el petróleo y el gas natural . [9]
Los estados de oxidación más comunes del azufre varían de -2 a +6. El azufre forma compuestos estables con todos los elementos, excepto los gases nobles .

Policationes de azufre, S2+8, S2+4y S2+16se producen cuando el azufre reacciona con agentes oxidantes en una solución fuertemente ácida. [47] Las soluciones coloreadas producidas al disolver azufre en óleum fueron reportadas por primera vez en 1804 por C. F. Bucholz, pero la causa del color y la estructura de los policationes involucrados solo se determinaron a fines de la década de 1960 .2+8es azul profundo, S2+4es amarillo y s2+16es rojo. [13]
La reducción del azufre produce diversos polisulfuros con la fórmula S2−
x, muchos de los cuales se han obtenido en forma cristalina. Un ejemplo ilustrativo es la producción de tetrasulfuro de sodio :
Algunos de estos dianiones se disocian para dar aniones radicales , como S−3da el color azul a la roca lapislázuli .

Esta reacción pone de relieve una propiedad distintiva del azufre: su capacidad de concatenarse (unirse a sí mismo mediante la formación de cadenas). La protonación de estos aniones polisulfuro produce los polisulfanos , H 2 S x , donde x = 2, 3 y 4. [49] En última instancia, la reducción del azufre produce sales de sulfuro:
La interconversión de estas especies se aprovecha en la batería de sodio-azufre .
El tratamiento del azufre con hidrógeno produce sulfuro de hidrógeno . Cuando se disuelve en agua, el sulfuro de hidrógeno es ligeramente ácido: [7]
El gas de sulfuro de hidrógeno y el anión hidrosulfuro son extremadamente tóxicos para los mamíferos, debido a su inhibición de la capacidad de transporte de oxígeno de la hemoglobina y ciertos citocromos de manera análoga al cianuro y la azida (ver más abajo, en precauciones ).
Los dos principales óxidos de azufre se obtienen quemando azufre:
Se observan muchos otros óxidos de azufre, incluidos los óxidos ricos en azufre , como el monóxido de azufre , el monóxido de disazufre , los dióxidos de disazufre y óxidos superiores que contienen grupos peroxo.
El azufre reacciona con el flúor para dar el altamente reactivo tetrafluoruro de azufre y el altamente inerte hexafluoruro de azufre . [50] Mientras que el flúor da compuestos S(IV) y S(VI), el cloro da derivados S(II) y S(I). Por lo tanto, el dicloruro de azufre , el dicloruro de disulfuro y los clorosulfanos superiores surgen de la cloración del azufre. El cloruro de sulfurilo y el ácido clorosulfúrico son derivados del ácido sulfúrico; el cloruro de tionilo (SOCl 2 ) es un reactivo común en la síntesis orgánica . [51] El bromo también oxida el azufre para formar dibromuro de azufre y dibromuro de disulfuro . [51]
El azufre oxida el cianuro y el sulfito para dar tiocianato y tiosulfato , respectivamente.
El azufre reacciona con muchos metales. Los metales electropositivos dan sales de polisulfuro. El azufre ataca al cobre, el cinc y la plata; véase deslustre . Aunque se conocen muchos sulfuros metálicos , la mayoría se preparan mediante reacciones de alta temperatura de los elementos. [52] Los geocientíficos también estudian los isótopos de los sulfuros metálicos en rocas y sedimentos para estudiar las condiciones ambientales en el pasado de la Tierra. [53]
Algunas de las principales clases de compuestos orgánicos que contienen azufre incluyen las siguientes: [54]
Los compuestos con enlaces múltiples carbono-azufre son poco comunes, con la excepción del disulfuro de carbono , un líquido incoloro volátil que es estructuralmente similar al dióxido de carbono. Se utiliza como reactivo para fabricar el polímero rayón y muchos compuestos organosulfurados. A diferencia del monóxido de carbono , el monosulfuro de carbono es estable solo como un gas extremadamente diluido, que se encuentra entre los sistemas solares. [55]
Los compuestos organosulfurados son responsables de algunos de los olores desagradables de la materia orgánica en descomposición. Son ampliamente conocidos como el odorante del gas natural doméstico, el olor a ajo y el rocío de zorrillo, así como un componente del mal aliento . No todos los compuestos orgánicos de azufre huelen desagradablemente en todas las concentraciones: el mercaptano de pomelo , un monoterpenoide que contiene azufre , en pequeñas concentraciones tiene el aroma característico del pomelo, pero tiene un olor genérico a tiol en concentraciones mayores. La mostaza de azufre , un potente vesicante , se utilizó en la Primera Guerra Mundial como agente incapacitante. [56]
Los enlaces azufre-azufre son un componente estructural utilizado para endurecer el caucho, de forma similar a los puentes disulfuro que dan rigidez a las proteínas (véase la descripción biológica a continuación). En el tipo más común de "curado" industrial o endurecimiento y fortalecimiento del caucho natural , el azufre elemental se calienta con el caucho hasta el punto en que las reacciones químicas forman puentes disulfuro entre las unidades de isopreno del polímero. Este proceso, patentado en 1843, [ cita requerida ] convirtió al caucho en un producto industrial importante, especialmente en los neumáticos de los automóviles. Debido al calor y al azufre, el proceso recibió el nombre de vulcanización , en honor al dios romano de la forja y el vulcanismo .

Al estar disponible en abundancia en forma nativa, el azufre era conocido en la antigüedad y se menciona en la Torá ( Génesis ). Las traducciones inglesas de la Biblia cristiana comúnmente se refieren al azufre ardiente como "azufre", dando lugar al término sermones de " fuego y azufre " , en los que se recuerda a los oyentes el destino de la condenación eterna que espera a los incrédulos e impenitentes. Es de esta parte de la Biblia [57] que se da a entender que el infierno "huele a azufre" (probablemente debido a su asociación con la actividad volcánica). Según el Papiro de Ebers , se usaba un ungüento de azufre en el antiguo Egipto para tratar los párpados granulados. El azufre se usaba para fumigar en la Grecia preclásica ; [58] esto se menciona en la Odisea . [59] Plinio el Viejo analiza el azufre en el libro 35 de su Historia natural , diciendo que su fuente más conocida es la isla de Melos . Menciona su uso para fumigación, medicina y blanqueamiento de telas. [60]
Una forma natural de azufre conocida como shiliuhuang (石硫黄) era conocida en China desde el siglo VI a. C. y se encontró en Hanzhong . [61] En el siglo III, los chinos habían descubierto que el azufre podía extraerse de la pirita . [61] Los taoístas chinos estaban interesados en la inflamabilidad del azufre y su reactividad con ciertos metales, aunque sus primeros usos prácticos se encontraron en la medicina tradicional china . [61] El Wujing Zongyao de 1044 d. C. describió varias fórmulas para la pólvora negra china , que es una mezcla de nitrato de potasio ( KNO
3), carbón y azufre. [62]
Los alquimistas indios, practicantes de la «ciencia de los químicos» ( sánscrito : रसशास्त्र , romanizado : rasaśāstra ), escribieron extensamente sobre el uso del azufre en operaciones alquímicas con mercurio, desde el siglo VIII d. C. en adelante. [64] En la tradición rasaśāstra , el azufre es llamado «el maloliente» ( गन्धक , gandhaka ).
Los primeros alquimistas europeos dieron al azufre un símbolo alquímico único , un triángulo sobre una cruz (🜍). (Esto a veces se confunde con el símbolo astronómico de la lanza cruzada ⚴ para 2 Palas ). La variación conocida como azufre tiene un símbolo que combina una cruz de dos barras sobre una lemniscata (🜏). En el tratamiento tradicional de la piel, se utilizaba azufre elemental (principalmente en cremas) para aliviar afecciones como la sarna , la tiña , la psoriasis , el eczema y el acné . Se desconoce el mecanismo de acción, aunque el azufre elemental se oxida lentamente a ácido sulfuroso, que es (a través de la acción del sulfito ) un agente reductor y antibacteriano suave. [65] [66] [67]

El azufre aparece en una columna de álcali fijo (no ácido) en una tabla química de 1718. [69] Antoine Lavoisier utilizó azufre en experimentos de combustión, escribiendo sobre algunos de ellos en 1777. [70]
Los depósitos de azufre en Sicilia fueron la fuente dominante durante más de un siglo. A finales del siglo XVIII, se importaban unas 2.000 toneladas de azufre al año a Marsella , Francia, para la producción de ácido sulfúrico para su uso en el proceso Leblanc . En la industrialización de Gran Bretaña, con la derogación de los aranceles sobre la sal en 1824, la demanda de azufre de Sicilia aumentó drásticamente. El creciente control y explotación británicos de la minería, refinación y transporte del azufre, junto con el fracaso de esta lucrativa exportación para transformar la economía atrasada y empobrecida de Sicilia, llevaron a la Crisis del Azufre de 1840 , cuando el rey Fernando II dio el monopolio de la industria del azufre a una empresa francesa, violando un acuerdo comercial anterior de 1816 con Gran Bretaña. Finalmente, Francia negoció una solución pacífica. [71] [72]
En 1867 se descubrió azufre elemental en yacimientos subterráneos de Luisiana y Texas . Para extraer este recurso se desarrolló el exitoso proceso Frasch . [73]
A finales del siglo XVIII, los fabricantes de muebles utilizaban azufre fundido para producir incrustaciones decorativas . [74] El azufre fundido todavía se utiliza a veces para colocar pernos de acero en agujeros de hormigón perforados donde se desea una alta resistencia a los golpes para los puntos de fijación de equipos montados en el suelo. El azufre puro en polvo se utilizaba como tónico medicinal y laxante. [46]
Con la llegada del proceso de contacto , la mayor parte del azufre actual se utiliza para fabricar ácido sulfúrico para una amplia gama de usos, en particular como fertilizante. [75]
En los últimos tiempos, la principal fuente de azufre ha sido el petróleo y el gas natural . Esto se debe a la necesidad de eliminar el azufre de los combustibles para evitar la lluvia ácida , lo que ha dado lugar a un excedente de azufre. [9]
El azufre se deriva de la palabra latina sulpur , que fue helenizada a sulphur en la creencia errónea de que la palabra latina provenía del griego. Esta ortografía fue reinterpretada más tarde como representando un sonido /f/ y resultó en la ortografía sulfur , que aparece en latín hacia el final del período clásico . La verdadera palabra griega antigua para azufre, θεῖον , theîon (del anterior θέειον , théeion ), es la fuente del prefijo químico internacional tio- . La palabra griega estándar moderna para azufre es θείο, theío .
En el anglofrancés del siglo XII , era sulfre . En el siglo XIV, el latín erróneamente helenizado -ph- fue restaurado en el inglés medio sulphre . Para el siglo XV, ambas variantes de ortografía latina completa sulfur y sulphur se volvieron comunes en inglés. Las ortografías paralelas f~ph continuaron en Gran Bretaña hasta el siglo XIX, cuando la palabra fue estandarizada como sulphur . [76] Por otro lado, sulfur fue la forma elegida en los Estados Unidos, mientras que Canadá usa ambas.
La IUPAC adoptó la ortografía sulfur en 1990 [77] [78] al igual que el Comité de Nomenclatura de la Royal Society of Chemistry en 1992, restableciendo la ortografía sulfur en Gran Bretaña. [79] Los diccionarios Oxford señalan que "en química y otros usos técnicos... la ortografía -f- es ahora la forma estándar para esta y otras palabras relacionadas en contextos británicos y estadounidenses, y se utiliza cada vez más también en contextos generales". [80]


El azufre se puede encontrar solo e históricamente se obtenía generalmente en esta forma; la pirita también ha sido una fuente de azufre. [81] En las regiones volcánicas de Sicilia , en la antigüedad, se encontraba en la superficie de la Tierra y se utilizaba el " proceso siciliano ": los depósitos de azufre se apilaban y apilaban en hornos de ladrillos construidos en laderas inclinadas, con espacios de aire entre ellos. Luego, se pulverizaba algo de azufre, se esparcía sobre el mineral apilado y se encendía, lo que hacía que el azufre libre se derritiera por las colinas. Finalmente, los depósitos superficiales se agotaron y los mineros excavaron vetas que finalmente salpicaron el paisaje siciliano con minas laberínticas. La minería no estaba mecanizada y requería mucha mano de obra, con trabajadores que extraían el mineral de la roca y muchachos de las minas o carusi que llevaban cestas de mineral a la superficie, a menudo a través de una milla o más de túneles. Una vez que el mineral estaba en la superficie, se reducía y se extraía en hornos de fundición. Las condiciones en las minas de azufre de Sicilia eran horribles, lo que llevó a Booker T. Washington a escribir: "No estoy preparado ahora para decir hasta qué punto creo en un infierno físico en el otro mundo, pero una mina de azufre en Sicilia es lo más cercano al infierno que espero ver en esta vida". [82] El azufre todavía se extrae de depósitos superficiales en naciones más pobres con volcanes, como Indonesia , y las condiciones de los trabajadores no han mejorado mucho desde los días de Booker T. Washington. [83]
Hasta finales del siglo XX, el azufre elemental se extraía de los domos de sal (en los que a veces se encuentra en forma casi pura). Ahora se produce como subproducto de otros procesos industriales, como el refinado de petróleo, en el que el azufre no es deseable. Como mineral, se cree que el azufre nativo que se encuentra bajo los domos de sal es un recurso mineral fósil, producido por la acción de bacterias anaeróbicas sobre los depósitos de sulfato. Se extraía de estas minas de domos de sal principalmente mediante el proceso Frasch . [46] En este método, se bombeaba agua sobrecalentada a un depósito de azufre nativo para fundirlo y, a continuación, el producto fundido con una pureza del 99,5 % se devolvía a la superficie con aire comprimido. A lo largo del siglo XX, este procedimiento producía azufre elemental que no requería más purificación. Debido a la cantidad limitada de estos depósitos de azufre y al alto coste de su explotación, este proceso de extracción de azufre no se ha empleado de forma importante en ningún lugar del mundo desde 2002. [84] [85]

En la actualidad, el azufre se produce a partir del petróleo, el gas natural y recursos fósiles relacionados, de los que se obtiene principalmente como sulfuro de hidrógeno . [9] Los compuestos organosulfurados , impurezas indeseables del petróleo, pueden mejorarse sometiéndolos a hidrodesulfuración , que escinde los enlaces C–S: [84] [85]
El sulfuro de hidrógeno resultante de este proceso, y también como ocurre en el gas natural, se convierte en azufre elemental mediante el proceso Claus . Este proceso implica la oxidación de una parte del sulfuro de hidrógeno a dióxido de azufre y luego la proporción de los dos: [84] [85]
Debido al alto contenido de azufre de las arenas petrolíferas de Athabasca , ahora existen reservas de azufre elemental de este proceso en toda Alberta , Canadá. [86] Otra forma de almacenar azufre es como aglutinante para el hormigón, y el producto resultante tiene algunas propiedades deseables (véase hormigón con azufre ). [87]
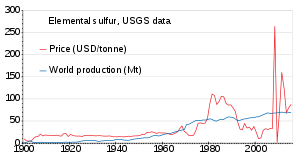
La producción mundial de azufre en 2011 ascendió a 69 millones de toneladas (Mt), de las cuales más de 15 países aportaron más de 1 Mt cada uno. Los países que producen más de 5 Mt son China (9,6), Estados Unidos (8,8), Canadá (7,1) y Rusia (7,1). [88] La producción ha ido aumentando lentamente desde 1900 hasta 2010; el precio fue inestable en la década de 1980 y alrededor de 2010. [89]
El azufre elemental se utiliza principalmente como precursor de otras sustancias químicas. Aproximadamente el 85% (1989) se convierte en ácido sulfúrico (H 2 SO 4 ):

En 2010, Estados Unidos produjo más ácido sulfúrico que cualquier otra sustancia química industrial inorgánica. [89] El principal uso del ácido es la extracción de minerales de fosfato para la producción de fertilizantes. Otras aplicaciones del ácido sulfúrico incluyen la refinación de petróleo, el procesamiento de aguas residuales y la extracción de minerales. [46]
El azufre reacciona directamente con el metano para dar disulfuro de carbono , que se utiliza para fabricar celofán y rayón . [46] Uno de los usos del azufre elemental es en la vulcanización del caucho, donde las cadenas de polisulfuro reticulan polímeros orgánicos. Grandes cantidades de sulfitos se utilizan para blanquear papel y para conservar frutos secos . Muchos surfactantes y detergentes (por ejemplo , lauril sulfato de sodio ) son derivados del sulfato. El sulfato de calcio , yeso (CaSO 4 ·2H 2 O) se extrae a una escala de 100 millones de toneladas cada año para su uso en cemento Portland y fertilizantes.
Cuando se generalizó la fotografía a base de plata , se utilizaban ampliamente el tiosulfato de sodio y el de amonio como "agentes fijadores". El azufre es un componente de la pólvora ("pólvora negra").
Los aminoácidos sintetizados por los organismos vivos, como la metionina y la cisteína, contienen grupos organosulfurados ( tioéster y tiol respectivamente). El antioxidante glutatión, que protege a muchos organismos vivos contra los radicales libres y el estrés oxidativo, también contiene azufre orgánico. Algunos cultivos , como la cebolla y el ajo, también producen diferentes compuestos organosulfurados , como el sin -propanetial -S -óxido, responsable de la irritación lagrimal (cebollas), o el disulfuro de dialilo y la alicina (ajo). Los sulfatos , que se encuentran comúnmente en los suelos y las aguas subterráneas, suelen ser una fuente natural suficiente de azufre para las plantas y las bacterias. La deposición atmosférica de dióxido de azufre (SO2 ) también es una fuente artificial común ( combustión de carbón ) de azufre para los suelos. En circunstancias normales, en la mayoría de los suelos agrícolas, el azufre no es un nutriente limitante para las plantas y los microorganismos (véase el barril de Liebig ). Sin embargo, en algunas circunstancias, los suelos pueden verse empobrecidos en sulfato , por ejemplo, si este es posteriormente lixiviado por agua meteórica ( lluvia ) o si los requerimientos en azufre para algunos tipos de cultivos son altos. Esto explica que el azufre sea cada vez más reconocido y utilizado como un componente de fertilizantes . La forma más importante de azufre para fertilizantes es el sulfato de calcio , que se encuentra comúnmente en la naturaleza como el mineral yeso (CaSO4 · 2H2O ) . El azufre elemental es hidrófobo (no soluble en agua) y no puede ser utilizado directamente por las plantas. El azufre elemental (ES) a veces se mezcla con bentonita para enmendar suelos empobrecidos para cultivos con altos requerimientos en organoazufre. Con el tiempo, los procesos abióticos de oxidación con oxígeno atmosférico y bacterias del suelo pueden oxidar y convertir el azufre elemental en derivados solubles, que luego pueden ser utilizados por microorganismos y plantas. El azufre mejora la eficiencia de otros nutrientes esenciales para las plantas, particularmente nitrógeno y fósforo. [90] Las partículas de azufre producidas biológicamente son naturalmente hidrófilas debido a un recubrimiento de biopolímero y son más fáciles de dispersar sobre la tierra en una pulverización de suspensión diluida, lo que resulta en una absorción más rápida por parte de las plantas.
El requerimiento de azufre de las plantas es igual o mayor que el de fósforo . Es un nutriente esencial para el crecimiento de las plantas, la formación de nódulos radiculares de las legumbres y los sistemas de inmunidad y defensa. La deficiencia de azufre se ha generalizado en muchos países de Europa. [91] [92] [93] Debido a que los aportes atmosféricos de azufre siguen disminuyendo, es probable que el déficit en la entrada/salida de azufre aumente a menos que se utilicen fertilizantes azufrados. Los aportes atmosféricos de azufre disminuyen debido a las medidas adoptadas para limitar las lluvias ácidas . [94] [90]

El azufre elemental es uno de los fungicidas y pesticidas más antiguos . El "azufre en polvo", azufre elemental en forma de polvo, es un fungicida común para uvas, fresas, muchas verduras y otros cultivos. Tiene una buena eficacia contra una amplia gama de enfermedades del mildiú polvoroso , así como contra la mancha negra. En la producción orgánica, el azufre es el fungicida más importante. Es el único fungicida utilizado en la producción de manzanas cultivadas orgánicamente contra la principal enfermedad, la sarna del manzano, en condiciones más frías. El bioazufre (azufre elemental producido biológicamente con características hidrófilas) también se puede utilizar para estas aplicaciones.
El azufre en polvo de formulación estándar se aplica a los cultivos con un espolvoreador de azufre o desde un avión espolvoreador . El azufre humectable es el nombre comercial del azufre en polvo formulado con ingredientes adicionales para hacerlo miscible en agua . [87] [95] Tiene aplicaciones similares y se utiliza como fungicida contra el moho y otros problemas relacionados con el moho en las plantas y el suelo.
El azufre elemental en polvo se utiliza como insecticida (en realidad, un acaricida ) " orgánico " (es decir, "verde") contra garrapatas y ácaros . Un método común de aplicación es espolvorear la ropa o las extremidades con azufre en polvo.
Se utiliza una solución diluida de azufre de calcio (elaborada combinando hidróxido de calcio con azufre elemental en agua) como baño para mascotas para destruir la tiña (hongos) , la sarna y otras dermatosis y parásitos .
Se quemaban velas de azufre casi puro para fumigar estructuras y barriles de vino, pero ahora se consideran demasiado tóxicas para las residencias.
El azufre (específicamente el octaazufre , S 8 ) se utiliza en preparaciones farmacéuticas para la piel para el tratamiento del acné y otras afecciones. Actúa como un agente queratolítico y también mata bacterias, hongos, ácaros de la sarna y otros parásitos. [96] El azufre precipitado y el azufre coloidal se utilizan, en forma de lociones , cremas, polvos, jabones y aditivos para el baño, para el tratamiento del acné vulgar , el acné rosácea y la dermatitis seborreica . [97]
Muchos fármacos contienen azufre. [98] Los primeros ejemplos incluyen las sulfonamidas antibacterianas , conocidas como sulfamidas . Un ejemplo más reciente es la acetilcisteína mucolítica . El azufre forma parte de muchas moléculas de defensa bacteriana. La mayoría de los antibióticos β-lactámicos , incluidas las penicilinas , las cefalosporinas y las monobactámicas , contienen azufre. [54]
Debido a su alta densidad energética y a la disponibilidad de azufre, se están realizando investigaciones para crear baterías recargables de litio y azufre . Hasta ahora, los electrolitos de carbonato han provocado fallos en dichas baterías después de un solo ciclo. En febrero de 2022, investigadores de la Universidad de Drexel no solo crearon una batería prototípica que duró 4000 ciclos de recarga, sino que también encontraron el primer azufre gamma monoclínico que permaneció estable por debajo de los 95 grados Celsius. [99]
El azufre es un componente esencial de todas las células vivas . Es el octavo elemento más abundante en el cuerpo humano por peso, [100] aproximadamente igual en abundancia al potasio , y ligeramente mayor que el sodio y el cloro . [101] Un cuerpo humano de 70 kg (150 lb) contiene aproximadamente 140 gramos (4,9 oz) de azufre. [102] La principal fuente dietética de azufre para los humanos son los aminoácidos que contienen azufre, [103] que se pueden encontrar en las proteínas vegetales y animales. [104]
En la década de 1880, mientras estudiaba Beggiatoa (una bacteria que vive en un entorno rico en azufre), Sergei Winogradsky descubrió que oxidaba sulfuro de hidrógeno ( H2S ) como fuente de energía, formando gotitas intracelulares de azufre. Winogradsky se refirió a esta forma de metabolismo como inorgoxidación (oxidación de compuestos inorgánicos). [105] Otro colaborador, que continuó estudiándolo, fue Selman Waksman . [106] Las bacterias primitivas que viven alrededor de los respiraderos volcánicos del océano profundo oxidan sulfuro de hidrógeno para su nutrición, como descubrió Robert Ballard . [10]
Los oxidantes de azufre pueden utilizar como fuentes de energía compuestos de azufre reducido, incluyendo sulfuro de hidrógeno, azufre elemental, sulfito , tiosulfato y varios politionatos (por ejemplo, tetrationato ). [107] Dependen de enzimas como la sulfuroxigenasa y la sulfitooxidasa para oxidar el azufre a sulfato. Algunos litótrofos pueden incluso utilizar la energía contenida en los compuestos de azufre para producir azúcares, un proceso conocido como quimiosíntesis . Algunas bacterias y arqueas utilizan sulfuro de hidrógeno en lugar de agua como donante de electrones en la quimiosíntesis, un proceso similar a la fotosíntesis que produce azúcares y utiliza oxígeno como aceptor de electrones . La quimiosíntesis basada en azufre puede compararse de forma simplificada con la fotosíntesis:
Existen bacterias que combinan estas dos formas de nutrición: las bacterias verdes del azufre y las bacterias moradas del azufre . [108] También las bacterias oxidantes del azufre pueden entrar en simbiosis con organismos más grandes, lo que permite que estos últimos utilicen el sulfuro de hidrógeno como alimento para ser oxidado. Ejemplo: el gusano tubícola gigante . [109]
Existen bacterias reductoras de sulfato que, en cambio, "respiran sulfato" en lugar de oxígeno. Utilizan compuestos orgánicos o hidrógeno molecular como fuente de energía. Utilizan azufre como aceptor de electrones y reducen diversos compuestos de azufre oxidados a sulfuro, a menudo a sulfuro de hidrógeno. Pueden crecer sobre otros compuestos de azufre parcialmente oxidados (por ejemplo, tiosulfatos, tionatos, polisulfuros, sulfitos).
Hay estudios que apuntan a que muchos depósitos de azufre nativo en lugares que fueron el fondo de los antiguos océanos tienen origen biológico. [110] [111] [112] Estos estudios indican que este azufre nativo se ha obtenido mediante actividad biológica, pero aún se desconoce con certeza quién es el responsable de ello (bacterias oxidantes de azufre o bacterias reductoras de sulfato).
Las raíces de las plantas absorben el azufre del suelo en forma de sulfato y lo transportan como éster de fosfato. El sulfato se reduce a sulfuro a través del sulfito antes de incorporarse a la cisteína y otros compuestos orgánicos de azufre. [113]
Si bien el papel de las plantas en la transferencia de azufre a los animales a través de las cadenas alimentarias se entiende más o menos, el papel de las bacterias del azufre apenas se está investigando. [114] [115]
En todas las formas de vida, la mayor parte del azufre está contenido en dos aminoácidos proteinogénicos ( cisteína y metionina ), por lo que el elemento está presente en todas las proteínas que contienen estos aminoácidos, así como en los respectivos péptidos . [116] Parte del azufre está comprendido en ciertos metabolitos, muchos de los cuales son cofactores , y polisacáridos sulfatados del tejido conectivo ( sulfatos de condroitina , heparina ).
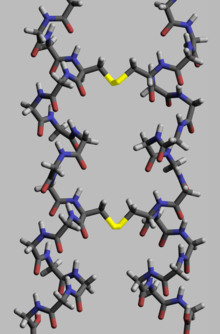
Las proteínas, para ejecutar su función biológica , necesitan tener una geometría espacial específica. La formación de esta geometría se realiza en un proceso llamado plegamiento de proteínas , y se proporciona mediante enlaces intra e intermoleculares. El proceso tiene varias etapas. Mientras que en las etapas principales una cadena polipeptídica se pliega debido a enlaces de hidrógeno , en etapas posteriores el plegamiento se proporciona (aparte de los enlaces de hidrógeno) por enlaces covalentes entre dos átomos de azufre de dos residuos de cisteína (los llamados puentes disulfuro) en diferentes lugares de una cadena (estructura proteica terciaria), así como entre dos residuos de cisteína en dos subunidades proteicas separadas (estructura proteica cuaternaria). Ambas estructuras se pueden ver fácilmente en la insulina . Como la energía de enlace de un puente disulfuro covalente es mayor que la energía de un enlace coordinado o interacción hidrofóbica, un mayor contenido de puentes disulfuro conduce a una mayor energía necesaria para la desnaturalización de la proteína . En general, los enlaces disulfuro son necesarios en las proteínas que funcionan fuera del espacio celular y no cambian la conformación (geometría) de las proteínas, sino que sirven como estabilizadores. [117] Dentro del citoplasma, los residuos de cisteína de las proteínas se almacenan en estado reducido (es decir, en forma -SH) por las tiorredoxinas . [118]
Esta propiedad se manifiesta en los siguientes ejemplos. La lisozima es lo suficientemente estable como para ser aplicada como fármaco. [119] Las plumas y el pelo tienen una resistencia relativa, y la queratina que contienen es considerada indigerible por la mayoría de los organismos. Sin embargo, hay hongos y bacterias que contienen queratinasa y son capaces de destruir la queratina.
Muchas enzimas celulares importantes utilizan grupos prostéticos que terminan con fracciones -SH para manejar reacciones que involucran sustancias bioquímicas que contienen acilo: dos ejemplos comunes del metabolismo básico son la coenzima A y el ácido alfa lipoico . [120] Los metabolitos relacionados con la cisteína, la homocisteína y la taurina , son otros aminoácidos que contienen azufre que son similares en estructura, pero no están codificados por el ADN , y no son parte de la estructura primaria de las proteínas, participan en varias ubicaciones de la fisiología de los mamíferos. [121] [122] Dos de las 13 vitaminas clásicas, la biotina y la tiamina , contienen azufre y sirven como cofactores para varias enzimas. [123] [124] En la química intracelular, el azufre opera como un portador de hidrógeno reductor y sus electrones para la reparación celular de la oxidación. El glutatión reducido , un tripéptido que contiene azufre, es un agente reductor a través de su fracción sulfhidrilo (–SH) derivada de la cisteína .
La metanogénesis , la ruta de la mayor parte del metano del mundo, es una transformación bioquímica de varios pasos del dióxido de carbono . Esta conversión requiere varios cofactores organosulfurados, entre ellos la coenzima M , CH 3 SCH 2 CH 2 SO−3, el precursor inmediato del metano . [125]
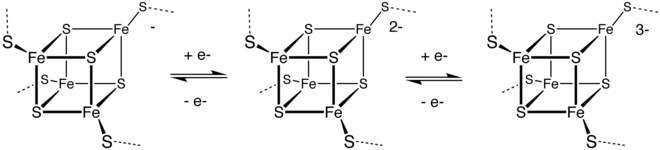
Las metaloproteínas, en las que el sitio activo es un ion de metal de transición (o un grupo de sulfuro de metal) a menudo coordinado por átomos de azufre de residuos de cisteína [126] , son componentes esenciales de las enzimas involucradas en los procesos de transferencia de electrones. Los ejemplos incluyen plastocianina (Cu 2+ ) y óxido nitroso reductasa (Cu–S). La función de estas enzimas depende del hecho de que el ion de metal de transición puede experimentar reacciones redox . Otros ejemplos incluyen muchas proteínas de zinc, [127] así como grupos de hierro-azufre . Las más omnipresentes son las ferrodoxinas , que sirven como lanzaderas de electrones en las células. En las bacterias, las importantes enzimas nitrogenasas contienen un grupo Fe–Mo–S y es un catalizador que realiza la importante función de fijación de nitrógeno , convirtiendo el nitrógeno atmosférico en amoníaco que puede ser utilizado por microorganismos y plantas para producir proteínas, ADN, ARN, alcaloides y otros compuestos orgánicos de nitrógeno necesarios para la vida. [128]
El azufre también está presente en el cofactor molibdeno . [129]
En los seres humanos, la metionina es un aminoácido esencial ; la cisteína es condicionalmente esencial y puede sintetizarse a partir de serina no esencial (en este caso, el donante de azufre sería la metionina). La deficiencia dietética rara vez ocurre en enfermedades comunes. Se intenta aplicar la deficiencia artificial de metionina en el tratamiento del cáncer, [130] pero el método sigue siendo potencialmente peligroso. [131]
La deficiencia aislada de sulfito oxidasa es una enfermedad genética rara y mortal que impide la producción de sulfito oxidasa , necesaria para metabolizar los sulfitos en sulfatos. [132]

Aunque el azufre elemental se absorbe mínimamente a través de la piel y tiene baja toxicidad para los seres humanos, la inhalación de polvo de azufre o el contacto con los ojos o la piel pueden causar irritación. La ingestión excesiva de azufre puede causar una sensación de ardor o diarrea [135] y se han reportado casos de acidosis metabólica potencialmente mortal después de que los pacientes consumieran deliberadamente azufre como remedio popular [136] [137]
Cuando el azufre se quema en el aire, produce dióxido de azufre . En el agua, este gas produce ácido sulfuroso y sulfitos; los sulfitos son antioxidantes que inhiben el crecimiento de bacterias aeróbicas y un aditivo alimentario útil en pequeñas cantidades. En altas concentraciones, estos ácidos dañan los pulmones , los ojos u otros tejidos . [138] En organismos sin pulmones, como los insectos, el sulfito en alta concentración impide la respiración . [139]
El trióxido de azufre (que se obtiene por catálisis a partir del dióxido de azufre) y el ácido sulfúrico son igualmente muy ácidos y corrosivos en presencia de agua. El ácido sulfúrico concentrado es un agente deshidratante potente que puede eliminar las moléculas de agua y los componentes del agua disponibles del azúcar y del tejido orgánico. [140]
La quema de carbón y/o petróleo por parte de la industria y las centrales eléctricas genera dióxido de azufre (SO2) que reacciona con el agua atmosférica y el oxígeno para producir ácido sulfuroso (H2SO3 ) . [ 141 ] Estos ácidos son componentes de la lluvia ácida , que reducen el pH del suelo y de los cuerpos de agua dulce, lo que a veces produce daños sustanciales al medio ambiente y la erosión química de estatuas y estructuras. Las normas sobre combustibles exigen cada vez más que los productores de combustible extraigan azufre de los combustibles fósiles para evitar la formación de lluvia ácida. Este azufre extraído y refinado representa una gran parte de la producción de azufre. En las centrales eléctricas a carbón, a veces se purifican los gases de combustión . Las centrales eléctricas más modernas que utilizan gas de síntesis extraen el azufre antes de quemarlo.
El sulfuro de hidrógeno es aproximadamente la mitad de tóxico que el cianuro de hidrógeno , e intoxica por el mismo mecanismo (inhibición de la enzima respiratoria citocromo oxidasa ), [142] aunque es menos probable que el sulfuro de hidrógeno cause envenenamientos repentinos por pequeñas cantidades inhaladas (cerca de su límite de exposición permisible (PEL) de 20 ppm) debido a su olor desagradable. [143] Sin embargo, su presencia en el aire ambiente en concentraciones superiores a 100-150 ppm adormece rápidamente el sentido del olfato, [144] y una víctima puede respirar cantidades cada vez mayores sin darse cuenta hasta que los síntomas graves causan la muerte. Las sales de sulfuro e hidrosulfuro disueltos son tóxicas por el mismo mecanismo.
{{cite journal}}: CS1 maint: DOI inactive as of August 2024 (link)Sigel, Astrid; Freisinger, Eva; Sigel, Roland K.O., eds. (2020). Transition Metals and Sulfur: A Strong Relationship for Life. Guest Editors Martha E Sosa Torres and Peter M.H.Kroneck. Berlin/Boston: de Gruyter. pp. xlv+455. ISBN 978-3-11-058889-7.