La biogeoquímica de isótopos de hidrógeno (HIBGC) es el estudio científico de los procesos biológicos, geológicos y químicos en el medio ambiente utilizando la distribución y abundancia relativa de los isótopos de hidrógeno . El hidrógeno tiene dos isótopos estables, protio 1 H y deuterio 2 H, que varían en abundancia relativa en el orden de cientos de permil . La relación entre estas dos especies puede denominarse firma isotópica de hidrógeno de una sustancia. La comprensión de las huellas isotópicas y las fuentes de fraccionamiento que conducen a la variación entre ellas se puede aplicar para abordar una amplia gama de preguntas que van desde la ecología y la hidrología hasta la geoquímica y las reconstrucciones paleoclimáticas . Dado que se requieren técnicas especializadas para medir la composición isotópica del hidrógeno natural (HIC), la HIBGC proporciona herramientas especializadas únicas para campos más tradicionales como la ecología y la geoquímica.
El estudio de los isótopos estables del hidrógeno comenzó con el descubrimiento del deuterio por el químico Harold Urey . [1] Aunque el neutrón no se descubrió hasta 1932, [2] Urey comenzó a buscar "hidrógeno pesado" en 1931. Urey y su colega George Murphy calcularon el corrimiento al rojo del hidrógeno pesado a partir de la serie de Balmer y observaron líneas muy débiles en un estudio espectrográfico . Para intensificar las líneas espectroscópicas para obtener datos publicables, Murphy y Urey se asociaron con Ferdinand Brickwedde y destilaron un grupo más concentrado de hidrógeno pesado, ahora llamado deuterio . Este trabajo sobre los isótopos del hidrógeno le valió a Urey el Premio Nobel de Química de 1934. [3]

También en 1934, los científicos Ernest Rutherford , Mark Oliphant y Paul Harteck produjeron el radioisótopo tritio (hidrógeno-3, 3 H) al golpear deuterio con núcleos de alta energía. El deuterio utilizado en el experimento fue un generoso regalo de agua pesada del físico de la UC Berkeley Gilbert N. Lewis . [4] El bombardeo de deuterio produjo dos isótopos no detectados previamente, helio-3 ( 3 He) y 3 H. Rutherford y sus colegas crearon con éxito 3 H, pero asumieron incorrectamente que 3 He era el componente radiactivo. El trabajo de Luis Walter Alvarez y Robert Cornog [5] aisló por primera vez 3 H y revirtió la noción incorrecta de Rutherford. Alvarez razonó que el tritio era radiactivo, pero no midió la vida media, aunque los cálculos en ese momento sugerían >10 años. Al final de la Segunda Guerra Mundial , el químico físico Willard Libby detectó la radiactividad residual de una muestra de tritio con un contador Geiger , [4] proporcionando una comprensión más precisa de la vida media , ahora aceptada como 12,3 años. [6]
El descubrimiento de los isótopos de hidrógeno también impactó a la física en la década de 1940, cuando se inventó por primera vez la espectroscopia de resonancia magnética nuclear . Los químicos orgánicos ahora usan la resonancia magnética nuclear (RMN) para mapear las interacciones de las proteínas [7] o identificar compuestos pequeños, [8] pero la RMN fue primero un proyecto apasionante de los físicos. Se descubrió que los tres isótopos del hidrógeno tenían propiedades magnéticas adecuadas para la espectroscopia de RMN. El primer químico en expresar completamente una aplicación de la RMN fue George Pake , quien midió el yeso ( ) como cristal y polvo. [9] La señal observada, llamada doblete de Pake , provenía de los hidrógenos magnéticamente activos en el agua. Luego, Pake calculó la longitud del enlace protón-protón . Las mediciones de RMN se revolucionaron aún más cuando las máquinas comerciales estuvieron disponibles en la década de 1960. Antes de esto, los experimentos de RMN implicaban construir proyectos masivos, ubicar imanes grandes y cablear a mano kilómetros de bobinas de cobre. [10] La RMN de protones siguió siendo la técnica más popular a lo largo de los avances en las décadas siguientes, pero 2 H y 3 H se utilizaron en otros sabores de la espectroscopia de RMN. 2 H tiene un momento magnético y un espín diferentes a los de 1 H, pero generalmente una señal mucho más pequeña. Históricamente, la RMN de deuterio es una alternativa pobre a la RMN de protones, pero se ha utilizado para estudiar el comportamiento de los lípidos en las membranas celulares . [11] Una variante de la RMN de 2 H llamada 2 H-SNIF ha demostrado potencial para comprender las composiciones de isótopos específicos de la posición y comprender las vías biosintéticas. [12] El tritio también se utiliza en RMN, [13] ya que es el único núcleo más sensible que 1 H, generando señales muy grandes. Sin embargo, la radiactividad del tritio desalentó muchos estudios de RMN de 3 H.
Aunque la radiactividad del tritio desalienta su uso en espectroscopia , el tritio es esencial para las armas nucleares . Los científicos comenzaron a comprender la energía nuclear ya en el siglo XIX, pero los grandes avances en los estudios de la bomba atómica se produjeron a principios de la década de 1940. Las investigaciones en tiempos de guerra, especialmente el Proyecto Manhattan , hicieron avanzar enormemente la comprensión de la radiactividad . El 3H es un subproducto de los reactores , resultado de golpear el litio-6 con neutrones , lo que produce casi 5 MeV de energía.

En las armas de fisión potenciadas, se calienta una mezcla de 2 H y 3 H hasta que se produce una fusión termonuclear para producir helio y neutrones libres . [14] Estos neutrones rápidos provocan entonces una mayor fisión, creando un "impulso". En 1951, en la Operación Greenhouse , un prototipo llamado George, validó la prueba de concepto para tal arma. [15] Sin embargo, la primera bomba de fisión potenciada verdadera, Greenhouse Item , se probó con éxito en 1952, dando un rendimiento de 45,5 kilotones, casi el doble que una bomba sin potencia. [15] Estados Unidos dejó de producir tritio en reactores nucleares en 1988, [16] pero las pruebas nucleares en la década de 1950 añadieron grandes picos de radionucleidos al aire, especialmente carbono-14 y 3 H. [17] [18] Esto complicó las mediciones para los geólogos que utilizaban la datación por carbono . Sin embargo, algunos oceanógrafos se beneficiaron del aumento de 3 H, utilizando la señal en el agua para rastrear la mezcla física de masas de agua. [19]
En biogeoquímica, los científicos se centraron principalmente en el deuterio como trazador de procesos ambientales, especialmente el ciclo del agua . El geoquímico estadounidense Harmon Craig , una vez estudiante de posgrado de Urey, descubrió la relación entre las proporciones de isótopos de hidrógeno y oxígeno del agua de lluvia . La correlación lineal entre los dos isótopos pesados se produce en todo el mundo y se denomina línea de agua meteórica global . [20] A fines de la década de 1960, el enfoque de los isótopos de hidrógeno se alejó del agua y se dirigió hacia las moléculas orgánicas . Las plantas usan agua para formar biomasa , pero un estudio de 1967 de Zebrowski, Ponticorvo y Rittenberg descubrió que el material orgánico en las plantas tenía menos 2 H que la fuente de agua. [21] La investigación de Zebrowski midió la concentración de deuterio de los ácidos grasos y aminoácidos derivados de los sedimentos en el proyecto de perforación Mohole . Estudios posteriores de Bruce Smith y Samuel Epstein en 1970 confirmaron el agotamiento de 2 H en los orgánicos en comparación con el agua ambiental. [22] En 1970, otro dúo, Schiegl y Vogel, analizaron el HIC a medida que el agua se convertía en biomasa, la biomasa en carbón y petróleo , y el petróleo en gas natural . [23] En cada paso, encontraron que el 2H se reducía aún más. Un artículo fundamental de 1980 de Marilyn Epstep, ahora M. Fogel, y Thomas Hoering titulado "Biogeoquímica de los isótopos estables de hidrógeno" refinó los vínculos entre los materiales orgánicos y las fuentes. [24]
En esta etapa temprana del estudio de isótopos estables de hidrógeno, la mayoría de las composiciones o fraccionamientos de isótopos se informaron como mediciones a granel de toda la materia orgánica o inorgánica . Algunas excepciones incluyen celulosa [25] [26] y metano [27] , ya que estos compuestos se separan fácilmente. Otra ventaja del metano para mediciones específicas de compuestos es la falta de intercambio de hidrógeno. La celulosa tiene hidrógeno intercambiable, pero la derivatización química puede prevenir el intercambio de hidrógeno de celulosa con agua o fuentes de hidrógeno mineral. Los estudios de celulosa y metano en los años 1970 y 1980 establecieron el estándar para la geoquímica moderna de isótopos de hidrógeno.
La medición de compuestos individuales se hizo posible a finales de los años 1990 y principios de los años 2000 con los avances en espectrometría de masas . [28] El Thermo Delta+XL transformó las mediciones como el primer instrumento capaz de realizar análisis de isótopos específicos de compuestos. Entonces fue posible observar muestras más pequeñas con más precisión. Las aplicaciones de isótopos de hidrógeno surgieron rápidamente en la geoquímica del petróleo midiendo el petróleo, la paleoclimatología observando biomarcadores de lípidos y la ecología construyendo dinámicas tróficas . Se están realizando avances en la composición de isótopos agrupados del metano [29] después del desarrollo del termómetro de carbonato . [30] [31] Las mediciones precisas también están permitiendo centrarse en las vías biosintéticas microbianas que involucran hidrógeno. [32] Los ecólogos que estudian los niveles tróficos están especialmente interesados en mediciones específicas de compuestos para reconstruir dietas pasadas y rastrear relaciones depredador-presa. [33] Las máquinas altamente avanzadas ahora prometen análisis de isótopos de hidrógeno específicos de la posición de biomoléculas y gas natural . [34]
Todos los isótopos de un elemento tienen el mismo número de protones y un número variable de neutrones. El hidrógeno tiene tres isótopos naturales: 1 H, 2 H y 3 H, llamados protio (H), deuterio (D) y tritio (T), respectivamente. Tanto el 1 H como el 2 H son estables, mientras que el 3 H es inestable y sufre una desintegración beta en 3 He. Si bien el 3 H tiene algunas aplicaciones importantes en geoquímica (como su uso como trazador de la circulación oceánica ), no se analizarán más en profundidad aquí.
El estudio de la biogeoquímica de isótopos estables implica la descripción de las abundancias relativas de varios isótopos en un determinado grupo químico, así como la forma en que los procesos fisicoquímicos cambian la fracción de esos isótopos en un grupo en comparación con otro. Se han desarrollado varios tipos de notación para describir la abundancia y el cambio en la abundancia de isótopos en estos procesos, y estos se resumen a continuación. En la mayoría de los casos, solo las cantidades relativas de un isótopo son de interés; la concentración absoluta de cualquier isótopo tiene poca importancia.
La descripción más fundamental de los isótopos de hidrógeno en un sistema es la abundancia relativa de 2 H y 1 H. Este valor se puede expresar como relación isotópica 2 R o abundancia fraccional 2 F, definida como:
y
donde x H es la cantidad de isótopo x H. La abundancia fraccionaria es equivalente a la fracción molar y produce el porcentaje de átomos cuando se multiplica por 100. En algunos casos se utiliza el exceso de porcentaje de átomos, que informa el porcentaje de átomos de una muestra menos el porcentaje de átomos de un estándar.
Las proporciones isotópicas de una sustancia se suelen comunicar en comparación con un estándar con composición isotópica conocida, y las mediciones de masas relativas siempre se realizan junto con la medición de un estándar. Para el hidrógeno, se utiliza el estándar de agua oceánica media de Viena , que tiene una proporción isotópica de 155,76 ± 0,1 ppm. El valor delta en comparación con este estándar se define como:
Estos valores delta suelen ser bastante pequeños y normalmente se informan como valores por mil (‰) que surgen de multiplicar la ecuación anterior por un factor de 1000.
El estudio de HIBGC se basa en el hecho de que varios procesos fisicoquímicos enriquecen o agotan preferentemente 2 H en relación con 1 H (véase efecto isotópico cinético [EIC], etc.). Se han desarrollado varias medidas para describir el fraccionamiento de un isótopo entre dos depósitos, a menudo el producto y el reactivo de un proceso fisicoquímico. La notación α describe la diferencia entre dos depósitos de hidrógeno A y B con la ecuación:
donde δ 2 H A es el valor delta del pool A en relación con VSMOW. Como muchos valores delta no varían mucho entre sí, el valor α suele ser muy cercano a la unidad. A menudo se utiliza una medida relacionada llamada épsilon (ε), que se expresa simplemente mediante:
Estos valores suelen ser muy cercanos a cero y se expresan como valores por mil, multiplicando α − 1 por 1000. Una medida final es Δ, que se pronuncia "cap delta", que es simplemente:
2 H y 1 H son isótopos estables. Por lo tanto, la relación 2 H/ 1 H de un depósito que contiene hidrógeno permanece constante mientras no se añada ni se elimine hidrógeno, una propiedad conocida como conservación de la masa . Cuando dos depósitos de hidrógeno A y B se mezclan con cantidades molares de hidrógeno m A y m B , cada uno con su propia abundancia fraccional inicial de deuterio ( F A y F B ), entonces la abundancia fraccional de la mezcla resultante viene dada por la siguiente ecuación exacta:
Los términos con Σ representan los valores de los depósitos combinados. La siguiente aproximación se utiliza a menudo para los cálculos relativos a la mezcla de dos depósitos con una composición isotópica conocida:
Esta aproximación es conveniente y aplicable con poco error en la mayoría de las aplicaciones que tienen que lidiar con depósitos de hidrógeno de procesos naturales. La diferencia máxima entre el valor delta ( δ ) calculado con las ecuaciones aproximadas y exactas viene dada por la siguiente ecuación:
Este error es bastante pequeño para casi todas las mezclas de valores isotópicos naturales, incluso para el hidrógeno, que puede tener variaciones naturales bastante grandes en los valores δ. [35] La estimación generalmente se evita cuando se encuentran valores δ anormalmente grandes, lo que es especialmente común en los experimentos de etiquetado isotópico .
Los procesos naturales dan lugar a amplias variaciones en la relación D/H (DHR) en diferentes depósitos de hidrógeno. Los KIE y los cambios físicos como la precipitación y la evaporación conducen a estas variaciones observadas. El agua de mar varía ligeramente, entre 0 y −10 por mil, mientras que el agua atmosférica puede variar entre aproximadamente −200‰ y +100‰. Las biomoléculas sintetizadas por los organismos conservan parte de la firma D/H del agua en la que crecieron, además de un gran factor de fraccionamiento que puede ser de varios cientos de ‰. Se pueden encontrar grandes diferencias D/H, de miles de ‰, entre la Tierra y otros cuerpos planetarios como Marte, probablemente debido a las variaciones en el fraccionamiento de isótopos durante la formación de los planetas y la pérdida de hidrógeno en el espacio.
Una serie de procesos comunes fraccionan los isótopos de hidrógeno para producir las variaciones isotópicas que se encuentran en la naturaleza. Los procesos físicos comunes incluyen la precipitación y la evaporación. Las reacciones químicas también pueden influir en gran medida en la partición de isótopos pesados y ligeros entre grupos. La velocidad de una reacción química depende en parte de las energías de los enlaces químicos formados y rotos en la reacción. Dado que los diferentes isótopos tienen diferentes masas, las energías de enlace difieren entre los isotólogos de una especie química. Esto dará como resultado una diferencia en la velocidad de una reacción para los diferentes isotólogos, lo que dará como resultado un fraccionamiento de los diferentes isótopos entre el reactivo y el producto en una reacción química. Esto se conoce como el efecto isotópico cinético (EIC). Un ejemplo clásico de EIC es la diferencia de DHR en el equilibrio entre H 2 O y H 2 que puede tener un valor α de hasta 3-4. [36]
En muchas áreas de estudio, el origen de una sustancia química o un grupo de sustancias químicas es de importancia central. Cuestiones como la fuente de los contaminantes ambientales, el origen de las hormonas en el cuerpo de un atleta o la autenticidad de los alimentos y los aromas son ejemplos en los que es necesario identificar y obtener compuestos químicos. Los isótopos de hidrógeno se han utilizado en estas y muchas otras áreas de estudio. Dado que muchos procesos pueden afectar a la DHR de un compuesto determinado, esta relación puede ser una señal diagnóstica para los compuestos producidos en un lugar específico o mediante un proceso determinado. Una vez que se conocen las DHR de varias fuentes, la medición de esta relación para una muestra de origen desconocido a menudo se puede utilizar para vincularla a una fuente o método de producción determinados.
1 H, con un protón y ningún neutrón , es el nucleido más abundante en el Sistema Solar , formado en las primeras rondas de explosiones estelares después del Big Bang . [37] Después de que el universo explotó a la vida, la nube caliente y densa de partículas comenzó a enfriarse, primero formando partículas subatómicas como quarks y electrones , que luego se condensaron para formar protones y neutrones . Los elementos más grandes que el hidrógeno y el helio se produjeron con estrellas sucesivas, formándose a partir de la energía liberada durante las supernovas .
También se sabe que el deuterio , 2 H, con un protón y un neutrón, tiene origen cósmico. Al igual que el protio, el deuterio se produjo muy temprano en la historia del universo, durante la nucleosíntesis del Big Bang (BBN). A medida que los protones y los neutrones se combinaban, se produjo helio-4 con un intermediario deuterio. Las reacciones alfa con 4 He producen muchos de los elementos más grandes que dominan el Sistema Solar actual. Sin embargo, antes de que el universo se enfriara, los fotones de alta energía destruyeron todo el deuterio, impidiendo la formación de elementos más grandes. Esto se llama el cuello de botella del deuterio , una restricción en la línea de tiempo para la nucleosíntesis . Todo el deuterio actual se originó a partir de esta fusión protón-protón después de un enfriamiento suficiente. [38]
El tritio , 3 H, con un protón y dos neutrones, también se produjo por colisiones de protones y neutrones en el universo primitivo, pero desde entonces se ha desintegrado radiactivamente en helio-3 . El tritio actual no puede proceder de BBN, debido a su corta vida media , 12,3 años. La concentración actual de 3 H está gobernada por las reacciones nucleares y los rayos cósmicos . La desintegración beta del 3 H en 3 He libera un electrón y un antineutrino, y unos 18 keV de energía. Se trata de una desintegración de baja energía, por lo que la radiación no puede penetrar la piel. Por tanto, el tritio solo es peligroso si se ingiere o inhala directamente. [39]
1 H es una partícula subatómica de espín 1/2 y, por lo tanto, un fermión . Otros fermiones incluyen neutrones , electrones y tritio. Los fermiones se rigen por el principio de exclusión de Pauli , donde no pueden existir dos partículas con el mismo número cuántico . [40] [41] Sin embargo, los bosones como el deuterio y los fotones no están limitados por la exclusión y múltiples partículas pueden ocupar el mismo estado energético. Esta diferencia fundamental entre 1 H y 2 H se manifiesta en muchas propiedades físicas. Las partículas con espín entero como el deuterio siguen la estadística de Bose-Einstein, mientras que los fermiones con espines semienteros siguen la estadística de Fermi-Dirac . Las funciones de onda que describen múltiples fermiones deben ser antisimétricas con respecto a las partículas que se intercambian, mientras que las funciones de onda de los bosones son simétricas. [42] Debido a que los bosones son indistinguibles y pueden ocupar el mismo estado, las colecciones de bosones se comportan de manera muy diferente a los fermiones a temperaturas más frías. A medida que los bosones se enfrían y se relajan hasta el estado de energía más bajo, ocurren fenómenos como la superfluidez y la superconductividad . [43]
Los isótopos difieren en el número de neutrones , lo que afecta directamente las propiedades físicas basadas en la masa y el tamaño. El hidrógeno normal (protio, 1 H) no tiene neutrón. El deuterio ( 2 H) tiene un neutrón y el tritio ( 3 H) tiene dos. Los neutrones agregan masa al átomo, lo que genera diferentes propiedades físicas químicas . Este efecto es especialmente fuerte para los isótopos de hidrógeno, ya que el neutrón agregado duplica la masa de 1 H a 2 H. Para elementos más pesados como el carbono , el nitrógeno , el oxígeno o el azufre , la diferencia de masa se diluye.
Los químicos físicos a menudo modelan el enlace químico con el oscilador armónico cuántico (QHO), simplificando un enlace hidrógeno-hidrógeno como dos bolas conectadas por un resorte. [41] [44] El QHO se basa en la ley de Hooke y es una buena aproximación del potencial de Morse que describe con precisión el enlace. Modelar H/ 2 H en una reacción química demuestra las distribuciones de energía de los isótopos en productos y reactivos. Los niveles de energía más bajos para el isótopo más pesado 2 H se pueden explicar matemáticamente por la dependencia del QHO de la inversa de la masa reducida μ. Por lo tanto, una masa reducida mayor es un denominador mayor y, por lo tanto, una energía de punto cero menor y un estado de energía menor en el pozo cuántico .

Calculando la masa reducida de un enlace 1H– 1H versus un enlace 2H– 2H obtenemos :
El oscilador armónico cuántico tiene niveles de energía de la siguiente forma, donde k es la constante del resorte y h es la constante de Planck. [41]
Los efectos de esta distribución de energía se manifiestan en el efecto isotópico cinético (KIE) y el efecto isotópico de equilibrio . [45] En una reacción reversible , en condiciones de equilibrio, la reacción avanza hacia adelante y hacia atrás, distribuyendo los isótopos para minimizar la energía libre termodinámica. Algún tiempo después, en el equilibrio, habrá más isótopos pesados en el lado del producto. La estabilidad de la energía más baja impulsa a los productos a enriquecerse en 2 H en relación con los reactivos. Por el contrario, en condiciones cinéticas, las reacciones son generalmente irreversibles. El paso limitante en la reacción es superar la barrera de energía de activación para alcanzar un estado intermedio. El isótopo más ligero tiene un estado de energía más alto en el pozo cuántico y, por lo tanto, se formará preferentemente en productos. Por lo tanto, en condiciones cinéticas, el producto estará relativamente empobrecido en 2 H.
Los KIE son comunes en los sistemas biológicos y son especialmente importantes para HIBGC. Los KIE suelen dar lugar a fraccionamientos mayores que las reacciones de equilibrio. En cualquier sistema isotópico, los KIE son más fuertes para diferencias de masa mayores. Los isótopos ligeros en la mayoría de los sistemas también tienden a moverse más rápido pero forman enlaces más débiles. A alta temperatura, la entropía explica una gran señal en la composición isotópica. Sin embargo, cuando la temperatura disminuye, los efectos isotópicos se expresan más y la aleatoriedad juega un papel menos importante. Estas tendencias generales se exponen para una mayor comprensión de la ruptura de enlaces, la difusión o efusión y las reacciones de condensación o evaporación .
Una de las principales complicaciones en el estudio de los isótopos de hidrógeno es la cuestión de la intercambiabilidad. En muchas escalas de tiempo, que van desde horas hasta épocas geológicas, los científicos tienen que considerar si las fracciones de hidrógeno en las moléculas estudiadas son las especies originales o si representan un intercambio con agua o hidrógeno mineral cercano. La investigación en esta área aún no es concluyente en lo que respecta a las tasas de intercambio, pero en general se entiende que el intercambio de hidrógeno complica la conservación de la información en los estudios de isótopos.
Los átomos de hidrógeno se separan fácilmente de los enlaces electronegativos , como los enlaces hidroxilo (O–H), los enlaces de nitrógeno (N–H) y los enlaces tiol / mercapto (S–H), en escalas de tiempo que van desde una hora hasta un día. Este intercambio rápido es particularmente problemático para las mediciones de materia orgánica a granel con estos grupos funcionales , porque las composiciones isotópicas tienen más probabilidades de reflejar el agua de origen y no el efecto isotópico. Por lo tanto, los registros del paleoclima que no miden aguas antiguas se basan en otros marcadores isotópicos. Los avances de la década de 1990 ofrecían un potencial prometedor para resolver este problema: se equilibraron las muestras con dos variaciones de agua pesada y se compararon. Sus proporciones representan un factor de intercambio que puede calibrar las mediciones para corregir el intercambio H/ 2H . [46]
Durante algún tiempo, los investigadores creyeron que las grandes moléculas de hidrocarburos eran inmunes al intercambio de hidrógeno, pero trabajos recientes han identificado muchas reacciones que permiten la reordenación de isótopos. El intercambio isotópico se vuelve relevante a escalas de tiempo geológicas y ha impactado el trabajo de los biólogos que estudian los biomarcadores lipídicos y de los geólogos que estudian el petróleo antiguo. Las reacciones responsables del intercambio incluyen [46] [47]

No se ha determinado la cinética detallada de estas reacciones. Sin embargo, se sabe que los minerales arcillosos catalizan el intercambio de hidrógeno iónico más rápido que otros minerales. [48] Por lo tanto, los hidrocarburos formados en entornos clásticos intercambian más que los de entornos carbonatados . El hidrógeno aromático y terciario también tienen mayores tasas de intercambio que el hidrógeno primario. Esto se debe a la creciente estabilidad de los carbocationes asociados . [49] Los carbocationes primarios se consideran demasiado inestables para existir y nunca se han aislado en un espectrómetro FT-ICR . [50] Por otro lado, los carbocationes terciarios son relativamente estables y a menudo son intermediarios en las reacciones de química orgánica . Esta estabilidad, que aumenta la probabilidad de pérdida de protones, se debe a la donación de electrones de los átomos de carbono cercanos. La resonancia y los pares solitarios cercanos también pueden estabilizar los carbocationes a través de la donación de electrones . Los carbonos aromáticos son, por tanto, relativamente fáciles de intercambiar.
Muchas de estas reacciones tienen una fuerte dependencia de la temperatura; una temperatura más alta típicamente acelera el intercambio. Sin embargo, pueden prevalecer diferentes mecanismos en cada ventana de temperatura. El intercambio iónico , por ejemplo, es más significativo a baja temperatura. En tales entornos de baja temperatura, existe el potencial de preservar la señal isotópica original del hidrógeno durante cientos de millones de años. [51] Sin embargo, muchas rocas en el tiempo geológico han alcanzado una madurez térmica significativa . Incluso para el inicio de la ventana del petróleo, parece que gran parte del hidrógeno se ha intercambiado. Recientemente, los científicos han explorado un lado positivo: el intercambio de hidrógeno es una reacción cinética de orden cero (para el hidrógeno unido al carbono a 80-100 °C, los tiempos medios son probablemente 10 4 –10 5 años). [51] La aplicación de las matemáticas de las constantes de velocidad permitiría la extrapolación a las composiciones isotópicas originales. Si bien esta solución es prometedora, hay demasiado desacuerdo en la literatura para realizar calibraciones robustas.
Los efectos de los isótopos de vapor se producen para 1 H, 2 H y 3 H, ya que cada isótopo tiene diferentes propiedades termodinámicas en las fases líquida y gaseosa. [52] En el caso del agua, la fase condensada está más enriquecida, mientras que el vapor está más empobrecido. Por ejemplo, la lluvia que se condensa a partir de una nube es más pesada que el punto de partida del vapor. En general, las grandes variaciones en la concentración de deuterio en el agua se deben a fraccionamientos entre depósitos líquidos, de vapor y sólidos. En contraste con el patrón de fraccionamiento del agua, las moléculas no polares, como los aceites y los lípidos, tienen contrapartes gaseosas enriquecidas con deuterio en relación con el líquido. [28] Se cree que esto está asociado con la polaridad de los enlaces de hidrógeno en el agua que no interfieren en los hidrocarburos de cadena larga.

Debido a los procesos de fraccionamiento físico y químico, se informan las variaciones en las composiciones isotópicas de los elementos, y los pesos atómicos estándar de los isótopos de hidrógeno han sido publicados por la Comisión de Pesos Atómicos y Abundancias Isotópicas de la IUPAC . Los HIC se informan en relación con el agua de referencia del Organismo Internacional de Energía Atómica (OIEA). En las reacciones isotópicas de equilibrio de H/ 2 H en general, se observa un enriquecimiento del isótopo pesado en el compuesto con el estado de oxidación más alto . Sin embargo, en nuestro entorno natural, el HIC varía mucho dependiendo de las fuentes y los organismos debido a las complejidades de los elementos que interactúan en estados de desequilibrio. En esta sección, se describen las variaciones observadas en el HIC de las fuentes de agua (hidrosfera), los organismos vivos (biosfera), las sustancias orgánicas (geosfera) y los materiales extraterrestres en el sistema solar.

Se observan variaciones en δD de diferentes fuentes de agua y capas de hielo debido a los procesos de evaporación y condensación . (Ver sección 6 para más detalles.) Cuando el agua de mar está bien mezclada, el δD en equilibrio está cerca de 0‰ (‰ SMOW) con un DHR de 155,76 ppm. Sin embargo, las variaciones continuas en δD son causadas por procesos de evaporación o precipitación que conducen al desequilibrio en los procesos de fraccionamiento. Un gran gradiente de HIC ocurre en las aguas superficiales de los océanos, y el valor de fluctuación en el agua superficial del Atlántico Noroeste es de alrededor de 20‰. Según los datos que examinan el supersegmento sur del Océano Pacífico , a medida que la latitud disminuye de 65˚S a 40˚S, δD fluctúa entre alrededor de −50‰ y −70‰. [54]
El índice de convección hidrotermal (HIC) del agua de mar (no solo del agua superficial) se encuentra en su mayoría en el rango de 0‰ a -10‰. Las estimaciones de δD para diferentes partes del océano en todo el mundo se muestran en el mapa. [55]

Los valores típicos de δD para las capas de hielo en las regiones polares varían de alrededor de −400‰ a −300‰ (‰SMOW). [57] Los valores de δD de los casquetes polares se ven afectados por la distancia al océano abierto, la latitud, la circulación atmosférica y la cantidad de insolación y temperatura. El cambio de temperatura afecta el HIC de los casquetes polares, por lo que el HIC del hielo puede proporcionar estimaciones de los ciclos climáticos históricos, como las líneas de tiempo de los períodos interglaciares y glaciales . [Véase la sección 7.2. Paleo-reconstrucción para más detalles]
Los δD de los casquetes polares a 70 km al sur de la estación Vostok y en la Antártida Oriental son -453,7‰ y -448,4‰ respectivamente, y se muestran en el mapa. [58]

El análisis realizado a partir de datos de mediciones satelitales estima el δD del aire en varias partes del mundo. La tendencia general es que el δD es más negativo a mayor latitud, por lo que el aire sobre la Antártida y el Ártico presenta un nivel de D de entre -230‰ y -260‰ o incluso menos.
Los δD atmosféricos estimados se muestran en el mapa. [60]
Una gran parte del vapor de agua atmosférico global proviene del Pacífico occidental cerca de los trópicos (media 2009) y el HIC del aire depende de la temperatura y la humedad. Las regiones cálidas y húmedas generalmente tienen un δD más alto. [61] El vapor de agua en el aire está en general más agotado que las fuentes de agua terrestres, ya que el 1 H 2 16 O se evapora más rápido que el 1 H 2 H 16 O debido a una mayor presión de vapor. Por otro lado, el agua de lluvia está en general más enriquecida que el vapor de agua atmosférico. [62] [63]

En el mapa se muestran los valores de δD de la precipitación anual en diferentes regiones del mundo. [65] La precipitación es más rica en D cerca del ecuador en los trópicos . Los valores de δD generalmente se encuentran en el rango de alrededor de -30 ~ -150‰ en el hemisferio norte y -30~+30‰ en las áreas terrestres del hemisferio sur. En América del Norte, el δD de la precipitación mensual promedio en todas las regiones es menor en enero (hasta alrededor de -300‰ en Canadá) que en julio (hasta alrededor de -190‰). [65]
La precipitación media general está determinada por el equilibrio entre la evaporación del agua de los océanos y otras aguas superficiales y la condensación del vapor de agua en forma de lluvia. La evaporación neta debe ser igual a la precipitación neta, y el δD para la precipitación es de alrededor de −22‰ (promedio global). [66] La Red Global de Isótopos en Precipitación (GNIP) investiga y monitorea la composición isotópica de la precipitación en varios sitios en todo el mundo. La precipitación media puede estimarse mediante la ecuación, δ 2 H = 8,17(±0,07) δ 18 O + 11,27(±0,65)‰ VSMOW. (Rozanski et al., 1993) Esta ecuación es una versión ligeramente modificada de la ecuación general de la línea global de agua meteórica (GMWL), δ 2 H = 8,13δ 18 O + 10,8, que proporciona la relación promedio entre δ 2 H y δ 18 O de las aguas terrestres naturales. [66] [67]

En el mapa se muestran los δDs frente a VSMOW de lagos en diferentes regiones. [69] El patrón general observado indica que los δDs de las aguas superficiales, incluidos lagos y ríos, son similares a los de la precipitación local. [70]
La composición isotópica del suelo está controlada por la entrada de la precipitación . Por lo tanto, el δD del suelo es similar al de la precipitación local. Sin embargo, debido a la evaporación, el suelo tiende a estar más enriquecido con D que la precipitación. El grado de enriquecimiento varía mucho dependiendo de la humedad atmosférica, la temperatura local y la profundidad del suelo debajo de la superficie. Según el estudio de Meinzer et al. (1999), a medida que aumenta la profundidad del suelo, el δD del agua del suelo disminuye. [70]
Los factores que afectan el δD de los lípidos de las algas son: δD del agua, especie de alga (hasta 160%), tipo de lípido (hasta 170%), salinidad (+0,9 ± 0,2% por PSU), tasa de crecimiento (0 ~ −30% por día) y temperatura (−2 ~ −8% por °C).
En un estudio de Zhang et al. (2009), los δD de los ácidos grasos en cultivos quimiostatizados de Thalassiosira pseudonana fueron −197,3‰, −211,2‰ y −208,0‰ para los ácidos grasos C14, C16 y C18 respectivamente. El δD del ácido graso C16 en las algas A. e. unicocca a 25°C, se determinó utilizando la ecuación empírica y = 0,890 x − 91,730, donde x es el δD del agua en la cosecha. Para otra especie de alga, B. v. aureus , la ecuación fue y = 0,869 x − 74,651. [71]
El grado de fraccionamiento D/H en la mayoría de los lípidos de las algas aumenta con el aumento de la temperatura y disminuye con el aumento de la salinidad. Las tasas de crecimiento tienen diferentes impactos en el fraccionamiento D/H según los tipos de especies. [72]
El δD de los lípidos del fitoplancton se ve afectado en gran medida por el δD del agua, y parece haber una correlación lineal entre esos dos valores. El δD de la mayoría de los demás productos biosintéticos del fitoplancton o las cianobacterias es más negativo que el del agua circundante. [73] Los valores de δD de los ácidos grasos en los metanótrofos que viven en el agua de mar se encuentran entre −50 y −170‰, y los de los esteroles y hopanoles varían entre −150 y −270‰. [74] [75]
El HIC de los fotoautótrofos se puede estimar utilizando la ecuación,
donde R l , R w y R s son los DHR de lípidos, agua y sustratos, respectivamente. X w es la fracción molar del lípido H derivado del agua externa, mientras que α l/w y α l/s denotan los fraccionamientos isotópicos netos asociados con la captación y utilización de agua e hidrógeno del sustrato, respectivamente.
Para los fotótrofos , R l se calcula asumiendo que X w = 1. El fraccionamiento isotópico entre lípidos y metano ( α l/m ) es 0,94 para ácidos grasos y 0,79 para lípidos isoprenoides. El fraccionamiento isotópico entre lípidos y agua ( α l/w ) es 0,95 para ácidos grasos y 0,85 para lípidos isoprenoides. Para plantas y algas , el fraccionamiento isotópico entre lípidos y metano ( α l/m ) es 0,94 para ácidos grasos y 0,79 para lípidos isoprenoides. [74]
Fuente: [71]

Los δDs para el alcano nC 29 (‰) frente a VSMOW para diferentes grupos de plantas son los siguientes. Aquí, representa δDs para el alcano nC 29 (‰) frente a VSMOW, y representa δDs para la precipitación media anual (‰) frente a VSMOW). [76]
En el caso de la cera de las hojas de las plantas , la humedad relativa, el momento de formación de la cera de las hojas y las condiciones de crecimiento, incluidos los niveles de luz, afectan la fracción D/H de la cera de las plantas. A partir del modelo de Craig-Gordon, se puede entender que el agua de las hojas en los gases de la cámara de crecimiento está significativamente enriquecida con D debido a la transpiración. [77]
La abundancia global de 2 H en las plantas se encuentra en el siguiente orden: fenilpropanoides > carbohidratos > material a granel > lípidos hidrolizables > esteroides. [78] En las plantas, los δD de los carbohidratos, que normalmente oscilan entre −70‰ y −140‰, son buenos indicadores del metabolismo fotosintético. El hidrógeno producido fotosintéticamente que está unido a las cadenas principales de carbono está ~100‰–170‰ más empobrecido en D que el agua en los tejidos vegetales.
El procesamiento heterotrófico de carbohidratos implica la isomerización de triosas fosfatos y la interconversión entre fructosa-6-fosfato y glucosa-6-fosfato . Estos procesos celulares promueven el intercambio entre H orgánico y H 2 O dentro de los tejidos vegetales, lo que lleva a un enriquecimiento de D de alrededor del 158‰ de esos sitios intercambiados. [79] El δD de plantas C 3 como la remolacha azucarera , la naranja y la uva varía de −132‰ a −117‰, y el de plantas C 4 como la caña de azúcar y el maíz varía de −91‰ a −75‰. El δD del metabolismo ácido de las crasuláceas (CAM) como la piña se estima en alrededor de −75‰. [78] La remolacha azucarera y la caña de azúcar contienen sacarosa, y el maíz contiene glucosa. La naranja y la piña son fuentes de glucosa y fructosa .
El contenido de deuterio de los azúcares de las especies vegetales mencionadas anteriormente no es distintivo. En las plantas C3 , el hidrógeno unido a los carbonos en las posiciones 4 y 5 de la glucosa proviene típicamente del NADPH en la vía fotosintética, y se ha descubierto que está más enriquecido con D. Mientras que en las plantas C4 , el hidrógeno unido a los carbonos en las posiciones 1 y 6 está más enriquecido con D. Los patrones de enriquecimiento de D en las especies CAM tienden a ser más cercanos a los de las especies C3 . [ 80]
El HIC del agua de la hoja es variable durante la biosíntesis, y el enriquecimiento en toda la hoja se puede describir mediante la ecuación, △D hoja = △D e × ([1 − e −p ]/P) [81] [76]
El δD típico de la planta a granel es de alrededor de -160‰, mientras que los δD para la celulosa y la lignina son -110‰ y -70‰ respectivamente. [78]
La HIC en los tejidos animales es difícil de estimar debido a las complejidades de la ingesta dietética y la composición isotópica de las fuentes de agua circundantes. Cuando se investigaron las especies de peces, la HIC promedio de las proteínas se encontraba en un amplio rango de −128‰ ~ +203‰. En el tejido en masa de los organismos, se encontró que todos los lípidos estaban depletados de D, y los valores de δD para los lípidos tienden a ser más bajos que los de las proteínas. Se estimó que el δD promedio para las proteínas de quironómidos y peces se encontraba en el rango de −128‰ a +203‰. [82]
La mayor parte del hidrógeno presente en los tejidos heterotróficos proviene del agua, no de la dieta, pero la proporción que proviene del agua varía. En general, el hidrógeno del agua se transfiere al NADPH y luego se lleva hasta los tejidos. Se puede observar un efecto trófico aparente (efecto de composición) para δD en los heterótrofos, por lo que se producen enriquecimientos significativos de D a partir de la ingesta de agua circundante en las redes alimentarias acuáticas. En algunos casos, la δD de las proteínas en los tejidos animales se ve afectada más por las fuentes de la dieta que por el agua circundante. [82]
Aunque pueden surgir diferentes δD para la misma clase de compuestos en diferentes organismos que crecen en agua con el mismo δD, esos compuestos generalmente tienen el mismo δD dentro de cada organismo. [Ver Sección 7.5. Ecología para más detalles]
Los δD de los ácidos grasos en los organismos vivos suelen ser de −73‰ a −237‰. Los δD de los ácidos grasos individuales varían ampliamente entre cultivos (−362‰ a +331‰), pero normalmente en menos de alrededor del 30‰ entre diferentes ácidos grasos de la misma especie. [71]
Las diferencias en δD para los compuestos dentro de la misma clase de lípidos son generalmente menores al 50‰, mientras que la diferencia cae en el rango de 50‰–150‰ para los compuestos en diferentes clases de lípidos. [71]
Los δD para grupos lipídicos típicos se determinan utilizando la siguiente ecuación:
Los lípidos poliisoprenoides están más agotados que los lípidos acetogénicos (n-alquilo) con δD más negativos.
Fuente: [83]

La composición isotópica de las alquenonas a menudo refleja el enriquecimiento o agotamiento isotópico del entorno circundante, y los δD de las alquenonas en diferentes regiones se muestran en el mapa. [87] [88]

Fuente: [90]
Según los estudios de Reddings et al., los δDs para carbones de diversas fuentes varían entre aproximadamente −90‰ y −170‰. [91]
Los δD de los carbones en diferentes regiones se muestran en el mapa. [92] [93]
Fuente: [94]
El metano producido por metanógenos marinos suele estar más enriquecido con D que el metano producido por metanógenos cultivados en agua dulce. Los δD para el metano termogénico varían de -275‰ a -100‰, y de -400‰ a -150‰ para el metano microbiano . [95]
El δD del H 2 atmosférico es de alrededor de +180‰, el δD más alto conocido para los materiales terrestres naturales (fracción molar de 2 H: 183,8 ppm). El δD del gas natural de un pozo de Kansas es de alrededor de −836‰ (fracción molar de 2 H: 25,5 ppm) [96]
En la electrólisis del agua , se produce gas hidrógeno en el cátodo, pero la electrólisis incompleta del agua puede causar un fraccionamiento isotópico que conduce al enriquecimiento de 2 H en la muestra de agua y a la producción de gas hidrógeno con componentes de deuterio.

Los δDs de los minerales que contienen hidroxilo del manto se estimaron en -80‰ ~ -40‰ mediante el análisis de la composición isotópica del agua juvenil. Los minerales de hidrógeno generalmente tienen grandes efectos isotópicos y la composición isotópica a menudo sigue el patrón observado para la precipitación.
Las fraccionaciones D/H en arcillas como caolinita, illita y esmectita son en la mayoría de los casos consistentes cuando no se aplican fuerzas externas significativas bajo temperatura y presión constantes.
La siguiente es una ecuación determinada empíricamente para estimar el factor de fraccionamiento D/H: 1000 In α caolinita-agua = −2,2 × 10 6 × T −2 − 7,7. [98]
En la tabla se muestran los δDs frente a ‰SMOW para los minerales de hidrógeno que se encuentran en el manto , rocas metamórficas , pizarras , arcillas marinas , carbonatos marinos y rocas sedimentarias . [57]
Variaciones de DHR en el Sistema Solar [99]

Las DHR de Júpiter y Saturno son casi del orden de 10 −5 , y las DHR de Urano y Neptuno están más cerca de 10 −4 . [102]
El hidrógeno es el elemento más abundante en el universo. Las variaciones en la composición isotópica de los materiales extraterrestres se deben a la acreción planetaria u otros procesos planetarios como el escape atmosférico , y son mayores para el H y el N que para el C y el O. La preservación del enriquecimiento de D se observa en meteoritos condríticos , partículas de polvo interplanetarias y volátiles cometarios .
A partir de los datos de abundancia de isótopos de helio , se estima que la DHR cósmica es de alrededor de 20 ppm: mucho menor que la DHR terrestre de 150 ppm. El enriquecimiento de D/H a partir del reservorio protosolar ocurre en la mayoría de los planetas, excepto en Júpiter y Saturno, los planetas gaseosos masivos. Las DHR de las atmósferas de Venus y Marte son ~2 × 10 −2 y ~8 × 10 −4 respectivamente. Las DHR de Urano y Neptuno son mayores que las del reservorio protosolar por un factor de ~3 debido a sus núcleos helados ricos en deuterio. Las DHR de los cometas son mucho mayores que los valores de los planetas del Sistema Solar con δD de alrededor de 1000‰. [103]
Los HIC en la galaxia y el Sistema Solar se muestran en la tabla.
La DHR se puede determinar con una combinación de diferentes técnicas de preparación e instrumentos para diferentes propósitos. Existen varios tipos de medición de HIC: (i) primero se convierte el hidrógeno orgánico o el agua en H 2 , seguido de una medición de alta precisión por espectrometría de masas de relación isotópica (IRMS); (ii) 2 H/ 1 H y 18 O/ 16 O se miden directamente como H 2 O mediante espectroscopia láser también con alta precisión; (iii) las moléculas intactas se miden directamente por RMN o espectrometría de masas con menor precisión que la IRMS.
Se requiere la conversión a moléculas simples (es decir, H2 para hidrógeno) antes de la IRMS para isótopos estables. Esto se debe a varias razones con respecto al hidrógeno:
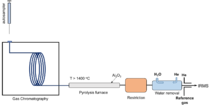
La preparación clásica fuera de línea para la conversión es la combustión sobre CuO a >800 °C en tubos de cuarzo sellados, seguida del aislamiento del agua resultante y la reducción a H2 sobre metal caliente a 400 ~1000 °C en una línea de vacío. [105] Luego, el gas producido se inyecta directamente en el espectrómetro de masas de doble entrada para su medición. [104] Los metales utilizados para la reducción a H2 incluyen U, Zn, Cr, Mg y Mn, etc. U y Zn se han utilizado ampliamente desde la década de 1950 [25] [106] [107] [108] [109] [110] hasta que Cr [111] se empleó con éxito a fines de la década de 1990.
La combustión/reducción fuera de línea tiene la mayor exactitud y precisión para la medición de HIC sin límites para los tipos de muestra. La incertidumbre analítica es típicamente de 1~2‰ en δD. Por lo tanto, todavía se utiliza hoy en día cuando se requieren los niveles más altos de precisión. Sin embargo, el procedimiento de preparación fuera de línea requiere mucho tiempo y es complicado. También requiere una muestra grande (varios 100 mg). Por lo tanto, la preparación en línea basada en combustión/reducción acoplada con el posterior sistema de flujo continuo-IRMS (CF-IRMS) se ha utilizado con más frecuencia en la actualidad. La reducción de cromo o la conversión a alta temperatura son los métodos de preparación en línea dominantes para la detección de HIC por IRMS.

TC/EA (o HTC, conversión a alta temperatura; HTP, pirólisis a alta temperatura ; HTCR, reducción de carbono a alta temperatura) es un método de preparación "en línea" o de "flujo continuo" seguido típicamente de detección IRMS. Esta es una técnica "a granel" que mide todo el hidrógeno en una muestra y proporciona la señal isotópica promedio. La muestra pesada se coloca en una cápsula de estaño o plata y se deja caer en un tubo de pirólisis de TC/EA. El tubo está hecho de carbono vítreo con relleno de carbono vítreo, por lo que los isótopos de oxígeno se pueden medir simultáneamente sin intercambio de oxígeno con la superficie de cerámica (Al2O3 ) . [ 113 ] Las moléculas luego se reducen a CO y H2 a alta temperatura (>1400 °C) en el reactor. Los productos gaseosos se separan a través de cromatografía de gases (GC) utilizando helio como gas portador, seguido de una interfaz de flujo dividido y finalmente se detectan por IRMS. El método TC/EA puede ser problemático para compuestos orgánicos con halógeno o nitrógeno debido a la competencia entre los subproductos de la pirólisis (por ejemplo, HCl y HCN) y la formación de H 2 . [114] [115] Además, es susceptible a la contaminación con agua, por lo que las muestras deben secarse escrupulosamente.
Una adaptación de este método consiste en determinar el hidrógeno no intercambiable (CH) y el hidrógeno intercambiable (enlaces a otros elementos, p. ej. O, S y N) en materia orgánica. Las muestras se equilibran con agua en carruseles de muestreadores automáticos sellados a 115 °C y luego se transfieren a un EA de pirólisis seguido de una medición IRMS. [116]
El método TC/EA es rápido y tiene una precisión bastante alta (~1‰). Estaba limitado a muestras sólidas; sin embargo, recientemente también se pueden medir muestras líquidas en el sistema TC/EA-IRMS adaptando un muestreador automático para líquidos. El inconveniente de TC/EA es el tamaño relativamente grande de la muestra (~ mg), que es menor que la combustión/reducción fuera de línea pero mayor que la GC/pirólisis. No puede separar diferentes compuestos como lo hace la GC/pirólisis y, por lo tanto, solo se puede proporcionar el promedio de toda la muestra, lo que también es un inconveniente para algunas investigaciones.
La interfase de GC (combustión o pirólisis) también es un método de preparación en línea seguido de detección IRMS. Este es un método "específico del compuesto", que permite la separación de analitos antes de la medición y, por lo tanto, proporciona información sobre la composición isotópica de cada compuesto individual. Después de la separación por GC, las muestras se convierten en moléculas gaseosas más pequeñas para las mediciones de isótopos. La GC/pirólisis utiliza la interfase de pirólisis entre GC e IRMS para la conversión de H y O en las moléculas en H 2 y CO. La GC-IRMS fue introducida por primera vez por Matthews y Hayes a fines de la década de 1970, [117] y luego se utilizó para δ 13 C, δ 15 N, δ 18 O y δ 34 S. El helio se utiliza como gas portador en los sistemas GC. Sin embargo, la separación de la señal DH (m/z = 3) de la cola del haz de 4 He + fue problemática debido a la intensa señal de 4 He + . [118] A principios de los años 1990, se realizaron intensos esfuerzos para resolver las dificultades de medir δD mediante GC/pirólisis-IRMS. En 1999, Hilkert et al. desarrollaron un método robusto integrando la conversión de alta temperatura (TC) en GC-IRMS y añadiendo un sector electrostático de precopa y una lente de retardo delante del colector de copa m/z=3. Varios grupos diferentes estaban trabajando en esto al mismo tiempo. [118] [119] [120] [121] Este GC/pirólisis-IRMS basado en TC se ha utilizado ampliamente para la medición de δD en la actualidad. Los productos comerciales de GC-IRMS incluyen interfaces de combustión y pirólisis para que δ 13 C y δD se puedan medir simultáneamente.
La ventaja significativa del método de GC/pirólisis para la medición de HIC es que puede separar diferentes compuestos en las muestras. Requiere el tamaño de muestra más pequeño (normalmente ~200 ng [119] ) en relación con otros métodos y tiene una alta precisión de 1~5 ‰. Pero este método es relativamente lento y está limitado a las muestras que se pueden aplicar en el sistema de GC.

La espectroscopia láser (o espectroscopia de cavidad ring-down , CRDS) es capaz de medir directamente la composición isotópica de 2 H/ 1 H, 17 O/ 16 O y 18 O/ 16 O en agua o metano. El uso de la espectroscopia láser en isótopos de hidrógeno fue reportado por primera vez por Bergamaschi et al. en 1994. [122] Midieron directamente 12 CH 3 D/ 12 CH 4 en metano atmosférico usando una espectroscopia láser de diodo sintonizable de sal de plomo. El desarrollo de CRDS fue reportado por primera vez por O'Keefe et al. en 1988. [123] En 1999, Kerstel et al. aplicaron con éxito esta técnica para determinar HIC en agua. [124] El sistema consta de un láser y una cavidad equipada con espejos de reflectividad de alta finura. La luz láser se inyecta en la cavidad, donde se produce la resonancia debido a la interferencia constructiva. Luego, el láser se apaga. Se mide la disminución de la intensidad de la luz. En presencia de una muestra de agua, la fotoabsorción por los isotópologos del agua sigue la ley cinética. El espectro óptico se obtiene registrando el tiempo de reducción de las características espectrales de H2O de interés en una determinada longitud de onda láser. La concentración de cada isotópologo es proporcional al área bajo cada característica espectral del isotópologo medida. [125]
La espectroscopia láser es rápida, sencilla y relativamente barata; y el equipo es portátil. Por lo tanto, se puede utilizar en el campo para medir muestras de agua. 2 H/ 1 H y 18 O/ 16 O se pueden determinar simultáneamente a partir de una única inyección. Requiere un tamaño de muestra pequeño, < 1 μL para agua. La precisión típica es ~ 1‰. Sin embargo, este es un instrumento específico para un compuesto, es decir, solo se puede medir un compuesto específico. Y los compuestos orgánicos coexistentes (es decir, el etanol ) podrían interferir con las características de absorción óptica de la luz del agua, lo que daría lugar a una contaminación cruzada.
2 H-Site-specific Natural Isotope Fractionation-Nuclear Magnetic Resonance ( 2 H-SNIF-NMR ) es un tipo de RMN especializada en medir la concentración de 2 H de moléculas orgánicas en abundancias naturales. Los espectros de RMN distinguen átomos de hidrógeno en diferentes entornos químicos (por ejemplo, el orden de carbono al que se une el hidrógeno, grupos funcionales adyacentes e incluso posiciones geminales de grupos metileno), lo que lo convierte en una herramienta poderosa para el análisis de isótopos de posición específica . El desplazamiento químico (en unidades de frecuencia) de 2 H es 6,5 veces menor que el de 1 H. Por lo tanto, es difícil resolver picos de 2 H. Para proporcionar suficiente resolución para separar picos de 2 H, se aplican instrumentos de campo magnético de alta resistencia (~11,4 T) [126] . El uso de RMN para estudiar isótopos de hidrógeno de productos naturales fue iniciado por Gerard Martin y sus colaboradores en la década de 1980. [127] Durante varias décadas se ha desarrollado y ampliado. La medición de RMN D/H a veces se combina con la medición de IR-MS para crear un estándar de referencia. [128] La sensibilidad de la RMN SNIF es relativamente baja, y normalmente requiere ~1 mmol de muestras para cada medición. [129] La precisión con respecto a la relación isotópica también es pobre en comparación con la espectrometría de masas. Incluso los instrumentos de última generación solo pueden medir DHR con un error de alrededor del 50~200‰ dependiendo del compuesto. [130] [131] [132] Por lo tanto, hasta ahora la técnica solo puede distinguir las grandes variaciones de D/H en materiales preservados. En 2007, Philippe Lesot y sus colegas avanzaron esta técnica con una RMN bidimensional utilizando cristales líquidos quirales (CLC) en lugar de solventes isotrópicos para disolver moléculas orgánicas. [133] Esto permite las mediciones de dobletes cuadrupolares para cada átomo de deuterio no equivalente. Por lo tanto, reduce las superposiciones de picos y proporciona información más detallada del entorno químico del hidrógeno. [131]
Los usos principales de 2 H-SNIF-NMR han sido en la atribución de fuentes, la ciencia forense y los estudios de vías biosintéticas . (Véase también la sección de Gray "Atribución de fuentes y ciencia forense"). Al medir compuestos de azúcar , una estrategia que ahorra tiempo es convertirlos en etanol a través de la fermentación porque la 2 H-SNIF NMR para etanol está bien establecida. [128] Varios estudios [128] [134] han demostrado que los isótopos de hidrógeno en la posición de metilo y metileno del etanol resultante no se ven afectados ni por la velocidad de fermentación ni por el medio. Otro ejemplo es el estudio de los monoterpenos. Desde la década de 1980, el estudio SNIF-NMR del α-pineno ha encontrado grandes variaciones en DHR entre sus sitios. En particular, la posición ex-C 2 tiene un fuerte agotamiento (~-750‰), que estaba en desacuerdo con el mecanismo biosintético aceptado (mecanismo de mevalonato) en ese momento, y condujo a un nuevo desarrollo de vías. Más recientemente, Ina Ehlers publicó su trabajo sobre las proporciones D6 S /D6 R de las moléculas de glucosa. Se descubrió que la distribución estereoquímica del diteterio se correlacionaba con las proporciones de fotorrespiración/fotosíntesis. Las proporciones de fotorrespiración/fotosíntesis están impulsadas por la fertilización con CO2 , [ 132] por lo que esto podría conducir a nuevos indicadores para reconstruir la concentración paleo-CO2 . También se ha trabajado con ácidos grasos de cadena larga y se ha descubierto que los sitios pares, que se cree que se derivan de la posición C2 del grupo acetilo, están más enriquecidos en 2 H que los hidrógenos impares que provienen de la posición C1 del grupo acetilo. [129] Duan et al. informaron de una fuerte KIE durante la desaturación del ácido oleico al ácido linoleico. [135]
En resumen, la física subyacente de la SNIF-RMN le permite medir isotopómeros . Otra ventaja de la medición de RMN sobre la espectrometría de masas es que analiza muestras de forma no destructiva. La 2 H SNIF-RMN se ha industrializado bien en la identificación de fuentes y la ciencia forense, y ha contribuido mucho a los estudios de vías bioquímicas. La aplicación de la 2 H SNIF-RMN a los registros geológicos es esporádica y aún necesita ser explorada.
Conventionally, mass spectrometry, such as gas chromatography-mass spectrometry (GC-MS) and gas chromatography -time of flight(GC-TOF), is a common technique for analyzing isotopically labeled molecules.[136][137] This method involves ionizing and analyzing isotopologues of an intact organic molecule of interest rather than its products of pyrolysis or conversion. However, it does not work for natural abundance hydrogen isotopes because conventional mass spectrometers do not have enough mass-resolving power to measure the 13C/D isotopologues of intact organic molecules or molecular fragments at natural abundance. For example, to resolve the single D substituted isotopologue peak of any hydrocarbons one will have to be able to at least exclude single 13C substituted isotopologue peak, which sits at the same cardinal mass yet 0.0029 amu lighter and is of orders of magnitude more abundant.
Recent advances in analytical instruments enable direct measurement of natural abundance DHRs in organic molecules. The new instruments have the same framework as any conventional gas source IRMS, but incorporate new features such as larger magnetic sector, double focusing sectors, quadrupole mass filter and multi-collectors. Two commercial examples are the Nu Panorama[138] and the Thermo Scientific 253 Ultra.[139] These instruments generally have good sensitivity and precision. Using only tens of nanomoles of methane, the Ultra can achieve a stable high precision of ~0.1‰ error in δD.[140] One of the first examples of this type of measurement has been clumped isotopes of methane.(See section of "natural gas" in Fossil fuels) Another strength of this kind of instruments is the ability to do site-specific isotopic ratio measurements. This technique is based on measuring DHRs of fragments from the ion source (e.g. CH3CH+
2 of propane molecule) that samples hydrogen atoms from different parts of the molecule.[141]
In summary, direct molecular mass-spectrometry has been commonly used to measure laboratory spiked isotope tracers. Recently advanced high resolution gas source isotope ratio mass spectrometers can measure hydrogen isotopes of organic molecules directly. These mass spectrometers can provide high precision and high sensitivity. The drawback of this type of instruments includes high cost, and standardization difficulty. Also, studying site-specific isotopes with mass spectrometry is less straightforward and needs more constraints than the SNIF-NMR method, and can only distinguish isotopologues but not isotopomers.

Water is the main source of hydrogen for all living things, so the isotopic composition of environmental water is a first-order control on that of the biosphere. The water (hydrological) cycle moves water around Earth's surface, significantly fractionating the hydrogen isotopes in water.[142] As the atmosphere's main moisture source, the ocean has a fairly uniform HIC across the globe around 0‰ (VSMOW).[143] Variations of δD larger than 10‰ in the ocean are generally confined to surface water due to evaporation, sea ice formation, and addition of meteoric water by precipitation, rivers or icebergs.[142] In the water cycle, the two main processes that fractionate hydrogen isotopes from seawater are evaporation and condensation. Oxygen isotopic composition (18O/16O) of water is also an important tracer in the water cycle, and cannot be separated from hydrogen isotopes when we talk about isotope fractionation processes associated with water.
When water evaporates from the ocean to the air, both equilibrium and kinetic isotope effects occur to determine the hydrogen and oxygen isotopic composition of the resulting water vapor. At the water-air interface, a stagnant boundary layer is saturated with water vapor (100% relative humidity), and the isotopic composition of water vapor in the boundary layer reflects an equilibrium fractionation with liquid water. The liquid-vapor equilibrium fractionations for hydrogen and oxygen isotopes are temperature-dependent:[144]
The amount of liquid-vapor equilibrium fractionation for hydrogen isotopes is about 8x that of oxygen isotopes at Earth surface temperatures, which reflects the relative mass differences of the two isotope systems: 2H is 100% heavier than 1H, 18O is 12.5% heavier than 16O. Above the boundary layer, there is a transition zone with relative humidity less than 100%, and there is a kinetic isotope fractionation associated with water vapor diffusion from the boundary layer to the transition zone, which is empirically related to the relative humidity (h):[145]
The KIE associated with diffusion reflects the mass difference of the heavy-isotope water molecules H2H16O and H218O relative to the normal isotopolog (H216O).
After water evaporates to the air, condensation and precipitation transport it and return it to the surface. Water vapor condenses in ascending air masses that develop a lower temperature and saturation vapor pressure. Since the cooling and condensation happen relatively slowly, it is a process with equilibrium isotope effects. However, as water vapor is progressively condensed and lost from the air during moisture transport, the isotopic composition of the remaining vapor, as well as the resulting precipitation, can be largely depleted due to the process of Rayleigh distillation. The equation for Rayleigh distillation is:[146]

where R0 is the isotope ratio in the initial water vapor, Rr is the isotope ratio in the remaining water vapor after some condensation, f is the fraction of water vapor remaining in the air, and α is the liquid-vapor equilibrium fractionation factor (α=1+ε). The isotopic composition of the resulting precipitation (Rp) can be derived from the composition of the remaining vapor:
As f decreases progressively during condensation, the remaining vapor becomes more and more depleted of the heavy isotopes, and the depletion becomes larger as f approaches zero. Rayleigh distillation can explain some first-order spatial patterns observed in the isotopic composition of precipitation across the globe, including isotopic depletion from the tropics to the poles, isotopic depletion from coastal to inland regions, and isotopic depletion with elevation over a mountain range,[1] all of which are associated with progressive moisture loss during transport. The Rayleigh distillation model can also be used to explain the strong correlation between δD and δ18O in global precipitation, expressed as the global meteoric water line (GMWL): δD = 8δ18O+10[147] (later updated to δD = 8.17±0.07 δ18O+11.27±0.65[41]) The slope of the GMWL reflects the relative magnitude of hydrogen and oxygen isotope fractionation during condensation. The intercept of GMWL is non-zero (called deuterium-excess, or d-excess), which means ocean water does fall on GMWL. This is associated with the KIE during evaporation when water vapor diffuses from the saturated boundary layer to the unsaturated transition zone, and cannot be explained by the Rayleigh model. Nevertheless, the robust pattern in GMWL strongly suggests a single dominant moisture source to the global atmosphere, which is the tropical West Pacific. It should also be pointed out that a local meteoric water line can have a different slope and intercept from the GMWL, due to differences in humidity and evaporation intensity at different places.[145] Hydrogen and oxygen isotopes in water thus serve as an excellent tracer of the hydrological cycle both globally and locally.
Based on the processes that fractionate isotopes in the water cycle, isotopic composition of meteoric water can be used to infer related environmental variables such as air temperature, precipitation amount, past elevations, lake levels, as well as to trace moisture sources. These studies form the field of isotope hydrology. Examples of isotope hydrology applications include:
Isotopic composition of precipitation can be used to infer changes in air temperature based on the Rayleigh process. Lower temperature corresponds to lower saturation vapor pressure, which leads to more condensation that drives the residual vapor toward isotope depletion. The resulting precipitation thus has a more negative δD and δ18O value at lower temperature. This precipitation isotope thermometer is more sensitive at lower temperatures, and widely applied at high latitudes. For example, δD and δ18O were found to have a temperature sensitivity of 8‰/°C and 0.9‰/°C in Antarctic snow, and a sensitivity of 5.6‰/°C and 0.69‰/°C across Arctic sites.[148] δD and δ18O of ice cores in Greenland, Antarctica and alpine glaciers are important archives of temperature change in the geological past.
In contrast to temperature control at high latitudes, the isotopic composition of precipitation in the tropics is mainly influenced by rainfall amount (negative correlation). This "amount effect" is also observed for summer precipitation in the subtropics.[41][148] Willi Dansgaard, who first proposed the term "amount effect", suggested several possible reasons for the correlation: (1) As cooling and condensation progress, the rainfall isotopic composition reflects an integrated isotopic depletion by the Rayleigh process; (2) A small amount of rainfall is more likely to be influenced by evaporation and exchange with surrounding moisture, which tend to make it more isotopically enriched. At low latitudes, the amount effect for δ18O is around −1.6‰/100mm precipitation increase at island stations, and −2.0‰/100mm at continental stations.[148] It was also noted that the amount effect was most pronounced when comparing isotopic composition of monthly precipitation at different places in the tropics.[148] The amount effect is also expected for HIC, but there are not as many calibration studies. Across southeast Asia, the δD sensitivity to monthly precipitation amount varies between −15 and −25‰/100mm depending on location.[149] In temperate regions, the isotopic composition of precipitation is dominated by rainfall amount in summer, but more controlled by temperature in the winter.[148] The amount effect may also be complicated by changes in regional moisture sources.[150] Reconstructions of rainfall amount in the tropics in the geological past are mostly based on δ18O of speleothems[151][152] or δD of biogenic lipids,[153][154] both of which are thought of as proxies for the isotopic composition of precipitation.
Hydrogen and oxygen isotopes also work as tracers for water budget in terrestrial reservoirs, including lakes, rivers, groundwater and soil water. For a lake, both the amount of water in the lake and the isotopic composition of the water are determined by a balance between inputs (precipitation, stream and ground water inflow) and outputs (evaporation, stream and ground water outflow).[142] The isotopic composition of lake water can often be used to track evaporation, which causes isotope enrichment in the lake water, as well as a δD-δ18O slope that is shallower than the meteoric water line.[155] The isotopic composition of river water is highly variable and have complicated sources over different timescales, but can generally be treated as a two-endmember mixing problem, a base-flow endmember (mainly ground water recharge) and an overland-flow endmember (mainly storm events). The isotope data suggest that the long-term integrated base-flow endmember is more important in most rivers, even during peak flows in summer.[142] Systematic river isotope data were collected across the world by the Global Network of Isotopes in Rivers (GNIR)[2].The isotopic composition of groundwater can also be used to trace its sources and flow paths. An example is a groundwater isotope mapping study in Sacramento, California, which showed lateral flow of river water with a distinct isotope composition into the groundwater that developed a significant water table depression due to pumping for human use.[156] The same study also showed an isotopic signal of agricultural water being recharged into the giant alluvial aquifer in California's Central Valley.[156] Finally, the isotopic composition of soil water is important for the study of plants. Below the water table, the soil has a relatively constant source of water with a certain isotopic composition. Above the water table, the isotopic composition of soil water is enriched by evaporation until a maximum at the surface. The vertical profile of isotopic composition of soil water is maintained by the diffusion of both liquid and vapor water.[157] A comparison of soil water and plant xylem water δD can be used to infer the depth at which plant roots get water from the soil.[158]

The isotopic compositions of ice cores from continental ice sheets and alpine glaciers have been developed as temperature proxies since the 1950s. Samuel Epstein was one of the first to show the applicability of this proxy by measuring oxygen isotopes in Antarctic snow, and also pointed out complications in the stable isotope-temperature correlation caused by the history of the air masses from which the snow formed.[160] Ice cores in Greenland and Antarctica can be thousands of meters thick and record snow isotopic composition of the past few glacial-interglacial cycles. Ice cores can be dated by layer counting on the top and ice flow modeling at depth, with additional age constraints from volcanic ash.[161] Cores from Greenland and Antarctica can be aligned in age at high-resolution by comparing globally well-mixed trace gas (e.g. CH4) concentrations in the air bubbles trapped in the cores.[162] Some of the first ice core records from Greenland and Antarctica with age estimates go back to the last 105 years, and showed a depletion in δD and δ18O in the last ice age.[163][164] The ice core record has since been extended to the last 800,000 years in Antarctica,[165] and at least 250,000 years in Greenland.[166] One of the best δD-based ice core temperature records is from the Vostok ice core in Antarctica, which goes back to 420,000 years.[159] The δD-temperature (of the inversion layer where snow forms) conversion in east Antarctica based on modern spatial gradient of δD (9‰/°C) is ΔTI=(ΔδDice-8Δδ18Osw)/9, which takes into account variations in seawater isotopic composition caused by global ice volume changes.[159] Many local effects can influence ice δD in addition to temperature. These effects include moisture origin and transport pathways, evaporation conditions and precipitation seasonality, which can be accounted for in more complicated models.[167] Nevertheless, the Vostok ice core record shows some very important results: (1) A consistent δD depletion of ~70‰ during the last four glacial periods compared to interglacial times, corresponding to a cooling of 8°C in Antarctica; (2) A consistent drop of atmospheric CO2 concentration by 100 ppmv and CH4 drop by ~300 ppbv during glacial times relative to interglacials, suggesting a role of greenhouse gases in regulating global climate; (3) Antarctic air temperature and greenhouse gas concentration changes precede global ice volume and Greenland air temperature changes during glacial terminations, and greenhouse gases may be an amplifier of insolation forcing during glacial-interglacial cycles.[159] Greenland ice core isotope records, in addition to showing glacial-interglacial cycles, also shows millennial-scale climate oscillations that may reflect reorganization in ocean circulation caused by ice melt charges.[166][168][169][170] There have also been ice core records generated in alpine glacials on different continents. A record from the Andes Mountains in Peru shows a temperature decrease of 5-6°C in the tropics during the last ice age.[171] A record from the Tibetan plateau shows a similar isotope shift and cooling during the last ice age.[172] Other existing alpine glacial isotope records include Mount Kilimanjaro in Tanzania, Mount Altai and West Belukha Plateau in Russia, Mount Logan in Canada, the Fremont Glacier in Wyoming, USA, and the Illimani Ice Core in Bolivia, most of which cover an interval of the Holocene epoch.[3]
The isotopic composition of biomolecules preserved in the sedimentary record can be used as a proxy for paleoenvironment reconstructions. Since water is the main hydrogen source for photoautotrophs, the HIC of their biomass can be related to the composition of their growth water and thereby used to gain insight into some properties of ancient environments.[173] Studying hydrogen isotopes can be very valuable, as hydrogen is more directly related to climate than other relevant stable isotope systems. However, hydrogen atoms bonded to oxygen, nitrogen, or sulfur are exchangeable with environmental hydrogen, which makes this system less straightforward[174] [ref to earlier H exchange section]. To study the HIC of biomolecules, it is preferable to use compounds where the hydrogen is largely bound to carbon, and thus not exchangeable on experimental timescales. By this criterion, lipids are a much better subject for hydrogen isotope studies than sugars or amino acids.
The net fractionation between source water and lipids is denoted εl/w:
where w refers to the water, and l refers to the lipids.
While the δD of source water is the biggest influence on the δD of lipids,[175] discrepancies between fractionation factor values obtained from the slope and from the intercept of the regression suggest that the relationship is more complex than a two-pool fractionation.[176] In other words, there are multiple fractionation steps that must be taken into account in understanding the isotopic composition of lipids.
The carbon-bonded HIC of cellulose, as inherited from leaf water, has the potential to preserve the original meteoric water signal. This was first demonstrated in the 1970s.[25][177] In a systematic survey across North America, tree cellulose δD was found to have temperature sensitivity 5.8‰/°C, similar to precipitation δD sensitivity of 5.6‰/°C.[178] This spatial correlation may be complicated by local effects of soil evaporation and leaf transpiration,[178] and the spatial gradient may not be representative of temporal changes in tree ring cellulose at a single place. The mechanism that generates the δD signal in cellulose from meteoric water is not fully understood, but at least includes leaf water transpiration, synthesis of carbohydrates, synthesis of cellulose from photosynthetic sugars, and exchange of sugars with xylem water.[179] Modeling studies show that observed tree ring cellulose δD can be produced when 36% of the hydrogen in sugars can exchange with xylem water, and effects such as humidity and rainfall seasonality may complicate the cellulose δD proxy.[179] Despite these complications, tree ring δD have been used for paleoclimate reconstructions of the past few millennia. For example, a tree ring cellulose δD records from pine trees in the White Mountains, California shows a 50‰ depletion from 6800 year ago to present. The cooling trend since the mid-Holocene thermal maximum is consistent with ice core and pollen records, but the corresponding magnitude of cooling is elusive due to complicated influences from local effects such as humidity and soil water composition.[180] The meaning of isotopes in cellulose and its applications is still an area of active study.

Terrestrial plants make leaf waxes to coat the surfaces of their leaves, to minimize water loss. These waxes are largely straight-chain n-alkyl lipids. They are insoluble, non-volatile, chemically inert, and resistant to degradation, making them easily preserved in the sedimentary record, and therefore good targets as biomarkers.[181]
The main water source for land plants is soil water, which largely resembles the HIC of rain water, but varies between environments and with enrichment by precipitation, depletion by evaporation, and exchange with atmospheric water vapor. There can be a significant offset between the δD value of source water and the δD value of leaf water at the site of lipid biosynthesis. No fractionation is associated with water uptake by roots, a process usually driven by capillary tension, with the one exception of xerophytes that burn ATP to pump water in extremely arid environments (with a roughly 10‰ depletion).[182] However, leaf water can be substantially enriched relative to soil water due to transpiration, an evaporative process which is influenced by temperature, humidity, and the composition of surrounding water vapor. The leaf water HIC can be described with a modified Craig-Gordon model,[183] where ΔDe is the steady state enrichment of leaf water, εeq is the temperature-dependent equilibrium fractionation between liquid water and vapor, εk is the KIE from diffusion between leaf internal air space and the atmosphere, ΔDv is the leaf/air disequilibrium, ea is atmospheric vapor pressure, and ei is internal leaf vapor pressure.
The Péclet effect, which describes the opposing forces of advection and diffusion can be added to the model as
where E is transpiration rate, L is length scale of transport, C is concentration of water, and D is diffusion coefficient.
While the role of rain water δD as the fundamental control on the final δD of lipids is well documented,[184] the importance of fractionation effects from rain water to soil water and leaf water on εl/w is appreciated but remains poorly understood.[173][185]
Organic biomolecules are generally depleted relative to the δD of leaf water.[173] However, differences between organisms, biosynthetic pathways, and biological roles of different molecules can lead to huge variability in fractionation; the diversity of lipid biomarkers spans a 600‰ range of δD values.[186] Lipid biosynthesis is biochemically complex, involving multiple enzyme-dependent steps that can lead to isotope fractionations. There are three major pathways of lipid biosynthesis, known as the mevalonate pathway, the acetogenic pathway, and the 1-deoxyD-xylulose-5-phosphate/2-methylerythroyl-4-phosphate pathway.[187] The acetogenic pathway is responsible for the production of n-alkyl lipids like leaf waxes, and is associated with a smaller δD depletion relative to source water than the other two lipid biosynthesis pathways.[32][188] While leaf water is the main source of hydrogen in leaf biomolecules, relatively depleted hydrogen from acetate or NADPH is often added during biosynthesis, and contributes to the HIC of the final molecule. Secondary hydrogen exchange reactions, meaning hydrogenation and dehydrogenation reactions outside of the primary biosynthetic pathway, also contribute substantially to the variability of lipid HIC.[189]
It is important to note that biological differences in fractionation stem not only from biochemical differences between different molecules, but also from physiological differences between different organisms. For example, the δDs of multiple leaf wax molecules are enriched in shrubs (median ~ −90‰) relative to trees (median ~ −135‰), which themselves are enriched relative to both C3 (median ~ −160‰) and C4 grasses (median ~ −140‰).[173] Between individual species, substantial variation in δD has been documented.[190][191][192][193] Other physiological factors that contribute to variable leaf wax δD values include the seasonal timing of leaf development,[194] response to external stress or environmental variability,[195] and the presence or absence of stomata[184]
It can be difficult to distinguish between physiological factors and environmental factors, when many physiological adaptations are directly related to environment.
Several environmental factors have been shown to contribute to leaf wax δD variability, in addition to environmental effects on the δD of source water. Humidity is known to impact lipid δD at moderate humidity levels, but not at particularly high (>80%) or low (<40%) humidity levels, and a broad trend of enriched δDs, meaning smaller εl/w, is seen in arid regions.[173][175][190] Temperature and sunlight intensity, both correlated to latitude, have strong effects on the rates of metabolism and transpiration, and by extension on εl/w.[196] Also, the average chain length of leaf wax molecules varies with geographic latitude, and εl/w has been shown to increase with increasing chain length.[184]
When using biomarkers as a proxy for reconstructing ancient environments, it is important to be aware of the biases inherent in the sedimentary record. Leaf matter incorporated into sediment is largely deposited in the autumn, so seasonal variations in leaf waxes must be considered accordingly.[184] Furthermore, sediments average leaf waxes over lots of different plants in both space and time, making it difficult to calibrate the biological constraints on εl/w.[173] Finally, preservation of biomolecules in the geologic record does not faithfully represent whole ecosystems, and there is always the threat of hydrogen exchange, particularly if the sediments are subjected to high temperatures.
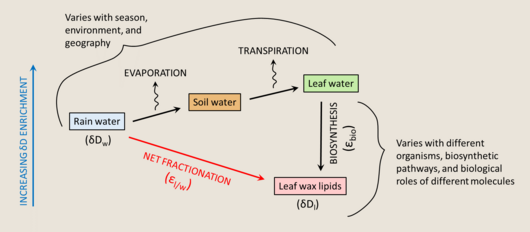
The HIC of leaf waxes can be summarized as the δD of rain water, with three main fractionation steps: evaporation from soil water, transpiration from leaf water, and lipid biosynthesis, which can be combined and measured as the net fractionation, εl/w.[173] With ever-improving measurement techniques for single molecules, and correlation with other independent proxies in the geological record that can help constrain some variables, investigating the HIC of leaf waxes can be extremely productive. Leaf wax δD data has been successfully applied to improving our understanding of climate driven changes in terrestrial hydrology, by showing that ocean circulation and surface temperature have a significant effect on continental precipitation.[197][198] Leaf wax δD values have also been used as records of paleoaltimetry to reconstruct the elevation gradients in ancient mountain ranges based on the effect of altitude on rain water δD.[199][200]
Another group of molecules often used in paleoreconstructions are alkenones, long-chain largely unsaturated lipids produced exclusively by coccolithophores. Coccolithophores are marine haptophyte algae, and include the globally iconic species Emiliania huxleyi, one of the main CaCO3 producers in the ocean. The δDs of alkenones are highly correlated to the δDs of seawater, and so can be used to reconstruct paleoenvironmental properties that constrain the isotopic composition of sea water. The most notable reconstruction that alkenone δD values are applied to is the salinity of ancient oceans.

Both the δDs of sea water and the fractionations associated with hyptophyte biochemistry (εbio) are fairly well understood, so alkenones can be readily used to observe the secondary effect of salinity on δD.[201] There is a well established positive linear correlation between salinity and εl/w, on the order of a ~3‰ change in fractionation per salinity unit.[202] Hypothesized mechanisms for this effect include enrichment of D in intracellular water due to reduced exchange with extracellular water at higher salinity,[203] removal of H from intracellular water due to increased production of solutes to maintain osmotic pressure at higher salinity,[204] and lower haptophyte growth rates at higher salinity[173]
Alkenone δDs have been used successfully to reconstruct past salinity changes in the Mediterranean Sea,[205] Black Sea,[206][207] Panama Basin,[208] and Mozambique Channel.[201] As an extension of salinity, this data was also used to draw further conclusions about ancient environments, such as ancient freshwater flooding events,[205][206] and the evolution of plankton in response to environmental changes[207]
The possibility of using water isotope depletion with elevation to reconstruct paleoaltimetry was demonstrated as early as the late 1960s, when Caltech geochemist Samuel Epstein tried to collect rainwater at different elevations in a single storm.[209] The δ18O and δD lapse rates vary within -1 to -5‰/km and -10 to -40‰/km respectively, but can vary with locations and seasons, and are not exactly linear with altitude.[210][211][212] One of the first studies in stable isotope paleoaltimetry demonstrated a meteoric water δD signature of -90 to -139‰ in fluid inclusions in quartz and adularia in an epithermal gold-silver deposit in Nevada, and suggested the applicability of stable isotopes in reconstruction of ancient topography in the Great Basin.[213] The hydrogen and oxygen isotopes of hydrous silicate minerals have since then been used to reconstruct topographic histories in mountain ranges across the world, including the North American Cordillera, the Rocky Mountains, the Himalayas, the European Alps, and Southern Alps in New Zealand.[209] Lab experiments with clay minerals have shown that the hydrogen and oxygen isotope compositions are relatively resistant to alteration at moderate temperature (<100°C), and can preserve the original meteoric water signal.[214] One important effect of mountain ranges on rainfall stable isotopes is the rain shadow effect, in which an isotopic depletion happens in precipitation on the leeward side compared to the windward side. A change in the difference in isotopic composition of precipitation on the two sides of a mountain can be used to infer the magnitude of the rain shadow effect.[209] In one such study, an isotope enrichment was observed in smectite on the east side of the Sierra Nevada in California from mid-Miocene to late Pliocene, suggesting a decrease in elevation during this period.[215] Another study found δDs around −140‰ in muscovite in the North America Cordillera during the early Eocene, which would suggest an elevation 1km higher than today at the time.[216] In addition to hydrous minerals, hydrogen isotopes in biomarkers such as leaf waxes have also been developed for paleoaltimetry studies. The δD lapse rate in leaf waxes (−21‰/km) falls in the range of meteoric water observations.[212][217] As an example study, leaf wax δD data has been used to confirm hydrous mineral paleoaltimetry for the high elevation of the Sierra Nevada during the Eocene.[200]
The HIC of oil, gas and coal is an important geochemical tool to study the formation, storage, migration and many other processes. The HIC signal of fossil fuels results from both inheritance of source material and water as well as fractionations during hydrocarbon generation and subsequent alteration by processes such as isotopic exchange or biodegradation. When interpreting HIC data of sedimentary organic matter one must take all the processes that might have an isotope effect into consideration.
Almost all the organic hydrogen is exchangeable to some extent. Isotopic exchange of organic hydrogen will reorder the distribution of deuterium and often incorporate external hydrogen. Generally, more mature materials are more heavily exchanged. With effective exchange, aliphatic hydrogen can finally reach isotopic equilibrium at the final stage. Equilibrium fractionation factor varies between hydrogen sites. For example, aliphatic hydrogen isotope fractionation depends on the carbon atom that the hydrogen atom bonds with. To first order, alkyl HIC follows this trend: δDPrimary carbon < δDSecondary carbon < δDTertiary carbon.[218] The fractionation factors between carbon sites also decrease with increasing temperature. This can be potentially used as a thermo-history indicator.[141] The fractionation between whole molecule and water can be estimated by averaging all hydrogen-positions, and this leads to a relatively small variation of equilibrium fractionation between different groups of hydrocarbons and water. A theoretical prediction estimated this to be −80‰ to −95‰ for steranes, −90‰ to −95‰ for hopanes, and −70‰ to −95‰ for typical cycloparaffins at 0−100°C.[219] At the temperature of the oil window and gas window, the equilibrium fractionation between different group of organic molecules is relatively small, as compared with large primary signals.
The study of hydrogen isotopes of fossil fuels has been applied as proxies and tools in the following aspects:
The first stage that sedimentary organic matter (SOM) experiences after deposition is diagenesis. During diagenesis, biological decomposition can alter the DHR of organics. Several experimental studies have shown that some biodegraded materials become slightly enriched in D (less than 50‰). Most organics become kerogen by the end of diagenesis. Generally, δD of kerogen spans a wide range. Many factors contribute to the kerogen we observe in geologic records, including:
Research on the Australian basins showed that δD of lacustrine algal sourced kerogen with terrestrial contributions varies from −105‰ to −200‰, and δD of kerogen from near-coastal depositional environment has a narrower range, −75‰ to −120‰.[224] The smaller span in DHRs of coastal kerogen is thought to reflect the relatively stable regional climate. Pedentchouk and his colleagues reported δD values of -70‰ to -120‰ in immature to low mature kerogen from early Cretaceous lacustrine sediments in West Africa.[221]
Coals are from type III kerogen mostly derived from land plants, which should have a primary D/H signal sensitive to local meteoric water. Reddings et al. analyzed coals of various origins and found them randomly scattered across the range of −90‰ to −170‰.[225] Rigby et al. found D contents decrease from −70‰ to −100‰ with increasing maturity in coal from Bass Basin and attributed this to latter exchange with low D water.[226] Smith et al. studied H isotopes of coal samples from Antarctica and Australia. They found a strong negative correlation between δD and inferred paleolatitude. For coal samples originating near the Equator, δD is around −50‰, while for those originating from polar regions, δD is around −150‰.[227] This δD trend along latitude is consistent meteoric water trend and thus is an evidence that coals can preserve much of the original signals.
There are two types of approach to study the alteration of DHRs of kerogen during catagenesis: (1) laboratory incubation of organic matter that enables mechanistic study with controlled experiments; (2) natural sample measurement that provides information of combined effects over geologic timescales. The complex composition and chemistry of kerogen complicates the results. Nevertheless, most research on HIC of kerogen show D enrichment with increasing maturity. Type II kerogen (marine derived) from New Albany Shale is reported to have δD rise from −120‰ to −70‰ as vitrinite reflectance increase from 0.3% to 1.5%.[228] Two main mechanisms have been proposed for enrichment. One of them is kinetic fractionation during hydrocarbon generation while the other is isotopic exchange with surrounding water. Anhydrous incubation experiments have shown that the products are generally more D-depleted than their precursors, causing enrichment in residual kerogen. Schimmelmann et al. studied the relationship between terrestrially-derived oil and their source rock kerogens from four Australian Basins. They found that on average the oil is depleted to corresponding kerogen by 23‰.[224] Hydrous incubation experiments suggest that 36–79% of bulk organic hydrogen may come from water at moderate maturity. While still under debate, it appears likely that incorporation of water hydrogen isotopes is the more dominant process for kerogen D- enrichment during catagenesis.[46]
In summary, D content of kerogen and coal is complicated and hard to resolve due to the complex chemistry. Nevertheless, studies have found the possible correlation between coal δD and paleo-latitude.
Commonly, HIC of natural gas from the same well has a trend of δDmethane < δDethane < δDpropane < δDC4+. This is because most natural gas is thought to be generated by stepwise thermal cracking that is mostly irreversible and thus governed by normal kinetic isotope effects (KIE) that favor light isotopes. The same trend, known as "the normal order",[229] holds for carbon isotopes in natural gas. For example, Angola gas reportedly has a methane δD range of −190‰ to −140‰, an ethane δD of −146‰ to −107‰, a propane δD of −116‰ to −90‰, and a butane δD of −118‰ to −85‰.[230] However, some recent studies show that opposite patterns could also exist, meaning δDmethane > δDethane > δDpropane. This phenomenon is often called 'isotopic reversal' or 'isotopic rollover'. The isotopic order could also be partly reversed, like δDmethane > δDethane < δDpropane or δDmethane < δDethane > δDpropane.[229] Burruss et al. found that in the deepest samples of northern Appalachian basin the hydrogen isotopic order for methane and ethane is reversed.[231] Liu et al., also found partial reversal in oil-related gas from the Tarim Basin.[229] The mechanism causing this reversal is still unknown. Possible explanations include mixing between gases of different maturities and sources, oxidation of methane, etc. Jon Telling et al., synthesized isotopically reversed (in both C and H) low-molecular alkanes using gas-phase radical recombination reactions in electrical discharge experiments, providing another possible mechanism.[232]
Methane is the main component of natural gas. Geosphere methane is intriguing for the large input of microbial methanogenesis. This process exhibits a strong KIE, resulting in greater D-depletion in methane relative to other hydrocarbons. δD ranges from −275‰ to −100‰ in thermogenic methane, and from −400‰ to −150‰ in microbial methane.[95] Also, methane formed by marine methanogens is generally enriched in D relative to methane from freshwater methanogens. δD of methane has been plotted together with other geochemical tools (like δ13C, gas wetness) to categorize and identify natural gas. A δD-δ13C diagram (sometimes called CD diagram, Whiticar diagram, or Schoell diagram) is widely used to place methane in one of the three distinct groups: thermogenic methane that is higher in both δ13C and δD; marine microbial methane that is more depleted in 13C and freshwater microbial methane that is more depleted in D. Hydrogenotrophic methanogenesis produces less D-depleted methane relative to acetoclastic methanogenesis. The location where the organism lives and substrate concentration also affect isotopic composition: rumen methanogenesis, which occurs in a more closed system and with higher partial pressures of hydrogen, exhibits a greater fractionation (−300 to −400‰) than wetland methanogenesis (−250 to −170‰).[233][234]
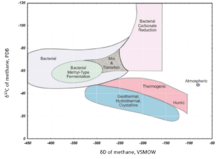
Recent advances in analytical chemistry have enabled high-precision measurements of multiply substituted (or 'clumped') isotopologues like 13CH32H. This is a novel tool for studying methane formation. This proxy is based on the abundance of clumped isotopologues of methane, which should be enriched compared to the stochastic distribution at thermodynamic equilibrium because the reduced zero-point energy for heavy-heavy isotope bonding is more than twice the reduced zero-point energy of heavy-light isotope bonding.[235] The extent of enrichment decreases with increasing temperature, as higher entropy tends to randomize isotope distribution. Stolper et al. established this temperature calibration using laboratory equilibrated methane and field methane from known formation temperature, and applied this to several gas reservoirs to study natural gas formation and mixing.[236] Wang et al. also reported strong non-equilibrium isotope effect in methane clumped isotopes from lab-cultured methanogens and field samples.[237] These methane samples have relatively low abundance of clumped isotopologues, sometimes even lower than the stochastic distribution. This indicates that there are irreversible steps in enzymatic reactions during methanogenesis[237] that fractionation against clumped isotopologues to create the depleted signal. Isotope clumping in methane has proven a robust proxy, and scientists are now moving towards higher-order alkane molecules like ethane for further work.[238]
Oil is generally a product of thermal breakdown of type I and type II kerogen during catagenesis. The HIC should reflect the source kerogen signal, generation fractionation, isotopic exchange and other maturation effects. Thermal maturation at the oil window can erase much of the HIC primary signals. The formation of oil involves breaking C-C and C-H bonds, resulting in depletion of 13C and 2H in the products and enrichment in the residual reactants due to KIEs. Yongchun Tang and his colleagues modeled this process based on laboratory-calibrated kinetics data and found that the frequency factor ratio for D/H is 1.07.[239] Moreover, oil is also affected by isotope fractionation from phase changes. However, the behavior of oil gas-liquid fractionation differs from water as the vapor phase of oil is 2H-enriched.[51] This depletes residual oil as it gets evaporated. Biodegradation of oil is also expected to fractionate hydrogen isotopes, as enzymatic breaking of C-H bond has a normal KIE. Several degradation experiments show that this fractionation is generally mild, ranging from −11‰ to −79‰.[51] This process should also enrich partially degraded oil. Finally, oil stored in a reservoir often had migrated through subsurface (aka geochromatography) from another source region, interacting with water. No data has been published to confirm the fractionation associated with migration, yet theoretical prediction shows that this is likely to be very small.[51]
Many studies of natural samples have shown slight increases in δD with thermal maturity. Amane Waseda reported δD of oil samples in northeast Japan to increase from around −130‰ to around −110‰ with higher maturity.[240] At low thermal maturity, dos Santos Neto and Hayes reported δD of saturate fraction of oil in Portiguar Basin derived from a lacustrine environment is -90‰, and from a marine-evaporitic environment is -120‰ to −135‰.[46][85]
Bulk analysis of oil, which yields a complex mixture of organic compounds, obscures much of the valuable information. Switching to compound-specific study greatly expanded our understanding of hydrogen isotopes of oil. Analyzing HIC at the compound level avoids problems from differences in exchange rates, simplifies sources and products relationships, and draws a much more detailed picture.[51] δDs of n-alkanes are generally thought to be representative of oil as they are the major components. Schimmelmann et al. confirmed that alkane fractions have almost the same DHRs as whole oils.[224] Depending on source material type and maturity, δD of n-alkanes can vary from −100‰ to −180‰. A common phenomenon of various oil and matured rock derived n-alkanes is a trend of increasing δD with chain length. For example, Li et al. analyzed oils from the Western Canada Sedimentary Basin and found δD increased between 20‰ and 40‰ from C13 to C27.[241] This "isotope slope" is an artifact of kinetic fractionation associated with thermal cracking of carbon chains. This trend has been experimentally reproduced and theoretically modeled by Tang et al.[223]
N-alkanes are also known to preserve detailed information of source material. Li et al. studied oils from the marine-derived Upper Cretaceous Second White Speckled Shale and found strong depleted signal around −180‰ in C12-C18. The low δD of this marine samples was explained by the discharge of a large high latitude river.[241] Schimmelmann et al. found that the δD of the oil sampled from coaly facies of the Crayfish group reaches down to −230‰ where as those sampled from algal facies of the same group are around −100‰. Such huge variation is hard to explain by any other causes than Australia splitting from Antarctica in late Cretaceous.[51] Another special case reported by Xiong et al.[242] studied Ordovician carbonates from Bohai Bay Basin. They found big differences between δD of n-alkanes, reflecting that the original signal is preserved rather than being homogenized. The result is not obvious as the sample is very mature (inferred vitrinite reflectance R0 up to 2.3). Thus this is strong evidence that carbonate systems have much lower catalytic efficiency of hydrogen exchange on hydrocarbons. Strong enrichment (~40‰) in odd carbon numbered alkanes to even carbon numbered alkanes is also found in some subset of samples and the reason is unclear at this point. This odd-even effect is also observed in immature clastic sediments.[243]
Ecohydrology is concerned with the interaction between ecosystems and water cycling, from measuring the small scale drainage of water into soil to tracking the broad movements of water evaporating from trees. Because deuterium acts as a conservative tracer, it works well for tracking water movement through plants and ecosystems. Though water movement in single-process phenomena such as evaporation is relatively simple to track, many systems (e.g. cloud forests) in the environment have multiple sources, and tracking water movement becomes more complicated.[244] Isotope spiking can also be done to determine water transport through soil and into plants by injecting deuterated water directly into the ground.[245]
Stable isotope analysis of xylem water can be used to follow the movement of water from soil into the plants and therefore provide a record of the depth of water acquisition. An advantage to using xylem water is that in theory, the HIC should directly reflect the input water without being affected by leaf transpiration. For example, Dawson and Ehleringer used this approach to determine whether trees that grow next to streams are using the surface waters from that stream.[246] Water from the surface would have the same isotopic composition as the stream, while water from farther below in the ground would be from past precipitation inputs. In this case, younger trees had a xylem water isotopic composition very close to the adjacent stream and likely used surface waters to get established. Older trees had depleted xylem water relative to the stream, reflecting that they source their water from deeper underground.[246] Other stable isotope studies have also determined that plants in redwood forests do not just take up water from their roots but acquire a significant proportion of water via stomatal uptake on leaves.[247]
Plant water can be used to characterize other plant physiological processes that affect the water cycle; for example, leaf water is widely used for modeling transpiration[248] and water-use efficiency (WUE).[249] In transpiration, the Craig-Gordon model for lake water enrichment through evaporation[250] has been found experimentally to fit well for modelling leaf water enrichment.[251] Transpiration can be measured by direct injection of deuterated water into the base of the tree, trapping all water vapor transpired from the leaves and measuring the subsequent condensate.[252] Water use can also be measured and is calculated from a heavy water injection as follows:
where WU is water use in kg/day, M is mass of deuterated water injected in grams, T is the final day of the experiment, Ci is concentration of deuterium at time interval i in grams/kilogram, and Δti is the length of time interval i in days. Though the calculated water use via thermal-dissipation-probing of some tropical plants such as bamboos, correlates strongly with measured water use found by tracking D2O movement, the exact values are not the same.[253] In fact, with the legume tree Gliricidia sepium, which produces a heartwood, transpired water did not even correlate strongly with injected 2H2O concentrations, which would further complicate water use measurements from direct injections. This possibly occurred because heartwoods could accumulate heavy water rather than move the water directly through xylem and to leaves.[253]
WUE, the ratio of carbon fixation to transpiration, has previously been associated with 13C/12C ratios using the equation:
where
HIC can be useful in tracking animal migration.[254] Animals with metabolically inert tissue (e.g. feathers or hair) synthesize that tissue using hydrogen from source water and food, but ideally do not incorporate subsequent water during migration. Because δD varies geographically, the difference between animal tissue δD and post-migration water δD, after accounting for the biological fractionation of assimilation, can provide information regarding animal movement. In monarch butterflies, for example, wing chitin is metabolically inert after it is built, so it can reflect the isotopic composition of the environmental water at the time and location of wing growth. This then creates a record of butterfly origin and can be used to determine migration distance.[255] This approach can also be used in bats and birds, using hair and feathers, respectively.[256][257] Since rainwater becomes depleted as elevation increases, this method can also track altitudinal migration. However, this is technically hard to do, and the resolution seems to be too poor to track small altitudinal changes.[257] 2H is most useful in tracking movement of species between areas with large continental water variation, since species movement can be complicated by the similarity of local water δD between places. For example, source water from Baja California may have the same δD as water from Maine.[258] Further, a proportion of the HIC in the tissue can exchange with water and complicate the interpretation of measurements. To determine this percentage of isotopic exchange, which varies according to local humidity levels, standards of metabolically inert tissue from the species of interest can be constructed and equilibriated to local conditions. This allows measured δD from different regions to be compared against each other.[259]
Assimilation of diet into tissue has a tissue-specific fractionation known as the trophic discrimination factor. Diet sources can be tracked through a food web via deuterium isotope profiles, though this is complicated by deuterium having two potential sources – water and food. Food more strongly impacts δD than does exchange with surrounding water, and that signal is seen across trophic levels.[260] However, different organisms derive organic hydrogen in varying ratios of water to food: for example, in quail, 20-30% of organic hydrogen was from water and the remainder from food. The precise percentage of hydrogen from water, depended on tissue source and metabolic activity.[261] In chironomids, 31-47% of biomass hydrogen derived from water,[260] and in microbes as much as 100% of fatty acid hydrogen can be derived from water depending on substrate.[186] In caterpillars, diet δD from organic matter correlates linearly with tissue δD. The same relationship does not appear to hold consistently for diet δD from water, however – water derived from either the caterpillar or its prey plant is more 2H-enriched than their organic material. Going up trophic levels from prey (plant) to predator (caterpillar) results in an isotopic enrichment.[262] This same trend of enrichment is seen in many other animals - carnivores, omnivores, and herbivores - and seems to follow 15N relative abundances. Carnivores at the same trophic level tend to exhibit the same level of 2H enrichment.[263] Because, as mentioned earlier, the amount of organic hydrogen produced from water varies between species, a model of trophic level related to absolute fractionation is difficult to make if the participating species are not known. Consistency in measuring the same tissues is also important, as different tissues fractionate deuterium differently. In aquatic systems, tracking trophic interactions is valuable for not only understanding the ecology of the system, but also for determining the degree of terrestrial input.[33][264] The patterns of deuterium enrichment consistent within trophic levels is a useful tool for assessing the nature of these interactions in the environment.[33]
Biological deuterium fractionation through metabolism is very organism and pathway dependent, resulting in a wide variability in fractionations.[186][265] Despite this, some trends still hold. Hydrogen isotopes tend to fractionate very strongly in autotrophs relative to heterotrophs during lipid biosynthesis - chemoautotrophs produce extremely depleted lipids, with the fractionation ranging from roughly −200 to −400‰.[266] This has been observed both in laboratory-grown cultures fed a known quantity of deuterated water and in the environment.[186][267] Proteins, however, do not follow as significant a trend, with both heterotrophs and autotrophs capable of generating large and variable fractionations.[266] In part, kinetic fractionation of the lighter isotope during formation of reducing equivalents NADH and NADPH result in lipids and proteins that are isotopically lighter.
Salinity appears to play a role in the degree of deuterium fractionation as well; more saline waters affect growth rate, the rate of hydrogen exchange, and evaporation rate. All of these factors influence lipid δD upon hydrogen being incorporated into biomass. In coccolithophores Emiliania huxleyi and Gephyrocapsa oceanica, alkenone δD has been found to correlate strongly to organism growth rate divided by salinity.[202] The relationship between deuterium fractionation and salinity could potentially be used in paleoenvironment reconstruction with preserved lipids in the rock record to determine, for example, ocean salinity at the time of organismal growth. However, the degree of fractionation is not necessarily consistent between organisms, complicating the determination of paleosalinity with this method.[202] There also appears to be a negative correlation between growth rate and fractionation in these coccolithophores. Further experiments on unicellular algae Eudorina unicocca and Volvox aureus show no effect of growth rate (controlled by nitrogen limitation) on fatty acid δD. However, sterols become more D-depleted as growth rate increases,[268] in agreement with alkenone isotopic composition in coccolithophores. Overall, although there are some strong trends with lipid δD, the specific fractionations are compound-specific. As a result, any attempt to create a salinometer through δD measurements will necessarily be specific to a single compound type.
An important goal of environmental chemistry is tracing the source and degradation of pollutants. Various methods have been used for fingerprinting pools of environmental pollutants such as the bulk chemical composition of a spill,[269] isotope ratios of the bulk chemical mixture,[270] or isotope ratios of individual constituent compounds. Stable isotopes of carbon and hydrogen can be used as complementary fingerprinting techniques for natural gas.[271] The DHR of hydrocarbons from the Deepwater Horizon oil spill was used to verify that they were likely from the Macondo well.[272] HICs have also been used as a measure of the relative amount of biodegradation that has occurred in oil reservoirs in China,[273] and studies on pure cultures of n-alkane degrading organisms have shown a chain-length dependence on the amount of hydrogen isotope fractionation during degradation.[274] Additional studies have also shown hydrogen isotope effects in the degradation of methyl tert-butyl ether[275] and toluene[276][277] that have been suggested to be useful in the evaluation of the level of degradation of these polluting compounds in the environment. In both cases the residual unreacted compounds became 2H-enriched to a few tens of ‰, with variations exhibited between different organisms and degree of reaction completeness. These observations of heavy residual compounds have been applied to field observations of biodegradation reactions such as removal of benzene and ethylbenzene,[278] which imparted a D/H fractionation of 27 and 50 ‰, respectively. Also, analysis of o-xylene in a polluted site showed high residual DHRs after biodegradation, consistent with activation of C-H bonds being a rate limiting step in this process[279]
Stable isotope ratios have found uses in various instances where the authenticity or origin of a chemical compound is called into question. Such situations include assessing the authenticity of food, wine and natural flavors; drug screening in sports (see doping in sport); pharmaceuticals; illicit drugs; and even helping identify human remains. In these cases it is often not enough to detect or quantify a certain compound, since the question is the origin of the compound. The strength of hydrogen isotope analysis in answering these questions is that the DHR of a natural product is often related to the natural water DHRs in the area where the product was formed (see: Hydrologic cycle). Since DHRs vary significantly between different areas, this can be a powerful tool in locating the original source of many different substance.
Foods, flavorings and scents are often sold with the guarantee that chemical additives come from natural sources. This claim becomes hard to test when the chemical compound has a known structure and is readily synthesized in a lab. Authentication of claims about the origins of these chemicals has made good use of various stable isotopes, including those of hydrogen. Combined carbon and hydrogen isotope analysis has been used to test the authenticity of (E)-methyl cinnamate,[280] γ-decalactone and δ-decalactone.[281] Hydrogen and nitrogen isotope ratios have been used for the authentication of alkylpyrazines used as "natural" coffee flavorings.[282]
The isotope ratio of carbon in athletes' steroids has been used to determine whether these steroids came from the athlete's body or an outside source. This test has been used in a number of high-profile anti-doping cases and has various benefits over simply characterizing the concentration of various compounds. Attempts are being made to create similar tests based on stable hydrogen isotopes[283] which could be used to complement the existing testing methods. One concern with this method was that the natural steroids produced by the human body may vary significantly based on the 2H content of drinking water, leading to false detection of doping based on HIC differences. This concern has been addressed in a recent study which concluded that the effect of DHR of drinking water did not pose an insurmountable source of error for this anti-doping testing strategy.[284]
The pharmaceutical industry has revenues of hundreds of billions of dollars a year globally. With such a large industry counterfeiting and copyright infringement are serious issues, and hydrogen isotope fingerprinting has become a useful tool in verifying the authenticity of various drugs. As described in the preceding sections, the utility of DHRs is highest when combined with measurements of other isotope ratios. In an early study on the stable isotope compositions of tropicamide, hydrocortisone, quinine and tryptophan; carbon, nitrogen, oxygen and hydrogen stable isotopes were analyzed by EA-IRMS; clear distinctions were able to be made between manufacturers and even batches of the drugs based on their isotope signatures.[285] In this study it was determined that the hydrogen and oxygen isotope ratios were the two best fingerprints for distinguishing between different drug sources. A follow-up study analyzing naproxen from various lots and manufacturers also showed similar ability to distinguish between sources of the drugs.[286] The use of these isotope signatures could not only be used to distinguish between different manufacturers, but also between different synthetic pathways for the same compound.[287] These studies relied on the natural variations that occurred in the synthesis of these drugs, but other studies have used starting ingredients that are intentionally labeled D and 13C, and showed that these labels could be traced into the final pharmaceutical product.[288] DHRs can also be determined for specific sites in a drug by 2H NMR, and has been used to distinguish between different synthetic methods for ibuprofen and naproxen in one study,[289] and prozac and fluoxetine in another.[290] These studies show that bulk DHR information for EA-IRMS, and site-specific DHRs from 2H NMR have great utility for pharmaceutical drug authenticity testing.
The sources and production mechanisms of illegal drugs has been another area that has seen successful application of hydrogen isotope characterization. Usually, as with other applications of stable isotope techniques, results are best when data for multiple stable isotopes are compared with one another. δ2H, δ13C and δ15N have been used together to analyze tablets of MDA and MDMA and has successfully identified differences which could be used to differentiate between different sources or production mechanisms.[291] The same combination of stable isotopes with the addition of δ18O was applied to heroin and associated packaging and could successfully distinguish between different samples.[292] Analysis using deuterium NMR was also able to shed light on the origin and processing of both cocaine and heroin.[293] In the case of heroin this site-specific natural isotopic fraction measured by deuterium NMR (SNIF-NMR) method could be used for determining the geographic origin of the molecule by analyzing so-called natural sites (which were present in the morphine from which heroin is made), as well as gaining information on the synthesis process by analyzing the artificial sites (added during drug processing).
The geographic variation in DHR in human drinking water is recorded in hair. Studies have shown a very strong relation between an individual's hair and drinking water DHRs.[294]
Since tap water DHR depends strongly on geography, a person's hair DHR can be used to determine regions where they most likely lived during hair growth. This idea has been used in criminal investigations to try to constrain the movements of a person prior to their death, in much the same way DHRs have been used to track animal migration. By analyzing sections of hair of varying ages, one can determine in what D/H regions a person was living at a specific time before their death.[295]
{{cite web}}: CS1 maint: multiple names: authors list (link){{cite book}}: |journal= ignored (help){{cite book}}: |journal= ignored (help){{cite book}}: |journal= ignored (help){{cite book}}: |journal= ignored (help){{cite book}}: |journal= ignored (help){{cite book}}: |journal= ignored (help)