Western blot
El Western blot, inmunoblot o electrotransferencia, es una técnica analítica usada en biología celular y molecular para identificar proteínas específicas en una mezcla compleja de proteínas, tal como la que se presenta en extractos celulares o de tejidos.
Finalmente, se detecta la unión antígeno-anticuerpo por actividad enzimática o fluorescencia, entre otros métodos.
El nombre (Western, occidental en inglés) le fue dado por W. Neal Burnette, y consiste en un juego de palabras con una técnica análoga pero que usa ADN, el Southern (sureño en inglés) blot, que en este caso debe su nombre a su descubridor, Edwin Southern.
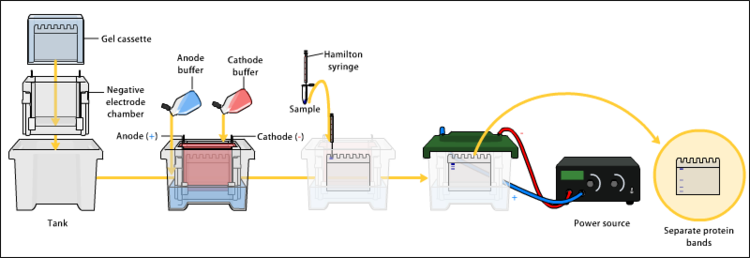
Esta transferencia puede realizarse por difusión, por vacío o por acción de un campo eléctrico (electrotransferencia).
Este montaje se coloca sobre un tampón, que ascenderá por capilaridad hacia el papel de filtro arrastrando consigo las proteínas.
[9][7] Este método se basa en una corriente eléctrica y un tampón de transferencia para llevar las proteínas desde el gel hacia la membrana.
Las proteínas del gel se desplazan hacia el polo positivo y quedan atrapadas por la membrana.
Para ello se emplea un anticuerpo específico contra ella unido a una enzima que, en presencia de su sustrato, catalice una reacción colorimétrica (produce color).
Así pues, tras el bloqueo se incuba en agitación moderada la membrana con una disolución de anticuerpo primario (0,5 - 5 μg/ml).
Este método apenas se usa actualmente, por ser significativamente más caro, peligroso y lento que los otros.
Enzimas como la peroxidasa de rábano (HRP) o una fosfatasa alcalina son válidas para este mecanismo.
Otro método más sofisticado consiste en la unión de una enzima que catalice una reacción quimioluminiscente.
Las anteriormente citadas enzimas también son válidas en este caso, aunque cada una usa un agente quimioluminiscente diferente.
Otro método basado en el mismo principio emplea anticuerpos unidos a fluorocromos del infrarrojo cercano, como el 2 - metoxi - 2,4 - difenil - 3 (2H) - furanona (MDPF) o el rojo Nilo.
Esto último presenta una ventaja, y es que no es necesario realizar una tinción del gel para comprobar la transferencia proteica.
[12] Otra opción es emplear un anticuerpo primario unido covalentemente a moléculas de biotina.
[7][14] Históricamente la detección se ha realizado en dos pasos por la relativa facilidad que supone producir anticuerpos primarios y secundarios en procesos separados.
Esto requiere un anticuerpo que reconozca al mismo tiempo la proteína de interés y una "etiqueta" detectable.
La detección colorimétrica depende de la incubación del Western blot con un sustrato que reacciona gracias a la enzima reporter (una peroxidasa, por ejemplo) unida al anticuerpo secundario.
La luz captada por una película fotográfica o, más recientemente, por cámaras CCD, que toman una imagen digital del Western blot.
Actualmente hay programas que permiten realizar análisis más profundos si se aplican ciertos estándares, como la obtención del peso molecular.
Se consigue así una imagen digital del Western blot que puede ser analizado para obtener el peso molecular o la cuantificación proteica.