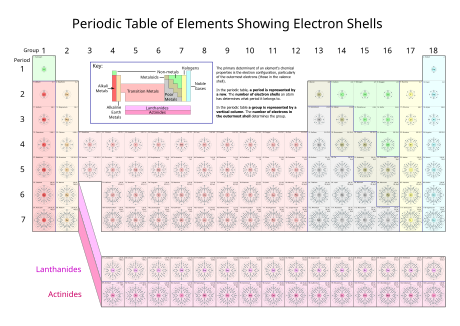
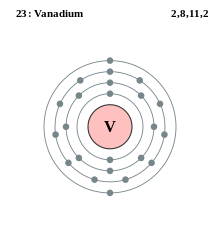
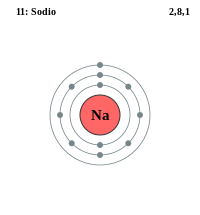
Capa electrónica
Los electrones en la capa electrónica más externa, llamada capa de valencia y que es la única que puede encontrarse parcialmente vacía, determinan las propiedades químicas del elemento químico.
La fórmula general es que la capa n puede, en principio, contener hasta 2 (n2) electrones.
En 1913, Bohr propuso un modelo del átomo en el que se indicaba la disposición de los electrones en sus órbitas secuenciales.
En ese momento, Bohr permitió que la capacidad de la órbita interior del átomo aumentara hasta ocho electrones a medida que los átomos se hacían más grandes, y "en el esquema que se da a continuación el número de electrones de este anillo [exterior] se pone arbitrariamente igual a la valencia normal del elemento correspondiente".
Utilizando estas y otras restricciones, propuso configuraciones que concuerdan con las que ahora sólo se conocen para los seis primeros elementos (Hidrógeno, Helio, Litio, Berilio, Boro y Carbono).
Barkla las llamó con las letras K, L, M, N, O, P, y Q.
Linus Pauling después generalizó y expandió la teoría al aplicar nociones de la mecánica estructural.
Durante este periodo Bohr estaba trabajando con Walther Kossel, cuales artículos del 1914 y 1916 llamaban a las órbitas "cáscaras".
[8][9] Sommerfeld conservó el modelo planetario de Bohr, pero añadió órbitas ligeramente elípticas (caracterizadas por números cuánticos adicionales l y m) para explicar la fina estructura espectroscópica de algunos elementos químicos.
[13] Moseley formaba parte del grupo de Rutherford, al igual que Niels Bohr.
Moseley midió las frecuencias de los rayos X emitidos por cada elemento entre el Calcio y el Zinc y descubrió que las frecuencias eran mayores a medida que los elementos se hacían más pesados.
El segundo haz de difracción lo denominó "fluorescente" porque dependía del material irradiado.
[17] Sin embargo, experimentos posteriores indicaron que las líneas de absorción K son producidas por los electrones más internos.
Los diversos subniveles posibles se muestran en la siguiente tabla: El sodio tiene once electrones.