El epitelio intestinal es la capa unicelular que forma la superficie luminal (revestimiento) tanto del intestino delgado como del intestino grueso (colon) del tracto gastrointestinal . Está compuesto por un epitelio columnar simple y sus principales funciones son la absorción y la secreción. Las sustancias útiles se absorben en el cuerpo y se restringe la entrada de sustancias nocivas. Las secreciones incluyen mucinas y péptidos .
Las células absorbentes del intestino delgado se denominan enterocitos y las del colon colonocitos . Los otros tipos de células son las células secretoras: células caliciformes , células de Paneth , células enteroendocrinas y células de Tuft . Las células de Paneth están ausentes en el colon. [1] [2]
Como parte de su función protectora, el epitelio intestinal constituye un componente importante de la barrera mucosa intestinal . Algunas enfermedades y afecciones son causadas por defectos funcionales en el epitelio intestinal. Por otro lado, diversas enfermedades y afecciones pueden provocar una disfunción del mismo, lo que, a su vez, puede provocar otras complicaciones.
El epitelio intestinal forma parte del revestimiento mucoso . El epitelio es un epitelio cúbico simple compuesto por una sola capa de células, mientras que las otras dos capas de la mucosa, la lámina propia y la muscularis mucosae , sostienen y se comunican con la capa epitelial. Para contener de forma segura el contenido del lumen intestinal , las células de la capa epitelial se unen entre sí mediante uniones estrechas , formando así una membrana contigua y relativamente impermeable.

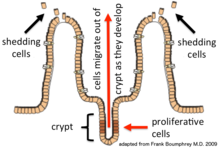
Las células epiteliales se renuevan continuamente cada 4 o 5 días a través de un proceso de división celular, maduración y migración. La renovación depende de las células proliferativas ( células madre ) que residen en la cripta (base) de las glándulas intestinales (invaginaciones epiteliales en el tejido conectivo subyacente). [3] Después de formarse en la base, las nuevas células migran hacia arriba y fuera de la cripta, madurando en el camino. Finalmente, sufren apoptosis y se desprenden hacia el lumen intestinal. [4] De esta manera, el revestimiento del intestino se renueva constantemente mientras que el número de células que componen la capa epitelial permanece constante. [5]
En el intestino delgado, la capa mucosa está especialmente adaptada para proporcionar una gran superficie con el fin de maximizar la absorción de nutrientes. La expansión de la superficie de absorción, 600 veces mayor que la de un tubo cilíndrico simple, se logra mediante tres características anatómicas: [6]
El borde en cepillo de la superficie apical de las células epiteliales está cubierto de glicocáliz , que está compuesto de oligosacáridos unidos a glicoproteínas y glicolípidos de membrana . [7]

Las células madre que residen en la base de las criptas producen diferentes tipos de células. [4] Cada tipo madura de acuerdo con su programa de diferenciación específico a medida que migra hacia arriba y hacia afuera de la cripta. Se han identificado y caracterizado muchos de los genes necesarios para la diferenciación en los diferentes tipos de células epiteliales. Los tipos de células producidas son: enterocitos (intestino delgado) (conocidos como colonocitos en el colon), células caliciformes , células enteroendocrinas , células de Paneth , células microplegadas , células en copa y células en penacho . Sus funciones se enumeran aquí: [8]
A lo largo del tracto digestivo, la distribución de los diferentes tipos de células epiteliales varía según la función de esa región. [5]

Importante para la función de barrera del epitelio intestinal, sus células están unidas de forma segura entre sí por cuatro tipos de unión celular que se pueden identificar a nivel ultraestructural : [14] [15]
Las uniones en hendidura acercan a las células adyacentes a 2 nanómetros una de otra. Están formadas por varias proteínas homólogas codificadas por la familia de genes de las conexinas que se unen para formar un complejo multiproteico . La estructura molecular de este complejo tiene forma de hexámero . El complejo, que está incrustado en las membranas celulares de las dos células unidas, forma un hueco o canal en medio de las seis proteínas. Este canal permite que varias moléculas , iones e impulsos eléctricos pasen entre las dos células. [16]
Estos complejos, que consisten en proteínas de adhesión transmembrana de la familia de las cadherinas , unen células adyacentes entre sí a través de sus citoesqueletos . [17] Los desmosomas dejan un espacio de 30 nanómetros entre las células. [16]
Las uniones adherentes, también llamadas zonula adherens, son complejos multiproteicos formados por proteínas de las familias de las cateninas y cadherinas. Se encuentran en la membrana en los puntos de contacto entre las células. Se forman por interacciones entre proteínas adaptadoras intracelulares , proteínas transmembrana y los citoesqueletos de actina de las células. Además de su papel en la unión de células adyacentes, estos complejos son importantes para regular la migración epitelial, la polaridad celular y la formación de otros complejos de unión celular. [15]
Las uniones estrechas, también llamadas zonula occludens, son los componentes más importantes del epitelio intestinal por su función de barrera. [18] Estos complejos, formados principalmente por miembros de las familias claudina y ocludina , constan de alrededor de 35 proteínas diferentes, [14] forman una cinta continua en forma de anillo alrededor de las células y están ubicados cerca de los bordes de las membranas laterales y apicales. [15]
Los dominios extracelulares de las proteínas transmembrana en células adyacentes se interconectan para formar un sello hermético. Estas interacciones incluyen aquellas entre proteínas de la misma membrana ("cis") y proteínas de células adyacentes ("trans"). Además, las interacciones pueden ser homofílicas (entre proteínas idénticas) o heterófilas (entre proteínas diferentes). [15]
De manera similar a las uniones adherentes, los dominios intracelulares de las uniones estrechas interactúan con diferentes proteínas de andamiaje , proteínas adaptadoras y complejos de señalización para regular la unión citoesquelética, la polaridad celular, la señalización celular y el tráfico vesical. [15]
Las uniones estrechas proporcionan un sello estrecho pero modificable entre células adyacentes en la capa epitelial y, por lo tanto, proporcionan un transporte paracelular selectivo de solutos. [15] Si bien antes se pensaba que eran estructuras estáticas, ahora se sabe que las uniones estrechas son dinámicas y pueden cambiar el tamaño de la abertura entre las células y, por lo tanto, adaptarse a los diferentes estados de desarrollo, fisiologías y patologías. [18] Funcionan como una barrera paracelular selectiva y semipermeable entre los compartimentos apical y basolateral de la capa epitelial. Su función es facilitar el paso de pequeños iones y solutos solubles en agua a través del espacio paracelular al tiempo que evitan el paso de antígenos luminales, microorganismos y sus toxinas. [15]
El epitelio intestinal tiene una estructura anatómica compleja que facilita la motilidad y las funciones digestivas, absortivas, inmunológicas y neuroendocrinas coordinadas. [19]
El moco secretado por las células caliciformes actúa como lubricante y protege la capa de células epiteliales contra la irritación del contenido de la mucosa. [20]
Tradicionalmente, las células de las criptas se consideraban principalmente células secretoras, mientras que los enterocitos se consideraban principalmente células de absorción. Sin embargo, estudios recientes han puesto en tela de juicio esta distribución funcional clásica y han demostrado que tanto las células de la superficie como las de las criptas pueden realizar funciones secretoras y de absorción y que, de hecho, estas funciones pueden ocurrir simultáneamente. [21] [22]
Sobre el borde en cepillo de la superficie apical de los enterocitos se encuentra el glicocáliz , que es una red laxa compuesta por las cadenas laterales de oligosacáridos de las hidrolasas integrales de membrana y otras enzimas esenciales para la digestión de proteínas y carbohidratos. Estas glicoproteínas , glicolípidos y enzimas catalizan las etapas digestivas finales de los carbohidratos y proteínas luminales. Los monosacáridos y aminoácidos así producidos se transportan posteriormente a través del epitelio intestinal y finalmente al torrente sanguíneo. [7]
La absorción de electrolitos y agua es una de las funciones más importantes del tracto digestivo. La absorción de agua es pasiva e isotónica, dependiendo de la velocidad y la dirección del flujo de soluto. Otros factores que influyen en la absorción de líquidos son la osmolaridad y la región intestinal específica. [19] La permeabilidad selectiva regulada se realiza a través de dos vías principales: la vía transcelular (transepitelial) y la vía paracelular. [15]

Consiste en el transporte específico de solutos a través de las células epiteliales. Está regulado predominantemente por las actividades de transportadores especializados que trasladan electrolitos específicos, aminoácidos, azúcares, ácidos grasos de cadena corta y otras moléculas dentro o fuera de la célula. [15]
La permeabilidad paracelular depende del transporte a través de los espacios que existen entre las células epiteliales. Está regulada por las uniones celulares que se localizan en las membranas laminares de las células. [15] Esta es la principal ruta de flujo pasivo de agua y solutos a través del epitelio intestinal. La regulación depende de las uniones estrechas intercelulares que tienen la mayor influencia en el transporte paracelular. [23] Estudios realizados con microscopio electrónico mostraron que la resistencia eléctrica de las capas epiteliales depende de la complejidad y el número de filamentos dentro de los complejos proteicos transmembrana de las uniones estrechas. [19] Además, la resistencia de la membrana plasmática y la conductancia transmembrana variable de las células epiteliales también pueden modular la función de la vía paracelular. [19]
La barrera formada por el epitelio intestinal separa el ambiente externo (el contenido de la luz intestinal ) del cuerpo [15] y es la superficie mucosa más extensa e importante del cuerpo. [18]
El epitelio intestinal cumple varias funciones cruciales y exhibe características inmunitarias tanto innatas como adaptativas. Controla de cerca su entorno intracelular y extracelular, comunica mensajes a las células vecinas e inicia rápidamente medidas activas de defensa y reparación, si es necesario. [24] Por un lado, actúa como una barrera, impidiendo la entrada de sustancias nocivas como antígenos extraños , toxinas y microorganismos . [14] [15] Por otro lado, actúa como un filtro selectivo que facilita la absorción de nutrientes dietéticos , electrolitos , agua y varias otras sustancias beneficiosas del lumen intestinal. [15]
Cuando se pierde la integridad de la barrera intestinal, aumenta la permeabilidad intestinal y puede producirse un paso incontrolado de sustancias nocivas. Esto puede provocar, según la predisposición genética del individuo, el desarrollo de inflamaciones , infecciones , alergias , enfermedades autoinmunes o cáncer , en el propio intestino o en otros órganos. [19]
Aunque funcionan principalmente como parte del sistema digestivo , los enterocitos del epitelio intestinal también expresan receptores tipo Toll y proteínas de dominio de oligomerización de nucleótidos que reconocen diversos tipos de microbios y contribuyen al funcionamiento del sistema inmunológico . [25] [26] Por lo tanto, el epitelio intestinal no solo sirve como una barrera física que separa la luz intestinal del cuerpo propiamente dicho, sino que también lleva a cabo funciones de reconocimiento de patógenos como parte del sistema inmunológico intrínseco .
La pérdida de integridad del epitelio intestinal desempeña un papel patogénico clave en la enfermedad inflamatoria intestinal (EII). [27] Los cambios en la composición de la microbiota intestinal son un factor ambiental importante en el desarrollo de la EII. Los cambios perjudiciales en la microbiota intestinal inducen una respuesta inmunitaria inapropiada (descontrolada) que da como resultado daño al epitelio intestinal. Las brechas en esta barrera crítica (el epitelio intestinal) permiten una mayor infiltración de microbiota que, a su vez, provoca más respuestas inmunitarias. La EII es una enfermedad multifactorial que, no obstante, está impulsada en parte por una respuesta inmunitaria exagerada a la microbiota intestinal que causa defectos en la función de la barrera epitelial. [28]
Los ácidos biliares son componentes normales del contenido luminal del tracto gastrointestinal , donde pueden actuar como detergentes fisiológicos y reguladores de la homeostasis epitelial intestinal . [29] La exposición excesiva a largo plazo de las células epiteliales intestinales a los ácidos biliares puede causar estrés oxidativo que conduce a daño oxidativo del ADN y mutación cancerígena . [30]