El glicocáliz ( pl.: glicocálices o glicocálix ) , también conocido como matriz pericelular y, en ocasiones, como capa celular, es una cubierta de glicoproteína y glicolípido que rodea las membranas celulares de las bacterias , las células epiteliales y otras células. Fue descrito en un artículo de revisión en 1970. [1]
Las células epiteliales animales tienen una capa similar a una pelusa en la superficie externa de sus membranas plasmáticas . Esta capa viscosa es el glicocáliz, que consta de varias fracciones de carbohidratos de glicolípidos y glicoproteínas de membrana , que sirven como moléculas de soporte. En general, la porción de carbohidratos de los glicolípidos que se encuentran en la superficie de las membranas plasmáticas ayuda a que estas moléculas contribuyan al reconocimiento , la comunicación y la adhesión intercelular entre células . [2]
El glicocáliz es un tipo de identificador que el cuerpo utiliza para distinguir entre sus propias células sanas y los tejidos trasplantados, las células enfermas o los organismos invasores. En el glicocáliz se incluyen moléculas de adhesión celular que permiten que las células se adhieran entre sí y guían el movimiento de las células durante el desarrollo embrionario. [3] El glicocáliz desempeña un papel importante en la regulación del tejido vascular endotelial , incluida la modulación del volumen de glóbulos rojos en los capilares . [4]
El término se aplicó inicialmente a la matriz de polisacáridos que recubre las células epiteliales, pero se ha descubierto que sus funciones van mucho más allá.
El glicocáliz se encuentra en la superficie apical de las células endoteliales vasculares que recubren el lumen . Cuando los vasos se tiñen con colorantes catiónicos como el azul alcián , la microscopía electrónica de transmisión muestra una pequeña capa de forma irregular que se extiende aproximadamente 50-100 nm hacia el interior del lumen de un vaso sanguíneo. Otro estudio utilizó tinción con tetróxido de osmio durante la sustitución por congelación y mostró que el glicocáliz endotelial podría tener hasta 11 μm de espesor. [5] Está presente en una amplia gama de lechos microvasculares (capilares) y macrovasos (arterias y venas). El glicocáliz también consta de una amplia gama de enzimas y proteínas que regulan la adherencia de leucocitos y trombocitos , ya que su función principal en la vasculatura es mantener la homeostasis del plasma y de la pared vascular. Estas enzimas y proteínas incluyen:
Las enzimas y proteínas mencionadas anteriormente sirven para reforzar la barrera del glicocáliz contra enfermedades vasculares y de otro tipo. Otra función principal del glicocáliz dentro del endotelio vascular es que protege las paredes vasculares de la exposición directa al flujo sanguíneo, al mismo tiempo que actúa como barrera de permeabilidad vascular. [6] Sus funciones protectoras son universales en todo el sistema vascular, pero su importancia relativa varía según su ubicación exacta en la vasculatura. En el tejido microvascular, el glicocáliz actúa como barrera de permeabilidad vascular al inhibir la coagulación y la adhesión de leucocitos. Los leucocitos no deben adherirse a la pared vascular porque son componentes importantes del sistema inmunológico que deben poder viajar a una región específica del cuerpo cuando sea necesario. En el tejido vascular arterial, el glicocáliz también inhibe la coagulación y la adhesión de leucocitos, pero a través de la mediación de la liberación de óxido nítrico inducida por el esfuerzo cortante . Otra función protectora en todo el sistema cardiovascular es su capacidad para afectar la filtración del líquido intersticial desde los capilares hacia el espacio intersticial. [7]
El glicocáliz, que se encuentra en la superficie apical de las células endoteliales , está compuesto por una red cargada negativamente de proteoglicanos , glicoproteínas y glicolípidos. [8] A lo largo de la superficie luminal del glicocáliz vascular existe una capa vacía que excluye los glóbulos rojos. [9]
Debido a que el glicocáliz es tan prominente en todo el sistema cardiovascular, la alteración de esta estructura tiene efectos perjudiciales que pueden causar enfermedades. Ciertos estímulos que causan ateroma pueden conducir a una mayor sensibilidad de la vasculatura. La disfunción inicial del glicocáliz puede ser causada por hiperglucemia o lipoproteínas de baja densidad ( LDL ) oxidadas, que luego causan aterotrombosis . En la microvasculatura, la disfunción del glicocáliz conduce a un desequilibrio interno de fluidos y potencialmente a un edema . En el tejido vascular arterial, la alteración del glicocáliz causa inflamación y aterotrombosis. [10]
Se han realizado experimentos para probar con precisión cómo se puede alterar o dañar el glicocáliz. Un estudio en particular utilizó un modelo de corazón perfundido aislado diseñado para facilitar la detección del estado de la porción de la barrera vascular y buscó causar el desprendimiento inducido por la agresión del glicocáliz para determinar la relación de causa y efecto entre el desprendimiento del glicocáliz y la permeabilidad vascular. Se pensó que la perfusión hipóxica del glicocáliz era suficiente para iniciar un mecanismo de degradación de la barrera endotelial. El estudio encontró que el flujo de oxígeno a través de los vasos sanguíneos no tenía que estar completamente ausente ( hipoxia isquémica ), pero que los niveles mínimos [ aclaración necesaria ] de oxígeno eran suficientes para causar la degradación. El desprendimiento del glicocáliz puede ser desencadenado por estímulos inflamatorios, como el factor de necrosis tumoral alfa . Sin embargo, sea cual sea el estímulo, el desprendimiento del glicocáliz conduce a un aumento drástico [ aclaración necesaria ] en la permeabilidad vascular. La permeabilidad de las paredes vasculares es una desventaja, ya que permitiría el paso de algunas macromoléculas u otros antígenos dañinos. [11]
Se han observado otras fuentes de daño al glicocáliz endotelial en varias condiciones patológicas como inflamación, [12] hiperglucemia, [13] isquemia-reperfusión, [14] infecciones virales [15] y sepsis. [16]
Algunos componentes clave del glicocáliz, como los sindecanos , el heparán sulfato , el condroitín sulfato y el hialuronano, pueden desprenderse de la capa endotelial mediante enzimas. La hialuronidasa , la heparanasa/heparinasa, las metaloproteasas de matriz y de tipo membrana , la trombina, la plasmina y la elastasa son algunos ejemplos de enzimas que pueden inducir el desprendimiento del glicocáliz y, por lo tanto, estas sheddasas pueden contribuir a la degradación de la capa de glicocáliz en varias condiciones patológicas. [17] La investigación muestra que la actividad de la hialuronidasa plasmática disminuye en el choque séptico experimental y clínico y, por lo tanto, no se considera una sheddasa en la sepsis. [18] Al mismo tiempo, aumenta la inhibición plasmática endógena de la hialuronidasa y podría servir como protección contra el desprendimiento del glicocáliz.
El estrés cortante del fluido también es un problema potencial si el glicocáliz se degrada por cualquier razón. Este tipo de estrés por fricción es causado por el movimiento de fluido viscoso (es decir, sangre) a lo largo del límite del lumen. Otro experimento similar se llevó a cabo para determinar qué tipos de estímulos causan estrés cortante del fluido. La medición inicial se tomó con microscopía intravital, que mostró una capa de plasma de movimiento lento, el glicocáliz, de 1 μm de espesor. El tinte ligero dañó el glicocáliz mínimamente, pero ese pequeño cambio aumentó el hematocrito capilar . Por lo tanto, la microscopía óptica de fluorescencia no debe usarse para estudiar el glicocáliz porque ese método en particular usa un tinte. El glicocáliz también puede reducirse en espesor cuando se trata con LDL oxidada. [19] Estos estímulos, junto con muchos otros factores, pueden causar daño al delicado glicocáliz. Estos estudios son evidencia de que el glicocáliz juega un papel crucial en la salud del sistema cardiovascular.
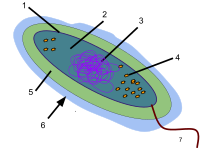
Un glicocáliz, que literalmente significa "capa de azúcar" ( glykys = dulce, kalyx = cáscara), es una red de polisacáridos que se proyectan desde las superficies celulares de las bacterias , lo que lo clasifica como un componente de superficie universal de una célula bacteriana, que se encuentra justo fuera de la pared celular bacteriana. Un glicocáliz gelatinoso distintivo se llama cápsula , mientras que una capa irregular y difusa se llama capa de baba . Esta capa está extremadamente hidratada y se tiñe de rojo rutenio .
Las bacterias que crecen en ecosistemas naturales, como el suelo, los intestinos bovinos o el tracto urinario humano, están rodeadas por una especie de microcolonia encerrada en un glicocáliz . [20] Sirve para proteger a la bacteria de los fagocitos dañinos creando cápsulas o permitiendo que la bacteria se adhiera a superficies inertes, como dientes o rocas, a través de biopelículas (por ejemplo, Streptococcus pneumoniae se adhiere a células pulmonares, procariotas u otras bacterias que pueden fusionar sus glicocálices para envolver la colonia).
También se puede encontrar un glicocáliz en la porción apical de las microvellosidades del tracto digestivo , especialmente en el intestino delgado. Crea una malla de 0,3 μm de espesor y está formada por mucopolisacáridos ácidos y glicoproteínas que se proyectan desde la membrana plasmática apical de las células absorbentes epiteliales. Proporciona una superficie adicional para la adsorción e incluye enzimas secretadas por las células absorbentes que son esenciales para los pasos finales de la digestión de proteínas y azúcares.