La anquilostoma es una infección causada por un tipo de parásito intestinal conocido como anquilostoma . [1] [5] Inicialmente, puede producirse picazón y sarpullido en el lugar de la infección. Aquellos que sólo se ven afectados por unos pocos gusanos pueden no presentar síntomas. Las personas infectadas por muchos gusanos pueden experimentar dolor abdominal , diarrea, pérdida de peso y cansancio . El desarrollo físico y mental de los niños puede verse afectado. Puede producirse anemia . [1]
Dos infecciones comunes por anquilostomiasis en humanos son la anquilostomiasis y la necatoriasis , causadas por las especies Ancylostoma duodenale y Necator americanus respectivamente. Los huevos de anquilostoma se depositan en las heces de las personas infectadas. Si estos terminan en el medio ambiente, pueden convertirse en larvas (gusanos inmaduros), que luego pueden penetrar la piel. Un tipo también se puede transmitir a través de alimentos contaminados. Los factores de riesgo incluyen caminar descalzo en climas cálidos, donde el saneamiento es deficiente. El diagnóstico se realiza mediante el examen de una muestra de heces con un microscopio . [1]
La enfermedad se puede prevenir a nivel individual no caminando descalzo en zonas donde la enfermedad es común. A nivel poblacional, disminuir la defecación al aire libre , no utilizar heces crudas como fertilizante y la desparasitación masiva son efectivos. [1] El tratamiento suele ser con los medicamentos albendazol o mebendazol durante uno a tres días. Es posible que se necesiten suplementos de hierro en personas con anemia. [3]
Los anquilostomas infectaron a alrededor de 428 millones de personas en 2015. [4] Las infecciones graves pueden ocurrir tanto en niños como en adultos, pero son menos comunes en los adultos. [2] Rara vez son fatales. [6] La anquilostomiasis es una helmintiasis transmitida por el suelo y está clasificada como una enfermedad tropical desatendida . [7]
Ningún síntoma o signo es específico de la anquilostomiasis, pero da lugar a una combinación de inflamación intestinal y anemia progresiva por deficiencia de hierro y deficiencia de proteínas . La tos, el dolor de pecho, las sibilancias y la fiebre a veces son el resultado de una infección grave. También pueden ocurrir dolores epigástricos, indigestión, náuseas, vómitos , estreñimiento y diarrea en etapas tempranas o posteriores, aunque los síntomas gastrointestinales tienden a mejorar con el tiempo. Los signos de infección grave avanzada son los de anemia y deficiencia de proteínas, que incluyen emaciación , insuficiencia cardíaca y distensión abdominal con ascitis . [ cita necesaria ]
La invasión larval de la piel (principalmente en las Américas) puede producir una enfermedad de la piel llamada larva migrans cutánea, también conocida como erupción rastrera. Los huéspedes de estos gusanos no son humanos y las larvas sólo pueden penetrar las cinco capas superiores de la piel, donde provocan un intenso picor local , normalmente en el pie o en la parte inferior de la pierna, conocido como picor del suelo . Esta infección se debe a larvas del anquilostoma A. braziliense . Las larvas migran en túneles tortuosos entre el estrato basal y el estrato córneo de la piel, provocando lesiones vesiculares serpiginosas . Con el avance de las larvas, las porciones posteriores de las lesiones se vuelven secas y con costras. Las lesiones suelen provocar una picazón intensa. [8]
El período de incubación puede variar entre unas pocas semanas y muchos meses y depende en gran medida de la cantidad de parásitos anquilostomas con los que esté infectado un individuo. [9]

Las infecciones por anquilostomas en humanos incluyen anquilostomiasis y necatoriasis . La anquilostomiasis es causada por Ancylostoma duodenale , que es el tipo más común que se encuentra en Medio Oriente , África del Norte , India y (anteriormente) en el sur de Europa . La necatoriasis es causada por Necator americanus , el tipo más común en América , África subsahariana , el sudeste asiático , China e Indonesia . [ cita necesaria ]
Otros animales como pájaros , perros y gatos también pueden verse afectados. A. tubaeforme infecta a gatos, A. caninum infecta a perros y A. braziliense y Uncinaria stenocephala infectan tanto a gatos como a perros. Algunas de estas infecciones pueden transmitirse a los humanos . [10]
Los gusanos A. duodenale son de color blanco grisáceo o rosado y tienen la cabeza ligeramente inclinada en relación con el resto del cuerpo. Esta curva forma una forma de gancho definitiva en el extremo anterior que da nombre a los anquilostomas. Poseen bocas bien desarrolladas con dos pares de dientes. Mientras que los machos miden aproximadamente un centímetro por 0,5 milímetros, las hembras suelen ser más largas y robustas. Además, los machos se pueden distinguir de las hembras por la presencia de una bolsa copuladora posterior prominente. [11]
N. americanus es muy similar en morfología a A. duodenale . N. americanus es generalmente más pequeño que A. duodenale , los machos suelen medir entre 5 y 9 mm de largo y las hembras aproximadamente 1 cm de largo. Mientras que A. duodenale posee dos pares de dientes, N. americanus posee un par de placas cortantes en la cápsula bucal. Además, la forma del gancho está mucho más definida en Necator que en Ancylostoma . [11]
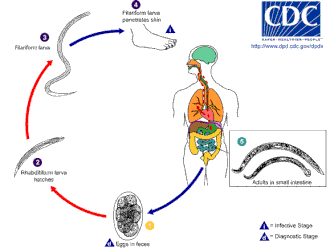
La anquilostoma prospera en suelos cálidos donde las temperaturas superan los 18 °C (64 °F). Existen principalmente en suelos arenosos o arcillosos y no pueden vivir en arcilla o barro. Los promedios de precipitaciones deben ser superiores a 1.000 mm (39 pulgadas) al año para que sobrevivan. Sólo si se dan estas condiciones los huevos pueden eclosionar. Las larvas infecciosas de N. americanus pueden sobrevivir a temperaturas más altas, mientras que las de A. duodenale se adaptan mejor a climas más fríos. Generalmente, viven sólo unas pocas semanas como máximo en condiciones naturales y mueren casi inmediatamente al exponerse a la luz solar directa o a la desecación . [ cita necesaria ]
La infección del huésped es por las larvas, no por los huevos. Si bien A. duodenale puede ingerirse, el método habitual de infección es a través de la piel; Esto comúnmente es causado por caminar descalzo por áreas contaminadas con materia fecal. Las larvas son capaces de penetrar la piel del pie, y una vez dentro del cuerpo, migran a través del sistema vascular hasta los pulmones , y de allí suben a la tráquea , y son deglutidas. Luego pasan por el esófago y entran al sistema digestivo, terminando su recorrido en el intestino , donde las larvas maduran hasta convertirse en gusanos adultos. [12] [13]
Una vez en el intestino del huésped, Necator tiende a causar una infección prolongada, generalmente de 1 a 5 años (muchos gusanos mueren uno o dos años después de infectarse), aunque se ha registrado que algunos gusanos adultos viven 15 años o más. Los adultos de Ancylostoma tienen una vida corta y sobreviven en promedio solo unos 6 meses. Sin embargo, la infección puede prolongarse porque las larvas latentes pueden "reclutar" secuencialmente a partir de "almacenes" de tejido (ver Patología, más arriba) durante muchos años, para reemplazar a los gusanos adultos expirados. Esto puede dar lugar a fluctuaciones estacionales en la prevalencia e intensidad de la infección (aparte de las variaciones estacionales normales en la transmisión). [ cita necesaria ]

Se aparean dentro del huésped; las hembras ponen de 10.000 a 30.000 huevos por día y entre 15 y 56 millones de huevos durante su vida adulta, que se excretan en las heces. Debido a que se necesitan de 5 a 7 semanas para que los gusanos adultos maduren, se apareen y produzcan huevos, en las primeras etapas de una infección muy grave, pueden ocurrir síntomas agudos sin que se detecten huevos en las heces del paciente. Esto puede dificultar mucho el diagnóstico. [ cita necesaria ]
Los huevos de N. americanus y A. duodenale se pueden encontrar en suelos cálidos y húmedos, donde eventualmente eclosionan y se convierten en larvas de primera etapa, o L1. L1, la etapa rabditoforme no infecciosa que se alimenta, se alimentará de microbios del suelo y eventualmente mudará en larvas de segunda etapa, L2, que también se encuentra en la etapa rabditoforme. Se alimentará durante unos 7 días y luego mudará hasta convertirse en larva de tercer estadio, o L3. Esta es la etapa filariforme del parásito, es decir, la forma infectiva de las larvas que no se alimentan. Las larvas L3 son extremadamente móviles y buscan terrenos más elevados para aumentar sus posibilidades de penetrar la piel de un huésped humano. Las larvas L3 pueden sobrevivir hasta 2 semanas sin encontrar un huésped. Mientras que las larvas de N. americanus solo infectan a través de la penetración de la piel, A. duodenale puede infectar tanto por penetración como por vía oral. Una vez que las larvas L3 han ingresado con éxito al huésped, viajan a través de las vénulas subcutáneas y los vasos linfáticos del huésped humano. Finalmente, las larvas L3 ingresan a los pulmones a través de los capilares pulmonares y penetran en los alvéolos. Luego viajan por la tráquea para ser tosidos y tragados por el huésped. Después de ser tragadas, las larvas L3 se encuentran en el intestino delgado, donde mudan a la etapa L4, o gusano adulto. Todo el proceso, desde la penetración en la piel hasta el desarrollo adulto, tarda entre 5 y 9 semanas. Las hembras adultas liberan huevos ( N. americanus alrededor de 9.000 a 10.000 huevos/día y A. duodenale 25.000 a 30.000 huevos/día), que pasan a través de las heces del huésped humano. Estos huevos eclosionan en el medio ambiente al cabo de varios días y el ciclo comienza de nuevo. [12] [14] [15]
La infección por anquilostomiasis generalmente se considera asintomática, pero, como describió Norman Stoll en 1962, es una infección extremadamente peligrosa porque su daño es "silencioso e insidioso". [16] Un individuo puede experimentar síntomas generales poco después de la infección. La picazón, que es una reacción alérgica en el lugar de penetración y entrada del parásito, es común en pacientes infectados con N. americanus . [11] Además, pueden producirse tos y neumonitis a medida que las larvas comienzan a penetrar en los alvéolos y viajar hasta la tráquea. Luego, una vez que las larvas llegan al intestino delgado del huésped y comienzan a madurar, el individuo infectado experimentará diarrea y otras molestias gastrointestinales. [11] Sin embargo, los síntomas "silenciosos e insidiosos" a los que se refiere Stoll están relacionados con infecciones crónicas por anquilostomas de gran intensidad. La principal morbilidad asociada con la anquilostomiasis es causada por la pérdida de sangre intestinal, la anemia por deficiencia de hierro y la desnutrición proteica. [14] Resultan principalmente de anquilostomas adultos en el intestino delgado que ingieren sangre, rompen eritrocitos y degradan la hemoglobina en el huésped. [12] Esta pérdida de sangre a largo plazo puede manifestarse físicamente a través de edema facial y periférico ; Algunos pacientes infectados por anquilostomas también experimentan eosinofilia y pica/ geofagia causadas por anemia por deficiencia de hierro. [11] Recientemente, se ha prestado más atención a otros resultados importantes de la anquilostomiasis que desempeñan un papel importante en la salud pública. Actualmente se acepta ampliamente que los niños que padecen una infección crónica por anquilostomas pueden experimentar retraso en el crecimiento, así como deficiencias intelectuales y cognitivas. [12] [17] Además, investigaciones recientes se han centrado en el potencial de resultados materno-fetales adversos cuando la madre se infecta con uncinarias durante el embarazo. [ cita necesaria ]
La enfermedad se relacionó con gusanos nematodos ( Ankylostoma duodenalis ) de un tercio a media pulgada de largo en el intestino, principalmente a través de los trabajos de Theodor Bilharz y Griesinger en Egipto (1854). [18]
Los síntomas pueden estar relacionados con la inflamación del intestino estimulada por la alimentación de anquilostomas, como náuseas, dolor abdominal y diarrea intermitente, y con anemia progresiva en caso de enfermedad prolongada: apetito caprichoso, pica / geofagia (o comer tierra), estreñimiento obstinado seguido de diarrea , palpitaciones , pulso filiforme, frialdad de la piel, palidez de las mucosas, fatiga y debilidad, dificultad para respirar y, en los casos de evolución mortal, disentería , hemorragias y edemas . [18] Los gusanos chupan sangre y dañan la mucosa . Sin embargo, la pérdida de sangre en las heces no es visible. [ cita necesaria ]
Los análisis de sangre en las primeras etapas de la infección a menudo muestran un aumento en el número de eosinófilos, un tipo de glóbulo blanco que se estimula preferentemente con infecciones por gusanos en los tejidos (también están presentes grandes cantidades de eosinófilos en la respuesta inflamatoria local). Se observará una caída de los niveles de hemoglobina en sangre en casos de infección prolongada con anemia. [ cita necesaria ]
A diferencia de la mayoría de las helmintiasis intestinales , donde las cargas parasitarias más intensas tienden a ocurrir en los niños, la prevalencia e intensidad de uncinarias pueden ser mayores entre los hombres adultos. La explicación de esto es que la infección por anquilostomiasis tiende a ser ocupacional, de modo que los compañeros de trabajo y otros grupos cercanos mantienen una alta prevalencia de infección entre ellos al contaminar su entorno laboral. Sin embargo, en la mayoría de las zonas endémicas, las mujeres adultas son las más gravemente afectadas por la anemia, principalmente porque tienen necesidades fisiológicas de hierro mucho mayores (menstruación, embarazos repetidos). Una consecuencia interesante de esto en el caso de la infección por Ancylostoma duodenale es la transmisión translactacional de Infección: no todas las larvas de esta especie, que invasan la piel, pasan inmediatamente a través de los pulmones y llegan al intestino, sino que se propagan por todo el cuerpo a través de la circulación y quedan latentes dentro de las fibras musculares. En una mujer embarazada, después del parto, algunas o todas estas larvas son estimuladas para volver a entrar en la circulación (presumiblemente por cambios hormonales repentinos) y luego pasar a las glándulas mamarias, de modo que el recién nacido pueda recibir una gran dosis de larvas infecciosas. a través de la leche de su madre. Esto explica casos de otro modo inexplicables de infecciones por anquilostomiasis muy graves, incluso mortales, en niños de aproximadamente un mes de edad, en lugares como China, India y el norte de Australia. Un fenómeno idéntico se observa mucho más comúnmente con las infecciones por Ancylostoma caninum en perros, donde los cachorros recién nacidos pueden incluso morir de hemorragia intestinal causada por una gran cantidad de anquilostomas que se alimentan. Esto también refleja el estrecho vínculo evolutivo entre los parásitos humanos y caninos, que probablemente tienen un ancestro común que se remonta a cuando los humanos y los perros comenzaron a vivir estrechamente juntos. Las larvas filariformes son la etapa infectiva del parásito: la infección ocurre cuando las larvas en el suelo penetran la piel o cuando se ingieren a través de alimentos y agua contaminados después de la penetración en la piel. [ cita necesaria ]

El diagnóstico depende de encontrar huevos de gusanos característicos en el examen microscópico de las heces, aunque esto no es posible en la infección temprana. Los primeros signos de infección en la mayoría de los perros incluyen cojera limbular y picazón anal. Los huevos son ovalados o elípticos, miden 60 por 40 µm, incoloros, no teñidos de bilis y con una fina membrana de cáscara hialina transparente . Cuando el gusano lo libera en el intestino, el óvulo contiene un óvulo no segmentado . Durante su paso por el intestino, el óvulo se desarrolla y por tanto los óvulos que pasan en las heces tienen un óvulo segmentado, normalmente con 4 a 8 blastómeros . Como los huevos de Ancylostoma y Necator (y de la mayoría de las otras especies de anquilostomas) son indistinguibles, para identificar el género se deben cultivar en el laboratorio para permitir que las larvas eclosionen. Si la muestra fecal se deja durante un día o más en condiciones tropicales, las larvas habrán eclosionado, por lo que es posible que los huevos ya no sean evidentes. En tal caso, es esencial distinguir los anquilostomas de las larvas de Strongyloides , ya que la infección por estas últimas tiene implicaciones más graves y requiere un manejo diferente. Las larvas de las dos especies de anquilostomas también se pueden distinguir microscópicamente, aunque esto no se hace de forma rutinaria, sino normalmente con fines de investigación. Rara vez se ven gusanos adultos (excepto mediante endoscopia, cirugía o autopsia), pero si se encuentran, permitirían la identificación definitiva de la especie. La clasificación se puede realizar en función de la longitud de la cavidad bucal, el espacio entre la abertura bucal y el esófago: las larvas rabditoformes de uncinarias tienen cavidades bucales largas, mientras que las larvas rabditoformes de Strongyloides tienen cavidades bucales cortas. [11]
Las investigaciones recientes se han centrado en el desarrollo de herramientas basadas en el ADN para el diagnóstico de infecciones, la identificación específica de uncinarias y el análisis de la variabilidad genética dentro de las poblaciones de anquilostomas. [19] Debido a que los huevos de anquilostoma a menudo son indistinguibles de otros huevos de parásitos, los ensayos de PCR podrían servir como un enfoque molecular para el diagnóstico preciso de anquilostoma en las heces. [19] [20]
Las larvas infecciosas se desarrollan y sobreviven en un ambiente de tierra húmeda, particularmente suelo arenoso y arcilloso. No pueden sobrevivir en arcilla o lodo. Las principales líneas de precaución son las que dictan las buenas conductas de higiene :
La moxidectina está disponible en los Estados Unidos como solución tópica ( imidacloprid + moxidectina) para perros y gatos. Utiliza moxidectina para el control y la prevención de ascárides, anquilostomas, dirofilariasis y tricocéfalos .
.jpg/440px-Medical_Civic_Action_Program_in_Shinile_Woreda,_Ethiopia,_2010_(5120478292).jpg)
La mayoría de estos problemas de salud pública se han centrado en los niños infectados con anquilostomas. Este enfoque en los niños se debe en gran medida a la gran cantidad de evidencia que ha demostrado fuertes asociaciones entre la infección por anquilostomiasis y problemas de aprendizaje, aumento de las ausencias escolares y disminución de la productividad económica futura. [12] En 2001, la 54.ª Asamblea Mundial de la Salud aprobó una resolución exigiendo a los estados miembros que alcanzaran un objetivo mínimo de desparasitación regular de al menos el 75% de todos los niños en edad escolar en riesgo para el año 2010. [21] A 2008 Organización Mundial de la Salud La publicación informó sobre estos esfuerzos para tratar a niños escolares en riesgo. Algunas de las estadísticas interesantes fueron las siguientes: 1) sólo 9 de 130 países endémicos pudieron alcanzar la meta del 75%; y 2) se llegó a menos de 77 millones de niños en edad escolar (del total de 878 millones en riesgo), lo que significa que sólo el 8,78% de los niños en riesgo están recibiendo tratamiento por anquilostoma. [22]
Los programas de desparasitación masiva en las escuelas han sido la estrategia más popular para abordar el problema de la anquilostomiasis en los niños. Los programas escolares son extremadamente rentables ya que las escuelas ya cuentan con una infraestructura disponible, extensa y sostenida con una fuerza laboral calificada que tiene una estrecha relación con la comunidad. [21] Con poca capacitación por parte del sistema de salud local, los maestros pueden administrar fácilmente los medicamentos que a menudo cuestan menos de 0,50 dólares por niño al año. [23]
Recientemente, muchas personas han comenzado a preguntarse si los programas escolares son necesariamente el enfoque más eficaz. Una preocupación importante con los programas escolares es que a menudo no llegan a los niños que no asisten a la escuela, ignorando así a un gran número de niños en riesgo. Un estudio de 2008 de Massa et al. Continuó el debate sobre los programas escolares. Examinaron los efectos de los tratamientos dirigidos a la comunidad versus los tratamientos escolares en la región de Tanga en Tanzania. Una conclusión importante fue que la intensidad media de la infección por anquilostomas era significativamente menor en las aldeas que empleaban el enfoque de tratamiento dirigido a la comunidad que el enfoque basado en la escuela. El modelo de tratamiento dirigido por la comunidad utilizado en este estudio específico permitió a los aldeanos tomar el control del tratamiento del niño al hacer que los aldeanos seleccionaran a sus propios distribuidores comunitarios de medicamentos para administrar los medicamentos antihelmínticos. Además, los aldeanos organizaron e implementaron sus propios métodos para distribuir las drogas a todos los niños. [24] Los resultados positivos asociados con este nuevo modelo resaltan la necesidad de una participación comunitaria a gran escala en las campañas de desparasitación. [ cita necesaria ]
Muchos programas masivos de desparasitación también combinan sus esfuerzos con una educación en salud pública. Estos programas de educación para la salud a menudo enfatizan importantes técnicas preventivas como: lavarse las manos antes de comer y mantenerse alejado del agua o de áreas contaminadas con heces humanas. Estos programas también pueden enfatizar que se deben usar zapatos; sin embargo, estos conllevan sus propios riesgos para la salud y pueden no ser efectivos. [25] Los patrones de uso de calzado en ciudades y pueblos de todo el mundo están determinados por las creencias culturales y los niveles de educación dentro de esa sociedad. El uso de zapatos evitará la entrada de infecciones por anquilostomas de los suelos circundantes a las zonas sensibles de la piel; como las zonas entre los dedos de los pies. [26]
Ejemplos históricos, como las campañas contra los anquilostomas en Mississippi y Florida entre 1943 y 1947, han demostrado que la causa principal de la infección por anquilostomas es el saneamiento deficiente, que puede solucionarse construyendo y manteniendo sanitarios . Pero si bien estas pueden parecer tareas simples, plantean importantes desafíos de salud pública. La mayoría de las poblaciones infectadas provienen de zonas afectadas por la pobreza y con condiciones sanitarias muy deficientes. Por lo tanto, lo más probable es que los niños en situación de riesgo no tengan acceso a agua potable para lavarse las manos y vivan en entornos sin una infraestructura sanitaria adecuada. Por lo tanto, la educación sanitaria debe abordar las medidas preventivas de manera que sean viables y sostenibles en el contexto de entornos con recursos limitados. [ cita necesaria ]
La evaluación de numerosas intervenciones de salud pública ha demostrado en general que la mejora en cada componente individual normalmente atribuido a la pobreza (por ejemplo, saneamiento, educación sanitaria y estado nutricional subyacente) a menudo tiene un impacto mínimo en la transmisión. Por ejemplo, un estudio encontró que la introducción de letrinas en una comunidad con recursos limitados solo redujo la prevalencia de la infección por anquilostomas en un cuatro por ciento. [27] Sin embargo, otro estudio en Salvador, Brasil, encontró que la mejora del drenaje y el alcantarillado tuvo un impacto significativo en la prevalencia de la anquilostomiasis, pero ningún impacto en la intensidad de la infección por anquilostomas. [28] Esto parece sugerir que el control ambiental por sí solo tiene un efecto limitado pero incompleto sobre la transmisión de anquilostomas. Por lo tanto, es imperativo que se realicen más investigaciones para comprender la eficacia y sostenibilidad de los programas integrados que combinan numerosos métodos preventivos, incluidos la educación, el saneamiento y el tratamiento.
El tratamiento más común para la anquilostomiasis son los benzimidazoles , específicamente albendazol y mebendazol . Los BZA matan a los gusanos adultos uniéndose a la β- tubulina del nematodo y posteriormente inhibiendo la polimerización de los microtúbulos dentro del parásito. [14] En determinadas circunstancias, se pueden utilizar levamisol y pamoato de pirantel . [12] Una revisión de 2008 encontró que la eficacia de los tratamientos de dosis única para las infecciones por anquilostomas fue la siguiente: 72% para albendazol, 15% para mebendazol y 31% para pamoato de pirantel. [29] Esto corrobora afirmaciones anteriores de que el albendazol es mucho más eficaz que el mebendazol para las infecciones por anquilostomas. También es de destacar que la Organización Mundial de la Salud recomienda el tratamiento antihelmíntico en mujeres embarazadas después del primer trimestre. [14] También se recomienda que, si el paciente también tiene anemia, se administre sulfato ferroso (200 mg) tres veces al día al mismo tiempo que el tratamiento antihelmíntico; esto debe continuar hasta que los valores de hemoglobina vuelvan a la normalidad, lo que podría tardar hasta 3 meses. [11]
La anquilostoma se puede tratar con crioterapia local cuando la anquilostomiasis todavía está en la piel. [30]
El albendazol es eficaz tanto en la etapa intestinal como durante la etapa en que el parásito aún está migrando debajo de la piel. [30]
En caso de anemia, la suplementación con hierro puede aliviar los síntomas de la anemia por deficiencia de hierro . Sin embargo, a medida que se restablecen los niveles de glóbulos rojos, puede desarrollarse una escasez de otros elementos esenciales como el ácido fólico o la vitamina B 12 , por lo que también se pueden complementar.
Durante la década de 1910, los tratamientos comunes para los anquilostomas incluían timol , 2-naftol , cloroformo , gasolina y aceite de eucalipto . [31] En la década de 1940, el tratamiento de elección utilizaba tetracloroetileno , [32] administrado en dosis de 3 a 4 cc en ayunas, seguido de 30 a 45 g de sulfato de sodio . Se informó que el tetracloroetileno tenía una tasa de curación del 80 por ciento para las infecciones por Necator, pero del 25 por ciento para las infecciones por Ancylostoma, y a menudo producía una intoxicación leve en el paciente.
Otras cuestiones importantes relacionadas con el tratamiento de la anquilostoma son la reinfección y la resistencia a los medicamentos. Se ha demostrado que la reinfección después del tratamiento puede ser extremadamente elevada. Algunos estudios incluso muestran que el 80% de las tasas de infección por anquilostomiasis previas al tratamiento se pueden observar en las comunidades tratadas en un plazo de 30 a 36 meses. [14] Si bien puede ocurrir una reinfección, aún se recomienda que se realicen tratamientos regulares, ya que esto minimizará la aparición de resultados crónicos. También existe una creciente preocupación por la cuestión de la resistencia a los medicamentos. Ha aparecido resistencia a los medicamentos en los antihelmínticos de primera línea utilizados para los nematodos del ganado. En general, los nematodos humanos tienen menos probabilidades de desarrollar resistencia debido a tiempos de reproducción más prolongados, tratamientos menos frecuentes y tratamientos más específicos. No obstante, la comunidad mundial debe tener cuidado de mantener la eficacia de los antihelmínticos actuales, ya que no hay nuevos medicamentos antihelmínticos en las últimas etapas de desarrollo. [14]
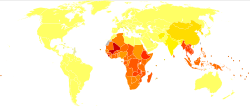
Se estima que entre 576 y 740 millones de personas están infectadas con anquilostomas. [33] [14] De estos individuos infectados, alrededor de 80 millones están gravemente afectados. [19] La principal causa de infección por anquilostomiasis es N. americanus , que se encuentra en América, África subsahariana y Asia. [12] A. duodenale se encuentra en entornos focales más dispersos, a saber, Europa y el Mediterráneo. La mayoría de las personas infectadas se concentran en África subsahariana y Asia oriental/islas del Pacífico, y cada región tiene estimaciones de 198 millones y 149 millones de personas infectadas, respectivamente. Otras regiones afectadas incluyen: Asia del Sur (50 millones), América Latina y el Caribe (50 millones), Asia del Sur (59 millones), Medio Oriente/África del Norte (10 millones). [14] La mayoría de estas personas infectadas viven en zonas afectadas por la pobreza y con condiciones sanitarias deficientes. La infección por anquilostomas se concentra más entre los más pobres del mundo, que viven con menos de 2 dólares al día. [12]
Si bien la anquilostomiasis puede no provocar directamente la mortalidad, sus efectos sobre la morbilidad exigen atención inmediata. Al considerar los años de vida ajustados por discapacidad (AVAD), las enfermedades tropicales desatendidas, incluida la anquilostomiasis, se ubican entre las enfermedades diarreicas, la cardiopatía isquémica , la malaria y la tuberculosis como uno de los problemas de salud más importantes del mundo en desarrollo.
Se ha estimado que se han perdido hasta 22,1 millones de AVAD debido a la anquilostomiasis. Recientemente, ha habido un interés creciente por abordar los problemas de salud pública asociados con la infección por anquilostomas. Por ejemplo, la Fundación Bill y Melinda Gates donó recientemente 34 millones de dólares para luchar contra las enfermedades tropicales desatendidas, incluida la anquilostoma. [34] El ex presidente estadounidense Clinton también anunció un megacompromiso en la Reunión Anual de 2008 de la Iniciativa Global Clinton (CGI) para desparasitar a 10 millones de niños. [35]
Muchas de las cifras relativas a la prevalencia de la anquilostomiasis son estimaciones, ya que actualmente no existe ningún mecanismo de vigilancia internacional para determinar la prevalencia y la distribución global. [12] Algunas tasas de prevalencia se han medido a través de datos de encuestas en regiones endémicas de todo el mundo. Los siguientes son algunos de los hallazgos más recientes sobre las tasas de prevalencia en regiones donde la anquilostomiasis es endémica.
Darjeeling , distrito de Hooghly , Bengala Occidental , India (Pal et al. 2007) [36]
Pueblo de Xiulongkan, provincia de Hainan , China (Gandhi et al. 2001) [37]
Hòa Bình , noroeste de Vietnam (Verle et al. 2003) [38]
Minas Gerais , Brasil (Fleming et al. 2006) [39]
KwaZulu-Natal , Sudáfrica (Mabaso et al. 2004) [40]
Condado de Lowndes, Alabama , Estados Unidos [41] [42]
También ha habido avances tecnológicos que pueden facilitar un mapeo más preciso de la prevalencia de uncinarias. Algunos investigadores han comenzado a utilizar sistemas de información geográfica (SIG) y sensores remotos (RS) para examinar la ecología y epidemiología de los helmintos. Brooker y cols. utilizó esta tecnología para crear mapas de distribución de helmintos del África subsahariana. Al relacionar datos ambientales obtenidos por satélite con datos de prevalencia de encuestas escolares, pudieron crear mapas de prevalencia detallados. El estudio se centró en una amplia gama de helmintos, pero se encontraron conclusiones interesantes sobre la anquilostomiasis específicamente. En comparación con otros helmintos, los anquilostomas pueden sobrevivir en condiciones mucho más cálidas y tienen una gran prevalencia en el extremo superior del rango térmico. [43]
Las herramientas de diagnóstico molecular mejoradas son otro avance tecnológico que podría ayudar a mejorar las estadísticas de prevalencia existentes. Investigaciones recientes se han centrado en el desarrollo de una herramienta basada en el ADN que pueda utilizarse para el diagnóstico de infecciones, la identificación específica de anquilostomas y el análisis de la variabilidad genética en poblaciones de anquilostomas. Una vez más, esto puede servir como una herramienta importante para diferentes medidas de salud pública contra la anquilostomiasis. La mayor parte de la investigación sobre herramientas de diagnóstico se centra ahora en la creación de un ensayo rápido y rentable para el diagnóstico específico de la anquilostomiasis. Muchos tienen la esperanza de que se pueda lograr su desarrollo en los próximos cinco años. [ ¿ cuando? ] [19]
Los síntomas que ahora se atribuyen a la anquilostomiasis aparecen en documentos de papiro del antiguo Egipto ( c. 1500 a. C. ), descritos como un trastorno caracterizado por anemia. Avicena , médico persa del siglo XI, descubrió el gusano en varios de sus pacientes y lo relacionó con su enfermedad. En épocas posteriores, la afección prevaleció notablemente en la industria minera de Inglaterra , Francia , Alemania , Bélgica , el norte de Queensland y otros lugares. [18]
El médico italiano Angelo Dubini fue el descubridor del gusano en 1838, tras la autopsia de una campesina. Dubini publicó detalles en 1843 e identificó la especie como A. duodenale . Trabajando en el sistema médico egipcio en 1852, el médico alemán Theodor Bilharz , basándose en el trabajo de su colega Wilhelm Griesinger , encontró estos gusanos durante las autopsias y dio un paso más al vincularlos con casos endémicos locales de clorosis , que probablemente se llamaría deficiencia de hierro. Anemia hoy.
Un gran avance se produjo 25 años más tarde, tras una epidemia de diarrea y anemia que se produjo entre los trabajadores italianos empleados en el túnel ferroviario del San Gotardo . [18] En un artículo de 1880, los médicos Camillo Bozzolo , Edoardo Perroncito y Luigi Pagliani plantearon correctamente la hipótesis de que la anquilostomiasis estaba relacionada con el hecho de que los trabajadores tenían que defecar dentro del túnel de 15 km y que muchos usaban zapatos gastados. [44] El entorno de trabajo a menudo contenía agua estancada, a veces hasta las rodillas, y las larvas eran capaces de sobrevivir varias semanas en el agua, lo que les permitía infectar a muchos de los trabajadores. En 1897 se estableció que la piel era la principal vía de infección y se aclaró el ciclo de vida biológico de la anquilostoma.
En 1899, el zoólogo estadounidense Charles Wardell Stiles identificó la anemia perniciosa progresiva observada en el sur de los Estados Unidos como causada por el anquilostoma A. duodenale . Las pruebas realizadas en el siglo XX revelaron infestaciones muy graves en niños en edad escolar. En Puerto Rico , el Dr. Bailey K. Ashford, un médico del ejército estadounidense, organizó y llevó a cabo una campaña de tratamiento de parásitos, que curó aproximadamente a 300.000 personas (un tercio de la población puertorriqueña) y redujo la tasa de mortalidad por esta anemia en un 90 por ciento. durante los años 1903-04.

El 26 de octubre de 1909, se organizó la Comisión Sanitaria Rockefeller para la Erradicación de la Anquilostomiasis como resultado de una donación de 1 millón de dólares de John D. Rockefeller , Sr. El programa de cinco años fue un éxito notable y una gran contribución a la salud pública de los Estados Unidos, inculcando educación pública, medicamentos, trabajo de campo y departamentos de salud gubernamentales modernos en once estados del sur. [45] La exhibición de anquilostomas fue una parte destacada de la feria estatal de Mississippi de 1910.
La comisión encontró que un promedio del 40% de los niños en edad escolar estaban infectados con anquilostomas. Las áreas con niveles más altos de infección por anquilostomas antes del programa de erradicación experimentaron mayores aumentos en la matrícula escolar, la asistencia y la alfabetización después de la intervención. Los estudios econométricos han demostrado que este efecto no puede explicarse por una variedad de factores alternativos, incluidas las tendencias diferenciales entre áreas, los cambios en los precios de los cultivos, los cambios en ciertas políticas educativas y de salud y el efecto de la erradicación de la malaria. [46] No se encontraron resultados contemporáneos significativos para los adultos que deberían haberse beneficiado menos de la intervención debido a sus tasas de infección sustancialmente más bajas (anteriores). El programa casi erradicó la uncinaria y prosperaría posteriormente con nuevos fondos como División de Salud Internacional de la Fundación Rockefeller . [47]
La campaña contra la anquilostomiasis de la Federación de Rusia en México mostró cómo la ciencia y la política desempeñan un papel en el desarrollo de políticas de salud. Reunió a funcionarios gubernamentales, funcionarios de salud, trabajadores de salud pública, funcionarios de Rockefeller y la comunidad. Esta campaña se lanzó para erradicar los anquilostomas en México. Aunque la campaña no se centró en tratamientos a largo plazo, sí marcó los términos de la relación entre México y la Fundación Rockefeller. El conocimiento científico detrás de esta campaña ayudó a dar forma a las políticas de salud pública, mejoró la salud pública y construyó una relación sólida entre Estados Unidos y México. [48]
En la década de 1920, la erradicación de los anquilostomas llegó al Caribe y América Latina, donde se informó de una gran mortalidad entre la población de las Indias Occidentales hacia finales del siglo XVIII, así como a través de descripciones enviadas desde Brasil y varias otras regiones tropicales y subtropicales. [18]
El tratamiento a principios del siglo XX se basaba en el uso de sal de Epsom para reducir la mucosidad protectora, seguida de timol para matar los gusanos. [49] [31] En la década de 1940, el tetracloroetileno era el método principal. [32] No fue hasta mediados del siglo XX cuando se desarrollaron nuevos compuestos farmacológicos orgánicos. [50]
Se estima que un tercio de todas las mujeres embarazadas en los países en desarrollo están infectadas con anquilostomas, el 56% de todas las mujeres embarazadas en los países en desarrollo experimentan anemia y el 20% de todas las muertes maternas están directa o indirectamente relacionadas con la anemia. Números como este han generado un mayor interés en el tema de la anemia relacionada con uncinarias durante el embarazo. [51] Al comprender que la infección crónica por anquilostomas a menudo puede provocar anemia, muchas personas ahora se preguntan si el tratamiento de la anquilostomiasis podría afectar las tasas de anemia grave y, por lo tanto, también en la salud materna e infantil. La mayor parte de la evidencia sugiere que la contribución de la anquilostomiasis a la anemia materna justifica que todas las mujeres en edad fértil que viven en zonas endémicas estén sujetas a un tratamiento antihelmíntico periódico. La Organización Mundial de la Salud incluso recomienda que las mujeres embarazadas infectadas reciban tratamiento después del primer trimestre. [14] Independientemente de estas sugerencias, sólo Madagascar, Nepal y Sri Lanka han añadido la desparasitación a sus programas de atención prenatal. [52]
Esta falta de desparasitación de las mujeres embarazadas se explica por el hecho de que la mayoría de las personas todavía temen que el tratamiento antihelmíntico tenga resultados adversos en el parto. Pero un estudio de 2006 realizado por Gyorkos et al. encontraron que al comparar un grupo de mujeres embarazadas tratadas con mebendazol con un grupo de control con placebo, ambos ilustraron tasas bastante similares en resultados adversos en el parto. El grupo tratado demostró un 5,6% de resultados adversos en el parto, mientras que el grupo de control tuvo un 6,25% de resultados adversos en el parto. [51] Además, Larocque et al. ilustró que el tratamiento para la anquilostomiasis en realidad produjo resultados positivos para la salud del bebé. Este estudio concluyó que el tratamiento con mebendazol más suplementos de hierro durante la atención prenatal redujo significativamente la proporción de bebés con muy bajo peso al nacer en comparación con un grupo de control con placebo. [53] Hasta ahora, los estudios han validado recomendaciones para tratar a mujeres embarazadas infectadas por anquilostomas durante el embarazo.
Una revisión encontró que una dosis única de antihelmínticos (medicamentos contra lombrices) administrada en el segundo trimestre del embarazo "puede reducir la anemia materna y la prevalencia de lombrices cuando se usa en entornos con alta prevalencia de helmintiasis materna". [54]
La intensidad de la infección por anquilostomas, así como las especies de anquilostomas, aún no se han estudiado, ya que se relacionan con la anemia relacionada con los anquilostomas durante el embarazo. Además, se deben realizar más investigaciones en diferentes regiones del mundo para ver si persisten las tendencias observadas en los estudios completados. [ cita necesaria ]
La coinfección con uncinarias y Plasmodium falciparum es común en África. [55] Aunque se desconocen las cifras exactas, los análisis preliminares estiman que hasta una cuarta parte de los escolares africanos (17,8 a 32,1 millones de niños de 5 a 14 años) pueden estar coincidentemente en riesgo de contraer P. falciparum y anquilostoma. [56] Si bien las hipótesis originales afirmaban que la coinfección con múltiples parásitos afectaría la respuesta inmune del huésped a un solo parásito y aumentaría la susceptibilidad a la enfermedad clínica, los estudios han arrojado resultados contrastantes. Por ejemplo, un estudio realizado en Senegal demostró que el riesgo de infección clínica de malaria aumentaba en niños infectados con helmintos en comparación con niños libres de helmintos, mientras que otros estudios no han logrado reproducir tales resultados, [ 57] e incluso en experimentos de laboratorio con ratones el efecto La influencia de los helmintos en la malaria es variable. [58]
Algunas hipótesis y estudios sugieren que las infecciones por helmintos pueden proteger contra la malaria cerebral debido a la posible modulación de las respuestas de citocinas proinflamatorias y antiinflamatorias. [59] Además, se desconocen los mecanismos subyacentes a esta supuesta mayor susceptibilidad a la enfermedad. Por ejemplo, las infecciones por helmintos causan una respuesta inmune potente y altamente polarizada caracterizada por un aumento de la producción de citoquinas de células T auxiliares tipo 2 (T h 2) e inmunoglobulina E (IgE). [60] Sin embargo, se desconoce el efecto de tales respuestas sobre la respuesta inmune humana. Además, tanto la malaria como la infección por helmintos pueden causar anemia, pero no se comprende bien el efecto de la coinfección y el posible aumento de la anemia. [50]
La hipótesis de la higiene afirma que los bebés y niños que no están expuestos a agentes infecciosos son más susceptibles a enfermedades alérgicas mediante la modulación del desarrollo del sistema inmunológico. La teoría fue propuesta por primera vez por David P. Strachan, quien señaló que la fiebre del heno y el eccema eran menos comunes en los niños que pertenecían a familias numerosas. [61] Desde entonces, los estudios han observado el efecto de los gusanos gastrointestinales en el desarrollo de alergias en el mundo en desarrollo. Por ejemplo, un estudio realizado en Gambia encontró que la erradicación de gusanos en algunas aldeas provocó un aumento de las reacciones cutáneas a las alergias entre los niños. [62]
Si bien la administración masiva de antihelmínticos anual o semestral es un aspecto crítico de cualquier intervención de salud pública, muchos han comenzado a darse cuenta de lo insostenible que es debido a aspectos como la pobreza, las altas tasas de reinfección y la disminución de la eficacia de los medicamentos con el uso repetido. . Por lo tanto, la investigación actual se ha centrado en el desarrollo de una vacuna que podría integrarse en los programas de control existentes. El objetivo del desarrollo de vacunas no es necesariamente crear una vacuna con inmunidad esterilizante o protección completa contra la inmunidad. Una vacuna que reduzca la probabilidad de que las personas vacunadas desarrollen infecciones graves y, por tanto, reduzcan los niveles sanguíneos y de nutrientes, aún podría tener un impacto significativo en la elevada carga de morbilidad en todo el mundo.
La investigación actual se centra en dos etapas del desarrollo del gusano: la etapa larvaria y la etapa adulta. La investigación sobre antígenos larvales se ha centrado en proteínas que son miembros de la superfamilia de proteínas relacionadas con la patogénesis , las proteínas secretadas por Ancylostoma . [63] Aunque se describieron por primera vez en Anyclostoma , estas proteínas también se han aislado con éxito del producto secretado de N. americanus . N. americanus ASP-2 (Na-ASP-2) es actualmente la principal vacuna candidata contra la anquilostoma en etapa larvaria. Ya se ha realizado un estudio aleatorizado, doble ciego y controlado con placebo; 36 adultos sanos sin antecedentes de infección por anquilostomiasis recibieron tres inyecciones intramusculares de tres concentraciones diferentes de Na-ASP-2 y se observaron durante seis meses después de la vacunación final. [64] La vacuna indujo importantes respuestas inmunes celulares y anti-Na-ASP-2 IgG. Además, era seguro y no producía efectos secundarios debilitantes. La vacuna se encuentra ahora en un ensayo de fase uno; A voluntarios adultos sanos con evidencia documentada de infección previa en Brasil se les administra la misma concentración de dosis en el mismo programa utilizado en el estudio inicial. [63] Si este estudio tiene éxito, el siguiente paso sería realizar un ensayo de fase dos para evaluar la tasa y la intensidad de la infección por anquilostomas entre las personas vacunadas. Debido a que la vacuna Na-ASP-2 solo se dirige a la etapa larvaria, es fundamental que todos los sujetos inscritos en el estudio sean tratados con medicamentos antihelmínticos para eliminar los gusanos adultos antes de la vacunación.
También se han identificado antígenos de anquilostomas adultos como candidatos potenciales para vacunas. Cuando los gusanos adultos se adhieren a la mucosa intestinal del huésped humano, los eritrocitos se rompen en el tracto digestivo del gusano, lo que provoca la liberación de hemoglobina libre que posteriormente se degrada mediante una cascada proteolítica. Varias de estas proteínas responsables de esta cascada proteolítica también son esenciales para la nutrición y supervivencia del gusano. [65] Por lo tanto, una vacuna que pudiera inducir anticuerpos para estos antígenos podría interferir con la vía digestiva del anquilostoma y perjudicar su supervivencia. Se han identificado tres proteínas: la proteasa aspártica-hemoglobinasa APR-1, la cisteína proteasa-hemoglobinasa CP-2 y una glutatión S-transferasa. [66] [67] [68] La vacunación con APR-1 y CP-2 condujo a una reducción de la pérdida de sangre del huésped y del recuento de huevos fecales en perros. [66] [67] Con APR-1, la vacunación incluso condujo a una reducción de la carga de gusanos. [66] Actualmente, la investigación se ve obstaculizada en el desarrollo de al menos uno de estos antígenos como una proteína recombinante para su prueba en ensayos clínicos.
El término "anquilostoma" se utiliza a veces para referirse a la infección por anquilostoma. [12] Un anquilostoma es un tipo de gusano parásito ( helminto ).
{{cite journal}}: |first1=tiene nombre genérico ( ayuda )Mantenimiento CS1: nombres numéricos: lista de autores ( enlace ){{cite journal}}: |first1=tiene nombre genérico ( ayuda )Mantenimiento CS1: nombres numéricos: lista de autores ( enlace ){{cite book}}: |journal=ignorado ( ayuda )Los servicios de salud pública inadecuados y la falta general de conocimientos ciudadanos básicos sobre salud e higiene reflejaban la debilidad del sistema de educación pública. Los problemas de salud, especialmente en los estados de la costa del Golfo, donde las heladas llegaron tarde, si es que llegaron, abundaron en una época en la que departamentos de salud pública activos en otras partes del país estaban erradicando enfermedades nutricionales y bacterianas. La anquilostoma, un parásito intestinal, infectó y debilitó crónicamente a un gran número de sureños, tal vez hasta 2 millones. En la década de 1930, un estudio cooperativo realizado por la Junta de Salud del Estado de Florida, la Fundación Rockefeller y la Universidad de Vanderbilt encontró que los adolescentes del estado de 15 a 18 años eran el grupo más afectado (44,7 por ciento), y el Panhandle el área más gravemente afectada con casi la mitad. de sus adolescentes (49,2 por ciento) estaban infestados de anquilostomas (Eberson, 1980; y Link, 1988). John D. Rockefeller encontró la situación tan atroz a principios del siglo XX que estableció y financió la Comisión Sanitaria Rockefeller para la Erradicación de la Anquilostomiasis.
{{cite book}}: |journal=ignorado ( ayuda )