
Los tipos hipotéticos de bioquímica son formas de bioquímica que se considera científicamente viable pero cuya existencia no está demostrada en este momento. [2] Todos los tipos de organismos vivos que se conocen actualmente en la Tierra utilizan compuestos de carbono para funciones estructurales y metabólicas básicas, agua como disolvente y ADN o ARN para definir y controlar su forma. Si existe vida en otros planetas o lunas , puede ser químicamente similar, aunque también es posible que haya organismos con químicas bastante diferentes [3] ; por ejemplo, que involucren otras clases de compuestos de carbono, compuestos de otro elemento u otro disolvente en lugar de agua.
La posibilidad de que las formas de vida se basen en bioquímicas "alternativas" es tema de un debate científico en curso, basado en lo que se sabe sobre los entornos extraterrestres y sobre el comportamiento químico de diversos elementos y compuestos. Es un tema de interés para la biología sintética y también es un tema habitual en la ciencia ficción .
El silicio ha sido un elemento muy discutido como una alternativa hipotética al carbono. El silicio está en el mismo grupo que el carbono en la tabla periódica y, al igual que el carbono, es tetravalente . Las alternativas hipotéticas al agua incluyen el amoníaco , que, como el agua, es una molécula polar y cósmicamente abundante; y disolventes hidrocarbonados no polares como el metano y el etano , que se sabe que existen en forma líquida en la superficie de Titán .

Una biosfera de sombra es una biosfera microbiana hipotética de la Tierra que utiliza procesos bioquímicos y moleculares radicalmente diferentes a los de la vida conocida actualmente. [11] [12] Aunque la vida en la Tierra está relativamente bien estudiada, la biosfera de sombra todavía puede pasar desapercibida porque la exploración del mundo microbiano se centra principalmente en la bioquímica de los macroorganismos.
Tal vez la bioquímica alternativa menos inusual sería aquella en la que sus biomoléculas tuvieran una quiralidad diferente . En la vida terrestre conocida, los aminoácidos son casi universalmente de la forma L y los azúcares de la forma D. Es posible que existan moléculas que utilicen aminoácidos D o azúcares L ; sin embargo, las moléculas de dicha quiralidad serían incompatibles con organismos que utilizaran moléculas de quiralidad opuesta. En la Tierra se encuentran aminoácidos cuya quiralidad es opuesta a la norma, y se cree generalmente que estas sustancias son el resultado de la descomposición de organismos de quiralidad normal. Sin embargo, el físico Paul Davies especula que algunos de ellos podrían ser productos de la vida "antiquiral". [13]
Sin embargo, es cuestionable si una bioquímica de este tipo sería verdaderamente extraña. Aunque ciertamente sería una estereoquímica alternativa , las moléculas que se encuentran abrumadoramente en un enantiómero en la gran mayoría de los organismos pueden, no obstante, encontrarse a menudo en otro enantiómero en organismos diferentes (a menudo basales ), como en las comparaciones entre miembros de Archaea y otros dominios , [ cita requerida ] lo que hace que sea un tema abierto si una estereoquímica alternativa es realmente novedosa.
En la Tierra, todos los seres vivos conocidos tienen una estructura y un sistema basados en el carbono. Los científicos han especulado sobre los pros y los contras de utilizar elementos distintos del carbono para formar las estructuras moleculares necesarias para la vida, pero nadie ha propuesto una teoría que emplee dichos átomos para formar todas las estructuras necesarias. Sin embargo, como argumentó Carl Sagan , es muy difícil estar seguro de si una afirmación que se aplica a toda la vida en la Tierra resultará ser aplicable a toda la vida en todo el universo. [14] Sagan utilizó el término " chovinismo del carbono " para tal suposición. [15] Consideró que el silicio y el germanio eran alternativas concebibles al carbono [15] (otros elementos plausibles incluyen, entre otros, el paladio y el titanio ); pero, por otro lado, señaló que el carbono parece más versátil químicamente y es más abundante en el cosmos. [16] Norman Horowitz ideó los experimentos para determinar si podría existir vida en Marte que llevó a cabo la sonda Viking Lander de 1976 , la primera misión estadounidense en posar con éxito una sonda en la superficie de Marte. Horowitz sostuvo que la gran versatilidad del átomo de carbono lo convierte en el elemento con más probabilidades de aportar soluciones, incluso exóticas, a los problemas de supervivencia en otros planetas. [17] Consideró que sólo existía una remota posibilidad de que pudieran existir formas de vida no basadas en el carbono con sistemas de información genética capaces de autorreplicarse y con capacidad de evolucionar y adaptarse.

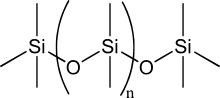

El átomo de silicio ha sido muy discutido como base para un sistema bioquímico alternativo, porque el silicio tiene muchas similitudes químicas con el carbono y está en el mismo grupo de la tabla periódica . Al igual que el carbono, el silicio puede crear moléculas lo suficientemente grandes como para transportar información biológica. [18]
Sin embargo, el silicio tiene varios inconvenientes como alternativa al carbono. El carbono es diez veces más abundante cósmicamente que el silicio, y su química parece naturalmente más compleja. [19] En 1998, los astrónomos habían identificado 84 moléculas que contenían carbono en el medio interestelar , pero solo 8 contenían silicio, de las cuales la mitad también incluía carbono. [20] Aunque la Tierra y otros planetas terrestres son excepcionalmente ricos en silicio y pobres en carbono (el silicio es aproximadamente 925 veces más abundante en la corteza terrestre que el carbono), la vida terrestre se basa en el carbono. Puede evitar el silicio porque los compuestos de silicio son menos variados, inestables en presencia de agua o bloquean el flujo de calor. [19]
En relación con el carbono, el silicio tiene un radio atómico mucho mayor y forma enlaces covalentes mucho más débiles con los átomos, excepto el oxígeno y el flúor , con los que forma enlaces muy fuertes. [18] Casi ningún enlace múltiple con el silicio es estable, aunque el silicio exhibe un número de coordinación variado . [21] Los silanos , análogos de silicio de los alcanos , reaccionan rápidamente con el agua y los silanos de cadena larga se descomponen espontáneamente. [22] En consecuencia, la mayor parte del silicio terrestre está "encerrado" en sílice , y no en una amplia variedad de precursores biogénicos. [21]
Las siliconas , que alternan átomos de silicio y oxígeno , son mucho más estables que los silanos, e incluso pueden ser más estables que los hidrocarburos equivalentes en entornos extraterrestres ricos en ácido sulfúrico. [22] Alternativamente, los enlaces débiles en los compuestos de silicio pueden ayudar a mantener un ritmo rápido de vida a temperaturas criogénicas . Los polisilanoles, los homólogos de silicio de los azúcares , se encuentran entre los pocos compuestos solubles en nitrógeno líquido . [23] [ ¿Fuente poco confiable? ] [21]
Todas las macromoléculas de silicio conocidas son polímeros artificiales, y por lo tanto "monótonos comparados con el universo combinatorio de las macromoléculas orgánicas". [18] [21] Aun así, alguna vida terrestre utiliza sílice biogénica : los esqueletos de silicato de las diatomeas . AG Cairns-Smith planteó la hipótesis de que los minerales de silicato en el agua desempeñaban un papel crucial en la abiogénesis , en el sentido de que los compuestos de carbono biogénico se formaban alrededor de sus estructuras cristalinas. [24] [25] Aunque no se observan en la naturaleza, los enlaces carbono-silicio se han añadido a la bioquímica bajo evolución dirigida (selección artificial): se ha diseñado una proteína citocromo c de Rhodothermus marinus para catalizar nuevos enlaces carbono-silicio entre hidrosilanos y compuestos diazo . [26]
El arsénico , que es químicamente similar al fósforo , aunque venenoso para la mayoría de las formas de vida en la Tierra, se incorpora a la bioquímica de algunos organismos. [29] Algunas algas marinas incorporan arsénico en moléculas orgánicas complejas como arsenosugares y arsenobetaínas . Los hongos y las bacterias pueden producir compuestos volátiles de arsénico metilado. Se ha observado reducción de arsenato y oxidación de arsenito en microbios ( Chrysiogenes arsenatis ). [30] Además, algunos procariotas pueden usar arsenato como aceptor terminal de electrones durante el crecimiento anaeróbico y algunos pueden utilizar arsenito como donante de electrones para generar energía.
Se ha especulado que las primeras formas de vida en la Tierra pueden haber utilizado la bioquímica del arsénico en lugar del fósforo en la estructura de su ADN. [31] Una objeción común a este escenario es que los ésteres de arsenato son mucho menos estables a la hidrólisis que los ésteres de fosfato correspondientes , por lo que el arsénico es poco adecuado para esta función. [32]
Los autores de un estudio de geomicrobiología de 2010 , apoyado en parte por la NASA, han postulado que una bacteria, llamada GFAJ-1 , recogida en los sedimentos del lago Mono en el este de California , puede emplear dicho "ADN de arsénico" cuando se cultiva sin fósforo. [33] [34] Propusieron que la bacteria puede emplear altos niveles de poli-β-hidroxibutirato u otros medios para reducir la concentración efectiva de agua y estabilizar sus ésteres de arsenato. [34] Esta afirmación fue duramente criticada casi inmediatamente después de su publicación por la falta percibida de controles apropiados. [35] [36] El escritor científico Carl Zimmer contactó a varios científicos para una evaluación: "Me comuniqué con una docena de expertos ... Casi unánimemente, creen que los científicos de la NASA no han logrado demostrar su caso". [37] Otros autores no pudieron reproducir sus resultados y demostraron que el estudio tenía problemas con la contaminación por fosfato, lo que sugiere que las bajas cantidades presentes podrían sustentar formas de vida extremófilas. [38] Alternativamente, se sugirió que las células GFAJ-1 crecen reciclando el fosfato de los ribosomas degradados, en lugar de reemplazarlo con arsenato. [39]
Además de los compuestos de carbono, toda la vida terrestre conocida actualmente también requiere agua como disolvente. Esto ha llevado a discusiones sobre si el agua es el único líquido capaz de cumplir esa función. La idea de que una forma de vida extraterrestre podría basarse en un disolvente distinto del agua ha sido tomada en serio en la literatura científica reciente por el bioquímico Steven Benner , [40] y por el comité astrobiológico presidido por John A. Baross. [41] Los disolventes discutidos por el comité de Baross incluyen amoniaco , [42] ácido sulfúrico , [43] formamida , [44] hidrocarburos, [44] y (a temperaturas mucho más bajas que las de la Tierra) nitrógeno líquido , o hidrógeno en forma de fluido supercrítico . [45]
El agua como disolvente limita las formas que puede adoptar la bioquímica. Por ejemplo, Steven Benner propone la teoría de los polielectrolitos del gen , que sostiene que para que un biopolímero genético como el ADN funcione en el agua, requiere cargas iónicas repetidas. [46] Si el agua no es necesaria para la vida, se eliminan estos límites a los biopolímeros genéticos.
Carl Sagan una vez se describió a sí mismo como un chovinista del carbono y un chovinista del agua; [47] sin embargo, en otra ocasión dijo que era un chovinista del carbono pero "no tanto un chovinista del agua". [48] Especuló sobre los hidrocarburos, [48] : 11 ácido fluorhídrico , [49] y amoníaco [48] [49] como posibles alternativas al agua.
Algunas de las propiedades del agua que son importantes para los procesos de la vida incluyen:
El agua como compuesto es abundante en el cosmos, aunque gran parte de ella se encuentra en forma de vapor o hielo. Se considera probable o posible la presencia de agua líquida subterránea en varias de las lunas exteriores: Encélado (donde se han observado géiseres), Europa , Titán y Ganímedes . La Tierra y Titán son los únicos mundos conocidos actualmente que tienen cuerpos estables de líquido en sus superficies.
Sin embargo, no todas las propiedades del agua son necesariamente ventajosas para la vida. [50] Por ejemplo, el hielo de agua tiene un albedo alto , [50] lo que significa que refleja una cantidad significativa de luz y calor del Sol. Durante las eras de hielo , a medida que el hielo reflectante se acumula sobre la superficie del agua, aumentan los efectos del enfriamiento global. [50]
Existen algunas propiedades que hacen que ciertos compuestos y elementos sean mucho más favorables que otros como disolventes en una biosfera exitosa. El disolvente debe poder existir en equilibrio líquido en un rango de temperaturas que el objeto planetario encontraría normalmente. Debido a que los puntos de ebullición varían con la presión, la pregunta tiende a no ser si el disolvente potencial permanece líquido, sino a qué presión . Por ejemplo, el cianuro de hidrógeno tiene un rango estrecho de temperatura en fase líquida a 1 atmósfera, pero en una atmósfera con la presión de Venus , con 92 bares (91 atm) de presión, puede existir en forma líquida en un amplio rango de temperaturas.
La molécula de amoniaco (NH 3 ), al igual que la molécula de agua, es abundante en el universo, siendo un compuesto de hidrógeno (el elemento más simple y común) con otro elemento muy común, el nitrógeno. [51] El posible papel del amoniaco líquido como disolvente alternativo para la vida es una idea que se remonta al menos a 1954, cuando J. B. S. Haldane planteó el tema en un simposio sobre el origen de la vida. [52]
En una solución de amoníaco son posibles numerosas reacciones químicas, y el amoníaco líquido tiene similitudes químicas con el agua. [51] [53] El amoníaco puede disolver la mayoría de las moléculas orgánicas al menos tan bien como lo hace el agua y, además, es capaz de disolver muchos metales elementales. Haldane señaló que varios compuestos orgánicos comunes relacionados con el agua tienen análogos relacionados con el amoníaco; por ejemplo, el grupo amina relacionado con el amoníaco (−NH 2 ) es análogo al grupo hidroxilo relacionado con el agua (−OH). [53]
El amoníaco, al igual que el agua, puede aceptar o donar un ion H + . Cuando el amoníaco acepta un H + , forma el catión amonio (NH4 + ) , análogo al hidronio (H3O + ) . Cuando dona un ion H + , forma el anión amida (NH2- ) , análogo al anión hidróxido (OH- ) . [ 42] Sin embargo, en comparación con el agua, el amoníaco es más propenso a aceptar un ion H + y menos propenso a donarlo; es un nucleófilo más fuerte . [42] El amoníaco añadido al agua funciona como una base de Arrhenius : aumenta la concentración del anión hidróxido. Por el contrario, utilizando una definición de acidez y basicidad del sistema disolvente , el agua añadida al amoníaco líquido funciona como un ácido, porque aumenta la concentración del catión amonio. [53] El grupo carbonilo (C=O), muy utilizado en la bioquímica terrestre, no sería estable en solución de amoníaco, pero podría utilizarse en su lugar el grupo imina análogo (C=NH). [42]
Sin embargo, el amoníaco presenta algunos problemas como base para la vida. Los enlaces de hidrógeno entre las moléculas de amoníaco son más débiles que los del agua, lo que hace que el calor de vaporización del amoníaco sea la mitad del del agua, su tensión superficial un tercio y reduce su capacidad para concentrar moléculas no polares mediante un efecto hidrofóbico . Gerald Feinberg y Robert Shapiro han cuestionado si el amoníaco podría mantener unidas las moléculas prebióticas lo suficientemente bien como para permitir el surgimiento de un sistema autorreproductor. [54] El amoníaco también es inflamable en oxígeno y no podría existir de manera sostenible en un entorno adecuado para el metabolismo aeróbico . [55]

Una biosfera basada en amoníaco probablemente existiría a temperaturas o presiones atmosféricas que son extremadamente inusuales en relación con la vida en la Tierra. La vida en la Tierra generalmente existe dentro del punto de fusión y el punto de ebullición del agua, a una presión designada como presión normal , y entre 0 y 100 °C (273 y 373 K ). Cuando también se mantiene a presión normal, los puntos de fusión y ebullición del amoníaco son -78 °C (195 K) y -33 °C (240 K) respectivamente. Debido a que las reacciones químicas generalmente ocurren más lentamente a temperaturas más bajas, la vida basada en amoníaco que exista en este conjunto de condiciones podría metabolizarse más lentamente y evolucionar más lentamente que la vida en la Tierra. [55] Por otro lado, las temperaturas más bajas también podrían permitir que los sistemas vivos usen especies químicas que serían demasiado inestables a las temperaturas de la Tierra para ser útiles. [51]
Otro conjunto de condiciones en las que el amoníaco es líquido a temperaturas similares a las de la Tierra implicaría que se encuentre a una presión mucho más alta. Por ejemplo, a 60 atm, el amoníaco se funde a -77 °C (196 K) y hierve a 98 °C (371 K). [42]
El amoníaco y las mezclas de amoníaco y agua permanecen líquidos a temperaturas muy por debajo del punto de congelación del agua pura, por lo que estas bioquímicas podrían ser adecuadas para planetas y lunas que orbitan fuera de la zona de habitabilidad basada en agua . Tales condiciones podrían existir, por ejemplo, bajo la superficie de la luna más grande de Saturno , Titán . [56]
El metano (CH 4 ) es un hidrocarburo simple: es decir, un compuesto de dos de los elementos más comunes en el cosmos: hidrógeno y carbono. Tiene una abundancia cósmica comparable con el amoníaco. [51] Los hidrocarburos podrían actuar como disolvente en un amplio rango de temperaturas, pero carecerían de polaridad . Isaac Asimov, el bioquímico y escritor de ciencia ficción, sugirió en 1981 que los polilípidos podrían formar un sustituto de las proteínas en un disolvente no polar como el metano. [51] La sonda espacial Cassini ha detectado lagos compuestos por una mezcla de hidrocarburos, incluidos metano y etano , en la superficie de Titán .
Existe un debate sobre la eficacia del metano y otros hidrocarburos como disolvente para la vida en comparación con el agua o el amoníaco. [57] [58] [59] El agua es un disolvente más fuerte que los hidrocarburos, lo que permite un transporte más fácil de sustancias en una célula. [60] Sin embargo, el agua también es más reactiva químicamente y puede descomponer moléculas orgánicas grandes mediante hidrólisis. [57] Una forma de vida cuyo disolvente fuera un hidrocarburo no se enfrentaría a la amenaza de que sus biomoléculas se destruyeran de esta manera. [57] Además, la tendencia de la molécula de agua a formar fuertes enlaces de hidrógeno puede interferir con los enlaces de hidrógeno internos en moléculas orgánicas complejas. [50] La vida con un disolvente de hidrocarburo podría hacer un mayor uso de los enlaces de hidrógeno dentro de sus biomoléculas. [57] Además, la fuerza de los enlaces de hidrógeno dentro de las biomoléculas sería apropiada para una bioquímica de baja temperatura. [57]
El astrobiólogo Chris McKay ha argumentado, sobre bases termodinámicas, que si existe vida en la superficie de Titán, utilizando hidrocarburos como disolvente, es probable que también utilice los hidrocarburos más complejos como fuente de energía al reaccionar con hidrógeno, reduciendo el etano y el acetileno a metano. [61] Darrell Strobel de la Universidad Johns Hopkins identificó en 2010 una posible evidencia de esta forma de vida en Titán : una mayor abundancia de hidrógeno molecular en las capas atmosféricas superiores de Titán en comparación con las capas inferiores, lo que sugiere una difusión descendente a una velocidad de aproximadamente 10 25 moléculas por segundo y la desaparición del hidrógeno cerca de la superficie de Titán. Como señaló Strobel, sus hallazgos estaban en línea con los efectos que Chris McKay había predicho si estuvieran presentes formas de vida metanogénicas . [60] [61] [62] El mismo año, otro estudio mostró niveles bajos de acetileno en la superficie de Titán, que fueron interpretados por Chris McKay como consistentes con la hipótesis de que los organismos reducen el acetileno a metano. [60] Al tiempo que replanteaba la hipótesis biológica, McKay advirtió que otras explicaciones para los hallazgos de hidrógeno y acetileno deben considerarse más probables: las posibilidades de procesos físicos o químicos aún no identificados (por ejemplo, un catalizador de superficie no vivo que permite que el acetileno reaccione con hidrógeno), o fallas en los modelos actuales de flujo de material. [63] Señaló que incluso un catalizador no biológico efectivo a 95 K sería en sí mismo un descubrimiento sorprendente. [63]
Una membrana celular hipotética denominada azotosoma, capaz de funcionar en metano líquido en las condiciones de Titán, fue modelada por computadora en un artículo publicado en febrero de 2015. Compuesta de acrilonitrilo , una pequeña molécula que contiene carbono, hidrógeno y nitrógeno, se predice que tiene estabilidad y flexibilidad en metano líquido comparable a la de una bicapa de fosfolípidos (el tipo de membrana celular que posee toda la vida en la Tierra) en agua líquida. [64] [65] Un análisis de datos obtenidos usando el Atacama Large Millimeter / submillimeter Array (ALMA), completado en 2017, confirmó cantidades sustanciales de acrilonitrilo en la atmósfera de Titán. [66] [67] Estudios posteriores cuestionaron si el acrilonitrilo podría autoensamblarse en azotosomas. [68]
El fluoruro de hidrógeno (HF), al igual que el agua, es una molécula polar y, debido a su polaridad, puede disolver muchos compuestos iónicos. A presión atmosférica , su punto de fusión es de 189,15 K (−84,00 °C) y su punto de ebullición es de 292,69 K (19,54 °C); la diferencia entre ambos es de un poco más de 100 K. El HF también forma enlaces de hidrógeno con sus moléculas vecinas, al igual que el agua y el amoníaco. Ha sido considerado como un posible disolvente para la vida por científicos como Peter Sneath [69] y Carl Sagan. [49]
El HF es peligroso para los sistemas de moléculas de los que está hecha la vida en la Tierra, pero ciertos otros compuestos orgánicos, como las ceras de parafina , son estables con él. [49] Al igual que el agua y el amoníaco, el fluoruro de hidrógeno líquido admite una química ácido-base. Usando una definición del sistema de solventes de acidez y basicidad, el ácido nítrico funciona como una base cuando se agrega al HF líquido. [70]
Sin embargo, el fluoruro de hidrógeno es cósmicamente raro, a diferencia del agua, el amoníaco y el metano. [71]
El sulfuro de hidrógeno es el análogo químico más cercano al agua , [72] pero es menos polar y es un disolvente inorgánico más débil. [73] El sulfuro de hidrógeno es bastante abundante en la luna Io de Júpiter y puede estar en forma líquida a poca distancia debajo de la superficie; el astrobiólogo Dirk Schulze-Makuch lo ha sugerido como un posible disolvente para la vida allí. [74] En un planeta con océanos de sulfuro de hidrógeno, la fuente del sulfuro de hidrógeno podría provenir de volcanes, en cuyo caso podría estar mezclado con un poco de fluoruro de hidrógeno , que podría ayudar a disolver los minerales. La vida de sulfuro de hidrógeno podría usar una mezcla de monóxido de carbono y dióxido de carbono como fuente de carbono. Podrían producir y vivir de monóxido de azufre , que es análogo al oxígeno (O 2 ). El sulfuro de hidrógeno, como el cianuro de hidrógeno y el amoníaco, sufre el pequeño rango de temperatura en el que es líquido, aunque eso, como el del cianuro de hidrógeno y el amoníaco, aumenta con el aumento de la presión.
El dióxido de silicio , también conocido como sílice y cuarzo, es muy abundante en el universo y tiene un amplio rango de temperaturas en el que es líquido. Sin embargo, su punto de fusión es de 1.600 a 1.725 °C (2.912 a 3.137 °F), por lo que sería imposible fabricar compuestos orgánicos a esa temperatura, porque todos ellos se descompondrían. Los silicatos son similares al dióxido de silicio y algunos tienen puntos de fusión más bajos que el sílice. Feinberg y Shapiro han sugerido que la roca de silicato fundido podría servir como medio líquido para organismos con una química basada en silicio, oxígeno y otros elementos como el aluminio . [75]

Otros disolventes propuestos a veces:
El ácido sulfúrico en forma líquida es fuertemente polar. Permanece líquido a temperaturas más altas que el agua, su rango líquido es de 10 °C a 337 °C a una presión de 1 atm, aunque por encima de los 300 °C se descompone lentamente. Se sabe que el ácido sulfúrico es abundante en las nubes de Venus , en forma de gotitas de aerosol . En una bioquímica que utilizó ácido sulfúrico como disolvente, el grupo alqueno (C=C), con dos átomos de carbono unidos por un doble enlace, podría funcionar de forma análoga al grupo carbonilo (C=O) en la bioquímica basada en agua. [43]
Se ha propuesto que podría existir vida en Marte y que se utilizaría una mezcla de agua y peróxido de hidrógeno como disolvente. [79] Una mezcla de 61,2 % (en masa) de agua y peróxido de hidrógeno tiene un punto de congelación de -56,5 °C y tiende a sobreenfriarse en lugar de cristalizarse. También es higroscópica , una ventaja en un entorno con escasez de agua. [80] [81]
El dióxido de carbono supercrítico se ha propuesto como candidato para la bioquímica alternativa debido a su capacidad para disolver selectivamente compuestos orgánicos y ayudar al funcionamiento de las enzimas y porque los planetas tipo "súper-Tierra" o "súper-Venus" con atmósferas densas de alta presión pueden ser comunes. [76]
Los físicos han observado que, aunque la fotosíntesis en la Tierra generalmente involucra plantas verdes, una variedad de plantas de otros colores también podrían apoyar la fotosíntesis, esencial para la mayor parte de la vida en la Tierra, y que otros colores podrían ser preferidos en lugares que reciben una mezcla diferente de radiación estelar que la Tierra. [82] [83] Estos estudios indican que las plantas azules serían poco probables; sin embargo, las plantas amarillas o rojas pueden ser relativamente comunes. [83]
Muchas plantas y animales de la Tierra experimentan cambios bioquímicos importantes durante sus ciclos de vida como respuesta a las condiciones ambientales cambiantes, por ejemplo, al tener un estado de espora o hibernación que puede mantenerse durante años o incluso milenios entre etapas de vida más activas. [84] Por lo tanto, sería bioquímicamente posible mantener la vida en entornos que solo son periódicamente consistentes con la vida tal como la conocemos.
Por ejemplo, las ranas en climas fríos pueden sobrevivir durante largos períodos de tiempo con la mayor parte del agua de su cuerpo en estado congelado, [84] mientras que las ranas del desierto en Australia pueden volverse inactivas y deshidratarse en períodos secos, perdiendo hasta el 75% de sus fluidos, pero volver a la vida rehidratándose rápidamente en períodos húmedos. [85] Cualquiera de los dos tipos de rana parecería bioquímicamente inactiva (es decir, no viva) durante los períodos de inactividad para cualquier persona que carezca de un medio sensible para detectar niveles bajos de metabolismo.

El código genético puede haber evolucionado durante la transición del mundo del ARN al mundo de las proteínas . [86] La hipótesis del mundo de la alanina postula que la evolución del código genético (la llamada fase GC [87] ) comenzó con solo cuatro aminoácidos básicos : alanina , glicina , prolina y ornitina (ahora arginina ). [88] La evolución del código genético terminó con 20 aminoácidos proteinogénicos . Desde un punto de vista químico, la mayoría de ellos son derivados de la alanina particularmente adecuados para la construcción de hélices α y láminas β , elementos estructurales secundarios básicos de las proteínas modernas. La evidencia directa de esto es un procedimiento experimental en biología molecular conocido como escaneo de alanina .
Un hipotético "Mundo Prolina" crearía una posible vida alternativa con el código genético basado en el andamiaje químico de la prolina como la columna vertebral de la proteína . De manera similar, también son concebibles un "Mundo Glicina" y un "Mundo Ornitina", pero la naturaleza no ha elegido ninguno de ellos. [89] La evolución de la vida con Prolina, Glicina u Ornitina como la estructura básica para polímeros similares a proteínas ( foldámeros ) conduciría a mundos biológicos paralelos. Tendrían planes corporales y genética morfológicamente radicalmente diferentes de los organismos vivos de la biosfera conocida . [90]
En 2007, Vadim N. Tsytovich y sus colegas propusieron que las partículas de polvo suspendidas en un plasma podrían exhibir comportamientos similares a los de la vida real , en condiciones que podrían existir en el espacio. [91] [92] Los modelos informáticos mostraron que, cuando el polvo se cargaba, las partículas podían autoorganizarse en estructuras helicoidales microscópicas, y los autores ofrecen "un esbozo aproximado de un posible modelo de... reproducción de la estructura helicoidal del grano".
En 2020, Luis A. Anchordoqu y Eugene M. Chudnovsky, de la City University de Nueva York, plantearon la hipótesis de que la vida basada en collares cósmicos compuestos por monopolos magnéticos conectados por cuerdas cósmicas podría evolucionar dentro de las estrellas. [5] Esto se lograría mediante un estiramiento de las cuerdas cósmicas debido a la intensa gravedad de la estrella, lo que le permitiría adoptar formas más complejas y potencialmente formar estructuras similares a las estructuras de ARN y ADN que se encuentran en la vida basada en el carbono. Como tal, es teóricamente posible que tales seres pudieran eventualmente volverse inteligentes y construir una civilización utilizando la energía generada por la fusión nuclear de la estrella. Debido a que tal uso consumiría parte de la producción de energía de la estrella, la luminosidad también disminuiría. Por esta razón, se piensa que tal vida podría existir dentro de estrellas que se observa que se enfrían más rápido o son más tenues de lo que predicen los modelos cosmológicos actuales.
Frank Drake sugirió en 1973 que la vida inteligente podría habitar estrellas de neutrones . [93] Los modelos físicos de 1973 implicaban que las criaturas de Drake serían microscópicas. [ cita requerida ]
Los científicos que han considerado posibles alternativas a la bioquímica carbono-agua incluyen:
{{cite web}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace )