Un espermatozoide ( / s p ər ˌ m æ t ə ˈ z oʊ . ən , ˌ s p ɜːr m ə t ə - / ; [1] también escrito espermatozoön ; pl. : espermatozoo ; del griego antiguo σπέρμα ( spérma ) 'semilla' y ζῷον ( zôion ) 'animal') es un espermatozoide móvil producido por animales machos que dependen de la fertilización interna. Un espermatozoide es una forma móvil de la célula haploide que es el gameto masculino que se une a un óvulo para formar un cigoto . (Un cigoto es una sola célula, con un conjunto completo de cromosomas , que normalmente se desarrolla en un embrión ).
Los espermatozoides aportan aproximadamente la mitad de la información genética nuclear a la descendencia diploide (excluyendo, en la mayoría de los casos, el ADN mitocondrial ). En los mamíferos, el sexo de la descendencia está determinado por el espermatozoide: un espermatozoide que lleva un cromosoma X dará lugar a una descendencia femenina (XX), mientras que uno que lleva un cromosoma Y dará lugar a una descendencia masculina (XY). Los espermatozoides fueron observados por primera vez en el laboratorio de Antonie van Leeuwenhoek en 1677. [2]
El espermatozoide humano es la célula reproductora de los hombres y solo sobrevive en ambientes cálidos; una vez que abandona el cuerpo masculino, la probabilidad de supervivencia del espermatozoide se reduce y puede morir, disminuyendo así la calidad total del esperma . Los espermatozoides se dividen en dos tipos: "femeninos" y "masculinos". Los espermatozoides que dan lugar a una descendencia femenina (XX) después de la fecundación se diferencian en que llevan un cromosoma X, mientras que los espermatozoides que dan lugar a una descendencia masculina (XY) llevan un cromosoma Y. [3]
Un espermatozoide humano consta de una cabeza plana en forma de disco de 5,1 μm por 3,1 μm y una cola conocida como flagelo de 50 μm de largo. [4] El flagelo propulsa al espermatozoide (a aproximadamente 1–3 mm/minuto en humanos) al agitarse en un cono elíptico. [5] Los espermatozoides tienen un mecanismo de guía olfativa y, después de llegar a las trompas de Falopio , deben atravesar un período de capacitación antes de penetrar en el óvulo. [6]
Cabeza: Tiene un núcleo compacto con solo sustancia cromática y está rodeado solo por un borde delgado de citoplasma. Por encima del núcleo se encuentra una estructura similar a un casquete llamada acrosoma , formada por modificación del aparato de Golgi, que secreta la enzima espermatolisina ( hialuronidasa, enzima penetrante de la corona, zona lisina o acrosina ), que es necesaria para la fecundación. A medida que el espermatozoide se acerca al óvulo, experimenta la reacción acrosómica en la que la membrana que rodea el acrosoma se fusiona con la membrana plasmática de la cabeza del espermatozoide, exponiendo el contenido del acrosoma. [7]
Cuello: Es la parte más pequeña (0,03 μm), y posee un centríolo proximal paralelo a la base del núcleo y un centríolo distal perpendicular al anterior. El centríolo proximal está presente también en el espermatozoide maduro; el centríolo distal desaparece tras el ensamblaje del axonema. El centríolo proximal entra en el óvulo durante la fecundación e inicia la primera división del óvulo, que no tiene centríolo. El centríolo distal da origen al filamento axial que forma la cola y tiene una disposición (9+2). En la pieza intermedia se encuentra una membrana transitoria llamada Manchette .
Pieza intermedia: Tiene entre 10 y 14 espirales de mitocondrias que rodean el filamento axial en el citoplasma. Proporciona movilidad, por lo que se la denomina la central energética del espermatozoide. También tiene un centriolo anular (anillo) que forma una barrera de difusión entre la pieza intermedia y la pieza principal y sirve como estructura estabilizadora para la rigidez de la cola. [8]
Cola: El flagelo es la parte más larga (50 μm), tiene un filamento axial rodeado de citoplasma y membrana plasmática, pero en el extremo posterior el filamento axial está desnudo. El flagelo da movimiento a la célula.
El semen tiene una naturaleza alcalina y los espermatozoides no alcanzan su movilidad total (hipermovilidad) hasta que llegan a la vagina , donde el pH alcalino se neutraliza con los fluidos vaginales ácidos. Este proceso gradual dura entre 20 y 30 minutos. Durante este período, el fibrinógeno de las vesículas seminales forma un coágulo que fija y protege a los espermatozoides. Justo cuando se vuelven hipermóviles, la fibrinolisina de la glándula prostática disuelve el coágulo, lo que permite que los espermatozoides progresen de manera óptima.
El espermatozoide se caracteriza por tener un mínimo de citoplasma y el ADN más densamente empaquetado conocido en eucariotas . En comparación con los cromosomas mitóticos de las células somáticas , el ADN del espermatozoide está al menos seis veces más condensado. [9]
El espécimen contribuye con ADN / cromatina , un centriolo y quizás también un factor activador de ovocitos (OAF). [10] También puede contribuir con ARN mensajero paterno (ARNm), contribuyendo también al desarrollo embrionario. [10]
El espermatozoide humano contiene al menos 7500 proteínas diferentes . [11]
La genética del esperma humano se ha asociado con la evolución humana , según un estudio de 2020. [12] [13] [14]
Los daños en el ADN presentes en los espermatozoides en el período posterior a la meiosis pero anterior a la fertilización pueden repararse en el óvulo fertilizado, pero si no se reparan, pueden tener efectos nocivos graves sobre la fertilidad y el embrión en desarrollo. Los espermatozoides humanos son particularmente vulnerables al ataque de radicales libres y a la generación de daño oxidativo en el ADN. [15] [16] (véase, por ejemplo, 8-Oxo-2'-desoxiguanosina ).
La exposición de los varones a ciertos riesgos laborales, ambientales o relacionados con el estilo de vida puede aumentar el riesgo de aneuploidía en los espermatozoides. [17] En particular, el riesgo de aneuploidía aumenta con el tabaquismo, [18] [19] y la exposición ocupacional al benceno, [20] insecticidas, [21] [22] y compuestos perfluorados. [23] El aumento de la aneuploidía de los espermatozoides a menudo se produce en asociación con un mayor daño del ADN. La fragmentación del ADN y el aumento de la susceptibilidad del ADN in situ a la desnaturalización, características similares a las observadas durante la apoptosis de las células somáticas, caracterizan a los espermatozoides anormales en los casos de infertilidad masculina . [24] [25]
Aunque durante mucho tiempo se ha considerado imposible la reparación del ADN en los espermatozoides humanos debido al alto nivel de compactación del ADN en estas células, los espermatozoides humanos poseen una vía de reparación por escisión de bases truncada que está mediada por la 8-oxoguanina ADN glicosilasa 1 (OGG1) . [26] Por lo tanto, los espermatozoides maduros parecen tener una capacidad limitada para generar una respuesta de reparación del ADN al estrés oxidativo . [26]
Las moléculas de glicoproteínas que se encuentran en la superficie de los espermatozoides eyaculados son reconocidas por todos los sistemas inmunológicos femeninos y son interpretadas como una señal de que no se debe rechazar la célula. De lo contrario, el sistema inmunológico femenino podría atacar a los espermatozoides en el tracto reproductivo . Las glicoproteínas específicas que recubren los espermatozoides también son utilizadas por algunas células cancerosas y bacterianas, algunos gusanos parásitos y glóbulos blancos infectados por el VIH, evitando así una respuesta inmunológica del organismo huésped . [27]
La barrera hemato-testicular , mantenida por las uniones estrechas entre las células de Sertoli de los túbulos seminíferos, impide la comunicación entre los espermatozoides en formación en el testículo y los vasos sanguíneos (y las células inmunitarias que circulan por ellos) dentro del espacio intersticial . Esto les impide provocar una respuesta inmunitaria. La barrera hemato-testicular también es importante para evitar que las sustancias tóxicas interrumpan la espermatogénesis. [ cita requerida ]

En la mayoría de los animales con capacidad de reproducción sexual, la fertilización depende de los espermatozoides.
Algunas especies de mosca de la fruta producen el espermatozoide más grande conocido que se encuentra en la naturaleza. [28] [29] Drosophila melanogaster produce espermatozoides que pueden medir hasta 1,8 mm, [30] mientras que su pariente Drosophila bifurca produce el espermatozoide más grande conocido, midiendo más de 58 mm de longitud. [28] En Drosophila melanogaster , todo el espermatozoide, incluida la cola, se incorpora al citoplasma del ovocito , sin embargo, para Drosophila bifurca solo una pequeña porción de la cola ingresa al ovocito. [31]
El ratón de campo Apodemus sylvaticus posee espermatozoides con morfología falciforme. Otra característica que hace únicos a estos gametocitos es la presencia de un gancho apical en la cabeza del espermatozoide. Este gancho se utiliza para unirse a los ganchos o a los flagelos de otros espermatozoides. La agregación es causada por estas uniones y resultan trenes móviles. Estos trenes proporcionan una mejor motilidad en el tracto reproductivo femenino y son un medio por el cual se promueve la fertilización. [32]
La fase postmeiótica de la espermatogénesis del ratón es muy sensible a los agentes genotóxicos ambientales , porque a medida que las células germinales masculinas forman espermatozoides maduros pierden progresivamente la capacidad de reparar los daños en el ADN. [33] La irradiación de ratones machos durante la espermatogénesis tardía puede inducir daños que persisten durante al menos 7 días en los espermatozoides fertilizadores, y la interrupción de las vías de reparación de roturas de doble cadena del ADN materno aumenta las aberraciones cromosómicas derivadas de los espermatozoides. [34] El tratamiento de ratones machos con melfalán , un agente alquilante bifuncional empleado con frecuencia en quimioterapia, induce lesiones del ADN durante la meiosis que pueden persistir en un estado no reparado a medida que las células germinales progresan a través de fases competentes para la reparación del ADN del desarrollo espermatogénico. [35] Dichos daños no reparados del ADN en los espermatozoides, después de la fertilización, pueden dar lugar a crías con diversas anomalías.
Los erizos de mar como Arbacia punctulata son organismos ideales para utilizar en la investigación de espermatozoides, ya que generan grandes cantidades de espermatozoides en el mar, lo que los hace muy adecuados como organismos modelo para experimentos. [36]
Los espermatozoides de los marsupiales suelen ser más largos que los de los mamíferos placentarios . [37]
Los gametofitos de las briofitas , los helechos y algunas gimnospermas producen espermatozoides móviles , al contrario de los granos de polen empleados en la mayoría de las gimnospermas y todas las angiospermas . Esto hace imposible la reproducción sexual en ausencia de agua , ya que el agua es un medio necesario para que el espermatozoide y el óvulo se encuentren. Las algas y los espermatozoides de las plantas inferiores suelen ser multiflagelados (véase la imagen) y, por tanto, morfológicamente diferentes de los espermatozoides animales. [38]
Algunas algas y hongos producen espermatozoides inmóviles, llamados espermatozoides. En las plantas superiores y en algunas algas y hongos, la fecundación implica la migración del núcleo del espermatozoide a través de un tubo de fecundación (por ejemplo, el tubo polínico en las plantas superiores) para llegar al óvulo. [ cita requerida ]
Los espermatozoides se producen en los túbulos seminíferos de los testículos en un proceso llamado espermatogénesis . Las células redondas llamadas espermatogonias se dividen y se diferencian para convertirse en espermatozoides. Durante la cópula , la cloaca o vagina se insemina y luego los espermatozoides se desplazan a través de la quimiotaxis hasta el óvulo dentro de un oviducto .
En técnicas de reproducción asistida se denomina normozoospermia a una cantidad total de eyaculados >39 millones , >32% con motilidad progresiva y >4% con morfología normal. Asimismo, una eyaculación normal en humanos debe tener un volumen superior a 1,5 ml, siendo un volumen excesivo 6 ml por eyaculación ( hiperespermia ). Un volumen insuficiente se denomina hipospermia . Estos problemas están relacionados con varias complicaciones en la producción de espermatozoides, por ejemplo:
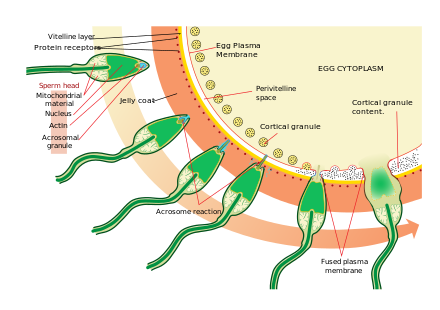
El acercamiento al óvulo es un proceso de quimiotaxis bastante complejo y de múltiples pasos guiado por diferentes sustancias químicas/estímulos en niveles individuales de filogenia. Uno de los caracteres de señalización más significativos y comunes del evento es que se ha demostrado un prototipo de receptores de quimiotaxis profesionales, el receptor de péptidos formilo (60.000 receptores/célula), así como la capacidad activadora de su ligando formilo Met-Leu-Phe en la membrana superficial incluso en el caso de los espermatozoides humanos. [39] Los espermatozoides de mamíferos se vuelven aún más activos cuando se acercan a un óvulo en un proceso llamado activación del esperma . Se ha demostrado que la activación del esperma es causada por ionóforos de calcio in vitro , progesterona liberada por las células del cúmulo cercanas y la unión a ZP3 de la zona pelúcida . Las células del cúmulo están incrustadas en una sustancia similar a un gel hecha principalmente de ácido hialurónico , y se desarrollan en el ovario con el óvulo y lo sostienen a medida que crece.
El cambio inicial se denomina “hiperactivación”, y provoca un cambio en la movilidad de los espermatozoides, que nadan más rápido y los movimientos de su cola se vuelven más enérgicos y erráticos.
Un descubrimiento reciente relaciona la hiperactivación con una entrada repentina de iones de calcio en las colas. La cola en forma de látigo (flagelo) del espermatozoide está llena de canales iónicos formados por proteínas llamadas CatSper . Estos canales son selectivos y solo permiten el paso de iones de calcio. La apertura de los canales CatSper es responsable de la entrada de calcio. El aumento repentino de los niveles de calcio hace que el flagelo forme curvas más profundas, impulsando al espermatozoide con más fuerza a través del entorno viscoso. La hiperactividad del espermatozoide es necesaria para atravesar dos barreras físicas que protegen al óvulo de la fertilización.
El segundo proceso en la activación de los espermatozoides es la reacción del acrosoma . Esto implica la liberación del contenido del acrosoma, que se dispersa, y la exposición de las enzimas adheridas a la membrana acrosómica interna del espermatozoide. Esto ocurre después de que el espermatozoide se encuentra por primera vez con el óvulo. Este mecanismo de tipo cerradura y llave es específico de cada especie y evita que el espermatozoide y el óvulo de diferentes especies se fusionen. Hay algunas pruebas de que esta unión es lo que desencadena que el acrosoma libere las enzimas que permiten que el espermatozoide se fusione con el óvulo.
La ZP3, una de las proteínas que componen la zona pelúcida, se une a una molécula asociada en el espermatozoide. Las enzimas de la membrana acrosómica interna digieren la zona pelúcida. Una vez que el espermatozoide penetra en la zona pelúcida, parte de la membrana celular del espermatozoide se fusiona con la membrana del óvulo y el contenido de la cabeza se difunde en el óvulo.
Tras la penetración, se dice que el ovocito se ha activado . Experimenta su división meiótica secundaria y los dos núcleos haploides (paterno y materno) se fusionan para formar un cigoto . Para evitar la polispermia y minimizar la posibilidad de producir un cigoto triploide , varios cambios en la zona pelúcida del óvulo los vuelven impenetrables poco después de que el primer espermatozoide ingrese al óvulo.
Los espermatozoides se pueden almacenar en diluyentes como el diluyente de temperatura variable Illini (IVT), que se ha demostrado que puede preservar una alta fertilidad de los espermatozoides durante más de siete días. [40] El diluyente IVT está compuesto de varias sales, azúcares y agentes antibacterianos y gasificado con CO 2 . [40]
La criopreservación de semen se puede utilizar durante períodos de almacenamiento mucho más prolongados. En el caso de los espermatozoides humanos, el período de almacenamiento más prolongado con éxito registrado con este método es de 21 años. [41]
La capacitación es la fase final del desarrollo de los espermatozoides, cuando adquieren la capacidad de fecundar al ovocito. In vivo, ocurre durante la eyaculación, cuando los espermatozoides salen de la vagina y entran en el tracto reproductor femenino superior. In vitro, ocurre cuando los espermatozoides son lavados y purificados. Casi el 30-40% de la infertilidad se debe al factor masculino, por lo que se han creado varias estrategias con el fin de recuperar los espermatozoides funcionales. La medida MMP (Million Motile Progressive cells per milliliter) es sinónimo de capacitación , y es un parámetro muy útil para decidir, junto con un espermiograma , el tipo de tratamiento necesario. Representa la relación entre el % de espermatozoides móviles progresivos obtenidos en capacitados y el % de espermatozoides móviles progresivos obtenidos en eyaculados. Se basa en el porcentaje de recuperación. En función del porcentaje, decidiremos la calidad de la recuperación de espermatozoides móviles: se considera óptimo entre 15 y 25 millones de espermatozoides/ml, suficiente entre 5 y 15 millones y subóptimo o insuficiente cuando se alcanzan menos de 5 millones. En función de los valores que hayamos obtenido, junto con los resultados del espermiograma, se mostrarán las diferentes técnicas.
Por ejemplo, si se encuentran más de 1,0×10 6 espermatozoides móviles progresivos por mililitro, se recomendará mantener relaciones sexuales, y si éstas fallan, el siguiente paso será la inseminación intrauterina y posteriormente la fecundación in vitro convencional .
Con menos de 1,0×10 6 espermatozoides móviles progresivos por mililitro, realizaremos una inyección intracitoplasmática de espermatozoides . En caso de azoospermia (ausencia de espermatozoides en el eyaculado), realizaremos una biopsia testicular para comprobar si hay espermatozoides en los testículos o si no se están produciendo.