Clase de receptores acoplados a proteína G implicados en la quimiotaxis
Los receptores de péptidos formilo ( FPR ) pertenecen a una clase de receptores acoplados a proteína G involucrados en la quimiotaxis . [1] [2] En humanos, hay tres isoformas de receptores de péptidos formilo, cada una codificada por un gen separado que se denominan FPR1 , FPR2 y FPR3 . [1] Estos receptores se identificaron originalmente por su capacidad para unirse a péptidos N-formilo como la N -formilmetionina producida por la degradación de células bacterianas o huésped. [3] [4] Por lo tanto, los receptores de péptidos formilo están involucrados en la mediación de la respuesta de las células inmunes a la infección. Estos receptores también pueden actuar para suprimir el sistema inmunológico en ciertas condiciones. [5] La estrecha relación filogenética de la señalización en la quimiotaxis y el olfato se demostró recientemente mediante la detección de proteínas similares a los receptores de péptidos formilo como una familia distinta de quimiosensores del órgano vomeronasal en ratones. [6] [7]
La Unión Internacional de Farmacología Básica y Clínica ahora acepta correctamente el término FPR como FPR1 . [2]
Descubrimiento
Estudios realizados en la década de 1970 encontraron que una serie de oligopéptidos que contienen N-formilmetionina , incluido el miembro más potente y mejor conocido de esta serie, N-formilmetionina-leucil-fenilalanina (fMLF o fMet-Leu-Phe), estimulaban a los neutrófilos de conejo y humanos mediante un aparente mecanismo dependiente del receptor para migrar en un patrón direccional en ensayos de laboratorio clásicos de quimiotaxis . Dado que estos oligopéptidos fueron producidos por bacterias o análogos sintéticos de dichos productos, se sugirió que los oligopéptidos N-formil son factores quimiotácticos importantes y sus receptores son receptores de factores quimiotácticos importantes que actúan respectivamente como elementos de señalización y reconocimiento de señales para iniciar respuestas inflamatorias con el fin de defenderse contra la invasión bacteriana. Estudios posteriores definieron un receptor para los oligopéptidos N-formil, el receptor de péptidos formilo (FPR), llamado así en función de su capacidad para unirse y ser activado por los oligopéptidos. Posteriormente se descubrieron dos receptores, que recibieron el nombre de FPR1 y FPR2, basándose en la similitud de la secuencia de aminoácidos predicha de sus genes con la del FPR, en lugar de en su capacidad de unirse o ser activados por los oligopéptidos de formilo. Estos tres receptores fueron renombrados como FPR1, FPR2 y FPR3 y se descubrió que tienen especificidades muy diferentes para los oligopéptidos de formilo y funciones muy diferentes que incluyen iniciar respuestas inflamatorias a los péptidos N-formilo liberados no solo por las bacterias sino también a una multiplicidad de elementos liberados por los tejidos del huésped; amortiguar y resolver las respuestas inflamatorias; y tal vez contribuir al desarrollo de ciertos cánceres neurológicos y una variedad de enfermedades neurológicas basadas en amiloide . [2]
Estructura y función
El receptor de péptidos formílicos (FPR) pertenece a la clase de receptores que poseen siete dominios transmembrana hidrofóbicos. La conformación del FPR se estabiliza mediante varias interacciones. Estas incluyen la posible formación de puentes salinos entre Arg84-Arg205, Lys85-Arg205 y Lys85-Asp284 que ayudan a determinar la estructura tridimensional de los dominios transmembrana, así como residuos con carga positiva (Arg, Lys) que interactúan con fosfatos con carga negativa. Además, el residuo Arg163 puede interactuar con el bolsillo de unión del ligando del segundo bucle extracelular del FPR.
Con respecto a la unión del péptido formilo Met-Leu-Phe, existen interacciones potenciales adicionales que incluyen interacciones de enlace de hidrógeno entre Arg84 y Lys85 del primer bucle extracelular y el grupo N-formilo del ligando, así como la estructura peptídica del formilo Met-Leu-Phe, que pueden formar interacciones similares. Se demostró que la fracción formilo-Met del ligando forma puentes disulfuro con residuos de Cys, y también se demostró una interacción con Arg163. (Es importante mencionar que algunas interacciones que estabilizan la conformación del receptor también pueden influir en la unión del ligando). Algunos oligopéptidos también se describieron como constituyentes característicos vinculados a Asn-s de la parte N-terminal extracelular y al bolsillo de unión del ligando del segundo bucle extracelular. Estos componentes también pueden determinar o hacer más específica la interacción ligando-receptor. [7] [8]
Vías de señalización
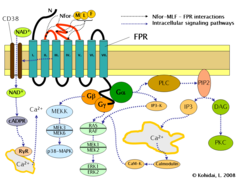
La inducción de FPR desencadena múltiples cambios en las células eucariotas , incluida la reorganización del citoesqueleto , que a su vez facilita la migración celular y la síntesis de quimiocinas . Las vías importantes reguladas por FPR incluyen:
- Activación de la fosfolipasa C (PLC) dependiente de la proteína G , que da como resultado la descomposición del fosfolípido constituyente de la membrana, fosfatidilinositol (4,5)-bisfosfato (PIP2) en inositol (1,4,5)-trifosfato (IP3) y diacilglicerol (DAG). El IP3 es uno de los inductores más eficaces del aumento de Ca 2+ desde los depósitos citoplasmáticos y desde el exterior de la célula a través de la apertura de los canales de Ca 2+ . A su vez, el DAG es un inductor de la proteína quinasa C (PKC).
- Activación de la GTPasa pequeña reguladora, RAS . La RAS activa puede a su vez activar RAF , una quinasa Ser/Thr. En el siguiente paso se activan las quinasas de proteína activadas por mitógeno (quinasas MAP). (También conocidas como quinasas reguladas por señales extracelulares - ERKs o quinasa MAP/ERK (MEK)). Como resultado del último paso, se activan ERK1 y ERK2 . Las formas fosforiladas de ERK pueden continuar la cascada desencadenando la activación de más quinasas interactuantes, lo que da como resultado una actividad transcripcional alterada en el núcleo.
- La unión del ligando a FPR también puede inducir la activación de CD38 , una ectoenzima de la membrana superficial. Como resultado de la activación, las moléculas de NAD + ingresarán al citoplasma. El NAD + se convierte en ADP ribosa cíclica (cADPR), un segundo mensajero que interactúa con los receptores de rianodina (RyR) en la superficie del retículo endoplasmático rugoso . El resultado general del proceso es un aumento de los niveles de Ca 2+ citoplasmático a través de la vía directa descrita anteriormente y también a través de vías indirectas como la apertura de canales de Ca 2+ en la membrana celular. El aumento sostenido de Ca 2+ es necesario para la migración dirigida de las células. [9]
Véase también
Referencias
- ^ ab Migeotte I, Communi D, Parmentier M (diciembre de 2006). "Receptores de péptidos formilo: una subfamilia promiscua de receptores acoplados a proteína G que controlan las respuestas inmunitarias". Cytokine & Growth Factor Reviews . 17 (6): 501–19. doi :10.1016/j.cytogfr.2006.09.009. PMID 17084101.
- ^ abc Ye RD, Boulay F, Wang JM, Dahlgren C, Gerard C, Parmentier M, Serhan CN, Murphy PM (junio de 2009). "Unión Internacional de Farmacología Básica y Clínica. LXXIII. Nomenclatura para la familia de receptores de péptidos formilo (FPR)". Pharmacological Reviews . 61 (2): 119–61. doi :10.1124/pr.109.001578. PMC 2745437 . PMID 19498085.
- ^ Le Y, Murphy PM, Wang JM (noviembre de 2002). "Revisión de los receptores de péptidos de formilo". Tendencias en inmunología . 23 (11): 541–8. doi :10.1016/S1471-4906(02)02316-5. PMID 12401407.
- ^ Panaro MA, Acquafredda A, Sisto M, Lisi S, Maffione AB, Mitolo V (2006). "Función biológica de los receptores de péptidos N-formilo". Inmunofarmacología e inmunotoxicología . 28 (1): 103–27. doi :10.1080/08923970600625975. hdl :11586/115781. PMID 16684671. S2CID 23082578.
- ^ Braun MC, Wang JM, Lahey E, Rabin RL, Kelsall BL (junio de 2001). "La activación del receptor del péptido formilo por el péptido derivado del VIH T-20 suprime la producción de interleucina-12 p70 por monocitos humanos". Blood . 97 (11): 3531–6. doi :10.1182/blood.V97.11.3531. PMID 11369647.
- ^ Rivière S, Challet L, Fluegge D, Spehr M, Rodriguez I (mayo de 2009). "Las proteínas similares a los receptores de péptidos formilo son una nueva familia de quimiosensores vomeronasales". Nature . 459 (7246): 574–7. Bibcode :2009Natur.459..574R. doi :10.1038/nature08029. PMID 19387439. S2CID 4302009.
- ^ ab Yuan S, Ghoshdastider U, Trzaskowski B, Latek D, Debinski A, Pulawski W, Wu R, Gerke V, Filipek S (2012). "El papel del agua en el mecanismo de activación del receptor 1 del péptido N-formilo humano (FPR1) basado en simulaciones de dinámica molecular". PLOS ONE . 7 (11): e47114. Bibcode :2012PLoSO...747114Y. doi : 10.1371/journal.pone.0047114 . PMC 3506623 . PMID 23189124.
- ^ Lala A, Gwinn M, De Nardin E (septiembre de 1999). "Función del receptor de péptidos formilo humano: papel de los residuos cargados conservados y no conservados". Revista Europea de Bioquímica . 264 (2): 495–9. doi : 10.1046/j.1432-1327.1999.00647.x . PMID 10491096.
- ^ Partida-Sánchez S, Cockayne DA, Monard S, Jacobson EL, Oppenheimer N, Garvy B, Kusser K, Goodrich S, Howard M, Harmsen A, Randall TD, Lund FE (noviembre de 2001). "La producción cíclica de ADP-ribosa por CD38 regula la liberación intracelular de calcio, la entrada de calcio extracelular y la quimiotaxis en los neutrófilos y es necesaria para la eliminación bacteriana in vivo". Nature Medicine . 7 (11): 1209–16. doi :10.1038/nm1101-1209. PMID 11689885. S2CID 13239085.
Enlaces externos
- "Receptores de formilpéptidos". Base de datos de receptores y canales iónicos de la IUPHAR . Unión Internacional de Farmacología Básica y Clínica. Archivado desde el original el 19 de junio de 2015. Consultado el 2 de noviembre de 2007 .
- Receptor de péptidos formilo en los encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.