Un hemograma completo ( CBC ), también conocido como hemograma completo ( FBC ), es un conjunto de pruebas de laboratorio médico que proporcionan información sobre las células de la sangre de una persona . El hemograma indica los recuentos de glóbulos blancos , glóbulos rojos y plaquetas , la concentración de hemoglobina y el hematocrito (el porcentaje en volumen de glóbulos rojos). También se informan los índices de glóbulos rojos , que indican el tamaño promedio y el contenido de hemoglobina de los glóbulos rojos, y puede incluirse un diferencial de glóbulos blancos , que cuenta los diferentes tipos de glóbulos blancos.
El hemograma completo suele realizarse como parte de una evaluación médica y puede utilizarse para controlar la salud o diagnosticar enfermedades. Los resultados se interpretan comparándolos con rangos de referencia , que varían con el sexo y la edad. Condiciones como la anemia y la trombocitopenia se definen por resultados anormales del hemograma. Los índices de glóbulos rojos pueden proporcionar información sobre la causa de la anemia de una persona, como la deficiencia de hierro y la deficiencia de vitamina B12 , y los resultados del diferencial de glóbulos blancos pueden ayudar a diagnosticar infecciones virales , bacterianas y parasitarias y trastornos sanguíneos como la leucemia . No todos los resultados que quedan fuera del rango de referencia requieren intervención médica.
El hemograma generalmente se realiza mediante un analizador de hematología automatizado , que cuenta las células y recopila información sobre su tamaño y estructura. Se mide la concentración de hemoglobina y los índices de glóbulos rojos se calculan a partir de las mediciones de glóbulos rojos y hemoglobina. Se pueden utilizar pruebas manuales para confirmar de forma independiente resultados anormales. Aproximadamente entre el 10% y el 25% de las muestras requieren una revisión manual del frotis de sangre , [5] en la que la sangre se tiñe y se observa bajo un microscopio para verificar que los resultados del analizador sean consistentes con la apariencia de las células y buscar anomalías. El hematocrito se puede determinar manualmente centrifugando la muestra y midiendo la proporción de glóbulos rojos, y en laboratorios sin acceso a instrumentos automatizados, las células sanguíneas se cuentan bajo el microscopio utilizando un hemocitómetro .
En 1852, Karl Vierordt publicó el primer procedimiento para realizar un hemograma, que implicaba esparcir un volumen conocido de sangre en un portaobjetos de microscopio y contar cada célula. La invención del hemocitómetro en 1874 por Louis-Charles Malassez simplificó el análisis microscópico de las células sanguíneas y, a finales del siglo XIX, Paul Ehrlich y Dmitri Leonidovich Romanowsky desarrollaron técnicas para teñir glóbulos blancos y rojos que todavía se utilizan para examinar frotis de sangre. . En la década de 1920 se desarrollaron métodos automatizados para medir la hemoglobina, y Maxwell Wintrobe introdujo el método del hematocrito Wintrobe en 1929, que a su vez le permitió definir los índices de glóbulos rojos. Un hito en la automatización de los recuentos de células sanguíneas fue el principio Coulter , que fue patentado por Wallace H. Coulter en 1953. El principio Coulter utiliza mediciones de impedancia eléctrica para contar las células sanguíneas y determinar su tamaño; es una tecnología que sigue utilizándose en muchos analizadores automatizados. Otras investigaciones realizadas en la década de 1970 implicaron el uso de mediciones ópticas para contar e identificar células, lo que permitió la automatización del diferencial de glóbulos blancos.

La sangre está compuesta por una porción líquida, llamada plasma , y una porción celular que contiene glóbulos rojos , glóbulos blancos y plaquetas . [nota 1] [7] El hemograma completo evalúa los tres componentes celulares de la sangre. Algunas afecciones médicas, como la anemia o la trombocitopenia , se definen por marcados aumentos o disminuciones en el recuento de células sanguíneas. [8] Los cambios en muchos sistemas de órganos pueden afectar la sangre, por lo que los resultados del hemograma son útiles para investigar una amplia gama de afecciones. Por la cantidad de información que aporta, el hemograma completo es una de las pruebas de laboratorio médico más realizadas. [9] [10] [11]
El CBC se utiliza a menudo para detectar enfermedades como parte de una evaluación médica. [12] También se solicita cuando un proveedor de atención médica sospecha que una persona tiene una enfermedad que afecta las células sanguíneas, como una infección , un trastorno hemorrágico o algunos cánceres . A las personas a las que se les ha diagnosticado trastornos que pueden causar resultados anormales de hemograma o que están recibiendo tratamientos que pueden afectar el recuento de células sanguíneas se les puede realizar un hemograma regular para controlar su salud, [4] [12] y la prueba a menudo se realiza todos los días en personas que están hospitalizadas. [13] Los resultados pueden indicar la necesidad de una transfusión de sangre o plaquetas . [14]
El hemograma completo tiene aplicaciones específicas en muchas especialidades médicas . A menudo se realiza antes de que una persona se someta a una cirugía para detectar anemia, garantizar que los niveles de plaquetas sean suficientes y detectar infecciones, [15] [16] así como después de la cirugía, para poder controlar la pérdida de sangre . [12] [17] En medicina de emergencia , el CBC se utiliza para investigar numerosos síntomas, como fiebre , dolor abdominal y dificultad para respirar , [18] [19] [20] y para evaluar hemorragias y traumatismos . [21] [22] Los recuentos sanguíneos se controlan estrechamente en personas que reciben quimioterapia o radioterapia para el cáncer, porque estos tratamientos suprimen la producción de células sanguíneas en la médula ósea y pueden producir niveles muy bajos de glóbulos blancos, plaquetas y hemoglobina . [23] Los hemogramas regulares son necesarios para las personas que toman algunos medicamentos psiquiátricos , como clozapina y carbamazepina , que en casos raros pueden causar una disminución potencialmente mortal en la cantidad de glóbulos blancos ( agranulocitosis ). [24] [25] Debido a que la anemia durante el embarazo puede tener como resultado peores resultados para la madre y su bebé, el hemograma completo es una parte rutinaria de la atención prenatal ; [26] y en los recién nacidos , puede ser necesario un hemograma completo para investigar la ictericia o contar el número de células inmaduras en el diferencial de glóbulos blancos , lo que puede ser un indicador de sepsis . [27] [28]
El hemograma completo es una herramienta esencial de la hematología , que es el estudio de la causa, pronóstico, tratamiento y prevención de enfermedades relacionadas con la sangre. [29] Los resultados del hemograma y el examen de frotis reflejan el funcionamiento del sistema hematopoyético : los órganos y tejidos involucrados en la producción y el desarrollo de las células sanguíneas, particularmente la médula ósea . [9] [30] Por ejemplo, un recuento bajo de los tres tipos de células ( pancitopenia ) puede indicar que la producción de células sanguíneas se está viendo afectada por un trastorno de la médula ósea, y un examen de la médula ósea puede investigar más a fondo la causa. [31] Las células anormales en el frotis de sangre pueden indicar leucemia aguda o linfoma , [30] mientras que un recuento anormalmente alto de neutrófilos o linfocitos, en combinación con síntomas indicativos y hallazgos en el frotis de sangre, pueden generar sospechas de un trastorno mieloproliferativo o un trastorno linfoproliferativo . El examen de los resultados del hemograma y del frotis de sangre puede ayudar a distinguir entre causas de anemia, como deficiencias nutricionales , trastornos de la médula ósea , anemias hemolíticas adquiridas y afecciones hereditarias como la anemia falciforme y la talasemia . [32] [33]
Los rangos de referencia para el hemograma representan el rango de resultados encontrados en el 95% de las personas aparentemente sanas. [nota 2] [35] Por definición, el 5% de los resultados siempre estarán fuera de este rango, por lo que algunos resultados anormales pueden reflejar una variación natural en lugar de significar un problema médico. [36] Esto es particularmente probable si dichos resultados están sólo ligeramente fuera del rango de referencia, si son consistentes con resultados anteriores o si no hay otras anomalías relacionadas mostradas por el CBC. [37] Cuando la prueba se realiza en una población relativamente sana, el número de anomalías clínicamente insignificantes puede exceder el número de resultados que representan una enfermedad. [38] Por esta razón, organizaciones profesionales en los Estados Unidos, el Reino Unido y Canadá recomiendan no realizar pruebas de hemograma preoperatorio para cirugías de bajo riesgo en personas sin condiciones médicas relevantes. [15] [39] [40] Las extracciones de sangre repetidas para pruebas hematológicas en pacientes hospitalizados pueden contribuir a la anemia adquirida en el hospital y pueden resultar en transfusiones innecesarias. [38]
La muestra se recolecta extrayendo sangre en un tubo que contiene un anticoagulante (generalmente EDTA ) para detener su coagulación natural . [41] La sangre generalmente se extrae de una vena , pero cuando esto es difícil, se puede extraer de los capilares mediante una punción en el dedo o mediante un pinchazo en el talón en los bebés. [42] [43] Las pruebas generalmente se realizan en un analizador automatizado, pero se pueden utilizar técnicas manuales como un examen de frotis de sangre o una prueba manual de hematocrito para investigar resultados anormales. [44] Los recuentos celulares y las mediciones de hemoglobina se realizan manualmente en laboratorios que carecen de acceso a instrumentos automatizados. [45]
A bordo del analizador, la muestra se agita para distribuir uniformemente las células, luego se diluye y se divide en al menos dos canales, uno de los cuales se usa para contar glóbulos rojos y plaquetas, el otro para contar glóbulos blancos y determinar la concentración de hemoglobina. . Algunos instrumentos miden la hemoglobina en un canal separado y se pueden usar canales adicionales para recuentos diferenciales de glóbulos blancos, recuentos de reticulocitos y mediciones especializadas de plaquetas. [46] [47] [48] Las células se suspenden en una corriente de fluido y sus propiedades se miden a medida que pasan por los sensores en una técnica conocida como citometría de flujo . [nota 3] [49] [52] Se puede utilizar el enfoque hidrodinámico para aislar células individuales de modo que se puedan obtener resultados más precisos: la muestra diluida se inyecta en una corriente de fluido a baja presión, lo que hace que las células de la muestra se alinearse en fila india mediante flujo laminar . [53] [54]


Para medir la concentración de hemoglobina, se agrega un reactivo químico a la muestra para destruir ( lisar ) los glóbulos rojos en un canal separado del utilizado para los recuentos de glóbulos rojos. En los analizadores que realizan recuentos de glóbulos blancos en el mismo canal que la medición de hemoglobina, esto permite contar los glóbulos blancos más fácilmente. [55] Los analizadores de hematología miden la hemoglobina mediante espectrofotometría y se basan en la relación lineal entre la absorbancia de la luz y la cantidad de hemoglobina presente. Se utilizan productos químicos para convertir diferentes formas de hemoglobina, como oxihemoglobina y carboxihemoglobina , en una forma estable, generalmente cianmetahemoglobina , y para crear un cambio de color permanente. La absorbancia del color resultante, cuando se mide a una longitud de onda específica (normalmente 540 nanómetros ), corresponde a la concentración de hemoglobina. [56] [57]
Los sensores cuentan e identifican las células de la muestra utilizando dos principios fundamentales: impedancia eléctrica y dispersión de la luz . [58] El recuento de células basado en impedancia funciona según el principio de Coulter : las células están suspendidas en un fluido que transporta una corriente eléctrica y, cuando pasan a través de una pequeña abertura (una abertura), provocan disminuciones en la corriente debido a su mala conductividad eléctrica . La amplitud del pulso de voltaje generado cuando una celda cruza la apertura se correlaciona con la cantidad de líquido desplazado por la celda y, por lo tanto, con el volumen de la celda, [59] [60] mientras que el número total de pulsos se correlaciona con el número de celdas en el muestra. La distribución de los volúmenes de las células se traza en un histograma y, al establecer umbrales de volumen basados en los tamaños típicos de cada tipo de célula, se pueden identificar y contar las diferentes poblaciones de células. [61]
En las técnicas de dispersión de luz, la luz de un láser o de una lámpara halógena de tungsteno se dirige al flujo de células para recopilar información sobre su tamaño y estructura. Las células dispersan la luz en diferentes ángulos a medida que pasan a través del haz, que se detecta mediante fotómetros . [62] La dispersión directa, que se refiere a la cantidad de luz dispersada a lo largo del eje del haz, es causada principalmente por la difracción de la luz y se correlaciona con el tamaño celular, mientras que la dispersión lateral (luz dispersada en un ángulo de 90 grados) es causada por la reflexión y refracción y proporciona información sobre la complejidad celular. [62] [63]
Los métodos basados en radiofrecuencia se pueden utilizar en combinación con impedancia. Estas técnicas funcionan según el mismo principio de medir la interrupción de la corriente cuando las células pasan a través de una abertura, pero dado que la corriente de RF de alta frecuencia penetra en las células, la amplitud del pulso resultante se relaciona con factores como el tamaño relativo del núcleo . la estructura del núcleo y la cantidad de gránulos en el citoplasma . [64] [65] Los glóbulos rojos pequeños y los restos celulares, que son similares en tamaño a las plaquetas, pueden interferir con el recuento de plaquetas, y las plaquetas grandes pueden no contarse con precisión, por lo que algunos analizadores utilizan técnicas adicionales para medir las plaquetas, como la fluorescencia. tinción, dispersión de luz multiángulo y etiquetado de anticuerpos monoclonales . [48]
La mayoría de los analizadores miden directamente el tamaño promedio de los glóbulos rojos, que se denomina volumen celular medio (MCV), y calculan el hematocrito multiplicando el recuento de glóbulos rojos por el MCV. Algunos miden el hematocrito comparando el volumen total de glóbulos rojos con el volumen de sangre muestreado y derivan el MCV del hematocrito y el recuento de glóbulos rojos. [66] La concentración de hemoglobina, el recuento de glóbulos rojos y el hematocrito se utilizan para calcular la cantidad promedio de hemoglobina dentro de cada glóbulo rojo, la hemoglobina corpuscular media (MCH); y su concentración, la concentración media de hemoglobina corpuscular (MCHC). [67] Otro cálculo, el ancho de distribución de los glóbulos rojos (RDW), se deriva de la desviación estándar del volumen celular medio y refleja la variación en el tamaño celular. [68]

Después de ser tratados con reactivos, los glóbulos blancos forman tres picos distintos cuando sus volúmenes se representan en un histograma. Estos picos corresponden aproximadamente a poblaciones de granulocitos , linfocitos y otras células mononucleares , lo que permite realizar un diferencial de tres partes basado únicamente en el volumen celular. [69] [70] Los analizadores más avanzados utilizan técnicas adicionales para proporcionar un diferencial de cinco a siete partes, como la dispersión de luz o el análisis de radiofrecuencia, [70] o el uso de tintes para teñir sustancias químicas específicas dentro de las células, por ejemplo, ácidos nucleicos . que se encuentran en concentraciones más altas en células inmaduras [71] o mieloperoxidasa , una enzima que se encuentra en las células del linaje mieloide . [72] [73] Los basófilos se pueden contar en un canal separado donde un reactivo destruye otros glóbulos blancos y deja los basófilos intactos. Los datos recopilados de estas mediciones se analizan y se representan en un diagrama de dispersión , donde forman grupos que se correlacionan con cada tipo de glóbulo blanco. [70] [72] Otro enfoque para automatizar el recuento diferencial es el uso de software de microscopía digital, [74] que utiliza inteligencia artificial para clasificar los glóbulos blancos a partir de fotomicrografías del frotis de sangre. Las imágenes de las células se muestran a un operador humano, quien puede reclasificar las células manualmente si es necesario. [75]
La mayoría de los analizadores tardan menos de un minuto en realizar todas las pruebas del hemograma completo. [58] Debido a que los analizadores toman muestras y cuentan muchas células individuales, los resultados son muy precisos. [76] Sin embargo, es posible que algunas células anormales no se identifiquen correctamente, lo que requiere una revisión manual de los resultados del instrumento y la identificación por otros medios de células anormales que el instrumento no pudo categorizar. [5] [77]
Las pruebas en el lugar de atención se refieren a pruebas realizadas fuera del laboratorio, como al lado de la cama de una persona o en una clínica. [78] [79] Este método de prueba es más rápido y utiliza menos sangre que los métodos convencionales, y no requiere personal especialmente capacitado, por lo que es útil en situaciones de emergencia y en áreas con acceso limitado a recursos. Los dispositivos comúnmente utilizados para pruebas de hematología en el lugar de atención incluyen el HemoCue , un analizador portátil que utiliza espectrofotometría para medir la concentración de hemoglobina de la muestra, y el i-STAT , que deriva una lectura de hemoglobina estimando la concentración de glóbulos rojos de la conductividad de la sangre. [79] La hemoglobina y el hematocrito se pueden medir en dispositivos de punto de atención diseñados para pruebas de gases en sangre , pero estas mediciones a veces se correlacionan mal con las obtenidas mediante métodos estándar. [78] Existen versiones simplificadas de analizadores de hematología diseñados para su uso en clínicas que pueden proporcionar un recuento sanguíneo completo y diferencial. [80]
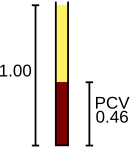
Las pruebas se pueden realizar manualmente cuando no hay equipos automatizados disponibles o cuando los resultados del analizador indican que se necesita más investigación. [45] Los resultados automatizados se marcan para revisión manual de frotis de sangre en 10 a 25 % de los casos, lo que puede deberse a poblaciones de células anormales que el analizador no puede contar adecuadamente, [5] indicadores internos generados por el analizador que sugieren que los resultados podrían ser resultados inexactos, [81] o numéricos que quedan fuera de los umbrales establecidos. [77] Para investigar estos problemas, se extiende sangre en un portaobjetos de microscopio, se tiñe con una tinción de Romanowsky y se examina bajo un microscopio . [82] Se evalúa la apariencia de los glóbulos rojos, blancos y las plaquetas, y se informan las anomalías cualitativas si están presentes. [83] Los cambios en la apariencia de los glóbulos rojos pueden tener una importancia diagnóstica considerable; por ejemplo, la presencia de células falciformes es indicativa de enfermedad de células falciformes y una gran cantidad de glóbulos rojos fragmentados ( esquistocitos ) requiere una investigación urgente, ya que puede sugieren una anemia hemolítica microangiopática . [84] En algunas afecciones inflamatorias y en trastornos paraproteicos como el mieloma múltiple , los niveles altos de proteína en la sangre pueden hacer que los glóbulos rojos aparezcan apilados en el frotis, lo que se denomina rouleaux . [85] Algunas enfermedades parasitarias , como la malaria y la babesiosis , se pueden detectar encontrando los organismos causantes en el frotis de sangre, [86] y el recuento de plaquetas se puede estimar a partir del frotis de sangre, lo cual es útil si el recuento de plaquetas automatizado es incorrecto. [77]
Para realizar una diferenciación manual de glóbulos blancos, el microscopista cuenta 100 células en el frotis de sangre y las clasifica según su apariencia; a veces se cuentan 200 células. [87] Esto proporciona el porcentaje de cada tipo de glóbulo blanco y, al multiplicar estos porcentajes por el número total de glóbulos blancos, se puede obtener el número absoluto de cada tipo de glóbulo blanco. [88] El recuento manual está sujeto a errores de muestreo porque se cuentan muy pocas células en comparación con el análisis automatizado, [76] pero puede identificar células anormales que los analizadores no pueden, [72] [77] como las células blásticas que se observan en la leucemia aguda. [89] Las características clínicamente significativas, como la granulación tóxica y la vacuolación , también se pueden determinar mediante el examen microscópico de los glóbulos blancos. [90]
El hematocrito se puede realizar manualmente llenando un tubo capilar con sangre, centrifugándolo y midiendo el porcentaje de sangre que consta de glóbulos rojos. [66] Esto es útil en algunas afecciones que pueden causar que los resultados automatizados del hematocrito sean incorrectos, como la policitemia (un recuento de glóbulos rojos muy elevado) [66] o leucocitosis grave (un recuento de glóbulos blancos muy elevado, que interfiere con la producción de glóbulos rojos). mediciones de células sanguíneas haciendo que los glóbulos blancos se cuenten como glóbulos rojos). [91]
Los glóbulos rojos, blancos y las plaquetas se pueden contar utilizando un hemocitómetro , un portaobjetos de microscopio que contiene una cámara que contiene un volumen específico de sangre diluida. La cámara del hemocitómetro está grabada con una rejilla calibrada para ayudar en el recuento de células. Las células que se ven en la cuadrícula se cuentan y se dividen por el volumen de sangre examinada, que se determina a partir del número de cuadrados contados en la cuadrícula, para obtener la concentración de células en la muestra. [45] [92] Los recuentos celulares manuales requieren mucha mano de obra y son inexactos en comparación con los métodos automatizados, por lo que rara vez se utilizan, excepto en laboratorios que no tienen acceso a analizadores automatizados. [45] [92] Para contar los glóbulos blancos, la muestra se diluye usando un líquido que contiene un compuesto que lisa los glóbulos rojos, como el oxalato de amonio , el ácido acético o el ácido clorhídrico . [93] A veces se agrega un tinte al diluyente que resalta los núcleos de los glóbulos blancos, haciéndolos más fáciles de identificar. Los recuentos manuales de plaquetas se realizan de manera similar, aunque algunos métodos dejan intactos los glóbulos rojos. El uso de un microscopio de contraste de fases , en lugar de un microscopio óptico , puede hacer que las plaquetas sean más fáciles de identificar. [94] El recuento manual de glóbulos rojos rara vez se realiza, ya que es inexacto y hay otros métodos disponibles, como la hemoglobinometría y el hematocrito manual, para evaluar los glóbulos rojos; pero si es necesario, se pueden contar los glóbulos rojos en sangre diluida con solución salina. [95]
La hemoglobina se puede medir manualmente usando un espectrofotómetro o colorímetro . Para medir la hemoglobina manualmente, la muestra se diluye usando reactivos que destruyen los glóbulos rojos para liberar la hemoglobina. Se utilizan otros productos químicos para convertir diferentes tipos de hemoglobina en una sola forma, lo que permite medirla fácilmente. Luego se coloca la solución en una cubeta medidora y se mide la absorbancia a una longitud de onda específica, que depende del tipo de reactivo utilizado. Se utiliza un estándar de referencia que contiene una cantidad conocida de hemoglobina para determinar la relación entre la absorbancia y la concentración de hemoglobina, lo que permite medir el nivel de hemoglobina de la muestra. [96]
En zonas rurales y económicamente desfavorecidas, las pruebas disponibles están limitadas por el acceso a equipos y personal. En los centros de atención primaria de estas regiones, las pruebas pueden limitarse al examen de la morfología de los glóbulos rojos y la medición manual de la hemoglobina, mientras que en los laboratorios de distrito se realizan técnicas más complejas, como recuentos celulares manuales y diferenciales, y a veces recuentos celulares automatizados. Los hospitales y centros académicos regionales y provinciales suelen tener acceso a analizadores automatizados. Cuando no se dispone de instalaciones de laboratorio, se puede obtener una estimación de la concentración de hemoglobina colocando una gota de sangre en un tipo estandarizado de papel absorbente y comparándola con una escala de colores. [97]
Los analizadores automatizados deben calibrarse periódicamente . La mayoría de los fabricantes proporcionan sangre conservada con parámetros definidos y los analizadores se ajustan si los resultados están fuera de los umbrales definidos. [98] Para garantizar que los resultados sigan siendo precisos, las muestras de control de calidad, que normalmente proporciona el fabricante del instrumento, se analizan al menos una vez al día. Las muestras se formulan para proporcionar resultados específicos y los laboratorios comparan sus resultados con los valores conocidos para garantizar que el instrumento funcione correctamente. [99] [100] Para los laboratorios sin acceso a material comercial de control de calidad, una organización reguladora india recomienda analizar muestras de pacientes por duplicado y comparar los resultados. [101] Una medición de promedio móvil , en la que los resultados promedio de las muestras de pacientes se miden a intervalos establecidos, se puede utilizar como técnica de control de calidad adicional. Suponiendo que las características de la población de pacientes permanecen aproximadamente iguales a lo largo del tiempo, el promedio debe permanecer constante; Grandes cambios en el valor promedio pueden indicar problemas en el instrumento. [99] [100] Los valores de MCHC son particularmente útiles a este respecto. [102]
Además de analizar muestras de control de calidad interno con resultados conocidos, los laboratorios pueden recibir muestras de evaluación de calidad externa de organizaciones reguladoras. Si bien el propósito del control de calidad interno es garantizar que los resultados del analizador sean reproducibles dentro de un laboratorio determinado, la evaluación de calidad externa verifica que los resultados de diferentes laboratorios sean consistentes entre sí y con los valores objetivo. [103] Los resultados esperados para las muestras de evaluación de calidad externa no se divulgan al laboratorio. [104] Los programas de evaluación de calidad externa se han adoptado ampliamente en América del Norte y Europa occidental, [99] y a menudo se requiere que los laboratorios participen en estos programas para mantener la acreditación . [105] Las cuestiones logísticas pueden dificultar que los laboratorios de zonas de escasos recursos implementen programas externos de evaluación de la calidad. [106]
El hemograma mide las cantidades de plaquetas y glóbulos rojos y blancos, junto con los valores de hemoglobina y hematocrito. Los índices de glóbulos rojos (MCV, MCH y MCHC), que describen el tamaño de los glóbulos rojos y su contenido de hemoglobina, se informan junto con el ancho de distribución de los glóbulos rojos (RDW), que mide la cantidad de variación en los tamaños de los glóbulos rojos. células. Se puede realizar un diferencial de glóbulos blancos, que enumera los diferentes tipos de glóbulos blancos, y en ocasiones se incluye un recuento de glóbulos rojos inmaduros (reticulocitos). [4] [107]
Los glóbulos rojos transportan oxígeno desde los pulmones a los tejidos y, a su regreso, transportan dióxido de carbono a los pulmones, donde se exhala. Estas funciones están mediadas por la hemoglobina de las células. [109] El analizador cuenta los glóbulos rojos y reporta el resultado en unidades de 10 6 células por microlitro de sangre (× 10 6 /μL) o 10 12 células por litro (× 10 12 /L), y mide su tamaño promedio. que se denomina volumen celular medio y se expresa en femtolitros o micrómetros cúbicos. [4] Al multiplicar el volumen celular medio por el recuento de glóbulos rojos, se puede derivar el hematocrito (HCT) o el volumen de células empaquetadas (PCV), una medida del porcentaje de sangre compuesto por glóbulos rojos; [66] y cuando el hematocrito se realiza directamente, el volumen celular medio se puede calcular a partir del hematocrito y el recuento de glóbulos rojos. [110] [111] La hemoglobina, medida después de la lisis de los glóbulos rojos, generalmente se informa en unidades de gramos por litro (g/L) o gramos por decilitro (g/dL). [112] Suponiendo que los glóbulos rojos son normales, existe una relación constante entre la hemoglobina y el hematocrito: el porcentaje de hematocrito es aproximadamente tres veces mayor que el valor de hemoglobina en g/dL, más o menos tres. Esta relación, llamada regla de tres , se puede utilizar para confirmar que los resultados del CBC son correctos. [113]
A partir del recuento de glóbulos rojos, la concentración de hemoglobina y el hematocrito se calculan otras dos mediciones: la hemoglobina corpuscular media y la concentración de hemoglobina corpuscular media . [114] [115] Estos parámetros describen el contenido de hemoglobina de cada glóbulo rojo. El MCH y el MCHC pueden resultar confusos; En esencia, el MCH es una medida de la cantidad promedio de hemoglobina por glóbulo rojo. El MCHC da la proporción promedio de la célula que es hemoglobina. El MCH no tiene en cuenta el tamaño de los glóbulos rojos, mientras que el MCHC sí. [116] En conjunto, el MCV, el MCH y el MCHC se denominan índices de glóbulos rojos . [114] [115] Los cambios en estos índices son visibles en el frotis de sangre: los glóbulos rojos que son anormalmente grandes o pequeños se pueden identificar en comparación con el tamaño de los glóbulos blancos, y las células con una concentración baja de hemoglobina aparecen pálidas. [117] Otro parámetro se calcula a partir de las mediciones iniciales de los glóbulos rojos: el ancho de distribución de los glóbulos rojos o RDW, que refleja el grado de variación en el tamaño de las células. [118]
.jpg/440px-Iron-deficiency_Anemia,_Peripheral_Blood_Smear_(4422704616).jpg)
Un recuento anormalmente bajo de hemoglobina, hematocrito o glóbulos rojos indica anemia. [119] La anemia no es un diagnóstico en sí misma, pero apunta a una afección subyacente que afecta los glóbulos rojos de la persona. [88] Las causas generales de anemia incluyen pérdida de sangre, producción de glóbulos rojos defectuosos ( eritropoyesis ineficaz ), disminución de la producción de glóbulos rojos (eritropoyesis insuficiente) y aumento de la destrucción de glóbulos rojos ( anemia hemolítica ). [120] La anemia reduce la capacidad de la sangre para transportar oxígeno, provocando síntomas como cansancio y dificultad para respirar. [121] Si el nivel de hemoglobina cae por debajo de los umbrales basados en la condición clínica de la persona, puede ser necesaria una transfusión de sangre. [122]
Un aumento del número de glóbulos rojos, que provoca un aumento de la hemoglobina y del hematocrito, [nota 4] se denomina policitemia . [126] La deshidratación o el uso de diuréticos pueden causar una policitemia "relativa" al disminuir la cantidad de plasma en comparación con los glóbulos rojos. Un verdadero aumento en la cantidad de glóbulos rojos, llamado policitemia absoluta, puede ocurrir cuando el cuerpo produce más glóbulos rojos para compensar los niveles crónicamente bajos de oxígeno en afecciones como enfermedades pulmonares o cardíacas , o cuando una persona tiene niveles anormalmente altos de eritropoyetina . , una hormona que estimula la producción de glóbulos rojos. En la policitemia vera , la médula ósea produce glóbulos rojos y otras células sanguíneas a un ritmo excesivamente alto. [127]
La evaluación de los índices de glóbulos rojos es útil para determinar la causa de la anemia. Si el MCV es bajo, la anemia se denomina microcítica , mientras que la anemia con un MCV elevado se denomina anemia macrocítica . La anemia con un MCHC bajo se llama anemia hipocrómica . Si hay anemia pero los índices de glóbulos rojos son normales, la anemia se considera normocrómica y normocítica . [117] El término hipercromía , que se refiere a un nivel alto de MCHC, generalmente no se utiliza. La elevación del MCHC por encima del valor de referencia superior es rara y ocurre principalmente en afecciones como la esferocitosis , la anemia de células falciformes y la enfermedad de la hemoglobina C. [115] [128] Un MCHC elevado también puede ser un resultado falso de condiciones como la aglutinación de glóbulos rojos (que causa una disminución falsa en el recuento de glóbulos rojos, elevando el MCHC) [129] [130] o cantidades muy elevadas de lípidos en la sangre (lo que provoca un falso aumento en el resultado de hemoglobina). [128] [131]
La anemia microcítica se asocia típicamente con deficiencia de hierro, talasemia y anemia de enfermedades crónicas , mientras que la anemia macrocítica se asocia con alcoholismo , deficiencia de folato y B12 , uso de algunos medicamentos y algunas enfermedades de la médula ósea. La pérdida aguda de sangre, la anemia hemolítica, los trastornos de la médula ósea y diversas enfermedades crónicas pueden provocar anemia con un cuadro sanguíneo normocítico. [115] [132] El MCV tiene un propósito adicional en el control de calidad del laboratorio. Es relativamente estable en el tiempo en comparación con otros parámetros del hemograma, por lo que un cambio importante en el MCV puede indicar que la muestra se extrajo del paciente equivocado. [133]
Un RDW bajo no tiene importancia clínica, pero un RDW elevado representa una mayor variación en el tamaño de los glóbulos rojos, una condición conocida como anisocitosis . [118] La anisocitosis es común en anemias nutricionales como la anemia por deficiencia de hierro y la anemia debida a deficiencia de vitamina B12 o folato, mientras que las personas con talasemia pueden tener un RDW normal. [118] Según los resultados del hemograma, se pueden tomar medidas adicionales para investigar la anemia, como una prueba de ferritina para confirmar la presencia de deficiencia de hierro o una electroforesis de hemoglobina para diagnosticar una hemoglobinopatía como la talasemia o la anemia de células falciformes. [134]
Los glóbulos blancos defienden contra las infecciones y participan en la respuesta inflamatoria . [136] Un recuento alto de glóbulos blancos, que se llama leucocitosis, a menudo ocurre en infecciones, inflamación y estados de estrés fisiológico . También puede ser causada por enfermedades que involucran una producción anormal de células sanguíneas, como los trastornos mieloproliferativos y linfoproliferativos . [137] Una disminución del recuento de glóbulos blancos, denominada leucopenia , puede provocar un mayor riesgo de contraer infecciones, [138] y ocurre en tratamientos como la quimioterapia y la radioterapia y en muchas afecciones que inhiben la producción de células sanguíneas. [139] La sepsis se asocia tanto con leucocitosis como con leucopenia. [140] El recuento total de glóbulos blancos generalmente se informa en células por microlitro de sangre (/μL) o 10 9 células por litro (× 10 9 /L). [4]
En el diferencial de glóbulos blancos se identifican y cuentan los diferentes tipos de glóbulos blancos. Los resultados se informan como porcentaje y como número absoluto por unidad de volumen. Generalmente se miden cinco tipos de glóbulos blancos: neutrófilos , linfocitos , monocitos , eosinófilos y basófilos . [141] Algunos instrumentos informan el número de granulocitos inmaduros, que es una clasificación que consiste en precursores de neutrófilos; concretamente, promielocitos , mielocitos y metamielocitos . [nota 5] [144] Otros tipos de células se informan si se identifican en el diferencial manual. [145]
Los resultados diferenciales son útiles para diagnosticar y controlar muchas afecciones médicas. Por ejemplo, un recuento elevado de neutrófilos ( neutrofilia ) se asocia con infección bacteriana, inflamación y trastornos mieloproliferativos, [146] [147] mientras que un recuento disminuido ( neutropenia ) puede ocurrir en personas que están recibiendo quimioterapia o tomando ciertos medicamentos, o que Tiene enfermedades que afectan la médula ósea. [148] [149] La neutropenia también puede ser causada por algunos trastornos congénitos y puede ocurrir transitoriamente después de infecciones virales o bacterianas en niños. [150] Las personas con neutropenia grave y signos clínicos de infección son tratadas con antibióticos para prevenir enfermedades potencialmente mortales. [151]

Un mayor número de neutrófilos en banda (neutrófilos jóvenes que carecen de núcleos segmentados) o granulocitos inmaduros se denomina desviación a la izquierda y ocurre en la sepsis y algunos trastornos sanguíneos, pero es normal durante el embarazo. [152] [153] Un recuento elevado de linfocitos ( linfocitosis ) se asocia con infección viral [6] y trastornos linfoproliferativos como la leucemia linfocítica crónica ; [154] los recuentos elevados de monocitos ( monocitosis ) se asocian con estados inflamatorios crónicos; [155] y el recuento de eosinófilos a menudo aumenta ( eosinofilia ) en infecciones parasitarias y afecciones alérgicas. [156] Un mayor número de basófilos, denominado basofilia , puede ocurrir en trastornos mieloproliferativos como la leucemia mieloide crónica y la policitemia vera. [147] La presencia de algunos tipos de células anormales, como células blásticas o linfocitos con características neoplásicas, sugiere una neoplasia maligna hematológica . [89] [157]
.jpg/440px-Essential_Thrombocythemia,_Peripheral_Blood_(10189570483).jpg)
Las plaquetas juegan un papel esencial en la coagulación. Cuando la pared de un vaso sanguíneo se daña, las plaquetas se adhieren a la superficie expuesta en el lugar de la lesión y tapan el espacio. La activación simultánea de la cascada de coagulación da como resultado la formación de fibrina , que refuerza el tapón de plaquetas para crear un coágulo estable . [158] Un recuento bajo de plaquetas, conocido como trombocitopenia, puede causar sangrado si es grave. [159] Puede ocurrir en personas que están recibiendo tratamientos que suprimen la médula ósea, como quimioterapia o radioterapia, o que toman ciertos medicamentos, como la heparina, que pueden inducir al sistema inmunológico a destruir las plaquetas. La trombocitopenia es una característica de muchos trastornos sanguíneos, como la leucemia aguda y la anemia aplásica , así como de algunas enfermedades autoinmunes . [160] [161] Si el recuento de plaquetas es extremadamente bajo, se puede realizar una transfusión de plaquetas. [162] La trombocitosis , es decir, un recuento alto de plaquetas, puede ocurrir en estados de inflamación o traumatismo, [163] así como en la deficiencia de hierro, [164] y el recuento de plaquetas puede alcanzar niveles excepcionalmente altos en personas con trombocitemia esencial , una enfermedad rara. Enfermedad de la sangre. [163] El recuento de plaquetas se puede informar en unidades de células por microlitro de sangre (/μL), [165] 10 3 células por microlitro (× 10 3 /μL) , o 10 9 células por litro (× 10 9 /L ). [4]
El volumen medio de plaquetas (VPM) mide el tamaño medio de las plaquetas en femtolitros. Puede ayudar a determinar la causa de la trombocitopenia; Un MPV elevado puede ocurrir cuando se liberan plaquetas jóvenes en el torrente sanguíneo para compensar el aumento de la destrucción de las plaquetas, mientras que una disminución de la producción de plaquetas debido a una disfunción de la médula ósea puede resultar en un MPV bajo. El MPV también es útil para diferenciar entre enfermedades congénitas que causan trombocitopenia. [118] [166] Algunos analizadores informan la fracción de plaquetas inmaduras (FPI) o el recuento de plaquetas reticuladas y proporciona información sobre la tasa de producción de plaquetas midiendo la cantidad de plaquetas inmaduras en la sangre. [167]
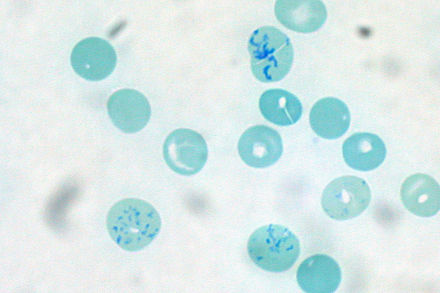
Los reticulocitos son glóbulos rojos inmaduros que, a diferencia de las células maduras, contienen ARN . A veces se realiza un recuento de reticulocitos como parte de un hemograma completo, generalmente para investigar la causa de la anemia de una persona o evaluar su respuesta al tratamiento. La anemia con un recuento alto de reticulocitos puede indicar que la médula ósea está produciendo glóbulos rojos a un ritmo mayor para compensar la pérdida de sangre o la hemólisis, [74] mientras que la anemia con un recuento bajo de reticulocitos puede sugerir que la persona tiene una afección que reduce el la capacidad del cuerpo para producir glóbulos rojos. [168] Cuando las personas con anemia nutricional reciben suplementos nutricionales, un aumento en el recuento de reticulocitos indica que su cuerpo está respondiendo al tratamiento produciendo más glóbulos rojos. [169] Los analizadores de hematología realizan recuentos de reticulocitos tiñendo los glóbulos rojos con un tinte que se une al ARN y midiendo el número de reticulocitos mediante dispersión de luz o análisis de fluorescencia. La prueba se puede realizar manualmente tiñendo la sangre con azul de metileno nuevo y contando el porcentaje de glóbulos rojos que contienen ARN bajo el microscopio. El recuento de reticulocitos se expresa como número absoluto [168] o como porcentaje de glóbulos rojos. [170]
Algunos instrumentos miden la cantidad promedio de hemoglobina en cada reticulocito; un parámetro que ha sido estudiado como indicador de deficiencia de hierro en personas que tienen condiciones que interfieren con las pruebas estándar. [171] La fracción de reticulocitos inmaduros (IRF) es otra medida producida por algunos analizadores que cuantifica la madurez de los reticulocitos: las células que son menos maduras contienen más ARN y, por lo tanto, producen una señal fluorescente más fuerte. Esta información puede ser útil para diagnosticar anemias y evaluar la producción de glóbulos rojos después del tratamiento de la anemia o del trasplante de médula ósea . [172]

Durante su formación en la médula ósea, el hígado y el bazo de los fetos, [173] los glóbulos rojos contienen un núcleo celular, que suele estar ausente en las células maduras que circulan en el torrente sanguíneo. Los glóbulos rojos nucleados son normales en los recién nacidos, [174] pero cuando se detectan en niños y adultos, indican una mayor demanda de glóbulos rojos, que puede deberse a hemorragias, algunos cánceres y anemia. [118] La mayoría de los analizadores pueden detectar estas células como parte del recuento celular diferencial. Un número elevado de glóbulos rojos nucleados puede provocar un recuento de glóbulos blancos falsamente alto, lo que requerirá un ajuste. [175]
Los analizadores de hematología avanzados generan mediciones novedosas de células sanguíneas que han demostrado importancia diagnóstica en estudios de investigación, pero que aún no han encontrado un uso clínico generalizado. [171] Por ejemplo, algunos tipos de analizadores producen lecturas de coordenadas que indican el tamaño y la posición de cada grupo de glóbulos blancos. Estos parámetros (denominados datos de población celular) [176] se han estudiado como marcadores potenciales de trastornos sanguíneos, infecciones bacterianas y malaria. Los analizadores que utilizan tinción de mieloperoxidasa para producir recuentos diferenciales pueden medir la expresión de la enzima en los glóbulos blancos, que se altera en diversos trastornos. [75] Algunos instrumentos pueden informar el porcentaje de glóbulos rojos que son hipocrómicos además de informar el valor promedio de MCHC, o proporcionar un recuento de glóbulos rojos fragmentados ( esquistocitos ), [171] que ocurren en algunos tipos de anemia hemolítica. [177] Debido a que estos parámetros a menudo son específicos de marcas particulares de analizadores, es difícil para los laboratorios interpretar y comparar los resultados. [171]
El hemograma completo se interpreta comparando el resultado con rangos de referencia, que representan los resultados encontrados en el 95% de las personas aparentemente sanas. [35] Basado en una distribución estadística normal , los rangos de las muestras analizadas varían según el sexo y la edad. [179]
En promedio, las mujeres adultas tienen valores más bajos de hemoglobina, hematocrito y recuento de glóbulos rojos que los hombres; la diferencia disminuye, pero sigue presente, después de la menopausia . [180] Los resultados del hemograma completo en niños y recién nacidos difieren de los de los adultos. El recuento de hemoglobina, hematocrito y glóbulos rojos de los recién nacidos es extremadamente alto para compensar los bajos niveles de oxígeno en el útero y la alta proporción de hemoglobina fetal , que es menos eficaz para transportar oxígeno a los tejidos que las formas maduras de hemoglobina dentro de los glóbulos rojos. células. [181] [182] El MCV también aumenta y el recuento de glóbulos blancos está elevado con preponderancia de neutrófilos. [181] [183] El recuento de glóbulos rojos y los valores relacionados comienzan a disminuir poco después del nacimiento, alcanzando su punto más bajo aproximadamente a los dos meses de edad y aumentando posteriormente. [184] [185] Los glóbulos rojos de los bebés mayores y los niños son más pequeños, con un MCH más bajo, que los de los adultos. En el diferencial de glóbulos blancos pediátricos, los linfocitos a menudo superan en número a los neutrófilos, mientras que en los adultos predominan los neutrófilos. [181]
Otras diferencias entre poblaciones pueden afectar los rangos de referencia: por ejemplo, las personas que viven en altitudes más altas tienen resultados más altos de hemoglobina, hematocrito y glóbulos rojos, y las personas de ascendencia africana tienen recuentos de glóbulos blancos más bajos en promedio. [186] El tipo de analizador utilizado para ejecutar el CBC también afecta los rangos de referencia. Por lo tanto, los rangos de referencia los establecen los laboratorios individuales en función de sus propias poblaciones de pacientes y equipos. [187] [188]
Algunas condiciones médicas o problemas con la muestra de sangre pueden producir resultados inexactos. Si la muestra está visiblemente coagulada, lo que puede deberse a una técnica de flebotomía deficiente , no es adecuada para la prueba, porque el recuento de plaquetas disminuirá falsamente y otros resultados pueden ser anormales. [189] [190] Las muestras almacenadas a temperatura ambiente durante varias horas pueden dar lecturas falsamente altas de MCV ( volumen corpuscular medio ), [191] porque los glóbulos rojos se hinchan a medida que absorben agua del plasma; y los resultados diferenciales de plaquetas y glóbulos blancos pueden ser inexactos en muestras envejecidas, ya que las células se degradan con el tiempo. [91]

Las muestras extraídas de individuos con niveles muy altos de bilirrubina o lípidos en plasma (denominadas muestra ictérica o muestra lipémica, respectivamente) [192] pueden mostrar lecturas falsamente altas de hemoglobina, porque estas sustancias cambian el color y la opacidad de la sangre. muestra, lo que interfiere con la medición de la hemoglobina. [193] Este efecto se puede mitigar reemplazando el plasma con solución salina. [91]
Algunas personas producen un anticuerpo que hace que sus plaquetas formen grumos cuando su sangre se introduce en tubos que contienen EDTA, el anticoagulante que normalmente se utiliza para recolectar muestras de CBC. Los analizadores automatizados pueden contar los grupos de plaquetas como plaquetas individuales, lo que lleva a una disminución falsa del recuento de plaquetas. Esto se puede evitar utilizando un anticoagulante alternativo como el citrato de sodio o la heparina . [194] [195]
Otra afección mediada por anticuerpos que puede afectar los resultados del hemograma completo es la aglutinación de glóbulos rojos . Este fenómeno hace que los glóbulos rojos se agrupen debido a los anticuerpos unidos a la superficie celular. [196] El analizador cuenta los agregados de glóbulos rojos como células individuales, lo que produce una disminución marcada del recuento de glóbulos rojos y del hematocrito, y un MCV y MCHC ( concentración de hemoglobina corpuscular media ) marcadamente elevados. [53] A menudo, estos anticuerpos solo son activos a temperatura ambiente (en cuyo caso se llaman aglutininas frías ), y la aglutinación se puede revertir calentando la muestra a 37 °C (99 °F). Las muestras de personas con anemia hemolítica autoinmune caliente pueden presentar aglutinación de glóbulos rojos que no se resuelve con el calentamiento. [130]
Si bien las células blásticas y de linfoma se pueden identificar en el diferencial manual, el examen microscópico no puede determinar de manera confiable el linaje hematopoyético de las células . Esta información suele ser necesaria para diagnosticar cánceres de sangre. Una vez identificadas las células anormales, se pueden utilizar técnicas adicionales, como la inmunofenotipificación mediante citometría de flujo, para identificar marcadores que proporcionen información adicional sobre las células. [197] [198]
,_United_Kingdom,_1850-1950.jpg/440px-Haemoglobinometer_(hemoglobinometer),_United_Kingdom,_1850-1950.jpg)
Antes de que se introdujeran los contadores de células automatizados , las pruebas de hemograma completo se realizaban manualmente: los glóbulos blancos, rojos y las plaquetas se contaban mediante microscopios. [200] La primera persona en publicar observaciones microscópicas de las células sanguíneas fue Antonie van Leeuwenhoek , [201] quien informó sobre la aparición de los glóbulos rojos en una carta de 1674 a las Actas de la Royal Society de Londres . [202] Jan Swammerdam había descrito los glóbulos rojos algunos años antes, pero no publicó sus hallazgos en ese momento. A lo largo de los siglos XVIII y XIX, las mejoras en la tecnología microscópica, como las lentes acromáticas, permitieron contar los glóbulos blancos y las plaquetas en muestras sin teñir. [203]
Al fisiólogo Karl Vierordt se le atribuye la realización del primer hemograma. [8] [204] [205] Su técnica, publicada en 1852, implicaba aspirar un volumen de sangre cuidadosamente medido en un tubo capilar y extenderlo sobre un portaobjetos de microscopio recubierto con clara de huevo . Después de que la sangre se secó, contó cada célula del portaobjetos; este proceso podría tardar más de tres horas en completarse. [206] El hemocitómetro, introducido en 1874 por Louis-Charles Malassez , simplificó el recuento microscópico de las células sanguíneas. [207] El hemocitómetro de Malassez consistía en un portaobjetos de microscopio que contenía un tubo capilar aplanado. Se introdujo sangre diluida en la cámara capilar mediante un tubo de goma sujeto a un extremo, y se adjuntó al microscopio un ocular con una rejilla escalada, que permitía al microscopista contar el número de células por volumen de sangre. En 1877, William Gowers inventó un hemocitómetro con una rejilla de conteo incorporada, eliminando la necesidad de producir oculares especialmente calibrados para cada microscopio. [208]
.jpg/440px-Portrait_of_Dimitriy_Leonidovitch_Romanovsky_Wellcome_L0002501_(cropped).jpg)
En la década de 1870, Paul Ehrlich desarrolló una técnica de tinción utilizando una combinación de un tinte ácido y básico que podía distinguir diferentes tipos de glóbulos blancos y permitir examinar la morfología de los glóbulos rojos. [203] Dmitri Leonidovich Romanowsky mejoró esta técnica en la década de 1890, utilizando una mezcla de eosina y azul de metileno envejecido para producir una amplia gama de tonos que no estaban presentes cuando cualquiera de los tintes se usaba solo. Esto se convirtió en la base de la tinción de Romanowsky, la técnica que todavía se utiliza para teñir frotis de sangre para su revisión manual. [209]
Las primeras técnicas para medir la hemoglobina se idearon a finales del siglo XIX e implicaban comparaciones visuales del color de la sangre diluida con un estándar conocido. [205] Los intentos de automatizar este proceso mediante espectrofotometría y colorimetría se vieron limitados por el hecho de que la hemoglobina está presente en la sangre en muchas formas diferentes, lo que significa que no se puede medir en una sola longitud de onda . En 1920, se introdujo un método para convertir las diferentes formas de hemoglobina en una forma estable (cianmetahemoglobina o hemiglobincianuro), lo que permitió medir automáticamente los niveles de hemoglobina. El método de la cianmetahemoglobina sigue siendo el método de referencia para la medición de la hemoglobina y todavía se utiliza en muchos analizadores de hematología automatizados. [57] [210] [211]
A Maxwell Wintrobe se le atribuye la invención de la prueba del hematocrito. [66] [212] En 1929, emprendió un proyecto de doctorado en la Universidad de Tulane para determinar los rangos normales de los parámetros de los glóbulos rojos e inventó un método conocido como hematocrito de Wintrobe. Las mediciones de hematocrito se habían descrito previamente en la literatura, pero el método de Wintrobe se diferenciaba en que utilizaba un tubo grande que podía producirse en masa según especificaciones precisas, con una escala incorporada. La fracción de glóbulos rojos en el tubo se midió después de la centrifugación para determinar el hematocrito. La invención de un método reproducible para determinar los valores de hematocrito permitió a Wintrobe definir los índices de glóbulos rojos. [205]

La investigación sobre el recuento celular automatizado comenzó a principios del siglo XX. [211] Un método desarrollado en 1928 utilizó la cantidad de luz transmitida a través de una muestra de sangre diluida, medida por fotometría, para estimar el recuento de glóbulos rojos, pero esto resultó inexacto para muestras con glóbulos rojos anormales. [8] Otros intentos fallidos, en las décadas de 1930 y 1940, involucraron detectores fotoeléctricos conectados a microscopios, que contaban las células a medida que eran escaneadas. [211] A finales de la década de 1940, Wallace H. Coulter , motivado por la necesidad de mejores métodos de recuento de glóbulos rojos tras el bombardeo de Hiroshima y Nagasaki , [213] intentó mejorar las técnicas de recuento de células fotoeléctricas. [nota 7] Su investigación contó con la ayuda de su hermano, Joseph R. Coulter, en un laboratorio en un sótano de Chicago. [60] Sus resultados utilizando métodos fotoeléctricos fueron decepcionantes, y en 1948, después de leer un artículo que relacionaba la conductividad de la sangre con su concentración de glóbulos rojos, Wallace ideó el principio de Coulter: la teoría de que una célula suspendida en un medio conductor genera una gota. en corriente proporcional a su tamaño cuando pasa a través de una abertura. [213]
Ese octubre, Wallace construyó un mostrador para demostrar el principio. Debido a limitaciones financieras, la abertura se hizo haciendo un agujero en un trozo de celofán de un paquete de cigarrillos. [60] [213] Wallace presentó una patente para la técnica en 1949, y en 1951 solicitó a la Oficina de Investigación Naval financiar el desarrollo del contador Coulter . [213] La solicitud de patente de Wallace fue concedida en 1953, y después de mejoras en la apertura y la introducción de un manómetro de mercurio para proporcionar un control preciso sobre el tamaño de la muestra, los hermanos fundaron Coulter Electronics Inc. en 1958 para comercializar sus instrumentos. El contador Coulter fue diseñado inicialmente para contar glóbulos rojos, pero con modificaciones posteriores demostró ser eficaz para contar glóbulos blancos. [60] Los contadores Coulter fueron ampliamente adoptados por los laboratorios médicos. [211]
El primer analizador capaz de producir múltiples recuentos de células simultáneamente fue el Technicon SMA 4A-7A , lanzado en 1965. Lo logró dividiendo muestras de sangre en dos canales: uno para contar glóbulos rojos y blancos y otro para medir la hemoglobina. Sin embargo, el instrumento era poco fiable y difícil de mantener. En 1968, se lanzó el analizador Coulter Model S y obtuvo un uso generalizado. De manera similar al instrumento Technicon, utilizó dos cámaras de reacción diferentes, una de las cuales se usó para el recuento de glóbulos rojos y otra para el recuento de glóbulos blancos y la determinación de hemoglobina. El Modelo S también determinó el volumen celular medio mediante mediciones de impedancia, lo que permitió derivar los índices de glóbulos rojos y el hematocrito. Los recuentos automatizados de plaquetas se introdujeron en 1970 con el instrumento Hemalog-8 de Technicon y fueron adoptados por los analizadores de la serie S Plus de Coulter en 1980. [214]
Una vez automatizado el recuento celular básico, el diferencial de glóbulos blancos siguió siendo un desafío. A lo largo de la década de 1970, los investigadores exploraron dos métodos para automatizar el recuento diferencial: el procesamiento de imágenes digitales y la citometría de flujo. Utilizando tecnología desarrollada en las décadas de 1950 y 1960 para automatizar la lectura de las pruebas de Papanicolaou , se produjeron varios modelos de analizadores de procesamiento de imágenes. [215] Estos instrumentos escanearían un frotis de sangre teñido para encontrar núcleos celulares y luego tomarían una instantánea de mayor resolución de la célula para analizarla mediante densitometría . [216] Eran costosos, lentos e hicieron poco para reducir la carga de trabajo en el laboratorio porque todavía requerían que se prepararan y teñiran frotis de sangre, por lo que los sistemas basados en citometría de flujo se hicieron más populares, [217] [218] y en 1990, No había analizadores de imágenes digitales disponibles comercialmente en los Estados Unidos ni en Europa occidental. [219] Estas técnicas disfrutaron de un resurgimiento en la década de 2000 con la introducción de plataformas de análisis de imágenes más avanzadas que utilizan redes neuronales artificiales . [220] [221] [222]
Los primeros dispositivos de citometría de flujo dispararon rayos de luz a las células en longitudes de onda específicas y midieron la absorbancia, fluorescencia o dispersión de la luz resultante, recopilando información sobre las características de las células y permitiendo cuantificar contenidos celulares como el ADN . [223] Uno de esos instrumentos, el espectrofotómetro celular rápido, desarrollado por Louis Kamentsky en 1965 para automatizar la citología cervical, podría generar diagramas de dispersión de células sanguíneas utilizando técnicas de tinción citoquímica. Leonard Ornstein, que había ayudado a desarrollar el sistema de tinción del espectrofotómetro celular rápido, y sus colegas crearon más tarde el primer analizador diferencial de glóbulos blancos por citometría de flujo comercial, el Hemalog D. [224] [225] Introducido en 1974, [226] [227] este analizador utilizó dispersión de luz, absorbancia y tinción celular para identificar los cinco tipos de glóbulos blancos normales, además de "células grandes no identificadas", una clasificación que generalmente consistía en linfocitos atípicos o células blásticas. El Hemalog D podía contar 10.000 células en una sola ejecución, una mejora notable con respecto al diferencial manual. [225] [228] En 1981, Technicon combinó el Hemalog D con el analizador Hemalog-8 para producir el Technicon H6000, el primer analizador combinado de hemograma completo y diferencial. Este analizador era impopular entre los laboratorios de hematología porque su funcionamiento requería mucha mano de obra, pero a finales de los 80 y principios de los 90 otros fabricantes, como Sysmex , Abbott , Roche y Beckman Coulter, produjeron ampliamente sistemas similares . [229]