El mieloma múltiple ( MM ), también conocido como mieloma de células plasmáticas y simplemente mieloma , es un cáncer de las células plasmáticas , un tipo de glóbulo blanco que normalmente produce anticuerpos . [6] A menudo, inicialmente no se notan síntomas. [10] A medida que progresa, pueden aparecer dolor óseo , anemia , insuficiencia renal e infecciones. [10] Las complicaciones pueden incluir hipercalcemia y amiloidosis . [3]
La causa del mieloma múltiple es desconocida. [4] Los factores de riesgo incluyen obesidad , exposición a radiación , antecedentes familiares, edad y ciertos productos químicos. [5] [11] [12] Existe un mayor riesgo de mieloma múltiple en ciertas ocupaciones. [13] Esto se debe a que la exposición ocupacional a solventes de hidrocarburos aromáticos tiene un papel en la causa del mieloma múltiple. [14] El mieloma múltiple es el resultado de una transformación maligna de múltiples pasos y casi universalmente se origina a partir de la etapa premaligna de gammapatía monoclonal de significado incierto (MGUS). A medida que la MGUS evoluciona a MM, se alcanza otra etapa previa de la enfermedad, conocida como mieloma latente (SMM) . [15]
En el MM, las células plasmáticas anormales producen anticuerpos anormales , que pueden causar problemas renales y sangre demasiado espesa . [10] Las células plasmáticas también pueden formar una masa en la médula ósea o el tejido blando. [10] Cuando hay un tumor, se llama plasmacitoma ; más de uno se llama mieloma múltiple. [10] El mieloma múltiple se diagnostica basándose en análisis de sangre u orina que encuentran proteínas de anticuerpos anormales (a menudo utilizando técnicas electroforéticas que revelan la presencia de un pico monoclonal en los resultados, denominado m-spike), biopsia de médula ósea que encuentra células plasmáticas cancerosas y imágenes médicas que encuentran lesiones óseas. [6] Otro hallazgo común son los niveles altos de calcio en sangre . [6]
El mieloma múltiple se considera tratable, pero generalmente incurable. [3] Las remisiones se pueden lograr con esteroides , quimioterapia , terapia dirigida y trasplante de células madre . [3] Los bifosfonatos y la radioterapia a veces se utilizan para reducir el dolor de las lesiones óseas. [3] [6] Recientemente, se han incluido nuevos enfoques que utilizan la terapia con células CAR-T en los regímenes de tratamiento. [16]
A nivel mundial, en 2020 se diagnosticó la enfermedad a unas 175.000 personas, mientras que ese año murieron unas 117.000. En Estados Unidos, las previsiones indican que en 2023 se diagnosticará la enfermedad a unas 35.000 personas y que ese año morirán unas 12.000. [17] En 2020, se calcula que en Estados Unidos había 170.405 personas con mieloma [18]
Es difícil evaluar las estadísticas de mortalidad porque los tratamientos para la enfermedad están avanzando rápidamente. Según los datos sobre las personas diagnosticadas con la enfermedad entre 2013 y 2019, aproximadamente el 60 % vivió cinco años o más después del diagnóstico, y aproximadamente el 34 % vivió diez años o más. [18] Las personas a las que se les diagnostica recientemente la enfermedad ahora tienen mejores perspectivas, gracias a la mejora de los tratamientos. [19]
La enfermedad suele aparecer alrededor de los 60 años y es más común en hombres que en mujeres. [6] Es poco común antes de los 40 años. [6] La palabra mieloma proviene del griego myelo- 'médula' y -oma 'tumor'. [20]
Dado que el mieloma puede afectar a muchos órganos, los síntomas y signos varían considerablemente. La fatiga y el dolor óseo son los síntomas más comunes en el momento de la presentación. Los criterios CRAB eran anteriormente el punto de referencia utilizado para establecer la presencia de mieloma múltiple activo (a diferencia de una forma anterior, generalmente asintomática y "latente" de la enfermedad). Los criterios CRAB son: [21] [2] [22]
A partir de 2014, [actualizar]el IMWG (Grupo de trabajo internacional sobre el mieloma) amplió y actualizó los criterios de diagnóstico para añadir tres eventos definitorios del mieloma, cualquiera de los cuales indica la presencia de mieloma múltiple activo. Cada uno de estos tres eventos puede ocurrir antes de que aparezca cualquiera de los criterios CRAB, lo que hace que más personas sean elegibles para el tratamiento con medicamentos contra el mieloma antes. [22]

El dolor óseo afecta a casi el 70% de las personas con mieloma múltiple y es uno de los síntomas más comunes. [2] : 653 [23] El dolor óseo del mieloma generalmente afecta la columna vertebral y las costillas, y empeora con la actividad. El dolor persistente y localizado puede indicar una fractura ósea patológica . La afectación de las vértebras puede provocar compresión de la médula espinal o cifosis . La enfermedad ósea del mieloma se debe a la sobreexpresión del ligando del activador del receptor para el factor nuclear κ B ( RANKL ) por el estroma de la médula ósea . RANKL activa los osteoclastos , que reabsorben el hueso. Las lesiones óseas resultantes son de naturaleza lítica (causan descomposición) y se ven mejor en radiografías simples, que pueden mostrar lesiones reabsortivas "perforadas" (incluida la apariencia de "gota de lluvia" del cráneo en la radiografía). La descomposición del hueso también conduce a la liberación de iones de calcio en la sangre, lo que lleva a la hipercalcemia y sus síntomas asociados. [24]
La anemia que se encuentra en el mieloma suele ser normocítica y normocrómica . Es resultado de la sustitución de la médula ósea normal por células tumorales infiltradas y de la inhibición de la producción normal de glóbulos rojos ( hematopoyesis ) por citocinas . [25]
La función renal deteriorada puede desarrollarse, ya sea de forma aguda o crónica , y con cualquier grado de gravedad. [26] [27] La causa más común de insuficiencia renal en el mieloma múltiple se debe a las proteínas secretadas por las células malignas. Las células de mieloma producen proteínas monoclonales de diversos tipos, más comúnmente inmunoglobulinas (anticuerpos) y cadenas ligeras libres , lo que da como resultado niveles anormalmente altos de estas proteínas en la sangre. Dependiendo del tamaño de estas proteínas, pueden excretarse a través de los riñones. Los riñones pueden resultar dañados por los efectos de las proteínas o las cadenas ligeras. El aumento de la resorción ósea conduce a hipercalcemia y causa nefrocalcinosis , lo que contribuye a la insuficiencia renal. La amiloidosis es un distante tercer lugar en la causalidad. Las personas con amiloidosis tienen altos niveles de proteína amiloide que puede excretarse a través de los riñones y causar daño a los riñones y otros órganos. [28] [29]
Las cadenas ligeras producen innumerables efectos que pueden manifestarse como el síndrome de Fanconi ( acidosis tubular renal tipo II ). [28]
Las infecciones colaterales son comunes en el mieloma múltiple, ya que la enfermedad altera el funcionamiento de los componentes sanguíneos que normalmente resisten a los patógenos. Las infecciones más comunes son las neumonías, las infecciones del tracto urinario y la sepsis. [30] El período de mayor riesgo para la aparición de la infección es en los primeros meses después del inicio de una nueva terapia farmacológica, ya que muchas terapias farmacológicas suprimen aún más la respuesta inmunitaria normal. [31]
Las infecciones (y los "eventos adversos" de todas las enfermedades) se clasifican mediante una escala estandarizada. [32] Con algunas terapias farmacológicas para el mieloma, más del 30% de las personas experimentan una infección de "Grado 3" o superior (muchas personas experimentan múltiples infecciones de este tipo), [33] lo que requiere una intervención al menos con antibióticos. [32] De las personas que mueren dentro de los 6 meses posteriores al diagnóstico de mieloma, entre el 20% y el 50% mueren por infecciones colaterales. [30]
La evaluación clínica de la respuesta inmunitaria de una persona se realiza típicamente mediante una prueba de laboratorio que mide los niveles de diferentes inmunoglobulinas en la sangre. Hay cinco variedades de inmunoglobulinas, indicadas por los sufijos -A, -D, -E, -G y -M. [34] En conjunto, el nivel de inmunoglobulina puede estar elevado con la enfermedad, pero la mayoría de estos anticuerpos aumentados son de una variedad monoclonal debido a la célula plasmática clonal y, por lo tanto, son ineficaces. Estos anticuerpos ineficaces son comúnmente de las variedades de inmunoglobulina -A y -G. [34] Cuando la medida de anticuerpos efectivos cae por debajo de un umbral (una condición denominada hipogammaglobulinemia ), [35] se pueden proporcionar inmunoglobulinas suplementarias mediante infusiones periódicas para reducir el riesgo de infecciones colaterales. [33]
Algunos síntomas (p. ej., debilidad , confusión y fatiga ) pueden deberse a anemia o hipercalcemia. El dolor de cabeza , los cambios visuales y la retinopatía pueden ser el resultado de la hiperviscosidad de la sangre según las propiedades de la paraproteína . Finalmente, pueden aparecer dolor radicular , pérdida del control de los intestinos o la vejiga (debido a la afectación de la médula espinal que conduce a la compresión de la médula ) o síndrome del túnel carpiano y otras neuropatías (debido a la infiltración de los nervios periféricos por amiloide ). Puede dar lugar a paraplejia en casos de presentación tardía. [ cita requerida ]
Cuando la enfermedad está bien controlada, los tratamientos actuales pueden provocar síntomas neurológicos, algunos de los cuales pueden causar neuropatía periférica, que se manifiesta como entumecimiento o dolor en las manos, los pies y la parte inferior de las piernas. [ cita requerida ]
Los síntomas iniciales pueden incluir dolor, entumecimiento, hinchazón, expansión de la mandíbula, movilidad dentaria y radiolucidez . [36] El mieloma múltiple en la boca puede imitar problemas dentales comunes como absceso periapical o absceso periodontal , gingivitis , periodontitis u otro agrandamiento o masas gingivales. [37]
La causa del mieloma múltiple generalmente es desconocida. [4]
Los estudios han informado de una predisposición familiar al mieloma. [42] [43] La hiperfosforilación de una serie de proteínas (las proteínas paratarg), una tendencia que se hereda de forma autosómica dominante, parece ser un mecanismo común en estas familias. Esta tendencia es más común en los afroamericanos con mieloma y puede contribuir a las tasas más altas de mieloma en este grupo. [42]
En un estudio para investigar la asociación entre la exposición ocupacional a solventes de hidrocarburos aromáticos ( benceno y sus muchos derivados), la evidencia ha demostrado que estos solventes tienen un papel en la causa del mieloma múltiple. [14] La aparición de mieloma múltiple puede ocurrir más en ciertas ocupaciones. El riesgo de que se produzca mieloma múltiple es mayor en ocupaciones como bombero, peluquero y en ocupaciones agrícolas e industriales. [44] El riesgo en ciertas ocupaciones se debe a la exposición a diferentes sustancias químicas. La exposición repetida a sustancias químicas aumenta el riesgo de mieloma múltiple. Se ha visto que el uso de pesticidas y sustancias químicas peligrosas en ocupaciones como la lucha contra incendios y la agricultura provoca un aumento del riesgo de mieloma múltiple. [13] Otras ocupaciones, como las ocupaciones industriales, también tienen un mayor riesgo de mieloma múltiple. Los trabajadores industriales están expuestos a sustancias químicas que contienen solventes de hidrocarburos aromáticos. [14] [13]
La exposición a disolventes de hidrocarburos aromáticos, benceno , tolueno y xileno , puede aumentar el riesgo de mieloma múltiple. Una mayor duración, alta intensidad de exposición o exposición repetida se asoció con un aumento del riesgo de mieloma múltiple de hasta un 63%. [14] Se estudió el tiempo transcurrido desde la exposición hasta el diagnóstico, y el diagnóstico después de la exposición se retrasó al menos 20 años. [14] Cuando se identificó la exposición a una sustancia química, generalmente se identificó la exposición a otro disolvente de hidrocarburo. [14] El mieloma múltiple afecta a más hombres, adultos mayores y afroamericanos. Estas poblaciones también tienen frecuencias de exposición más altas que sus contrapartes femeninas. [14]
En raras ocasiones, el virus de Epstein-Barr (VEB) se asocia con mieloma múltiple, en particular en personas que tienen una inmunodeficiencia debida, por ejemplo, al VIH/SIDA , un trasplante de órganos o una enfermedad inflamatoria crónica como la artritis reumatoide . [45] La Organización Mundial de la Salud (2016) clasifica el mieloma múltiple VEB-positivo como una forma de enfermedades linfoproliferativas asociadas al virus de Epstein-Barr y lo denomina mieloma de células plasmáticas asociado al virus de Epstein-Barr . La enfermedad VEB-positiva es más común en el plasmocitoma que en la forma de mieloma múltiple del cáncer de células plasmáticas. [46] Los tejidos implicados en la enfermedad VEB+ suelen mostrar focos de células VEB+ con la apariencia de células plasmáticas inmaduras o poco diferenciadas que proliferan rápidamente . [46] Las células expresan productos de genes VEB como EBER1 y EBER2. [47] Si bien el virus de Epstein-Barr contribuye al desarrollo y/o progresión de la mayoría de las enfermedades linfoproliferativas asociadas con el virus de Epstein-Barr, se desconoce su papel en el mieloma múltiple. [48] Sin embargo, las personas que son positivas al virus de Epstein-Barr y tienen plasmocitoma(s) localizado(s) tienen más probabilidades de progresar a mieloma múltiple en comparación con las personas con plasmocitoma(s) negativos al virus de Epstein-Barr. Esto sugiere que el virus de Epstein-Barr puede tener un papel en la progresión de los plasmocitomas a mieloma múltiple sistémico. [47]

Los linfocitos B se originan en la médula ósea y se desplazan hacia los ganglios linfáticos. A medida que progresan, maduran y muestran diferentes proteínas en sus superficies celulares (antígenos de superficie celular). Cuando se activan para secretar anticuerpos, se conocen como células plasmáticas. [49]
El mieloma múltiple se desarrolla en los linfocitos B después de que han abandonado la parte del ganglio linfático conocida como centro germinal . El tipo de célula normal más estrechamente asociado con las células de mieloma múltiple se considera generalmente como una célula B de memoria activada o el precursor de las células plasmáticas, el plasmablasto . [50]
El sistema inmunológico mantiene bajo estricto control la proliferación de células B y la secreción de anticuerpos. Cuando los cromosomas y los genes sufren daños, a menudo por reorganización, este control se pierde. A menudo, un gen promotor se desplaza (o se transloca) a un cromosoma, donde estimula la sobreproducción de un gen de anticuerpo. [ cita requerida ]
En personas con mieloma múltiple se observa con frecuencia una translocación cromosómica entre el gen de la cadena pesada de inmunoglobulina (en el cromosoma 14 , locus q32) y un oncogén (a menudo 11q13, 4p16.3, 6p21, 16q23 y 20q11 [51] ). Esta mutación produce una desregulación del oncogén, que se cree que es un evento iniciador importante en la patogénesis del mieloma. [52] El resultado es una proliferación de un clon de células plasmáticas y una inestabilidad genómica que conduce a más mutaciones y translocaciones. La anomalía del cromosoma 14 se observa en aproximadamente el 50% de todos los casos de mieloma. La eliminación de (partes del) cromosoma 13 también se observa en aproximadamente el 50% de los casos.
La producción de citocinas [53] (especialmente IL-6 ) por parte de las células plasmáticas causa gran parte de sus daños localizados, como la osteoporosis , y crea un microambiente en el que las células malignas prosperan. La angiogénesis (la generación de nuevos vasos sanguíneos) aumenta. [ cita requerida ]
Los anticuerpos producidos se depositan en varios órganos, provocando insuficiencia renal, polineuropatía y otros síntomas asociados al mieloma.
Las modificaciones epigenéticas , como la metilación del ADN o las modificaciones de las histonas , son clave para el establecimiento y la progresión de la enfermedad. [54] En un estudio que investigó el perfil de metilación del ADN de células de mieloma múltiple y células plasmáticas normales , se observó una desmetilación gradual de células madre a células plasmáticas, con ganancia de metilación específica del sitio. [55] La pérdida de metilación está asociada con la activación genética y la ganancia de metilación está correlacionada con el silenciamiento genético. El patrón de metilación desregulado en el mieloma múltiple da como resultado la activación de oncogenes específicos y la represión de genes supresores de tumores específicos . El patrón de metilación observado de CpG dentro de regiones intrónicas con marcas de cromatina relacionadas con potenciadores en el mieloma múltiple es similar al de las células madre y precursoras indiferenciadas. Estos resultados pueden representar una reprogramación epigenética de novo en el mieloma múltiple, que conduce a la adquisición de un patrón de metilación relacionado con la pluripotencialidad. [56]
Otros estudios han identificado un patrón de silenciamiento de genes específico del mieloma múltiple asociado con modificaciones anormales de histonas causadas por la desregulación del complejo represor polycomb 2 (PRC2). [57] [58] Se ha descrito que la mayor expresión de la subunidad PRC2, EZH2, es una característica común en el mieloma múltiple, lo que resulta en una acumulación y redistribución de la trimetilación de la lisina 27 de la histona H3 que avanza con la gravedad de la enfermedad. [59]
Las anomalías genéticas en el mieloma múltiple dividen la enfermedad en dos grupos principales, el mieloma múltiple hiperdiploide y el mieloma múltiple no hiperdiploide. El MM hiperdiploide se asocia con un buen pronóstico e incluye trisomías de cromosomas impares. El MM no hiperdiploide tiene un peor pronóstico y se caracteriza por translocaciones en el cromosoma 14, que conducen a la expresión de oncogenes. Estas translocaciones pueden ser t(11;14), t(6;14), t(4;14), t(14;16), t(14;20). [60] . Otras alteraciones genéticas son la amplificación de 1q, la deleción de 1p, la deleción 17, la deleción 13, la sobreexpresión de MYC y las mutaciones puntuales en vías clave.
Las mutaciones genéticas asociadas incluyen ATM , BRAF , CCND1 , DIS3 , FAM46C , KRAS , NRAS y TP53 . [61]
Los cambios genéticos y epigenéticos ocurren progresivamente. El cambio inicial, que a menudo implica una translocación del cromosoma 14, establece un clon de células plasmáticas de la médula ósea que causa el trastorno asintomático MGUS , que es un trastorno premaligno caracterizado por un aumento en el número de células plasmáticas en la médula ósea o la circulación de una inmunoglobulina proteica del mieloma. Otros cambios genéticos o epigénicos producen un nuevo clon de células plasmáticas de la médula ósea, generalmente descendiente del clon original, que causa el trastorno premaligno más grave, pero aún asintomático, el mieloma múltiple latente. Este mieloma se caracteriza por un aumento en el número de células plasmáticas de la médula ósea o niveles de la proteína del mieloma circulante por encima de lo observado en MGUS. [62]
Los cambios genéticos y epigenéticos subsiguientes conducen a un nuevo clon más agresivo de células plasmáticas, que causan mayores aumentos en el nivel de la proteína de mieloma circulante, mayores aumentos en el número de células plasmáticas de la médula ósea o el desarrollo de uno o más de un conjunto específico de síntomas "CRAB", que son la base para diagnosticar el mieloma múltiple maligno y tratar la enfermedad. [63]
En un pequeño porcentaje de casos de mieloma múltiple, otros cambios genéticos y epigenéticos conducen al desarrollo de un clon de células plasmáticas que se desplaza desde la médula ósea al sistema circulatorio , invade tejidos distantes y, por lo tanto, causa la más maligna de todas las discrasias de células plasmáticas , la leucemia de células plasmáticas . [39] [64] [65] Por lo tanto, una inestabilidad genética fundamental en las células plasmáticas o sus precursores conduce a la progresión:
Gammapatía monoclonal de significado incierto → mieloma múltiple latente → mieloma múltiple → leucemia de células plasmáticas
La gammapatía monoclonal de significado incierto y el mieloma múltiple latente son asintomáticos y se diagnostican típicamente de manera fortuita al detectar una proteína de mieloma en pruebas de electroforesis de proteínas séricas realizadas con otros fines. La MGUS es una afección relativamente estable que afecta al 3 % de las personas de 50 años y al 5 % de las personas de 70 años; progresa a mieloma múltiple a una tasa de 0,5 a 1 % de casos por año; el mieloma múltiple latente lo hace a una tasa del 10 % por año durante los primeros 5 años, pero luego cae bruscamente al 3 % por año durante los siguientes 5 años y, a partir de entonces, al 1 % por año. [39] [40]
En general, entre el 2 y el 4 % de los casos de mieloma múltiple finalmente progresan a leucemia de células plasmáticas . [64]
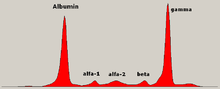
El nivel de globulina puede ser normal en una enfermedad establecida. Un médico puede solicitar una electroforesis de proteínas de la sangre y la orina, que puede mostrar la presencia de una banda de paraproteína (proteína monoclonal o proteína M ), con o sin reducción de las otras inmunoglobulinas (normales) (lo que se conoce como paresia inmunitaria). Un tipo de paraproteína es la proteína de Bence Jones , que es una paraproteína urinaria compuesta de cadenas ligeras libres. Las mediciones cuantitativas de la paraproteína son necesarias para establecer un diagnóstico y controlar la enfermedad. La paraproteína es una inmunoglobulina específica (o fragmento de inmunoglobulina) producida originalmente por la célula plasmática mutada que comenzó a multiplicarse, y que ahora es producida por toda la línea de células malignas. [66]
En teoría, el mieloma múltiple puede producir todas las clases de inmunoglobulina, pero las paraproteínas IgG son las más comunes, seguidas de las IgA y las IgM . El mieloma IgD e IgE son muy raros. Además, las cadenas ligeras y/o pesadas (los componentes básicos de los anticuerpos) pueden secretarse de forma aislada: cadenas ligeras κ o λ o cualquiera de los cinco tipos de cadenas pesadas (cadenas pesadas α, γ, δ, ε o μ). Las personas sin evidencia de una proteína monoclonal pueden tener mieloma "no secretor" (que no produce inmunoglobulinas); esto representa aproximadamente el 3% de todas las personas con mieloma múltiple. [67]
Otros hallazgos pueden incluir un nivel elevado de calcio (cuando los osteoclastos están descomponiendo el hueso, liberándolo al torrente sanguíneo), un nivel elevado de creatinina sérica debido a una función renal reducida , que se debe principalmente a los cilindros de depósito de paraproteína en el riñón, aunque el cilindro también puede contener inmunoglobulinas completas, proteína de Tamm-Horsfall y albúmina . [68]
Otras pruebas de laboratorio útiles incluyen la medición cuantitativa de IgA, IgG e IgM para buscar paresia inmunitaria, y la beta-2 microglobulina, que brinda información pronóstica. En el frotis de sangre periférica, se observa con frecuencia la formación de glóbulos rojos en forma de rouleaux , aunque esto no es específico.
La reciente introducción de un inmunoensayo comercial para la medición de cadenas ligeras libres ofrece potencialmente una mejora en el seguimiento de la progresión de la enfermedad y la respuesta al tratamiento, en particular cuando la paraproteína es difícil de medir con precisión mediante electroforesis (por ejemplo, en el mieloma de cadenas ligeras, o cuando el nivel de paraproteína es muy bajo). Las investigaciones iniciales también sugieren que la medición de cadenas ligeras libres también se puede utilizar, junto con otros marcadores, para la evaluación del riesgo de progresión de MGUS a mieloma múltiple. [69]
Este ensayo, el ensayo de cadena ligera libre sérica, ha sido recomendado recientemente por el Grupo de Trabajo Internacional sobre Mieloma para la detección, el diagnóstico, el pronóstico y el seguimiento de las discrasias de células plasmáticas . [70]
Generalmente se realiza una biopsia de médula ósea para estimar el porcentaje de médula ósea ocupada por células plasmáticas. Este porcentaje se utiliza en los criterios de diagnóstico del mieloma. La inmunohistoquímica (tinción de tipos celulares particulares utilizando anticuerpos contra proteínas de superficie) puede detectar células plasmáticas que expresan inmunoglobulina en el citoplasma y ocasionalmente en la superficie celular; las células de mieloma a menudo son CD56 , CD38 , CD138 y CD319 positivas y CD19 , CD20 y CD45 negativas. [21] La citometría de flujo se utiliza a menudo para establecer la naturaleza clonal de las células plasmáticas, que generalmente expresarán solo la cadena ligera kappa o lambda. La citogenética también se puede realizar en el mieloma con fines pronósticos, incluida una hibridación in situ fluorescente específica del mieloma y un cariotipo virtual . [ cita requerida ]
Las células plasmáticas que se observan en el mieloma múltiple tienen varias morfologías posibles. En primer lugar, podrían tener la apariencia de una célula plasmática normal, una célula grande dos o tres veces el tamaño de un linfocito periférico. Debido a que están produciendo anticuerpos de forma activa, el aparato de Golgi suele producir una zona de color claro adyacente al núcleo, llamada halo perinuclear. El núcleo único (con un único nucléolo en su interior con cromatina nuclear vesicular) es excéntrico, desplazado por un citoplasma abundante. Otras morfologías comunes observadas, pero que no son habituales en las células plasmáticas normales, incluyen:
Históricamente, el CD138 se ha utilizado para aislar células de mieloma con fines diagnósticos. Sin embargo, este antígeno desaparece rápidamente ex vivo . Sin embargo, recientemente se descubrió que el antígeno de superficie CD319 (SLAMF7) es considerablemente más estable y permite un aislamiento robusto de células plasmáticas malignas a partir de muestras retardadas o incluso criopreservadas. [73]
El pronóstico varía ampliamente dependiendo de varios factores de riesgo. La Clínica Mayo ha desarrollado un modelo de estratificación de riesgo denominado Estratificación de Mayo para Mieloma y Terapia Adaptada al Riesgo (mSMART), que divide a las personas en categorías de alto riesgo y riesgo estándar. [74] Las personas con deleción del cromosoma 13 o hipodiploidía según la citogenética convencional, t(4;14), t(14;16), t(14;20) o 17p según estudios genéticos moleculares, o con un alto índice de marcaje de células plasmáticas (3% o más) se consideran que tienen mieloma de alto riesgo. [75]
El examen diagnóstico de una persona con sospecha de mieloma múltiple incluye típicamente un estudio esquelético . Se trata de una serie de radiografías del cráneo, el esqueleto axial y los huesos largos proximales. La actividad del mieloma a veces aparece como "lesiones líticas" (con desaparición local del hueso normal debido a la reabsorción) o como "lesiones en sacabocados" en la radiografía del cráneo ("cráneo en gota de lluvia"). Las lesiones también pueden ser escleróticas , que se ven como radiodensas . [76] En general, la radiodensidad del mieloma está entre −30 y 120 unidades Hounsfield (UH). [77] La resonancia magnética es más sensible que las radiografías simples en la detección de lesiones líticas y puede reemplazar un estudio esquelético, especialmente cuando se sospecha enfermedad vertebral. Ocasionalmente, se realiza una tomografía computarizada para medir el tamaño de los plasmocitomas de tejidos blandos. Las gammagrafías óseas por lo general no tienen ningún valor adicional en la evaluación de personas con mieloma (no hay formación de hueso nuevo; las lesiones líticas no se visualizan bien en la gammagrafía ósea).
En 2003, el IMG [21] acordó los criterios de diagnóstico para el mieloma sintomático, el mieloma asintomático y la MGUS, que se actualizaron posteriormente en 2009: [78]
Nota: Las infecciones recurrentes por sí solas en una persona que no presenta ninguna de las características CRAB no son suficientes para realizar el diagnóstico de mieloma. Las personas que carecen de características CRAB, pero tienen evidencia de amiloidosis, deben considerarse amiloidosis y no mieloma. Las anomalías similares a CRAB son comunes en numerosas enfermedades y se debe considerar que estas anomalías son directamente atribuibles al trastorno de células plasmáticas relacionado y se debe hacer todo lo posible para descartar otras causas subyacentes de anemia, insuficiencia renal, etc.
En 2014, el IMWG actualizó sus criterios para incluir biomarcadores de malignidad. [70] [79] Estos biomarcadores son >60% de células plasmáticas clonales, una relación de cadena ligera libre involucrada/no involucrada en suero ≥ 100 (la concentración de la cadena ligera libre involucrada debe ser ≥ 100 mg/L) y más de una lesión focal ≥ 5 mm por resonancia magnética. [70] [79] Juntos, estos biomarcadores y los criterios CRAB se conocen como eventos definitorios de mieloma (MDE). Una persona debe tener >10% de células plasmáticas clonales y cualquier MDE para ser diagnosticada con mieloma. [70] Los criterios de biomarcadores se agregaron para que las personas latentes con mieloma múltiple con alto riesgo de desarrollar mieloma múltiple pudieran ser diagnosticadas antes de que ocurriera el daño orgánico, por lo que tendrían un mejor pronóstico. [79]
Las afecciones relacionadas incluyen plasmocitoma solitario (un tumor único de células plasmáticas, generalmente tratado con irradiación ), discrasia de células plasmáticas (donde solo los anticuerpos producen síntomas, por ejemplo, amiloidosis AL ), neuropatía periférica, organomegalia, endocrinopatía, trastorno de células plasmáticas monoclonales y cambios en la piel .
En el mieloma múltiple, la estadificación ayuda al pronóstico, pero no orienta las decisiones de tratamiento. El sistema de estadificación de Durie-Salmon se utilizó históricamente y fue reemplazado por el Sistema de estadificación internacional (ISS), publicado por el Grupo de trabajo internacional sobre mieloma en 2005. [80] El ISS revisado (R-ISS) se publicó en 2015 e incorpora la citogenética y la lactato deshidrogenasa (LDH). [81] : 1730–1 [82] [83] : 732–3
El riesgo de mieloma múltiple se puede reducir ligeramente manteniendo un peso corporal normal. [84]
La mayoría de las terapias farmacológicas emplean múltiples agentes, por ejemplo, las llamadas terapias "triplete" o "cuatrilete". Muchas de estas agrupaciones incluyen uno o más de un anticuerpo monoclonal (por ejemplo, isatuximab o daratumumab ), un agente inmunomodulador (por ejemplo, lenalidomida o pomalidomida ) y un inhibidor del proteasoma (por ejemplo, bortezomib , carfilzomib o ixazomib ), en combinación con un esteroide (por ejemplo, dexametasona ). [85]
Aunque las terapias tripletes fueron el estándar de atención durante muchos años, la práctica actual aplica más comúnmente cuatrillizos de medicamentos. [85] Estas terapias combinadas se mencionan comúnmente por sus iniciales, empleando letras mayúsculas para los nombres de marca de los medicamentos y letras minúsculas para los nombres de medicamentos genéricos, por ejemplo, VRd para Velcade (nombre de marca de bortezomib ), Revlimid (nombre de marca de lenalidomida ) y dexametasona. De manera similar con DKRd, con la D representando Darzalex (nombre de marca de daratumumab ) y la K representando Kyprolis (nombre de marca de carfilzomib ). [86] (La práctica emergente es no llamar a estos medicamentos " quimioterapia " porque no son los venenos intracelulares no específicos tradicionales que operan en la clásica forma de "quimio" de inhibir la mitosis o inducir daño al ADN. [87] [88] )
Por lo general, la eficacia de cada fármaco disminuye con el tiempo, a medida que el cáncer desarrolla mecanismos de resistencia a los fármacos, como la evolución clonal o las mutaciones genéticas. En parte por esta razón, históricamente no se ha tratado el mieloma múltiple cuando se encuentra en su etapa "latente", ya que los fármacos utilizados pueden tener una eficacia reducida si la enfermedad progresa a una etapa sintomática. Por lo tanto, el estándar de atención era la "espera vigilante" mientras la enfermedad estaba latente. [89] Sin embargo, cada vez se realizan más esfuerzos para estudiar si las terapias farmacológicas aplicadas durante la etapa latente podrían evitar que la enfermedad avance a la etapa activa. Son ejemplos de ello los ensayos clínicos GEM-CESAR, [90] ASCENT [91] e Immuno-PRISM [92] .
Una vez que la terapia farmacológica ha reducido la carga de cáncer de un paciente, algunos pacientes se someten a un trasplante de médula ósea (más apropiadamente llamado trasplante autólogo de células madre hematopoyéticas o ASCT) para suprimir aún más la enfermedad. Sin embargo, este procedimiento no está disponible para pacientes frágiles, [93] ya que esencialmente restablece aspectos del sistema inmunológico y requiere el redesarrollo de las defensas naturales, por ejemplo mediante la administración de vacunas infantiles. [94]
Cada vez se están explorando más terapias de medicina de precisión , y las investigaciones indican que ciertas variantes y subtipos genéticos de la enfermedad responden más favorablemente a algunas terapias farmacológicas que a otras. [95] Por ejemplo, algunas investigaciones indican que los pacientes con la translocación genética t(11,14) (presente en aproximadamente el 15-20% de los pacientes con mieloma múltiple) pueden beneficiarse particularmente de la terapia con Venetoclax (que está aprobada por la FDA para otros cánceres de la sangre, pero aún no está disponible para pacientes con mieloma múltiple, excepto a través de ensayos clínicos). [95] [96]
Si bien las terapias farmacológicas suelen implicar meses o años de tratamiento, la terapia CAR-T ofrece la alternativa de un solo tratamiento (aunque implique una hospitalización prolongada). Además, el tratamiento CAR-T parece proporcionar una remisión de la enfermedad más profunda y duradera que los medicamentos existentes. [97] Sin embargo, actualmente dicha terapia está aprobada por la FDA solo para pacientes en etapas más avanzadas de la enfermedad y está disponible solo en ciertos centros médicos. [98]
Una terapia futura que también aprovecha la respuesta inmunitaria de las células T es la clase de medicamentos denominados activadores de células T biespecíficos (BITE), o a veces simplemente anticuerpos biespecíficos . El primer medicamento de esta clase aprobado para el mieloma múltiple es Teclistamab , pero nuevamente su uso está reservado actualmente para pacientes en etapas más avanzadas de la enfermedad. [99] Otro medicamento BITE, Talquetamab , está en estudio; otros están en desarrollo. [100] (Los ensayos clínicos en curso están investigando la terapia BITE para pacientes latentes y recién diagnosticados. [92] )
Algunos pacientes buscan participar en ensayos clínicos de medicamentos, ya que estos ofrecen un grado de supervisión médica que no existe en la mayoría de los demás entornos clínicos, por no mencionar el acceso a nuevos medicamentos que parecen ser más prometedores que las terapias existentes. Algunos pacientes se mudan temporalmente a áreas urbanas donde se pueden realizar esos ensayos.
Los principales institutos de investigación del cáncer ofrecen la mayoría de los ensayos clínicos, pero algunos ensayos (en particular los ensayos de fase 3, en etapa avanzada) están disponibles en redes satélite que se extienden a cientos de hospitales. Los Institutos Nacionales de Salud de los Estados Unidos mantienen un directorio de ensayos clínicos. [101] En los Estados Unidos, ciudades como Nueva York, Boston, Houston y Rochester albergan importantes iniciativas de investigación sobre el mieloma múltiple; a nivel mundial, otros programas de investigación sobre el mieloma de primer nivel se encuentran en la Universidad de Salamanca, España, y en la Vrije Universiteit Brussels, entre otras.
La información médica pronto se vuelve obsoleta en áreas médicas de rápida evolución, como las terapias para el mieloma múltiple, por lo que los oncólogos de centros médicos más pequeños pueden no estar en condiciones de mantenerse al día con la literatura en todas las disciplinas relevantes. Esto ha dado lugar a organizaciones que trabajan para educar a los pacientes sobre los últimos avances en la enfermedad, por ejemplo, ofreciendo seminarios web con destacados investigadores y profesionales que se centran en el mieloma múltiple; ejemplos de dichas organizaciones son la International Myeloma Foundation y la Multiple Myeloma Research Foundation . Algunos pacientes interesados en seguir los últimos avances revisan las actas de las principales conferencias sobre cáncer hematológico, como la Conferencia de la Sociedad Estadounidense de Hematólogos (ASH), [102] la Conferencia de la Sociedad Estadounidense de Oncología Clínica (ASCO), [103] la Cumbre del IMWG de la IMF y la Conferencia Anual de la Asociación Europea de Hematología (EHA). [104]
El tratamiento está indicado en el mieloma con síntomas. Si no hay síntomas, pero hay una paraproteína típica del mieloma y médula ósea diagnóstica sin daño en los órganos diana, el tratamiento suele posponerse o restringirse a ensayos clínicos. [105] El tratamiento del mieloma múltiple se centra en disminuir la población de células plasmáticas clonales y, en consecuencia, disminuir los síntomas de la enfermedad.
El tratamiento preferido para los menores de 65 años es la quimioterapia de dosis alta, comúnmente con regímenes basados en bortezomib y lenalidomida -dexametasona, [106] seguida de un trasplante de células madre. Un estudio de 2016 concluyó que el trasplante de células madre es el tratamiento preferido del mieloma múltiple. [107] Hay dos tipos de trasplantes de células madre para tratar el mieloma múltiple. [108] En el trasplante autólogo de células madre hematopoyéticas (ASCT), las propias células madre del paciente se recolectan de la propia sangre del paciente. El paciente recibe quimioterapia de dosis alta y luego las células madre del paciente se trasplantan nuevamente al paciente. El proceso no es curativo, pero prolonga la supervivencia general y la remisión completa. En el trasplante alogénico de células madre, las células madre de un donante sano se trasplantan a la persona afectada. El trasplante alogénico de células madre tiene potencial curativo, pero se utiliza en un porcentaje muy pequeño de personas (y en casos de recaída, no como parte del tratamiento inicial). [51] Además, el trasplante alogénico de células madre tiene una tasa de mortalidad asociada al tratamiento del 5 al 10 %.
Las personas mayores de 65 años y las personas con enfermedades concurrentes significativas a menudo no pueden tolerar el trasplante de células madre. Para estas personas, el estándar de atención ha sido la quimioterapia con melfalán y prednisona. Estudios recientes entre esta población sugieren mejores resultados con nuevos regímenes de quimioterapia, por ejemplo, con bortezomib. [109] [110] El tratamiento con bortezomib, melfalán y prednisona tuvo una supervivencia general estimada del 83% a los 30 meses, lenalidomida más dexametasona en dosis bajas una supervivencia del 82% a los 2 años, y melfalán, prednisona y lenalidomida tuvieron una supervivencia del 90% a los 2 años. Hasta 2008, no se han realizado estudios comparativos directos de estos regímenes [actualizar]. [111]
Existe respaldo para terapias continuas con múltiples combinaciones de fármacos antimieloma bortezomib , lenalidomida y talidomida como tratamiento inicial para el mieloma múltiple no elegible para trasplante. [112] Se requieren estudios clínicos adicionales para determinar los posibles daños de estos fármacos y el efecto sobre la calidad de vida de la persona. [112] Una revisión de 2009 señaló: "La trombosis venosa profunda y la embolia pulmonar son los principales efectos secundarios de la talidomida y la lenalidomida. La lenalidomida causa más mielosupresión y la talidomida causa más sedación. La neuropatía periférica inducida por la quimioterapia y la trombocitopenia son los principales efectos secundarios del bortezomib". [113] La adición de daratumumab subcutáneo a la terapia de inducción y consolidación con bortezomib, lenalidomida y dexametasona, y a la terapia de mantenimiento con lenalidomida, confirió una mejor supervivencia libre de progresión entre los pacientes elegibles para trasplante con mieloma múltiple recién diagnosticado. [114]
Puede ser necesario el tratamiento del síndrome de hiperviscosidad relacionado para prevenir síntomas neurológicos o insuficiencia renal. [115] [116]
La mayoría de las personas, incluidas las tratadas con ASCT, sufren una recaída después del tratamiento inicial. A menudo se utiliza una terapia de mantenimiento con un ciclo prolongado de medicamentos de baja toxicidad para prevenir la recaída. Un metanálisis de 2017 mostró que la terapia de mantenimiento posterior al ASCT con lenalidomida mejoró la supervivencia libre de progresión y la supervivencia general en personas con riesgo estándar. [117] Un ensayo clínico de 2012 mostró que las personas con enfermedad de riesgo intermedio y alto se benefician de un régimen de mantenimiento basado en bortezomib. [118]
Las razones de la recaída incluyen la evolución de la enfermedad, ya sea por la presión selectiva aplicada por el tratamiento o por mutaciones de novo y/o si la enfermedad estaba representada inadecuadamente en la biopsia inicial. [81] La recaída dentro de los primeros 18 meses del diagnóstico se considera un mieloma múltiple funcional de alto riesgo. [81] Dependiendo de la condición de la persona, las modalidades de tratamiento previas utilizadas y la duración de la remisión, las opciones para la enfermedad recidivante incluyen el retratamiento con el agente original, el uso de otros agentes (como melfalán, ciclofosfamida, talidomida o dexametasona, solos o en combinación) y un segundo ASCT.
Más adelante en el curso de la enfermedad, se vuelve refractaria (resistente) al tratamiento que antes era eficaz. Esta etapa se conoce como mieloma múltiple recidivante/refractario (RRMM). Las modalidades de tratamiento que se utilizan comúnmente para tratar el RRMM incluyen dexametasona, inhibidores del proteasoma (p. ej., bortezomib y carfilzomib ), fármacos imida inmunomoduladores (p. ej., talidomida, lenalidomida y pomalidomida ) y ciertos anticuerpos monoclonales (p. ej. , isatuximab contra CD38 o anticuerpos dirigidos a CD319 ). La expectativa de supervivencia ha aumentado en los últimos años, [119] y se están desarrollando nuevos tratamientos. [ cita médica necesaria ]
La insuficiencia renal en el mieloma múltiple puede ser aguda (reversible) o crónica (irreversible). La insuficiencia renal aguda generalmente se resuelve cuando se controlan los niveles de calcio y paraproteína. El tratamiento de la insuficiencia renal crónica depende del tipo de insuficiencia renal y puede implicar diálisis .
Se han aprobado varias opciones más nuevas para el tratamiento de la enfermedad avanzada:
Talquetamab (Talvey) y elranatamab (Elrexfio) fueron aprobados para uso médico en los Estados Unidos en agosto de 2023. [131] [132] [133] [134]
El trasplante de células madre se puede utilizar para tratar el mieloma múltiple. [3] Los trasplantes de células madre conllevan un riesgo de enfermedad de injerto contra huésped . Las células estromales mesenquimales pueden reducir la mortalidad por todas las causas si se utilizan con un fin terapéutico y el uso terapéutico de las MSC puede aumentar la respuesta completa de la EICH aguda y crónica, pero la evidencia es muy incierta. [135] La evidencia sugiere que las MSC por razones profilácticas resultan en poca o ninguna diferencia en la mortalidad por todas las causas, en la recaída de enfermedades malignas y en la incidencia de la EICH aguda. [135] La evidencia sugiere que las MSC por razones profilácticas reducen la incidencia de la EICH crónica. [135]
Plerixafor (Mozobil) fue aprobado para uso médico en los Estados Unidos en 2008. [136]
Motixafortide (Aphexda) fue aprobado para uso médico en los Estados Unidos en septiembre de 2023. [137]
Además del tratamiento directo de la proliferación de células plasmáticas, se administran rutinariamente bifosfonatos (p. ej., pamidronato o ácido zoledrónico ) para prevenir fracturas; también se ha observado que tienen un efecto antitumoral directo incluso en personas sin enfermedad esquelética conocida. [ cita requerida ] Si es necesario, se pueden utilizar transfusiones de glóbulos rojos o eritropoyetina para el tratamiento de la anemia.
Las quimioterapias y los trasplantes de células madre pueden causar hemorragias no deseadas y pueden requerir transfusiones de plaquetas. Se ha observado que las transfusiones de plaquetas en personas sometidas a quimioterapia o trasplante de células madre para la prevención de eventos hemorrágicos tuvieron diferentes efectos en el número de participantes con un evento hemorrágico, el número de días en los que se produjo un sangrado, la mortalidad secundaria al sangrado y el número de transfusiones de plaquetas según la forma en que se utilizaron (terapéuticas, dependiendo de un umbral, diferentes esquemas de dosis o profilácticas). [139] [140]
La incorporación de ejercicios físicos al tratamiento estándar para pacientes adultos con neoplasias hematológicas como el mieloma múltiple puede dar como resultado poca o ninguna diferencia en la mortalidad, en la calidad de vida y en el funcionamiento físico. [141] Estos ejercicios pueden dar como resultado una ligera reducción de la depresión. [141] Además, los ejercicios físicos aeróbicos probablemente reducen la fatiga. La evidencia es muy incierta sobre el efecto y los eventos adversos graves [141]
Varias pautas nacionales de tratamiento del cáncer recomiendan cuidados paliativos tempranos para personas con mieloma múltiple avanzado en el momento del diagnóstico y para cualquier persona que presente síntomas significativos. [142] [143]
Los cuidados paliativos son apropiados en cualquier etapa del mieloma múltiple y pueden brindarse junto con el tratamiento curativo. Además de abordar los síntomas del cáncer, los cuidados paliativos ayudan a controlar los efectos secundarios no deseados, como el dolor y las náuseas relacionados con los tratamientos. [144] [145]
La profilaxis oral, las instrucciones de higiene y la eliminación de las fuentes de infección dentro de la boca antes de comenzar el tratamiento del cáncer pueden reducir el riesgo de complicaciones infecciosas. Antes de comenzar la terapia con bifosfonatos, se debe evaluar la salud dental de la persona para evaluar los factores de riesgo y prevenir el desarrollo de osteonecrosis de la mandíbula relacionada con la medicación (MRONJ). Si hay síntomas o apariencia radiográfica de MRONJ como dolor de mandíbula, dientes flojos, hinchazón de la mucosa, se recomienda la derivación temprana a un cirujano oral. Se deben evitar las extracciones dentales durante el período activo del tratamiento y tratar el diente con un tratamiento de conducto no quirúrgico. [146]
En general, la tasa de supervivencia a 5 años es de alrededor del 54% en los Estados Unidos. [147] Con una terapia de dosis alta seguida de ASCT, la supervivencia media se ha estimado en 2003 en alrededor de 4,5 años, en comparación con una media de alrededor de 3,5 años con una terapia "estándar". [148]
El sistema de estadificación internacional puede ayudar a predecir la supervivencia, con una supervivencia media (en 2005) de 62 meses para la enfermedad en estadio 1, 45 meses para la enfermedad en estadio 2 y 29 meses para la enfermedad en estadio 3. [80] La edad media en el momento del diagnóstico es de 69 años. [147]
El cariotipo de matriz SNP puede detectar alteraciones del número de copias de importancia pronóstica que podrían pasar desapercibidas con un panel FISH específico. [149]
La siguiente tabla describe el efecto pronóstico de varios hallazgos genéticos en el mieloma múltiple, con translocaciones cromosómicas designadas t, seguidas de su nomenclatura estándar: [150]


A nivel mundial, el mieloma múltiple afectó a 488.000 personas y provocó 101.100 muertes en 2015. [8] [9] Esto representa un aumento respecto de las 49.000 personas en 1990. [152]
El mieloma es el 17.º cáncer más común en el Reino Unido: alrededor de 4.800 personas fueron diagnosticadas con la enfermedad en 2011. Es la 16.ª causa más común de muerte por cáncer: alrededor de 2.700 personas murieron a causa de ella en 2012. [153]
En los Estados Unidos en 2016, se informaron aproximadamente 30.330 casos nuevos y 12.650 muertes. [7] Estas cifras se basan en suposiciones realizadas utilizando datos de 2011, que estimaron el número de personas afectadas en 83.367 personas, el número de casos nuevos en 6,1 por 100.000 personas por año y la mortalidad en 3,4 por 100.000 personas por año.
El mieloma múltiple es el segundo cáncer de sangre más frecuente (10%) después del linfoma no Hodgkin . [154] Representa alrededor del 1,8% de todos los cánceres nuevos y el 2,1% de todas las muertes por cáncer. [7]
El mieloma múltiple afecta a un número ligeramente mayor de hombres que de mujeres. Los afroamericanos y los nativos de las islas del Pacífico tienen el mayor número de casos nuevos de esta enfermedad en los Estados Unidos, y los asiáticos, el menor. Los resultados de un estudio determinaron que el número de casos nuevos de mieloma era de 9,5 casos por cada 100 000 afroamericanos y de 4,1 casos por cada 100 000 estadounidenses caucásicos. [155] Entre los afroamericanos, el mieloma es una de las 10 principales causas de muerte por cáncer. [156]
Se ha diagnosticado mieloma múltiple en perros, [157] gatos y caballos. [158]
En los perros, el mieloma múltiple representa alrededor del 8% de todos los tumores hematopoyéticos. El mieloma múltiple se presenta en perros mayores y no está particularmente asociado con machos o hembras. Ninguna raza parece estar sobrerrepresentada en las revisiones de casos que se han realizado. [159] El diagnóstico en perros generalmente se retrasa debido a la inespecificidad inicial y la variedad de signos clínicos posibles. El diagnóstico generalmente implica estudios de médula ósea, radiografías y estudios de proteínas plasmáticas. En perros, los estudios de proteínas generalmente revelan que la elevación de gammaglobulina monoclonal es IgA o IgG en igual número de casos. [159] En casos raros, la elevación de globulina es IgM, lo que se conoce como macroglobulinemia de Waldenström . [160] El pronóstico para el control inicial y el retorno a una buena calidad de vida en perros es bueno; el 43% de los perros que comenzaron con un protocolo de quimioterapia combinada lograron una remisión completa. La supervivencia a largo plazo es normal, con una mediana reportada de 540 días. [159] La enfermedad finalmente recurre y se vuelve resistente a las terapias disponibles. [ cita médica necesaria ] Las complicaciones de insuficiencia renal, sepsis o dolor pueden provocar la muerte de un animal, frecuentemente mediante eutanasia . [ cita médica necesaria ]
{{cite journal}}: |author1=tiene nombre genérico ( ayuda )Mantenimiento de CS1: nombres numéricos: lista de autores ( enlace )