.jpg/440px-Monarch_caterpillar_(23229).jpg)
_underside_Piedra_Herrada.jpg/440px-Monarch_(Danaus_plexippus_plexippus)_underside_Piedra_Herrada.jpg)
La mariposa monarca o simplemente monarca ( Danaus plexippus ) es una mariposa de algodoncillo ( subfamilia Danainae ) de la familia Nymphalidae . [6] Otros nombres comunes, según la región, incluyen algodoncillo , tigre común , vagabundo y marrón veteado de negro . [7] Es una de las mariposas más conocidas de América del Norte y un polinizador icónico , [8] aunque no es un polinizador especialmente eficaz de algodoncillos . [9] Sus alas presentan un patrón negro, naranja y blanco fácilmente reconocible, con una envergadura de 8,9 a 10,2 cm (3,5 a 4,0 pulgadas). [10] Una imitadora mülleriana , la mariposa virrey , es similar en color y patrón, pero es notablemente más pequeña y tiene una franja negra adicional en cada ala trasera.
La población de monarcas del este de América del Norte es notable por su migración instintiva anual hacia el sur a fines del verano/otoño desde el norte y centro de los Estados Unidos y el sur de Canadá hasta Florida y México. [6] Durante la migración de otoño, las monarcas cubren miles de millas, con un retorno multigeneracional correspondiente al norte en primavera. La población de monarcas del oeste de América del Norte al oeste de las Montañas Rocosas a menudo migra a sitios en el sur de California , pero también se han encontrado individuos en sitios de hibernación mexicanos. [11] [12] Las poblaciones no migratorias se encuentran más al sur en las Américas y en partes de Europa, Oceanía y el sudeste asiático.
Se cree que el nombre "monarca" se le dio en honor al rey Guillermo III de Inglaterra , ya que el color principal de la mariposa es el del título secundario del rey, Príncipe de Orange . [13] La monarca fue descrita originalmente por Carl Linnaeus en su Systema Naturae de 1758 y colocada en el género Papilio . [14] En 1780, Jan Krzysztof Kluk utilizó a la monarca como especie tipo para un nuevo género, Danaus . Aunque los trabajos publicados entre al menos 1883 y 1944 identificaron a la especie como Anosia plexippus , [15] el nombre del género se fusionó con Danaus en 2005. [16]
Danaus ( griego antiguo Δαναός ), bisnieto de Zeus , fue un rey mítico de Egipto o Libia , que fundó Argos ; Plexippus ( Πλήξιππος ) fue uno de los 50 hijos de Aegyptus , el hermano gemelo de Danaus. En griego homérico , su nombre significa "el que impulsa a los caballos", es decir, "jinete" o " auriga ". [17] En la décima edición de Systema Naturae , en la parte inferior de la página 467, [18] Linneo escribió que los nombres de Danai festivi , la división del género al que pertenecía Papilio plexippus , se derivaban de los hijos de Aegyptus. Linneo dividió su gran género Papilio , que contiene todas las especies de mariposas conocidas, en lo que ahora llamaríamos subgéneros. Los Danai festivi formaban uno de los "subgéneros" que contenían especies coloridas, a diferencia de los Danai candidi , que contenían especies con alas blancas brillantes. Linneo escribió: " Danaorum Candidorum nomina a filibus Danai Aegypti, Festivorum a filiis mutuatus sunt ". (En español: "Los nombres de los Danai candidi se derivan de las hijas de Danaus, los de los Danai festivi de los hijos de Aegyptus").
Robert Michael Pyle sugirió que Danaus es una versión masculinizada de Danaë (griego Δανάη ), la tataranieta de Danaus, a quien Zeus le llegó como una lluvia de oro, lo que le pareció una fuente más apropiada para el nombre de esta mariposa. [19]

Las monarcas pertenecen a la subfamilia Danainae de la familia Nymphalidae . Anteriormente, Danainae se consideraba una familia independiente, Danaidae . [20] Las tres especies de mariposas monarca son:
Se han identificado seis subespecies y dos morfos de color de D. plexippus : [7]
El nivel de población de la forma blanca en Oahu se acerca al 10%. En otras islas hawaianas, la forma blanca se presenta con una frecuencia relativamente baja. Se han encontrado monarcas blancas ( D. pp "forma nivosus") en todo el mundo, incluidos Australia, Nueva Zelanda, Indonesia y los Estados Unidos. [21] Sin embargo, algunos taxónomos no están de acuerdo con estas clasificaciones. [16] [23]
La monarca fue la primera mariposa cuyo genoma fue secuenciado. [24] : 12 La secuencia preliminar de 273 millones de pares de bases incluye un conjunto de 16.866 genes codificadores de proteínas. El genoma proporciona a los investigadores información sobre el comportamiento migratorio, el reloj circadiano, las vías de las hormonas juveniles y los microARN que se expresan de forma diferencial entre las monarcas de verano y las migratorias. [25] Más recientemente, se ha descrito la base genética de la migración de la monarca y la coloración de advertencia. [26]
No existe diferenciación genética entre las poblaciones migratorias del este y el oeste de América del Norte. [24] : 16 Investigaciones recientes han identificado las áreas específicas del genoma de la monarca que regulan la migración. No se observa ninguna diferencia genética entre una monarca migratoria y una que no migra, pero el gen se expresa en las monarcas migratorias, pero no en las que no migran. [27]
Una publicación de 2015 identificó genes de bracovirus de avispa en el genoma de la mariposa monarca de América del Norte [28], lo que dio lugar a artículos sobre las mariposas monarca como organismos genéticamente modificados . [29]
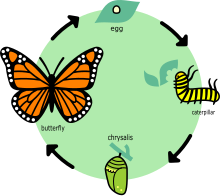
Como todos los lepidópteros, las monarcas experimentan una metamorfosis completa ; su ciclo de vida tiene cuatro fases: huevo, larva, pupa y adulto. Las monarcas pasan de huevo a adulto durante las temperaturas cálidas del verano en tan solo 25 días, y se extienden hasta siete semanas durante las condiciones frías de la primavera. Durante su desarrollo, tanto las larvas como sus huéspedes de algodoncillo son vulnerables a los extremos climáticos, los depredadores, los parásitos y las enfermedades; comúnmente, menos del 10% de los huevos y las orugas de las monarcas sobreviven. [24] : 21–22

El huevo se obtiene a partir de materiales ingeridos como larva y de los espermatóforos recibidos de los machos durante el apareamiento. [30] Las hembras monarca ponen huevos individualmente, con mayor frecuencia en el envés de una hoja joven de una planta de algodoncillo durante la primavera y el verano. [31] Las hembras secretan una pequeña cantidad de pegamento para fijar sus huevos directamente a la planta. Por lo general, ponen entre 300 y 500 huevos durante un período de dos a cinco semanas. [32]
Los huevos son de color crema o verde claro, de forma ovalada a cónica y miden aproximadamente 1,2 mm × 0,9 mm (0,047 in × 0,035 in). Los huevos pesan menos de 0,5 mg (0,0077 gr) cada uno y tienen crestas elevadas que se forman longitudinalmente desde la punta hasta el ápice y la base. Aunque cada huevo tiene 1 ⁄ 1000 de la masa de la hembra, esta puede poner huevos de hasta su propia masa. Las hembras ponen huevos más pequeños a medida que envejecen. Las hembras más grandes ponen huevos más grandes. [30] La cantidad de huevos puestos por una hembra, que puede aparearse varias veces, puede alcanzar los 1180. [33]
Los huevos tardan entre tres y ocho días en desarrollarse y eclosionar en larvas u orugas . [24] : 21 El consumo de algodoncillo por parte de las crías beneficia la salud y ayuda a defenderlas de los depredadores. [34] [35] Las monarcas ponen huevos a lo largo de la ruta migratoria del sur. [36]
.jpg/440px-Swallowtail_Caterpillar,_Monarch_Caterpillar_&_Queen_Caterpillar_in_Florida_(27224446333).jpg)
La larva (oruga) tiene cinco estadios ( estadios ) y muda al final de cada uno de ellos. Los estadios duran entre 3 y 5 días, dependiendo de factores como la temperatura y la disponibilidad de alimentos. [6] [37]
La oruga de primer estadio que emerge del huevo es de color verde pálido o blanco grisáceo, brillante y casi translúcida, con una cabeza grande y negra. Carece de coloración en bandas o tentáculos. La larva u oruga se come su cápsula de huevo y comienza a alimentarse de algodoncillo con un movimiento circular, a menudo dejando un agujero característico en forma de arco en la hoja. Las larvas de primer estadio más viejas tienen rayas oscuras sobre un fondo verdoso y desarrollan pequeñas protuberancias que luego se convierten en tentáculos frontales. El primer estadio suele tener entre 2 y 6 mm (0,079 y 0,236 pulgadas) de largo. [37]
La larva de segundo estadio desarrolla un patrón característico de bandas transversales blancas, amarillas y negras. La larva tiene un triángulo amarillo en la cabeza y dos conjuntos de bandas amarillas alrededor de este triángulo central. Ya no es translúcida y está cubierta de setas cortas . Comienzan a crecer pares de tentáculos negros, un par más grande en el tórax y un par más pequeño en el abdomen. El segundo estadio suele tener entre 6 mm (0,24 pulgadas) y 1 cm (0,39 pulgadas) de largo. [37]
La larva de tercer estadio tiene bandas más definidas y los dos pares de tentáculos se hacen más largos. Las patas del tórax se diferencian en un par más pequeño cerca de la cabeza y pares más grandes más atrás. Las larvas de tercer estadio suelen alimentarse utilizando un movimiento de corte en los bordes de las hojas. La larva de tercer estadio suele tener entre 1 y 1,5 cm (0,39 y 0,59 pulgadas) de largo. [37] La larva de cuarto estadio tiene un patrón de bandas diferente. Desarrolla manchas blancas en las propatas cerca de su espalda y suele tener entre 1,5 y 2,5 cm (0,59 y 0,98 pulgadas) de largo. [37]

La larva de quinto estadio tiene un patrón de bandas más complejo y puntos blancos en las patas delanteras, con patas delanteras pequeñas y muy cerca de la cabeza. Su longitud varía de 2,5 a 4,5 cm (0,98 a 1,77 pulgadas). [6] [37] Las larvas normalmente mastican una vena de látex para aliviar la presión y alimentarse por encima de ella. Las larvas de quinto estadio a menudo mastican una muesca en el pecíolo de la hoja que están comiendo, lo que alivia la presión del látex y hace que la hoja caiga en posición vertical.
A medida que la oruga completa su crecimiento, mide 4,5 cm (1,8 pulgadas) de largo (los ejemplares grandes pueden alcanzar los 5 cm (2,0 pulgadas)) y de 7 a 8 mm (0,28 a 0,31 pulgadas) de ancho, y pesa alrededor de 1,5 g (0,053 oz), en comparación con el primer estadio, que mide de 2 a 6 mm (0,079 a 0,236 pulgadas) de largo y de 0,5 a 1,5 mm (0,020 a 0,059 pulgadas) de ancho. Las larvas del quinto estadio aumentan mucho en tamaño y peso. Luego dejan de alimentarse y a menudo se las encuentra lejos de las plantas de algodoncillo mientras buscan un sitio para pupar. [37]
En un entorno de laboratorio, las etapas cuarta y quinta de la oruga mostraron signos de comportamiento agresivo con una menor disponibilidad de alimento. Se encontró que las orugas atacadas lo hacían cuando se alimentaban de hojas de algodoncillo, y las orugas atacaban cuando buscaban algodoncillo. [38] Esto demuestra el comportamiento agresivo de las orugas monarca debido a la disponibilidad de algodoncillo.

Para prepararse para la etapa de pupa o crisálida , la oruga elige un lugar seguro para la pupación, donde teje una almohadilla de seda sobre una superficie horizontal orientada hacia abajo. En este punto, se da la vuelta y se agarra firmemente con su último par de patas traseras y se cuelga boca abajo, en forma de la letra J. Después de "colgar en J" durante aproximadamente 12 a 16 horas, pronto endereza su cuerpo y entra en peristalsis unos segundos antes de que su piel se rompa detrás de su cabeza. Luego muda su piel durante un período de unos minutos, revelando una crisálida verde (video: https://www.youtube.com/watch?v=QLQmrIUILzc). Al principio, la crisálida es larga, blanda y algo amorfa, pero después de unas horas se compacta hasta adquirir su forma característica: una crisálida opaca de color verde pálido con pequeños puntos dorados cerca de la base y un borde dorado y negro alrededor del lado dorsal cerca de la parte superior. [39] Al principio, su exoesqueleto es blando y frágil, pero se endurece y se vuelve más duradero en aproximadamente un día. En este punto, mide unos 2,5 cm (0,98 pulgadas) de largo y 10-12 mm (0,39-0,47 pulgadas) de ancho, y pesa alrededor de 1,2 g (0,042 oz). A temperaturas normales de verano, madura en 8-15 días (normalmente 11-12 días). Durante esta etapa de pupa, la mariposa adulta se forma en el interior. Aproximadamente un día antes de emerger, el exoesqueleto se vuelve translúcido y la crisálida más azulada. Finalmente, después de unas 12 horas aproximadamente, se vuelve transparente, revelando los colores negro y naranja de la mariposa en su interior antes de que eclosione (emerja). [40]
En 2009, se criaron monarcas en la Estación Espacial Internacional , que emergieron con éxito de pupas ubicadas en el Aparato de Bioprocesamiento Genérico Comercial de la estación. [41]

El adulto emerge de su crisálida después de aproximadamente dos semanas de pupación (video: https://www.youtube.com/watch?v=tQDGizDHVs8 ). El adulto emergente cuelga boca abajo durante varias horas mientras bombea fluidos y aire a sus alas, que se expanden, se secan y se endurecen. Luego, la mariposa extiende y retrae sus alas. Una vez que las condiciones lo permiten, vuela y se alimenta de una variedad de plantas nectaríferas. Durante la temporada de reproducción, los adultos alcanzan la madurez sexual en 4 a 5 días. Sin embargo, la generación migratoria no alcanza la madurez hasta que finaliza la hibernación. [42]
La envergadura de las alas adultas varía de 8,9 a 10,2 centímetros (3,5 a 4,0 pulgadas). [10] Los lados superiores de las alas son de color naranja rojizo, las venas y los márgenes son negros y dos series de pequeñas manchas blancas aparecen en los márgenes. Las alas anteriores de la monarca también tienen algunas manchas naranjas cerca de sus puntas. Las partes inferiores de las alas son similares, pero las puntas de las alas anteriores y posteriores son de color marrón amarillento en lugar de naranja rojizo y las manchas blancas son más grandes. [43] La forma y el color de las alas cambian al comienzo de la migración y parecen más rojas y alargadas que las de los migrantes posteriores. [44] El tamaño y la forma de las alas difieren entre las monarcas migratorias y no migratorias. Las monarcas del este de América del Norte tienen alas anteriores más grandes y angulares que las de la población occidental. [24]
En las poblaciones del este de América del Norte, el tamaño general de las alas varía en función de las dimensiones físicas de las mismas. Los machos tienden a tener alas más grandes que las hembras y, por lo general, son más pesados que las hembras. Tanto los machos como las hembras tienen dimensiones torácicas similares. Las hembras monarca tienden a tener alas más gruesas, lo que se cree que les confiere una mayor resistencia a la tracción y reduce la probabilidad de sufrir daños durante la migración. Además, las hembras tenían una carga alar menor que los machos, lo que significaría que las hembras requieren menos energía para volar. [45]
Los adultos presentan dimorfismo sexual . Los machos son ligeramente más grandes que las hembras y tienen una mancha negra en una vena de cada ala trasera. Las manchas contienen escamas que producen feromonas que muchos lepidópteros utilizan durante el cortejo. Las hembras suelen ser más oscuras que los machos y tienen venas más anchas en las alas. Los extremos del abdomen de los machos y las hembras difieren en forma. [24] [43] [46] [47]
El tórax del adulto tiene seis patas, pero como en todas las Nymphalidae, las patas delanteras son pequeñas y se mantienen pegadas al cuerpo. La mariposa utiliza sólo las patas medias y traseras para caminar y agarrarse. [48]
Los adultos suelen vivir entre 2 y 5 semanas durante su temporada de reproducción. [24] : 22–23 Las larvas que crecen en altas densidades son más pequeñas, tienen menor supervivencia y pesan menos como adultas en comparación con las que crecen en densidades más bajas. [49]
Los experimentos fisiológicos sugieren que las mariposas monarca ven el mundo a través de un sistema tetracromático. [50] Al igual que los humanos , su retina contiene tres tipos de proteínas opsinas, expresadas en células fotorreceptoras distintas, cada una de las cuales absorbe luz en una longitud de onda diferente. A diferencia de los humanos, uno de esos tipos de células fotorreceptoras corresponde a una longitud de onda en el rango ultravioleta ; los otros dos corresponden al azul y al verde. [51]
Además de estas tres células fotorreceptoras en la retina principal, los ojos de la mariposa monarca contienen pigmentos filtrantes de color naranja que filtran la luz que llega a algunas opsinas que absorben el color verde, lo que crea una cuarta célula fotorreceptora sensible a la luz de longitud de onda más larga. [50] La combinación de opsinas verdes filtradas y no filtradas permite a las mariposas distinguir los colores amarillo y naranja. [50] La proteína opsina ultravioleta también se ha detectado en la región del borde dorsal de los ojos de la mariposa monarca. Un estudio sugiere que esto permite a las mariposas la capacidad de detectar la luz ultravioleta polarizada del cielo para orientarse con el sol durante su largo vuelo migratorio . [52]
Estas mariposas son capaces de distinguir colores basándose únicamente en su longitud de onda, y no en su intensidad; este fenómeno se denomina "visión de color verdadero". Esto es importante para muchos comportamientos de las mariposas, incluida la búsqueda de néctar para alimentarse, la elección de una pareja y la búsqueda de algodoncillo en el que poner huevos. Un estudio descubrió que las mariposas que buscan néctar reconocen más fácilmente el color de las flores a distancia que la forma de las flores. Esto puede deberse a que las flores tienen colores muy contrastantes con el fondo verde de un paisaje vegetal. [53] Por otro lado, la forma de las hojas es importante para la oviposición, de modo que las mariposas puedan asegurarse de que sus huevos se pongan en algodoncillo.
Más allá de la percepción del color, la capacidad de recordar ciertos colores es esencial en la vida de las mariposas monarca. Estos insectos pueden aprender fácilmente a asociar el color, y en menor medida, la forma, con recompensas alimenticias azucaradas. Cuando buscan néctar , el color es la primera señal que atrae la atención del insecto hacia una fuente potencial de alimento, y la forma es una característica secundaria que promueve el proceso. Cuando buscan un lugar para poner sus huevos, los roles del color y la forma se intercambian. Además, puede existir una diferencia entre las mariposas macho y hembra de otras especies en términos de la capacidad de aprender ciertos colores; sin embargo, no se observan diferencias entre los sexos en las mariposas monarca. [53]
El cortejo de la monarca se produce en dos fases. Durante la fase aérea, un macho persigue y a menudo obliga a una hembra a bajar al suelo. Durante la fase terrestre, las mariposas copulan y permanecen unidas durante unos 30 a 60 minutos. [54] Solo el 30% de los intentos de apareamiento terminan en cópula, lo que sugiere que las hembras pueden evitar el apareamiento, aunque algunas tienen más éxito que otras. [55] [56] Durante la cópula, un macho transfiere su espermatóforo a una hembra. Junto con el esperma , el espermatóforo proporciona a la hembra nutrición, lo que la ayuda a poner huevos. Un aumento en el tamaño del espermatóforo aumenta la fecundidad de las monarcas hembras. Los machos que producen espermatóforos más grandes también fertilizan más huevos de hembras. [57]
Las hembras y los machos suelen aparearse más de una vez. Las hembras que se aparean varias veces ponen más huevos. [58] El apareamiento de las poblaciones que hibernan ocurre en primavera, antes de la dispersión. El apareamiento depende menos de las feromonas que en otras especies de su género. [59] Las estrategias de búsqueda y captura de los machos pueden influir en el éxito de la cópula, y los cambios inducidos por el hombre en el hábitat pueden influir en la actividad de apareamiento de la monarca en los sitios de hibernación. [60]

El área de distribución de las poblaciones occidentales y orientales de D. p. plexippus se expande y se contrae según la estación. El área de distribución difiere entre las áreas de reproducción, las rutas de migración y los refugios de invierno. [24] : 18 Sin embargo, no existen diferencias genéticas entre las poblaciones occidentales y orientales de monarca; [27] el aislamiento reproductivo no ha llevado a la subespeciación de estas poblaciones, como ha sucedido en otras partes dentro del área de distribución de la especie. [24] : 19
En América, la monarca se extiende desde el sur de Canadá hasta el norte de Sudamérica. [6] También se encuentra en Bermudas , las Islas Cook , [61] Hawái, [62] [63] Cuba, [64] y otras islas del Caribe, [24] : 18 las Islas Salomón , Nueva Caledonia , Nueva Zelanda, [65] Papúa Nueva Guinea , [66] Australia, las Azores , las Islas Canarias , Madeira , Portugal continental, Gibraltar , [67] Filipinas y Marruecos . [68] Aparece en el Reino Unido en algunos años como migrante accidental. [69]
Las poblaciones invernantes de D. p. plexippus se encuentran en México, California, a lo largo de la costa del Golfo de los Estados Unidos , durante todo el año en Florida y en Arizona, donde el hábitat tiene las condiciones específicas necesarias para su supervivencia. [70] [71] En la costa este de los Estados Unidos , han hibernado tan al norte como Lago Mar, Virginia Beach, Virginia . [72] Su hábitat de invernada generalmente proporciona acceso a arroyos, abundante luz solar (lo que permite temperaturas corporales que permiten el vuelo) y vegetación de descanso adecuada, y está relativamente libre de depredadores.
Se han visto mariposas que hibernan y se posan en tilos, olmos, zumaques, langostas, robles, naranjos de Osage, moreras, pecanas, sauces, álamos y mezquites. [73] Mientras se reproducen, los hábitats de la monarca se pueden encontrar en campos agrícolas, pastizales, restos de praderas, áreas residenciales urbanas y suburbanas, jardines, árboles y bordes de caminos, en cualquier lugar donde haya acceso a plantas hospedantes de larvas. [74]
Las plantas hospedantes utilizadas por la oruga monarca incluyen:

La migración oriental de la monarca depende en gran medida de sólo tres de estas especies: Asclepias syriaca , A. viridis y A. asperula . [97] Sin embargo, Asclepias curassavica , o algodoncillo tropical, se planta a menudo como ornamental en los jardines de mariposas. Las plantaciones durante todo el año en los EE. UU. son controvertidas y criticadas, ya que pueden ser la causa de nuevos sitios de hibernación a lo largo de la costa del Golfo de EE. UU., lo que lleva a la reproducción durante todo el año de las monarcas. [98] Se cree que esto afecta negativamente los patrones de migración y causa una acumulación dramática del peligroso parásito, Ophryocystis elektroscirrha . [99] Nuevas investigaciones también han demostrado que las larvas de la monarca criadas en algodoncillo tropical muestran un desarrollo migratorio reducido (diapausa reproductiva), y cuando los adultos migratorios están expuestos al algodoncillo tropical, estimula el crecimiento del tejido reproductivo. [100]

Aunque las larvas sólo comen algodoncillo, las monarcas adultas se alimentan del néctar de muchas plantas, entre ellas: [101]
Las monarcas obtienen humedad y minerales del suelo húmedo y de la grava mojada, un comportamiento conocido como encharcamiento . También se ha observado a la monarca encharcándose en una mancha de aceite en el pavimento. [71]
_on_Oyamel_fir_(Abies_religiosa)_Piedra_Herrada.jpg/440px-Monarch_butterflies_(Danaus_plexippus_plexippus)_on_Oyamel_fir_(Abies_religiosa)_Piedra_Herrada.jpg)

En América del Norte, las monarcas migran tanto al norte como al sur anualmente, haciendo viajes de larga distancia que están plagados de riesgos. [6] Se trata de una migración multigeneracional, en la que cada monarca solo realiza una parte del viaje completo. [103] La población al este de las Montañas Rocosas intenta migrar a los santuarios de la Reserva de la Biosfera Mariposa Monarca en el estado mexicano de Michoacán y partes de Florida. La población occidental intenta llegar a destinos de hibernación en varios sitios costeros en el centro y sur de California. La población que hibernó al este de las Montañas Rocosas puede llegar tan al norte como Texas y Oklahoma durante la migración de primavera. La segunda, tercera y cuarta generaciones regresan a sus ubicaciones del norte en los Estados Unidos y Canadá en la primavera. [104]
Las monarcas criadas en cautiverio parecen capaces de migrar a sitios de hibernación en México, [105] aunque tienen una tasa de éxito migratorio mucho menor que las monarcas salvajes (ver la sección sobre crianza en cautiverio a continuación). [106] Recientemente se han descubierto sitios de hibernación de monarcas en Arizona. [107] Las monarcas del este de los EE. UU. generalmente migran distancias más largas que las monarcas del oeste de los EE. UU. [108]
Desde el siglo XIX, las mariposas monarcas se han extendido por todo el mundo y ahora hay muchas poblaciones no migratorias en todo el mundo. [109]
La velocidad de vuelo de los adultos ronda los 9 km/h (6 mph). [110]
Tanto en forma de oruga como de mariposa, las monarcas son aposemáticas y se alejan de los depredadores con una exhibición brillante de colores contrastantes para advertirles de su sabor indeseable y sus características venenosas. Un investigador de la monarca enfatiza que la depredación de huevos, larvas o adultos es natural, ya que las monarcas son parte de la cadena alimentaria, por lo que las personas no deberían tomar medidas para matar a los depredadores de las monarcas. [111]
Las larvas se alimentan exclusivamente de algodoncillo y consumen glucósidos cardíacos protectores. Los niveles de toxinas en las especies de Asclepias varían. No todas las monarcas son desagradables al paladar, pero presentan batesias o automimismo . Los niveles de glucósidos cardíacos son más altos en el abdomen y las alas. Algunos depredadores pueden diferenciar entre estas partes y consumir las más agradables al paladar. [112]
La hierba de las mariposas ( A. tuberosa ) carece de cantidades significativas de glucósidos cardíacos (cardenólidos), pero en cambio contiene otros tipos de glucósidos tóxicos, incluyendo pregnanas . [113] Esta diferencia puede reducir la toxicidad de las monarcas cuyas larvas se alimentan de esa especie de algodoncillo y afectar las opciones de reproducción de la mariposa, ya que un naturalista y otros han informado que las monarcas que ponen huevos no favorecen la planta. [114] Algunas otras algodoncillos tienen características similares. [115]
Si bien las monarcas tienen una amplia gama de depredadores naturales, no se sospecha que ninguno de ellos cause daño a la población general ni sea la causa de la disminución a largo plazo del tamaño de las colonias de invierno.
Varias especies de aves han adquirido métodos que les permiten ingerir monarcas sin experimentar los efectos nocivos asociados con los glucósidos cardíacos ( cardenólidos ). El oropéndola de lomo negro puede comer a la monarca mediante una exaptación de su comportamiento alimentario que le da la capacidad de identificar los cardenólidos por el gusto y rechazarlos. [116] Sin embargo, el picogrueso de cabeza negra ha desarrollado una insensibilidad a los venenos secundarios de las plantas que le permite ingerir monarcas sin vomitar. [117] Como resultado, estos oropéndolas y picogruesos tienen periódicamente altos niveles de cardenólidos en sus cuerpos, y se ven obligados a pasar por períodos de consumo reducido de monarca. Este ciclo reduce efectivamente la depredación potencial de las monarcas en un 50% e indica que el aposematismo de la monarca tiene un propósito legítimo. [116] El picogrueso de cabeza negra también ha desarrollado mutaciones de resistencia en el objetivo molecular de los venenos del corazón, la bomba de sodio. Las mutaciones específicas que evolucionaron en una de las cuatro copias del gen de la bomba de sodio del picogrueso son las mismas que se encuentran en algunos roedores que también han evolucionado para resistir los glucósidos cardíacos. [118] Los depredadores de aves conocidos incluyen sinsontes pardos , mirlos , petirrojos , cardenales , gorriones , arrendajos californianos y arrendajos piñoneros . [112]
La forma blanca de la monarca apareció en Oahu después de la introducción en 1965-1966 de dos especies de aves bulbul , Pycnonotus cafer y Pycnonotus jocosus . En la actualidad, son los insectívoros aviares más comunes en Hawái y probablemente los únicos que comen insectos tan grandes como las monarcas. Aunque las monarcas hawaianas tienen niveles bajos de glucósidos cardíacos, las aves también pueden ser tolerantes a esa toxina. Las dos especies cazan las larvas y algunas pupas de las ramas y el envés de las hojas de los arbustos de algodoncillo. Los bulbuls también comen adultos en reposo y en puesta de huevos, pero rara vez comen adultos voladores. Debido a su color, la forma blanca tiene una mayor tasa de supervivencia que la naranja. Esto se debe a una selección apóstata (es decir, las aves han aprendido que las monarcas anaranjadas se pueden comer), al camuflaje (el morfo blanco coincide con la pubescencia blanca del algodoncillo o con los parches de luz que brillan a través del follaje) o porque el morfo blanco no se ajusta a la imagen que las aves buscan de una monarca típica, por lo que se evita. [119]
Algunos ratones, en particular el ratón de orejas negras ( Peromyscus melanotis ), son capaces, como todos los roedores, de tolerar grandes dosis de cardenólidos y pueden comer monarcas. [120] Los adultos que hibernan se vuelven menos tóxicos con el tiempo, lo que los hace más vulnerables a los depredadores. En México, alrededor del 14% de las monarcas que hibernan son devoradas por pájaros y ratones y los ratones de orejas negras pueden comer hasta 40 monarcas por noche. [70] [120]
En América del Norte, los huevos y las larvas de primer estadio de la monarca son devorados por las larvas y los adultos de la mariquita asiática introducida ( Harmonia axyridis ). [121] La mantis china ( Tenodera sinensis ) consumirá las larvas una vez que se les quite el intestino, evitando así los cardenólidos. [122] Las avispas depredadoras comúnmente consumen larvas. [123] Muchos insectos hemípteros, incluidas las chinches apestosas depredadoras de la subfamilia Asopinae y las chinches asesinas de la familia Reduviidae , comen monarcas. Las larvas a veces pueden evitar la depredación dejándose caer de la planta o sacudiendo sus cuerpos. [124]
Los parasitoides , incluidas las moscas taquínidas y las avispas bracónidas, se desarrollan dentro de la larva de la monarca y finalmente la matan, para luego emerger de la larva o pupa. Los parásitos no insectos y las enfermedades infecciosas ( patógenos ) también matan a las monarcas.
Las monarcas son tóxicas y tienen un sabor desagradable debido a la presencia de cardenólidos en sus cuerpos, que las orugas ingieren mientras se alimentan de algodoncillo. [59] Las monarcas y otros insectos resistentes a los cardenólidos dependen de una forma resistente de la enzima Na+/ K+-ATPasa para tolerar concentraciones significativamente más altas de cardenólidos que las especies no resistentes. [125] Al ingerir una gran cantidad de plantas del género Asclepias , principalmente algodoncillo, las orugas monarca pueden secuestrar glucósidos cardíacos, o más específicamente cardenólidos , que son esteroides que actúan de manera similar a la digital . [126] Se ha descubierto que las monarcas pueden secuestrar cardenólidos de manera más efectiva de plantas con un contenido intermedio de cardenólidos en lugar de aquellas con un contenido alto o bajo. [127] Se encontró que tres mutaciones que evolucionaron en la Na+/ K+-ATPasa de la monarca eran suficientes juntas para conferir resistencia a los glucósidos cardíacos de la dieta. [125] Esto se comprobó intercambiando estas mutaciones en el mismo gen en la mosca de la fruta Drosophila melanogaster mediante la edición del genoma CRISPR-Cas9 . Estas moscas de la fruta convertidas en monarcas [128] eran completamente resistentes a la ouabaína dietética , un glucósido cardíaco que se encuentra en las Apocynaceae , e incluso secuestraron algo a través de la metamorfosis, como la monarca. [125]
Las distintas especies de algodoncillo tienen diferentes efectos sobre el crecimiento, la virulencia y la transmisión de parásitos. [129] Una especie, Asclepias curassavica , parece reducir los síntomas de la infección por Ophryocystis elektroscirrha (OE). Las dos posibles explicaciones para esto incluyen que promueve la salud general de la monarca para estimular el sistema inmunológico de la monarca o que los químicos de la planta tienen un efecto negativo directo sobre los parásitos OE. [129] A. curassavica no cura ni previene la infección con OE; simplemente permite que las monarcas infectadas vivan más tiempo, y esto permitiría que las monarcas infectadas propaguen las esporas de OE durante períodos más largos. Para el jardín de mariposas doméstico promedio, este escenario solo agrega más OE a la población local. [130]
Una vez que la oruga se convierte en mariposa, las toxinas se desplazan a distintas partes del cuerpo. Dado que muchas aves atacan las alas de la mariposa, tener tres veces más glucósidos cardíacos en las alas deja a los depredadores con un sabor muy desagradable y puede impedirles ingerir el cuerpo de la mariposa. [126] Para combatir a los depredadores que sólo les quitan las alas para ingerir el abdomen, las monarcas mantienen los glucósidos cardíacos más potentes en el abdomen. [131]

Las monarcas comparten la defensa del sabor nocivo con la mariposa virrey, de apariencia similar , en lo que es quizás uno de los ejemplos más conocidos de mimetismo . Aunque durante mucho tiempo se ha afirmado que es un ejemplo de mimetismo batesiano , el virrey es en realidad más desagradable que la monarca, lo que lo convierte en un caso de mimetismo mülleriano . [132]
La monarca es el insecto estatal de Alabama , [133] Idaho , [134] Illinois , [135] Minnesota , [136] Texas , [137] Vermont , [138] y Virginia Occidental . [139] Se introdujo una legislación para convertirla en el insecto nacional de los Estados Unidos, [140] pero esta fracasó en 1989 [141] y nuevamente en 1991. [142]
Cada vez más propietarios de viviendas están creando jardines de mariposas; se puede atraer a las monarcas cultivando un jardín de mariposas con especies específicas de algodoncillo y plantas nectaríferas. Se están realizando esfuerzos para establecer estas estaciones de paso para las monarcas. [143]
La película IMAX de 2012, Flight of the Butterflies , describe la historia de los Urquhart , Brugger y Trail para documentar la entonces desconocida migración de la monarca a las áreas de hibernación mexicanas. [144]
Se han creado santuarios y reservas en lugares de hibernación en México y California para limitar la destrucción del hábitat . Estos sitios pueden generar ingresos significativos por turismo. [145] Sin embargo, con menos turismo, las mariposas monarca pueden exhibir tasas de supervivencia más altas, ya que las mariposas en áreas aisladas del turismo han mostrado aumentos en el contenido de proteínas, la respuesta inmune y la defensa oxidativa. [146]
Organizaciones e individuos participan en programas de etiquetado. La información obtenida se utiliza para estudiar los patrones de migración. [147]
La novela de 2012 de Barbara Kingsolver , Flight Behavior , trata sobre la aparición ficticia de una gran población en los Apalaches . [148]
Los humanos interactúan con las monarcas cuando las crían en cautiverio, lo que se ha vuelto cada vez más popular. Sin embargo, existen riesgos en esta actividad controvertida. Por un lado, la crianza en cautiverio tiene muchos aspectos positivos. Las monarcas se crían en escuelas y se utilizan para liberaciones de mariposas en hospicios, eventos conmemorativos y bodas. [149] Los servicios conmemorativos por los ataques del 11 de septiembre incluyen la liberación de monarcas criadas en cautiverio. [150] Las monarcas se utilizan en escuelas y centros naturales con fines educativos. [151] Muchos propietarios crían monarcas en cautiverio como pasatiempo y con fines educativos. [152] Las monarcas nacidas en cautiverio son amigables con los humanos y es un placer jugar con ellas (https://www.youtube.com/watch?v=3brZuY-yWh0). Es posible que sea necesario enseñarles a alimentarse con alimentos artificiales (https://www.youtube.com/shorts/5KH3NLDaRvU).
Por otra parte, esta práctica se vuelve problemática cuando las monarcas son “criadas en masa”. Los artículos publicados en el Huffington Post en 2015 y en la revista Discover en 2016 han resumido la controversia en torno a esta cuestión. [153]
Los frecuentes informes de los medios de comunicación sobre la disminución de la población de monarcas han animado a muchos propietarios a intentar criar tantas monarcas como sea posible en sus hogares y luego liberarlas en la naturaleza en un esfuerzo por "aumentar la población de monarcas". Algunas personas, como una en el condado de Linn, Iowa , han criado miles de monarcas al mismo tiempo. [154]
Algunos científicos que estudian la monarca no aprueban la práctica de criar "grandes" cantidades de monarcas en cautiverio para liberarlas en la naturaleza debido a los riesgos de problemas genéticos y propagación de enfermedades. [155] Una de las mayores preocupaciones de la cría en masa es la posibilidad de propagar el parásito de la monarca, Ophryocystis elektroscirrha , en la naturaleza. Este parásito puede acumularse rápidamente en las monarcas cautivas, especialmente si se las aloja juntas. Las esporas del parásito también pueden contaminar rápidamente todo el equipo de alojamiento, de modo que todas las monarcas posteriores criadas en los mismos contenedores se infecten. Un investigador afirmó que la cría de más de 100 monarcas constituye una "cría en masa" y no debería realizarse. [156]
Además de los riesgos de enfermedades, los investigadores creen que estas monarcas criadas en cautiverio no están tan en forma como las salvajes, debido a las condiciones antinaturales en las que se crían. Los propietarios de viviendas a menudo crían a las monarcas en recipientes de plástico o vidrio en sus cocinas, sótanos, porches, etc., y bajo iluminación artificial y temperaturas controladas. Tales condiciones no imitarían las que las monarcas están acostumbradas en la naturaleza y pueden dar lugar a adultos que no sean aptos para las realidades de su existencia salvaje. En apoyo de esto, un estudio reciente realizado por un científico ciudadano descubrió que las monarcas criadas en cautiverio tienen una tasa de éxito migratorio menor que las monarcas salvajes. [106]
Un estudio de 2019 arrojó luz sobre la aptitud física de las monarcas criadas en cautiverio, al probar a las monarcas criadas y salvajes en un aparato de vuelo atado que evaluaba la capacidad de navegación. [157] En ese estudio, las monarcas que fueron criadas hasta la edad adulta en condiciones artificiales mostraron una reducción en la capacidad de navegación. Esto sucedió incluso con las monarcas que fueron traídas al cautiverio desde la naturaleza durante unos días. Algunas monarcas criadas en cautiverio mostraron una navegación adecuada. Este estudio reveló la fragilidad del desarrollo de las monarcas; si las condiciones no son adecuadas, su capacidad para migrar adecuadamente podría verse afectada. El mismo estudio también examinó la genética de una colección de monarcas criadas compradas a un criador de mariposas, y descubrió que eran dramáticamente diferentes de las monarcas salvajes, tanto que el autor principal las describió como "monarcas Frankenstein". [158]
Un estudio inédito de 2019 comparó el comportamiento de las larvas de monarca criadas en cautiverio con el de las silvestres. [159] El estudio mostró que las larvas criadas exhibieron un comportamiento más defensivo que las larvas silvestres. Se desconoce el motivo de esto, pero podría estar relacionado con el hecho de que las larvas criadas son manipuladas y/o perturbadas con frecuencia.
En febrero de 2015, el Servicio de Pesca y Vida Silvestre de Estados Unidos informó sobre un estudio que mostraba que casi mil millones de mariposas monarca habían desaparecido de sus sitios de hibernación desde 1990. La agencia atribuyó el declive de la mariposa monarca en parte a una pérdida de algodoncillo causada por herbicidas que habían utilizado los agricultores y los propietarios de viviendas. [160]

Según una comparación de 20 años de 2014, las cifras de hibernación al oeste de las Montañas Rocosas han disminuido más del 50% desde 1997 y las cifras de hibernación al este de las Montañas Rocosas han disminuido más del 90% desde 1995. Según la Xerces Society , la población de monarcas en California disminuyó un 86% en 2018, pasando de millones de mariposas a decenas de miles de mariposas. [161]
El recuento anual de invierno 2020-2021 de la sociedad mostró una disminución significativa en la población de California. En un sitio de Pacific Grove no había ni una sola mariposa monarca. Una explicación principal de esto fue la destrucción de los hábitats de algodoncillo de la mariposa. [24] [162] Se cree que esta población en particular comprende menos de 2000 individuos, a partir de 2022. [actualizar][ 163]

Un estudio de 2016 atribuyó la disminución del 90% de la población de monarcas orientales que hibernaron durante la década anterior principalmente a la pérdida del hábitat de reproducción y de algodoncillo. Los autores de la publicación afirmaron que existía una probabilidad del 11% al 57% de que esta población se "cuasi-extinguiera" en los próximos 20 años (es decir, que no pudiera mantener una población estable). [164] Otras amenazas identificadas en el estudio incluyen el cambio climático, los insecticidas y las enfermedades. [164]
Chip Taylor, director de Monarch Watch en la Universidad de Kansas , declaró en 2013 que el hábitat de algodoncillo del Medio Oeste "prácticamente ha desaparecido" con 120-150 millones de acres perdidos. [165] [166] Sin embargo, predijo en 2024 que en el futuro inmediato y quizás en las próximas dos décadas, la población de mariposas monarca del este será relativamente estable porque actualmente no está en una tendencia descendente continua como lo fue entre 2000 y 2006. [97] Para ayudar a combatir la disminución de la población, Monarch Watch fomenta la plantación de "estaciones de paso para monarcas". [152]
La disminución de la abundancia de algodoncillo y de las poblaciones de monarca entre 1999 y 2010 se correlaciona con la adopción de maíz y soja genéticamente modificados (GM) tolerantes a herbicidas, que ahora constituyen el 89% y el 94% de estos cultivos, respectivamente, en los EE. UU. [164] El maíz y la soja GM son resistentes al efecto del herbicida glifosato . Algunos conservacionistas atribuyen la desaparición del algodoncillo a las prácticas agrícolas en el Medio Oeste , donde las semillas GM se crían para resistir los herbicidas que los agricultores usan para matar plantas no deseadas que crecen cerca de sus hileras de cultivos alimentarios. [167] [168]
En 2015, el Consejo de Defensa de los Recursos Naturales presentó una demanda contra la Agencia de Protección Ambiental de los Estados Unidos (EPA). El Consejo argumentó que la agencia ignoró las advertencias sobre los peligros del uso de glifosato para las mariposas monarca. [169] Sin embargo, un estudio de 2018 sugirió que la disminución de la algodoncillo es anterior a la llegada de los cultivos transgénicos. [170]

Las mariposas monarca del este y del medio oeste aparentemente están experimentando problemas para llegar a México. Varios investigadores de la mariposa monarca han citado evidencia reciente obtenida a partir de datos científicos ciudadanos de largo plazo que muestran que el número de mariposas monarca en etapa de reproducción (adultas) no ha disminuido en las últimas dos décadas. [171] [172] [173]
La ausencia de descensos a largo plazo en el número de monarcas reproductoras y migratorias, pero sí los claros descensos en el número de monarcas que hibernan, sugieren que existe una creciente desconexión entre estas etapas de la vida. Un investigador ha sugerido que la mortalidad por colisiones con automóviles constituye una amenaza cada vez mayor para las monarcas migratorias. [174] Un estudio sobre la mortalidad en las carreteras del norte de México, publicado en 2019, mostró una mortalidad muy alta en solo dos "puntos críticos" cada año, que asciende a 200.000 monarcas muertas. [175]
El área de bosque mexicano al que migran las monarcas del este y medio oeste alcanzó su nivel más bajo en dos décadas en 2013. Se esperaba que la disminución aumentara durante la temporada 2013-2014. Las autoridades ambientales mexicanas continúan monitoreando la tala ilegal de los árboles de oyamel ; sin embargo, los criminales organizados han aplastado repetidamente tales esfuerzos en nombre de ganancias financieras a muy corto plazo. [176] El oyamel es una especie importante de hoja perenne en la que las mariposas que hibernan pasan un tiempo significativo durante su diapausa invernal o desarrollo suspendido. [177]
Un estudio de 2014 reconoció que si bien "la protección del hábitat de hibernación sin duda ha contribuido en gran medida a la conservación de las monarcas que se reproducen en todo el este de América del Norte", su investigación indica que la pérdida de hábitat en las zonas de reproducción de los Estados Unidos es la principal causa de las disminuciones poblacionales recientes y proyectadas. [178]
Las poblaciones de monarcas occidentales se han recuperado ligeramente desde 2014; el recuento de monarcas occidentales del Día de Acción de Gracias [179] registró 335 479 monarcas en 2022. La población aún tiene mucho camino por recorrer para recuperarse por completo.

Los parásitos incluyen las moscas taquínidas Sturmia convergens [180] y Lespesia archippivora . Las larvas de mariposa parasitadas por Lesperia se suspenden, pero mueren antes de la pupación . La larva de la mosca desciende al suelo, forma un pupario marrón y luego emerge como un adulto. [181]
Las avispas pteromalidas , específicamente Pteromalus cassotis , parasitan las pupas de la monarca. [182] Estas avispas ponen sus huevos en las pupas mientras la crisálida aún está blanda. Hasta 400 adultos emergen de la crisálida después de 14 a 20 días, [182] matando a la monarca.
La bacteria Micrococcus flacidifex danai también infecta a las larvas. Justo antes de la pupa, las larvas migran a una superficie horizontal y mueren unas horas más tarde, unidas sólo por un par de propatas, con el tórax y el abdomen colgando flácidos. El cuerpo se vuelve negro poco después. La bacteria Pseudomonas aeruginosa no tiene poderes invasivos, pero causa infecciones secundarias en insectos debilitados. Es una causa común de muerte en insectos criados en laboratorio. [181]
Ophryocystis elektroscirrha es otro parásito de la monarca. Infecta los tejidos subcutáneos y se propaga por esporas formadas durante la etapa de pupa. Las esporas se encuentran en todo el cuerpo de las mariposas infectadas, con la mayor cantidad en el abdomen. Estas esporas se transmiten, de la hembra a la oruga , cuando las esporas se desprenden durante la puesta de huevos y luego son ingeridas por las orugas. Los individuos gravemente infectados son débiles, incapaces de expandir sus alas o incapaces de eclosionar, y tienen una esperanza de vida más corta, pero los niveles de parásitos varían en las poblaciones. Este no es el caso en la cría en laboratorio, donde después de unas pocas generaciones, todos los individuos pueden estar infectados. [183]
La infección con O. elektroscirrha crea un efecto conocido como sacrificio selectivo , por el cual las monarcas migratorias que están infectadas tienen menos probabilidades de completar la migración. Esto da como resultado poblaciones que hibernan con cargas de parásitos más bajas. [184] Los propietarios de operaciones comerciales de cría de mariposas afirman que toman medidas para controlar este parásito en sus prácticas, [185] aunque esta afirmación es puesta en duda por muchos científicos que estudian a las monarcas. [186]
Las plantas Cynanchum louiseae y Cynanchum rossicum son problemáticas para las monarcas en América del Norte. Las monarcas ponen sus huevos en estos parientes de la algodoncillo trepador nativa ( Cynanchum laeve ) porque producen estímulos similares al algodoncillo. Una vez que los huevos eclosionan, las orugas se envenenan por la toxicidad de esta planta invasora de Europa. [187]
Las variaciones climáticas durante el otoño y el verano afectan la reproducción de las mariposas. Las lluvias y las temperaturas heladas afectan el crecimiento de las algodoncillos. Omar Vidal, director general de WWF-México, dijo: "El ciclo de vida de la monarca depende de las condiciones climáticas de los lugares donde se reproduce. Los huevos, larvas y pupas se desarrollan más rápidamente en condiciones más suaves. Las temperaturas superiores a los 35 °C (95 °F) pueden ser letales para las larvas, y los huevos se secan en condiciones cálidas y áridas, lo que provoca una disminución drástica en la tasa de eclosión". [188] Si la temperatura corporal de una monarca es inferior a 30 °C (86 °F), no puede volar. Para calentarse, se sienta al sol o agita rápidamente sus alas para calentarse. [189]
El cambio climático puede afectar dramáticamente la migración de la mariposa monarca. Un estudio de 2015 examinó el impacto del aumento de las temperaturas en el área de reproducción de la mariposa monarca y mostró que en los próximos 50 años la planta hospedante de la mariposa monarca expandirá su área de reproducción más al norte, hacia Canadá, y que las mariposas monarca seguirán este ejemplo. [190] Si bien esto ampliará los lugares de reproducción de la mariposa monarca, también tendrá el efecto de aumentar la distancia que deben recorrer las mariposas monarca para llegar a su destino de hibernación en México, lo que podría resultar en una mayor mortalidad durante la migración. [191]
Se ha demostrado que las algodoncillos cultivados a temperaturas elevadas contienen mayores concentraciones de cardenolidos, lo que hace que las hojas sean demasiado tóxicas para las orugas de la mariposa monarca. Sin embargo, es probable que estas mayores concentraciones sean una respuesta al aumento de la herbivoría de los insectos, que también es causada por el aumento de las temperaturas. Se desconoce si el aumento de las temperaturas hace que el algodoncillo sea demasiado tóxico para las orugas de la mariposa monarca cuando no hay otros factores presentes. [192] Además, se descubrió que el algodoncillo cultivado a niveles de dióxido de carbono de 760 partes por millón producía una mezcla diferente de los cardenolidos tóxicos, uno de los cuales era menos eficaz contra los parásitos de la mariposa monarca. [193]
El 20 de julio de 2022, la Unión Internacional para la Conservación de la Naturaleza añadió a la mariposa monarca migratoria (la subespecie común en América del Norte) a su lista roja como especie en peligro de extinción. [194] Sin embargo, una petición en 2023 dio como resultado que su estado se cambiara a "vulnerable". [2]
La mariposa monarca no está actualmente incluida en la lista de la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres ni protegida específicamente por las leyes internas de los Estados Unidos. [195]
El 14 de agosto de 2014, el Centro para la Diversidad Biológica y el Centro para la Seguridad Alimentaria presentaron una petición legal solicitando la protección de la Ley de Especies en Peligro de Extinción para la mariposa monarca y su hábitat, [24] basándose principalmente en las tendencias a largo plazo observadas en los sitios de hibernación. El Servicio de Pesca y Vida Silvestre de los Estados Unidos (FWS) inició una revisión del estado de la mariposa monarca en virtud de la Ley de Especies en Peligro de Extinción con una fecha límite para la presentación de información del 3 de marzo de 2015, que luego se extendió hasta 2020.
El 15 de diciembre de 2020, el FWS dictaminó que la adición de la mariposa a la lista de especies amenazadas y en peligro de extinción estaba "justificada, pero prohibida" porque necesitaba dedicar sus recursos a 161 especies de mayor prioridad. [196] El 27 de junio de 2023, el FWS publicó en el Registro Federal un Aviso de propuesta de reglamentación para una regla que le daría a la mariposa monarca un número de prioridad de inclusión (LPN) de 8 para agregar su especie a esa lista. [197] Los LPN varían de 1 a 12 (cuanto menor sea el LPN, mayor será la prioridad de inclusión). [198]
El número de monarcas que hibernan en México ha mostrado una tendencia descendente a largo plazo. Desde 1995, las cifras de cobertura han sido tan altas como 18 hectáreas (44 acres) durante el invierno de 1996-1997, pero en promedio alrededor de 6 hectáreas (15 acres). La cobertura disminuyó a su punto más bajo hasta la fecha (0,67 hectáreas (1,66 acres)) durante el invierno de 2013-2014, pero se recuperó a 4,01 hectáreas (10 acres) en 2015-2016. La población promedio de monarcas en 2016 se estimó en 200 millones. Históricamente, en promedio hay 300 millones de monarcas. El aumento de 2016 se atribuyó a condiciones de reproducción favorables en el verano de 2015. Sin embargo, la cobertura disminuyó en un 27% a 2,91 hectáreas (7,19 acres) durante el invierno de 2016-2017. Algunos creen que esto se debió a una tormenta que ocurrió durante marzo de 2016 en la temporada de hibernación anterior de las monarcas, [199] aunque esto parece poco probable ya que la mayoría de las investigaciones actuales muestran que los tamaños de las colonias de hibernación no predicen el tamaño de la próxima población reproductora de verano. [200]
En Ontario , Canadá, la mariposa monarca está catalogada como una especie de especial preocupación. [201] En el otoño de 2016, el Comité sobre el Estado de la Vida Silvestre en Peligro de Extinción en Canadá propuso que la monarca se clasificara como especie en peligro de extinción en Canadá, en lugar de su clasificación actual como una "especie de preocupación" en ese país. Esta medida, una vez promulgada, protegería el hábitat crítico de la monarca en Canadá, como las principales áreas de acumulación de otoño en el sur de Ontario, pero también tendría implicaciones para los científicos ciudadanos que trabajan con monarcas y para las actividades en las aulas. Si la monarca estuviera protegida a nivel federal en Canadá, estas actividades podrían estar limitadas o requerir permisos federales. [202]
En Nueva Escocia, la monarca está catalogada como en peligro a nivel provincial, a partir de 2017. [update]Esta decisión (así como la decisión de Ontario) aparentemente se basa en la presunción de que las disminuciones de las colonias de hibernación en México crean disminuciones en el área de reproducción en Canadá. [203] Se han realizado dos estudios recientes que examinan las tendencias a largo plazo en la abundancia de la monarca en Canadá, utilizando registros del atlas de mariposas [204] o encuestas de mariposas de ciencia ciudadana, [205] y ninguno muestra evidencia de una disminución de la población en Canadá.
Aunque el número de monarcas reproductores en el este de América del Norte aparentemente no ha disminuido, los informes sobre la disminución del número de mariposas que hibernan han inspirado esfuerzos para conservar la especie. [171] [172] [173]
El 20 de junio de 2014, el presidente Barack Obama emitió un memorando presidencial titulado "Creación de una estrategia federal para promover la salud de las abejas y otros polinizadores". El memorando estableció un grupo de trabajo sobre la salud de los polinizadores, que sería copresidido por el secretario de Agricultura y el administrador de la Agencia de Protección Ambiental , y establecía lo siguiente:
El número de mariposas monarca migratorias se redujo al nivel de población más bajo registrado en 2013-2014, y existe un riesgo inminente de que la migración fracase. [206]
La Administración de Servicios Generales de los Estados Unidos (GSA) publica conjuntos de requisitos de desempeño paisajístico en sus documentos P100, que establecen normas para el Servicio de Edificios Públicos de la GSA. A partir de marzo de 2015, esos requisitos de desempeño y sus actualizaciones han incluido cuatro aspectos principales para los diseños de plantación que tienen como objetivo brindar oportunidades adecuadas de alimentación en el sitio para los polinizadores objetivo. Los polinizadores objetivo incluyen abejas, mariposas y otros insectos beneficiosos. [207]
En mayo de 2015, el Grupo de Trabajo sobre la Salud de los Polinizadores publicó una "Estrategia nacional para promover la salud de las abejas y otros polinizadores". La estrategia establecía medidas federales para lograr tres objetivos, dos de los cuales eran:
- Mariposas Monarca: Aumentar la población oriental de la mariposa monarca a 225 millones de mariposas ocupando un área de aproximadamente 15 acres (6 hectáreas) en las zonas de hibernación en México, a través de acciones nacionales e internacionales y asociaciones público-privadas, para 2020.
- Superficie destinada al hábitat de los polinizadores: restaurar o mejorar 7 millones de acres de tierra para los polinizadores durante los próximos 5 años a través de acciones federales y asociaciones público-privadas. [208] [209]
Muchos de los proyectos prioritarios que identificó la Estrategia Nacional se centraron en el corredor I-35 , que se extiende a lo largo de 2.400 kilómetros desde Texas hasta Minnesota. La zona por la que pasa esa autopista proporciona hábitats de reproducción de primavera y verano en el corredor migratorio clave de la mariposa monarca en los Estados Unidos. [208] [209]
El Grupo de Trabajo publicó simultáneamente un "Plan de acción para la investigación sobre polinizadores". El Plan esbozaba cinco áreas de acción principales, abarcadas en diez capítulos temáticos específicos. Las áreas de acción eran: (1) Establecer una línea de base; (2) Evaluar los factores de estrés ambiental; (3) Restaurar el hábitat; (4) Comprender y apoyar a las partes interesadas; (5) Conservar y compartir el conocimiento. [209] [210]
En mayo de 2015, el Departamento de Agricultura de los Estados Unidos (USDA) y el Departamento del Interior de los Estados Unidos (USDI) publicaron un documento de 52 páginas titulado "Pollinator-Friendly Best Management Practices for Federal Lands" (Mejores prácticas de gestión favorables a los polinizadores para tierras federales). El documento consolidó información general sobre las prácticas y procedimientos que se deben utilizar al considerar las necesidades de los polinizadores en el desarrollo de proyectos y la gestión de tierras federales que se gestionan para la diversidad nativa y usos múltiples. El documento también contenía una serie de acciones que se deben considerar al determinar las tierras más adecuadas para la restauración y rehabilitación del hábitat de la mariposa monarca. Estas incluían una garantía de que las flores silvestres nativas están disponibles, son diversas y abundantes para proporcionar néctar a las mariposas monarca, y una garantía de que las especies de algodoncillo que las mariposas monarca prefieren para la puesta de huevos están disponibles o se plantarán. El documento identificó esas especies de algodoncillo para cada una de las siete regiones dentro de los Estados Unidos. [211]
El 4 de diciembre de 2015, el presidente Obama promulgó la Ley de Reparación del Transporte Terrestre de Estados Unidos (FAST, por sus siglas en inglés) (Pub. L. 114-94). [212] La Ley FAST puso un nuevo énfasis en los esfuerzos para apoyar a los polinizadores. Para lograrlo, la Ley FAST modificó el Título 23 (Carreteras) del Código de los Estados Unidos . La enmienda ordenó al Secretario de Transporte de los Estados Unidos que , al llevar a cabo programas bajo ese título en conjunto con estados dispuestos,:
La Ley FAST también estableció que las actividades para establecer y mejorar el hábitat de los polinizadores, el forraje y las estaciones de paso migratorios pueden ser elegibles para recibir fondos federales si están relacionadas con proyectos de transporte financiados bajo el Título 23. [213]
En febrero de 2016, la Oficina del Secretario del Interior emitió un memorando que contenía un anexo titulado "Estrategia para la implementación de un diseño y mantenimiento de paisajes favorables a los polinizadores en los sitios del Departamento del Interior". El anexo describía acciones específicas que abordarían la incorporación de un diseño y mantenimiento de paisajes favorables a los polinizadores en las nuevas construcciones y renovaciones importantes, los sitios existentes, los contratos, los arrendamientos y los acuerdos de ocupación, y los programas de educación y divulgación. El memorando que contenía el anexo ordenaba a las oficinas y departamentos del USDI (que incluyen la Oficina de Gestión de Tierras y el Servicio de Parques Nacionales ) que implementaran esas acciones en la medida en que fueran apropiadas y coherentes con la misión y la función de la instalación/sitio. [214]
En junio de 2016, el Grupo de Trabajo sobre la Salud de los Polinizadores publicó un "Plan de Acción de Asociación para los Polinizadores". Ese Plan ofrecía ejemplos de colaboraciones pasadas, actuales y futuras entre el gobierno federal e instituciones no federales para apoyar la salud de los polinizadores en el marco de cada uno de los objetivos de la Estrategia Nacional. [215]
La Agencia de Servicios Agrícolas del USDA ayuda a aumentar las poblaciones estadounidenses de mariposas monarca y otros polinizadores a través de la Iniciativa de Acres Estatales para la Mejora de la Vida Silvestre (SAFE, por sus siglas en inglés) de su Programa de Reservas de Conservación . La Iniciativa SAFE proporciona un pago de alquiler anual a los agricultores que aceptan retirar tierras ambientalmente sensibles de la producción agrícola y que plantan especies que mejorarán la salud y la calidad ambientales. Entre otras cosas, la iniciativa alienta a los propietarios de tierras a establecer humedales, pastos y árboles para crear hábitats para las especies que el FWS ha designado como amenazadas o en peligro de extinción. [216]
Como parte de su esfuerzo dirigido a la mariposa monarca, el Servicio de Conservación de Recursos Naturales (NRCS, por sus siglas en inglés) del USDA trabaja con productores agrícolas del medio oeste y las Grandes Llanuras del sur para combatir la disminución de las mariposas monarca plantando algodoncillo y otras plantas ricas en néctar en tierras privadas. El NRCS también proporciona guías y listas de plantas específicas para cada región que apoyan a las poblaciones de mariposas monarca y otros polinizadores en la región de los Grandes Apalaches, la región del medio oeste, las Grandes Llanuras del norte y del sur y la llanura costera occidental. [217]
Se está pidiendo a las empresas agrícolas y a otras organizaciones que reserven áreas que no hayan sido fumigadas para permitir que las mariposas monarcas se reproduzcan. Además, se están llevando a cabo iniciativas nacionales y locales para ayudar a establecer y mantener hábitats de polinizadores a lo largo de corredores que contienen líneas eléctricas y carreteras. La Administración Federal de Carreteras , los gobiernos estatales y las jurisdicciones locales están alentando a los departamentos de carreteras y a otros a limitar el uso de herbicidas, reducir el corte de césped, ayudar al crecimiento de la algodoncillo y alentar a las mariposas monarcas a reproducirse dentro de sus derechos de paso. [168] [218]
En 2020, el Programa Nacional de Investigación Cooperativa de Carreteras (NCHRP, por sus siglas en inglés) de la Junta de Investigación del Transporte publicó un informe de 208 páginas que describía un proyecto que había examinado el potencial de los corredores viales para proporcionar hábitat a las mariposas monarca. Una parte del proyecto desarrolló herramientas para que los administradores de carreteras optimizaran el hábitat potencial de las mariposas monarca en sus derechos de paso. [219]
Estos esfuerzos son controvertidos porque el riesgo de mortalidad de las mariposas cerca de las carreteras es alto. Varios estudios han demostrado que los vehículos de motor matan a millones de monarcas y otras mariposas cada año. [174] Además, algunas evidencias indican que las larvas de monarca que viven cerca de las carreteras experimentan condiciones de estrés fisiológico, como lo demuestra el aumento de su frecuencia cardíaca. [220]
El informe del NCHRP reconoció que, entre otros peligros, las carreteras presentan un peligro de colisiones de tráfico para las monarcas, afirmando que estos efectos parecen estar más concentrados en determinadas zonas de embudo durante la migración. [221] Sin embargo, el informe concluyó:
En resumen, existen amenazas a lo largo de los corredores viales para las monarcas y otros polinizadores, pero en el contexto de la cantidad de hábitat necesaria para la recuperación de poblaciones sostenibles, los bordes de las carreteras son de vital importancia. [221]

Se cree comúnmente que la práctica de la jardinería de mariposas y la creación de "estaciones de paso para la monarca" aumenta las poblaciones de mariposas. [222] Los esfuerzos para restaurar las poblaciones de monarca en descenso mediante el establecimiento de jardines de mariposas y estaciones de paso para la monarca requieren una atención particular a las preferencias alimentarias de la mariposa y a los ciclos poblacionales, así como a las condiciones necesarias para propagar y mantener el algodoncillo. [223]
Por ejemplo, en el área de Washington, DC , y en otras partes del noreste y medio oeste de los Estados Unidos, la algodoncillo común ( Asclepias syriaca ) es una de las plantas alimenticias más importantes para las orugas monarca. [224] Una guía de plantación de conservación del Departamento de Agricultura de los EE. UU. para Maryland recomienda que, para un hábitat óptimo para la vida silvestre y los polinizadores en sitios mesicos (especialmente para las monarcas), una mezcla de semillas debe contener 6,0% de A. syriaca por peso y 2,0% por semilla. [225]
Sin embargo, las monarcas prefieren poner huevos en A. syriaca cuando su follaje es suave y fresco. Debido a que la reproducción de la monarca alcanza su pico en esas áreas durante el final del verano cuando el follaje de la algodoncillo es viejo y duro, A. syriaca necesita ser segada o podada entre junio y agosto para asegurar que volverá a crecer rápidamente cuando la reproducción de la monarca alcance su pico. Existen condiciones similares para el algodoncillo vistoso ( A. speciosa ) en Michigan y para el algodoncillo cuerno de antílope verde ( A. viridis ), donde crece en las Grandes Llanuras del Sur y el Oeste de los Estados Unidos . [76] [226] Además, las semillas de A. syriaca y algunas otras algodoncillos necesitan períodos de tratamiento en frío ( estratificación en frío ) antes de que germinen. [227]
Para proteger las semillas de las lluvias intensas y de los pájaros que se las comen, se pueden cubrir con una tela ligera o con una capa de 13 mm (0,5 pulgadas) de mantillo de paja . [228] Sin embargo, el mantillo actúa como aislante . Las capas más gruesas de mantillo pueden impedir que las semillas germinen si impiden que la temperatura del suelo aumente lo suficiente cuando termina el invierno. Además, pocas plántulas pueden atravesar una capa gruesa de mantillo. [229]
Aunque las orugas de la monarca se alimentan de la hierba de las mariposas ( A. tuberosa ) en los jardines de mariposas, normalmente no es una planta hospedante muy utilizada por la especie. [230] La planta tiene hojas ásperas y una capa de tricomas , que pueden inhibir la oviposición o disminuir la capacidad de la hembra para detectar los químicos de las hojas. [231] [232] Los bajos niveles de cardenólidos de la planta también pueden disuadir a las monarcas de poner huevos en la planta. [233] Si bien las coloridas flores de A. tuberosa proporcionan néctar para muchas mariposas adultas, la planta puede ser menos adecuada para su uso en jardines de mariposas y estaciones de paso de monarcas que otras especies de algodoncillo. [231]
Las monarcas en etapa de reproducción prefieren poner huevos en algodoncillo de pantano ( A. incarnata ). [234] Sin embargo, A. incarnata es una planta de sucesión temprana que generalmente crece en los márgenes de humedales y en áreas inundadas estacionalmente. La planta se propaga lentamente a través de semillas, no se propaga por estolones y tiende a desaparecer a medida que aumentan las densidades vegetativas y los hábitats se secan. [235] Aunque las plantas de A. incarnata pueden sobrevivir hasta 20 años, la mayoría vive solo de dos a cinco años en jardines. La especie no tolera la sombra y no es un buen competidor vegetativo. [235]
Linneo, por una razón fantasiosa, le dio a este insecto el nombre de Plexippus . Este es su nombre específico, por el que se distingue de todas las demás mariposas. Pertenece al género Anosia . El género Anosia es uno de los géneros que componen la subfamilia de las Euplœinæ. Las Euplœinæ pertenecen a la gran familia de las Nymphalidæ. Las Nymphalidæ son parte del suborden de los Rhopalocera, o mariposas verdaderas, una de las dos grandes subdivisiones del orden Lepidoptera, perteneciente a la gran clase Insecta, la clase más alta del subreino de los Arthropoda. (página 63)
Las principales plantas hospedantes de la monarca puertorriqueña son el algodoncillo rojo ( Asclepias curassavica ), que es originaria de América del Norte y del Sur, y el algodoncillo gigante ( Calotropis procera ), que es originaria de Europa.
A diferencia de otras algodoncillos, esta planta tiene una savia clara y el nivel de glucósidos cardíacos tóxicos es constantemente bajo (aunque puede haber otros compuestos tóxicos presentes).
El látex de A. tuberosa parece ser diferente al de otras especies de Asclepias debido al hecho de que, aunque los cardenólidos están normalmente presentes en las especies de Asclepias , estos cardenólidos no se han encontrado en A. tuberosa . En cambio, algunos glucósidos de pregnano únicos se encuentran en A. tuberosa .
Aunque se considera que los cardenólidos son componentes característicos de Asclepias spp. junto con los glicósidos de pregnano, no pudimos encontrar cardenólidos en la fracción más hidrófoba del extracto de metanol de las partes aéreas de A. tuberosa , al igual que anteriormente.
Y si tiene condiciones cálidas y secas en su jardín, pruebe con la hierba mariposa ( A. tuberosa ). ... Es la menos favorecida por las orugas monarca porque tiene muy poca toxina (glucósidos cardíacos) en sus hojas.
( A. tuberosa ) es la menos favorecida por las orugas de la monarca ... porque tiene muy poca toxina (glucósidos cardíacos) en sus hojas.
Hojas ásperas para las orugas de la mariposa monarca, no suele ser una planta hospedante muy utilizada
He cultivado algodoncillo de pantano, algodoncillo de pantano, Asclepias currassavica (flor de sangre), Asclepias syriaca (algodoncillo común) y Asclepias verticillata (algodoncillo verticilado). He descubierto que el algodoncillo de pantano es la planta menos favorita de mis huéspedes monarca en mi jardín de Virginia Beach para poner huevos (¿quizás las hojas son más duras?).
En nuestro estudio, las especies de algodoncillo menos preferidas, A. tuberosa (sin elección; Fig. 2) y A. verticillata (elección; Fig. 3A), tienen niveles bajos de cardenolida registrados en la literatura (Roeske et al. 1976, Agrawal et al. 2009, 2015, Rasmann y Agrawal 2011)
En nuestro estudio, las especies de algodoncillo menos preferidas,
A. tuberosa
(sin elección; Fig. 2) y
A. verticillata
(elección; Fig. 3A), tienen niveles bajos de cardenolida registrados en la literatura (Roeske et al. 1976, Agrawal et al. 2009, 2015, Rasmann y Agrawal 2011)
Los virreyes son tan desagradables al paladar como las monarcas, y significativamente más desagradables que las reinas de poblaciones representativas de Florida.
El Servicio de Pesca y Vida Silvestre (FWS) determinó que agregar la mariposa a la lista de especies amenazadas y en peligro de extinción estaba "justificado", pero que no puede hacerlo porque necesita dedicar sus recursos a especies de mayor prioridad. El FWS dijo que su determinación de "justificado pero excluido" significa que cada año considerará agregar la mariposa a la lista hasta que decida proponer su inclusión o determine que las protecciones no están justificadas.
El P100 es un estándar obligatorio. No es una guía, libro de texto, manual, manual de capacitación ni un sustituto de la competencia técnica. El P100 representa el estado actual de la práctica en el diseño de instalaciones para cumplir con los compromisos de GSA, maximizar la eficiencia de los procesos comerciales y cumplir con los requisitos de la ley.
(c) Fomento del desarrollo yprotección de hábitats y forrajes para polinizadores en los derechos de paso de transporte.— Al llevar a cabo cualquier programa administrado por el Secretario en virtud de este título, el Secretario, en conjunto con los Estados
que lo deseen, según corresponda,(
1)
fomentará prácticas integradas de gestión de la vegetación en los costados de las carreteras y otros derechos de paso de transporte, incluida la reducción del corte de césped; y
(2)
fomentará el desarrollo de hábitat y forrajes para las mariposas monarca, otros polinizadores nativos y abejas melíferas mediante plantaciones de hierbas y pastos nativos, incluidas especies de algodoncillo nativas no invasivas que pueden servir como estaciones de paso migratorias para las mariposas y facilitar las migraciones de otros polinizadores.
Esta mezcla tiene un componente predominante de flores silvestres para un hábitat óptimo para la vida silvestre y los polinizadores.
¿Podría el corte de césped en la carretera estimular el crecimiento de algodoncillo y favorecer la reproducción de la mariposa monarca? Una investigación limitada en el este de América del Norte ha demostrado que el corte de césped en primavera o verano puede promover un nuevo crecimiento y ampliar la disponibilidad de plantas de algodoncillo para la reproducción de la mariposa monarca. El corte de césped puede estimular el crecimiento de algunas especies de algodoncillo, en particular las que se propagan a través de rizomas como el algodoncillo común ( A. syriaca ) y el algodoncillo vistoso ( A. speciosa ). El corte de césped en verano (junio o julio) en Michigan dio como resultado más huevos de monarca en tallos regenerados que en tallos sin cortar. La siega y quema en verano (julio) puede aumentar la disponibilidad de algodoncillo verde ( A. viridis ) a fines del verano y principios del otoño en las Grandes Llanuras del Sur, mientras que en áreas sin siega, el algodoncillo ha envejecido en agosto. En el oeste, el algodoncillo vistoso volverá a crecer después de la siega de verano y seguirá apoyando la reproducción de la monarca (Stephanie McKnight, observación personal). Sin embargo, se necesita más investigación en otras áreas para determinar el momento y la frecuencia óptimos de siega que promuevan no solo el algodoncillo sino también las plantas de néctar. También se desconoce si el beneficio de la disponibilidad adicional de algodoncillo en el otoño supera los costos de la mortalidad larvaria causada por la siega de verano. Es probable que los beneficios sean mayores en áreas donde las monarcas se reproducen principalmente en primavera y otoño y donde las especies dominantes de algodoncillo se propagan por rizomas. Fuentes: Alcock et al. 2016; Baum y Mueller, 2015; Bhowick 1994; Haan y Landis 2019; Fischer et al. 2015
"A la monarca no le importa dónde crece la algodoncillo, y ponerla en barrios residenciales tiene todo el sentido", dijo Doug Tallamy, entomólogo de la Universidad de Delaware, autor y experto en jardines de hábitat de vida silvestre. ... El Jardín del Hábitat de las Mariposas del Instituto Smithsoniano ... y el Jardín Ripley ... son dos buenos lugares para ver algodoncillo integrado en un entorno de jardín. En el jardín de mariposas, puede ver el algodoncillo común ... ahora con muy buen aspecto en matas frescas e inmaculadas. A finales del verano, parece alto, cansado y resistente. Tallamy dice que si lo cultiva, debe cortarlo al menos a la mitad en junio para producir follaje suave a finales del verano que será más masticable para las orugas. Si lo hace, asegúrese de que no haya larvas en la planta antes de cortarla.
Virginia tiene la suerte, por ejemplo, de contar con 13 especies nativas de Asclepias más 4 enredaderas trepadoras de las que pueden alimentarse las orugas de la monarca. Para obtener los mejores resultados, corte algunos de los tallos a fines del verano después de que hayan florecido. El otoño es cuando la mayoría de las monarcas ponen huevos en nuestras algodoncillos. Dado que las mariposas madre prefieren el crecimiento joven y tierno, puede proporcionar esto programando su poda para que haya hojas nuevas en septiembre aproximadamente para las monarcas que llegan. Solo asegúrese de dejar algunas para producir vainas para semillas. La monarca local favorita es el algodoncillo común ( A. syriaca )
Corte: a mitad de temporada, cuando las flores se hayan marchitado, corte algunas plantas comunes en un tercio aproximadamente. Esto promueve el crecimiento de nuevas plantas y podría generar una generación adicional de mariposas monarca en las hojas nuevas. Deje algunas plantas sin cortar si desea cosechar semillas de algodoncillo en otoño.
Muchas fuentes de semillas de algodoncillo requieren estratificación (tratamiento frío y húmedo) antes de la siembra. En una revisión de los requisitos de estratificación para el algodoncillo común, las recomendaciones variaron desde tan solo 7 días hasta 11 meses a 5 °C (41 °F) (Luna y Dumroese, 2013). La germinación de la algodoncillo ( A. tuberosa ) aumentó de 29 a 48 a 62% a medida que la duración de la estratificación aumentó de 0 a 30 a 60 días, respectivamente (Bir, 1986). Nuestro ensayo informal de estratificación natural con algodoncillo vistoso y algodoncillo de hoja estrecha ( A. fascicularis ) en el sur de Oregón reveló que las semillas comenzaron a germinar después de 15 semanas de estratificación (Fig. 3A).
Las semillas pueden ser difíciles de germinar y pueden necesitar un período de tratamiento con frío.
Comience a sembrar las semillas en el interior 2 meses antes de la última helada; las semillas deben estratificarse en frío.
Si se plantan en bandejas o en un invernadero, las semillas de algodoncillo común deben tratarse con frío durante tres meses.
Germinación: la semilla requiere un período frío y húmedo.
Cualquiera de los métodos estándar de propagación de semillas (Landis et al., 1999) son efectivos con algodoncillo. La siembra directa de semillas no estratificadas durante el otoño seguida de la exposición a las condiciones ambientales del invierno puede ser efectiva, pero las semillas deben cubrirse con mantillo y protegerse. Cubra las semillas sembradas con un mantillo fino; Las investigaciones han demostrado que las semillas de algodoncillo común germinan mejor cuando se plantan a 1 o 2 cm (0,4 a 0,8 pulgadas) de profundidad que cuando se plantan en la superficie del suelo (Jeffery y Robison, 1971).
He cultivado algodoncillo, algodoncillo de pantano, Asclepias currassavica (flor de sangre), Asclepias syriaca (algodoncillo común) y Asclepias verticillata (algodoncillo verticilado). He descubierto que el algodoncillo de mariposa es la menos favorita de mis huéspedes monarca en mi jardín de Virginia Beach para poner huevos (¿quizás las hojas son más duras?).
Hojas ásperas para las orugas de la mariposa monarca, no suele ser una planta hospedante muy utilizada. [¿ fuente autopublicada? ]
Además,
A. tuberosa
tiene una capa de tricomas, que puede inhibir la oviposición o disminuir la capacidad de una hembra para detectar los químicos de las hojas.
En nuestro estudio, las especies de algodoncillo menos preferidas, A. tuberosa (sin elección; Fig. 2) y A. verticillata (elección; Fig. 3A), tienen niveles bajos de cardenolida registrados en la literatura (Roeske et al., Agrawal et al., Rasmann y Agrawal)
Si tienes condiciones cálidas y secas, prueba con la hierba mariposa ( A. tuberosa ). ... Sin embargo, es la menos favorecida por las orugas monarca porque tiene muy poca toxina (glucósidos cardíacos) en sus hojas.
En las pruebas sin elección, vimos los conteos de huevos más altos en
Asclepias incarnata
, seguida de
Asclepias sullivantii
y
Asclepias syriaca
(Fig. 2). En las pruebas de preferencia, más de la mitad de todos los huevos puestos fueron en
A. incarnata
(Fig. 3).
Esperanza de vida
: En los jardines, la mayoría de las plantas viven entre dos y cinco años, pero se sabe que sobreviven hasta 20 años.
...
Propagación
: Se propaga lentamente a través de semillas.
... '
Condiciones de altura
: No tolera la sombra. Una planta de sucesión temprana que tiende a crecer en los márgenes de los humedales y en áreas inundadas estacionalmente. No es un buen competidor vegetativo y tiende a desaparecer a medida que aumenta la densidad vegetativa y los hábitats se secan.