El arsénico es un elemento químico con el símbolo As y el número atómico 33. Es un metaloide y uno de los pnicógenos , y por lo tanto comparte muchas propiedades con sus vecinos del grupo 15, el fósforo y el antimonio . El arsénico es un metal pesado notoriamente tóxico . Se encuentra de forma natural en muchos minerales , generalmente en combinación con azufre y metales, pero también como un cristal elemental puro . Tiene varios alótropos , pero solo la forma gris, que tiene un aspecto metálico, es importante para la industria.
El uso principal del arsénico es en aleaciones de plomo (por ejemplo, en baterías de automóviles y municiones ). El arsénico es un dopante de tipo n común en dispositivos electrónicos semiconductores . También es un componente del compuesto semiconductor III-V arseniuro de galio . El arsénico y sus compuestos, especialmente el trióxido, se utilizan en la producción de pesticidas , productos de madera tratada, herbicidas e insecticidas . Estas aplicaciones están disminuyendo con el creciente reconocimiento de la toxicidad del arsénico y sus compuestos. [12]
Desde la antigüedad se sabe que el arsénico es venenoso para los humanos. [13] Sin embargo, algunas especies de bacterias pueden utilizar compuestos de arsénico como metabolitos respiratorios . Se ha propuesto que cantidades traza de arsénico son un elemento dietético esencial en ratas, hámsteres, cabras y pollos. No se han realizado investigaciones para determinar si pequeñas cantidades de arsénico pueden desempeñar un papel en el metabolismo humano. [14] [15] Sin embargo, el envenenamiento por arsénico ocurre en la vida multicelular si las cantidades son mayores de las necesarias. La contaminación de las aguas subterráneas con arsénico es un problema que afecta a millones de personas en todo el mundo.
La Agencia de Protección Ambiental de los Estados Unidos afirma que todas las formas de arsénico son un riesgo grave para la salud humana. [16] La Agencia para Sustancias Tóxicas y Registro de Enfermedades de los Estados Unidos clasificó al arsénico en el puesto número 1 en su lista priorizada de sustancias peligrosas en sitios Superfund de 2001. [17] El arsénico está clasificado como un carcinógeno del Grupo A. [16 ]

Los tres alótropos de arsénico más comunes son el arsénico gris, amarillo y negro, siendo el gris el más común. [18] El arsénico gris (α-As, grupo espacial R 3 m No. 166) adopta una estructura de doble capa que consiste en muchos anillos entrelazados, ondulados y de seis miembros. Debido a la débil unión entre las capas, el arsénico gris es frágil y tiene una dureza de Mohs relativamente baja de 3,5. Los vecinos más cercanos y siguientes forman un complejo octaédrico distorsionado, con los tres átomos en la misma doble capa ligeramente más cerca que los tres átomos en la siguiente. [19] Este empaquetamiento relativamente cercano conduce a una alta densidad de 5,73 g/cm 3 . [20] El arsénico gris es un semimetal , pero se convierte en un semiconductor con una banda prohibida de 1,2-1,4 eV si se amorfiza. [21] El arsénico gris también es la forma más estable. El arsénico amarillo es blando y ceroso, y algo similar al tetrafósforo ( P 4 ). [22] Ambos tienen cuatro átomos dispuestos en una estructura tetraédrica en la que cada átomo está unido a cada uno de los otros tres átomos por un enlace simple. Este alótropo inestable, al ser molecular, es el más volátil, menos denso y más tóxico. El arsénico amarillo sólido se produce por enfriamiento rápido del vapor de arsénico, As 4 . Se transforma rápidamente en arsénico gris por la luz. La forma amarilla tiene una densidad de 1,97 g/cm 3 . [20] El arsénico negro es similar en estructura al fósforo negro . [20] El arsénico negro también se puede formar por enfriamiento del vapor a alrededor de 100–220 °C y por cristalización de arsénico amorfo en presencia de vapores de mercurio. [23] Es vítreo y quebradizo. El arsénico negro también es un mal conductor eléctrico. [24]
El arsénico sublima al calentarse a presión atmosférica y pasa directamente a estado gaseoso sin necesidad de líquido a 887 K (614 °C). El punto triple se encuentra a 3,63 MPa y 1090 K (820 °C). [20] [4]
El arsénico se presenta en la naturaleza como un isótopo estable , 75 As, y por lo tanto se le denomina elemento monoisotópico . [25] A partir de 2024, también se han sintetizado al menos 32 radioisótopos , con una masa atómica que varía de 64 a 95. [26] [27] El más estable de estos es el 73 As con una vida media de 80,30 días. Todos los demás isótopos tienen vidas medias de menos de un día, con la excepción del 71 As ( t 1/2 = 65,30 horas), 72 As ( t 1/2 = 26,0 horas), 74 As ( t 1/2 = 17,77 días), 76 As ( t 1/2 = 26,26 horas) y 77 As ( t 1/2 = 38,83 horas). Los isótopos que son más ligeros que el estable 75As tienden a desintegrarse por desintegración β + , y los que son más pesados tienden a desintegrarse por desintegración β − , con algunas excepciones.
Se han descrito al menos 10 isómeros nucleares , cuya masa atómica varía entre 66 y 84. El isómero más estable del arsénico es el 68mAs , con una vida media de 111 segundos. [25]
El arsénico tiene una electronegatividad y energías de ionización similares a las de su congénere pictógeno más ligero, el fósforo, y por lo tanto forma fácilmente moléculas covalentes con la mayoría de los no metales . Aunque es estable en aire seco, el arsénico forma una capa de bronce dorado al exponerse a la humedad que eventualmente se convierte en una capa superficial negra. [28] Cuando se calienta en el aire, el arsénico se oxida a trióxido de arsénico ; los humos de esta reacción tienen un olor parecido al ajo. Este olor se puede detectar al golpear minerales de arsénico como la arsenopirita con un martillo. [4] Se quema en oxígeno para formar trióxido de arsénico y pentóxido de arsénico , que tienen la misma estructura que los compuestos de fósforo más conocidos, y en flúor para dar pentafluoruro de arsénico . [28] El arsénico produce ácido arsénico con ácido nítrico concentrado , ácido arsénico con ácido nítrico diluido y trióxido de arsénico con ácido sulfúrico concentrado ; Sin embargo, no reacciona con agua, álcalis o ácidos no oxidantes. [29] El arsénico reacciona con metales para formar arseniuros , aunque estos no son compuestos iónicos que contengan el ion As 3− ya que la formación de dicho anión sería altamente endotérmica e incluso los arseniuros del grupo 1 tienen propiedades de compuestos intermetálicos . [28] Al igual que el germanio , el selenio y el bromo , que como el arsénico suceden a la serie de transición 3d , el arsénico es mucho menos estable en el estado de oxidación +5 que sus vecinos verticales fósforo y antimonio , y por lo tanto el pentóxido de arsénico y el ácido arsénico son oxidantes potentes . [28]
Los compuestos de arsénico se parecen, en algunos aspectos, a los del fósforo , que ocupa el mismo grupo (columna) de la tabla periódica . Los estados de oxidación más comunes del arsénico son: −3 en los arseniuros , que son compuestos intermetálicos similares a las aleaciones, +3 en los arsenitos y +5 en los arseniatos y la mayoría de los compuestos organoarsénicos. El arsénico también se une fácilmente a sí mismo, como se ve en el cuadrado As3−4iones en el mineral skutterudita . [30] En el estado de oxidación +3 , el arsénico es típicamente piramidal debido a la influencia del par solitario de electrones . [18]
Uno de los compuestos de arsénico más simples es el trihidruro, la arsina pirofórica , altamente tóxica e inflamable (AsH 3 ). Este compuesto generalmente se considera estable, ya que a temperatura ambiente se descompone solo lentamente. A temperaturas de 250–300 °C, la descomposición en arsénico e hidrógeno es rápida. [31] Varios factores, como la humedad , la presencia de luz y ciertos catalizadores (en particular, el aluminio) facilitan la velocidad de descomposición. [32] Se oxida fácilmente en el aire para formar trióxido de arsénico y agua, y tienen lugar reacciones análogas con azufre y selenio en lugar de oxígeno . [31]
El arsénico forma óxidos cristalinos incoloros e inodoros, As2O3 ( " arsénico blanco ") y As2O5, que son higroscópicos y fácilmente solubles en agua para formar soluciones ácidas. El ácido arsénico( V ) es un ácido débil y sus sales, conocidas como arsenatos , [ 33] son una fuente importante de contaminación por arsénico de las aguas subterráneas en regiones con altos niveles de minerales de arsénico de origen natural. [34] Los arseniatos sintéticos incluyen el arseniato verde de Scheele (arseniato de hidrógeno cúprico, arseniato de cobre ácido), el arseniato de calcio y el arseniato de hidrógeno de plomo . Estos tres se han utilizado como insecticidas agrícolas y venenos .
Los pasos de protonación entre el arseniato y el ácido arsénico son similares a los que se dan entre el fosfato y el ácido fosfórico . A diferencia del ácido fosforoso , el ácido arsénico es genuinamente tribásico, con la fórmula As(OH) 3 . [33]
Se conoce una amplia variedad de compuestos de azufre de arsénico. El oropimente ( As2S3 ) y el rejalgar ( As4S4 ) son bastante abundantes y antiguamente se utilizaban como pigmentos de pintura. En As4S10 , el arsénico tiene un estado de oxidación formal de +2 en As4S4 que presenta enlaces As -As de modo que la covalencia total de As sigue siendo 3. [ 35] Tanto el oropimente como el rejalgar, así como el As4S3 , tienen análogos de selenio; el análogo As2Te3 se conoce como el mineral kalgoorlieíta , [36] y el anión As2Te− se conoce como ligando en complejos de cobalto . [ 37]
Todos los trihaluros de arsénico (III) son bien conocidos, excepto el astaturo, que es desconocido. El pentafluoruro de arsénico (AsF 5 ) es el único pentahaluro importante, lo que refleja la menor estabilidad del estado de oxidación +5; aun así, es un agente fluorante y oxidante muy fuerte. (El pentacloruro es estable solo por debajo de −50 °C, temperatura a la que se descompone en tricloruro, liberando gas cloro. [20] )
El arsénico se utiliza como elemento del grupo 5 en los semiconductores III-V arseniuro de galio , arseniuro de indio y arseniuro de aluminio . [38] El recuento de electrones de valencia de GaAs es el mismo que el de un par de átomos de Si, pero la estructura de bandas es completamente diferente, lo que da como resultado propiedades en masa distintas. [39] Otras aleaciones de arsénico incluyen el semiconductor II-V arseniuro de cadmio . [40]

Se conoce una gran variedad de compuestos organoarsénicos. Varios de ellos se desarrollaron como agentes de guerra química durante la Primera Guerra Mundial, incluidos vesicantes como la lewisita y agentes vomitivos como la adamsita . [41] [42] [43] El ácido cacodílico , que tiene interés histórico y práctico, surge de la metilación del trióxido de arsénico, una reacción que no tiene analogía en la química del fósforo. El cacodilo fue el primer compuesto organometálico conocido (aunque el arsénico no es un metal verdadero) y recibió su nombre del griego κακωδία "hedor" por su olor ofensivo, parecido al ajo; es muy tóxico. [44]

El arsénico es el 53.º elemento más abundante en la corteza terrestre , con unas 1,5 partes por millón (0,00015 %). [45] Las concentraciones de fondo típicas de arsénico no superan los 3 ng/m 3 en la atmósfera; 100 mg/kg en el suelo; 400 μg/kg en la vegetación; 10 μg/L en agua dulce y 1,5 μg/L en agua de mar. [46] El arsénico es el 22.º elemento más abundante en el agua de mar [47] y ocupa el puesto 41.º en abundancia en el universo. [48]
Los minerales con la fórmula MAsS y MAs 2 (M = Fe , Ni , Co ) son las principales fuentes comerciales de arsénico, junto con el rejalgar (un mineral de sulfuro de arsénico) y el arsénico nativo (elemental). Un mineral ilustrativo es la arsenopirita ( Fe As S ), que está estructuralmente relacionada con la pirita de hierro . Se conocen muchos minerales menores que contienen As. El arsénico también se presenta en varias formas orgánicas en el medio ambiente. [49]

En 2014, China fue el principal productor de arsénico blanco con casi el 70% de la cuota mundial, seguido de Marruecos, Rusia y Bélgica, según el British Geological Survey y el United States Geological Survey . [51] La mayoría de las operaciones de refinación de arsénico en los EE. UU. y Europa han cerrado por preocupaciones ambientales. El arsénico se encuentra en el polvo de fundición de las fundiciones de cobre, oro y plomo, y se recupera principalmente del polvo de refinación de cobre. [52]
Al tostar la arsenopirita en aire, el arsénico se sublima como óxido de arsénico (III) y deja óxidos de hierro [49] , mientras que al tostar sin aire se produce arsénico gris. La purificación adicional del azufre y otros calcógenos se logra mediante sublimación al vacío, en una atmósfera de hidrógeno o mediante destilación a partir de una mezcla fundida de plomo y arsénico [53] .

La palabra arsénico tiene su origen en la palabra siríaca ������������������������������������������������������������������������������������������������������������������������������������������������������������ zarnika , [54] [55] del árabe al-zarnīḵ الزرنيخ ' el oropimento ', basado en el persa zar ("oro") de la palabra زرنيخ zarnikh , que significa "amarillo" ( literalmente "color dorado") y por lo tanto "oropimente (amarillo)". Fue adoptado en griego (usando etimología popular ) como arsenikon ( ἀρσενικόν ), una forma neutra del adjetivo griego arsenikos ( ἀρσενικός ), que significa "masculino", "viril".
Los hablantes de latín adoptaron el término griego arsenicum , que en francés se convirtió en arsénico , de donde proviene la palabra inglesa "arsenic". [55] Los sulfuros de arsénico (oropimente, rejalgar ) y óxidos se conocen y utilizan desde la antigüedad. [56] Zósimo ( c. 300 d. C. ) describe tostar sandarach (rejalgar) para obtener una nube de arsénico ( trióxido de arsénico ), que luego reduce a arsénico gris. [57] Como los síntomas del envenenamiento por arsénico no son muy específicos, la sustancia se utilizó con frecuencia para asesinar hasta la llegada en la década de 1830 de la prueba Marsh , una prueba química sensible para su presencia. (Otra prueba menos sensible pero más general es la prueba de Reinsch ). Debido a su uso por parte de la clase dominante para asesinarse entre sí y su potencia y discreción, el arsénico ha sido llamado el "veneno de reyes" y el "rey de los venenos". [58] [59] El arsénico llegó a ser conocido como "el polvo de la herencia" debido a su uso para matar a miembros de la familia en la era del Renacimiento . [60]

Durante la Edad del Bronce , el arsénico se fundía con cobre para fabricar bronce arsénico . [61] [62] Jabir ibn Hayyan describió el aislamiento del arsénico antes del año 815 d. C. [63] Albertus Magnus (Alberto el Grande, 1193-1280) aisló posteriormente el elemento a partir de un compuesto en 1250, calentando jabón junto con trisulfuro de arsénico . [64] En 1649, Johann Schröder publicó dos formas de preparar arsénico. [65] Los cristales de arsénico elemental (nativo) se encuentran en la naturaleza, aunque raramente.
El líquido fumante de Cadet ( cacodilo impuro ), a menudo considerado el primer compuesto organometálico sintético , fue sintetizado en 1760 por Louis Claude Cadet de Gassicourt a través de la reacción de acetato de potasio con trióxido de arsénico . [66]

En la época victoriana , las mujeres comían "arsénico" (" arsénico blanco " o trióxido de arsénico) mezclado con vinagre y tiza para mejorar la tez de sus rostros, haciendo que su piel fuera más pálida (para demostrar que no trabajaban en el campo). [67] El uso accidental de arsénico en la adulteración de alimentos condujo al envenenamiento por dulces de Bradford en 1858, que resultó en 21 muertes. [68] Desde finales del siglo XVIII, la producción de papel tapiz comenzó a utilizar tintes hechos de arsénico, [69] que se pensaba que aumentaba el brillo del pigmento. [70] Un relato de la enfermedad y la muerte de Napoleón I en 1821 implica un envenenamiento por arsénico que involucraba papel tapiz. [71]
Dos pigmentos de arsénico han sido ampliamente utilizados desde su descubrimiento: el verde de París en 1814 y el verde de Scheele en 1775. Después de que la toxicidad del arsénico se hizo ampliamente conocida, estos productos químicos se utilizaron con menos frecuencia como pigmentos y más a menudo como insecticidas. En la década de 1860, un subproducto de arsénico de la producción de tintes, el púrpura de Londres, fue ampliamente utilizado. Esta era una mezcla sólida de trióxido de arsénico, anilina, cal y óxido ferroso, insoluble en agua y muy tóxica por inhalación o ingestión [72] Pero luego fue reemplazado por el verde de París , otro tinte a base de arsénico. [73] Con una mejor comprensión del mecanismo toxicológico, otros dos compuestos se utilizaron a partir de la década de 1890. [74] El arsenito de cal y el arseniato de plomo se usaron ampliamente como insecticidas hasta el descubrimiento del DDT en 1942. [75] [76] [77]
En pequeñas dosis, los compuestos solubles de arsénico actúan como estimulantes y fueron populares como medicina entre mediados del siglo XVIII y el siglo XIX; [20] [78] [79] este uso fue especialmente frecuente en animales deportivos como caballos de carreras o perros de trabajo y continuó hasta el siglo XX. [80] Un estudio de 2006 de los restos del caballo de carreras australiano Phar Lap determinó que su muerte en 1932 fue causada por una sobredosis masiva de arsénico. El veterinario de Sydney Percy Sykes afirmó: "En aquellos días, el arsénico era un tónico bastante común, generalmente administrado en forma de solución ( solución de Fowler ) ... Era tan común que calculo que el 90 por ciento de los caballos tenían arsénico en su sistema". [81]
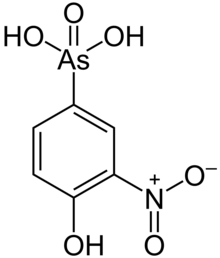
La toxicidad del arsénico para los insectos, las bacterias y los hongos llevó a su uso como conservante de la madera . [82] En la década de 1930, se inventó un proceso de tratamiento de la madera con arseniato de cobre cromado (también conocido como CCA o Tanalith ), y durante décadas, este tratamiento fue el uso industrial más extenso del arsénico. Una mayor apreciación de la toxicidad del arsénico llevó a una prohibición del CCA en productos de consumo en 2004, iniciada por la Unión Europea y los Estados Unidos. [83] [84] Sin embargo, el CCA sigue siendo de uso intensivo en otros países (como en las plantaciones de caucho de Malasia). [12]
El arsénico también se utilizó en diversos insecticidas y venenos agrícolas. Por ejemplo, el arseniato de hidrógeno y plomo era un insecticida común en los árboles frutales [85] , pero el contacto con el compuesto a veces provocaba daños cerebrales entre quienes trabajaban con los pulverizadores. En la segunda mitad del siglo XX, el arseniato de metilo monosódico (MSMA) y el arseniato de metilo disódico (DSMA), formas orgánicas menos tóxicas del arsénico, sustituyeron al arseniato de plomo en la agricultura. A su vez, estos arsenicales orgánicos se eliminaron gradualmente en los Estados Unidos en 2013 en todas las actividades agrícolas, excepto el cultivo de algodón. [86] [87]
La biogeoquímica del arsénico es compleja e incluye varios procesos de adsorción y desorción. La toxicidad del arsénico está relacionada con su solubilidad y se ve afectada por el pH. El arsenito ( AsO3−3) es más soluble que el arseniato ( AsO3−4) y es más tóxico; sin embargo, a un pH más bajo, el arsenato se vuelve más móvil y tóxico. Se descubrió que la adición de azufre, fósforo y óxidos de hierro a suelos con alto contenido de arsenito reduce en gran medida la fitotoxicidad del arsénico. [88]
El arsénico se utiliza como aditivo alimentario en la producción avícola y porcina , en particular se utilizó en los EE. UU. hasta 2015 para aumentar la ganancia de peso, mejorar la eficiencia alimentaria y prevenir enfermedades. [89] [90] Un ejemplo es la roxarsona , que había sido utilizada como iniciador de pollos de engorde por aproximadamente el 70% de los criadores de pollos de engorde de EE. UU. [91] En 2011, Alpharma, una subsidiaria de Pfizer Inc., que produce roxarsona, suspendió voluntariamente las ventas del fármaco en respuesta a estudios que mostraban niveles elevados de arsénico inorgánico, un carcinógeno, en pollos tratados. [92] Un sucesor de Alpharma, Zoetis , continuó vendiendo nitarsona hasta 2015, principalmente para su uso en pavos. [92]
Durante los siglos XVII, XVIII y XIX, se utilizaron varios compuestos de arsénico como medicamentos, entre ellos la arsfenamina (por Paul Ehrlich ) y el trióxido de arsénico (por Thomas Fowler ), para tratar enfermedades como el cáncer o la psoriasis . [93] La arsfenamina, así como el neosalvarsan , estaban indicados para la sífilis , pero han sido reemplazados por los antibióticos modernos . Sin embargo, los arsenicales como el melarsoprol todavía se utilizan para el tratamiento de la tripanosomiasis , ya que aunque estos fármacos tienen la desventaja de una toxicidad grave, la enfermedad es casi uniformemente mortal si no se trata. [94] En 2000, la Administración de Alimentos y Medicamentos de los Estados Unidos aprobó el trióxido de arsénico para el tratamiento de pacientes con leucemia promielocítica aguda resistente al ácido retinoico todo-trans . [95]
Un artículo de 2008 informa sobre el éxito en la localización de tumores utilizando arsénico-74 (un emisor de positrones). Este isótopo produce imágenes de tomografía por emisión de positrones más claras que el agente radiactivo anterior, el yodo -124, porque el cuerpo tiende a transportar yodo a la glándula tiroides, lo que produce ruido de señal. [96] Las nanopartículas de arsénico han demostrado la capacidad de matar células cancerosas con menor citotoxicidad que otras formulaciones de arsénico. [97]
El uso principal del arsénico es en la aleación con plomo. Los componentes de plomo en las baterías de los automóviles se refuerzan con la presencia de un porcentaje muy pequeño de arsénico. [12] [98] La descincificación del latón (una aleación de cobre y zinc) se reduce en gran medida mediante la adición de arsénico. [99] El "cobre arsenical desoxidado con fósforo" con un contenido de arsénico del 0,3% tiene una mayor estabilidad a la corrosión en ciertos entornos. [100] El arseniuro de galio es un material semiconductor importante, utilizado en circuitos integrados . Los circuitos hechos de GaAs son mucho más rápidos (pero también mucho más caros) que los hechos de silicio . A diferencia del silicio, el GaAs tiene una banda prohibida directa y se puede utilizar en diodos láser y LED para convertir la energía eléctrica directamente en luz. [12]
Después de la Primera Guerra Mundial , Estados Unidos construyó un arsenal de 20.000 toneladas de lewisita (ClCH=CHAsCl 2 ) , un vesicante organoarsénico (agente vesicante) e irritante pulmonar , que fue neutralizado con cloro y arrojado al Golfo de México en la década de 1950. [101] Durante la Guerra de Vietnam , Estados Unidos utilizó el Agente Azul , una mezcla de cacodilato de sodio y su forma ácida, como uno de los herbicidas arcoíris para privar a los soldados norvietnamitas de su follaje y arroz. [102] [103]
Algunas especies de bacterias obtienen su energía en ausencia de oxígeno oxidando diversos combustibles mientras reducen el arsenato a arsenito. En condiciones ambientales oxidativas, algunas bacterias utilizan el arsenito como combustible, que oxidan para formar arsenato. [114] Las enzimas involucradas se conocen como arsenato reductasas (Arr). [115]
En 2008, se descubrieron bacterias que emplean una versión de la fotosíntesis en ausencia de oxígeno con arsenitos como donantes de electrones , produciendo arseniatos (al igual que la fotosíntesis ordinaria utiliza agua como donante de electrones, produciendo oxígeno molecular). Los investigadores conjeturan que, a lo largo de la historia, estos organismos fotosintetizadores produjeron los arseniatos que permitieron que las bacterias reductoras de arseniato prosperaran. Se ha aislado una cepa , PHS-1, y está relacionada con la gammaproteobacteria Ectothiorhodospira shaposhnikovii . El mecanismo es desconocido, pero una enzima Arr codificada puede funcionar a la inversa de sus homólogos conocidos . [116]
En 2011 se postuló que la cepa GFAJ-1 de Halomonadaceae podría cultivarse en ausencia de fósforo si se sustituyera ese elemento por arsénico, [117] aprovechando el hecho de que los aniones arseniato y fosfato son estructuralmente similares. El estudio fue ampliamente criticado y posteriormente refutado por grupos de investigadores independientes. [118] [119]
El arsénico puede ser un oligoelemento esencial en las aves, que interviene en la síntesis de metabolitos de metionina, y las recomendaciones de alimentación se sitúan entre 0,012 y 0,050 mg/kg. [120]
Algunas evidencias indican que el arsénico es un oligoelemento esencial para los mamíferos. Sin embargo, se desconoce su función biológica . [14] [15]
El arsénico se ha relacionado con cambios epigenéticos , cambios hereditarios en la expresión genética que ocurren sin cambios en la secuencia de ADN . Estos incluyen metilación de ADN, modificación de histonas e interferencia de ARN . Los niveles tóxicos de arsénico causan hipermetilación significativa del ADN de los genes supresores de tumores p16 y p53 , lo que aumenta el riesgo de carcinogénesis . Estos eventos epigenéticos se han estudiado in vitro utilizando células renales humanas e in vivo utilizando células de hígado de rata y leucocitos de sangre periférica en humanos. [121] La espectrometría de masas de plasma acoplado inductivamente (ICP-MS) se utiliza para detectar niveles precisos de arsénico intracelular y otras bases de arsénico involucradas en la modificación epigenética del ADN. [122] Los estudios que investigan el arsénico como factor epigenético se pueden utilizar para desarrollar biomarcadores precisos de exposición y susceptibilidad.
El helecho chino ( Pteris vittata ) hiperacumula arsénico del suelo en sus hojas y se propone utilizarlo en la fitorremediación . [123]

El arsénico inorgánico y sus compuestos, al entrar en la cadena alimentaria , se metabolizan progresivamente a través de un proceso de metilación . [124] [125] Por ejemplo, el moho Scopulariopsis brevicaulis produce trimetilarsina si está presente arsénico inorgánico. [126] El compuesto orgánico arsenobetaína se encuentra en algunos alimentos marinos como el pescado y las algas, y también en los hongos en concentraciones mayores. La ingesta media de una persona es de unos 10-50 μg/día. Valores de alrededor de 1000 μg no son inusuales tras el consumo de pescado o de hongos, pero hay poco peligro en comer pescado porque este compuesto de arsénico es casi no tóxico. [127]
Las fuentes naturales de exposición humana incluyen cenizas volcánicas , erosión de minerales y menas, y agua subterránea mineralizada. El arsénico también se encuentra en alimentos, agua, suelo y aire. [128] El arsénico es absorbido por todas las plantas, pero está más concentrado en vegetales de hoja, arroz, jugo de manzana y uva, y mariscos. [129] Una vía adicional de exposición es la inhalación de gases y polvos atmosféricos. [130] Durante la era victoriana , el arsénico se usaba ampliamente en la decoración del hogar, especialmente en los papeles pintados. [131] En Europa, un análisis basado en 20.000 muestras de suelo en los 28 países muestra que el 98% de los suelos muestreados tienen concentraciones inferiores a 20 mg kg-1. Además, los puntos críticos de As están relacionados con la fertilización frecuente y la proximidad a las actividades mineras. [132]
La extensa contaminación de las aguas subterráneas por arsénico ha provocado un envenenamiento generalizado por arsénico en Bangladesh [133] y los países vecinos. Se estima que aproximadamente 57 millones de personas en la cuenca de Bengala beben agua subterránea con concentraciones de arsénico superiores a las establecidas por la Organización Mundial de la Salud, que son de 10 partes por mil millones (ppb). [134] Sin embargo, un estudio sobre las tasas de cáncer en Taiwán [135] sugirió que los aumentos significativos en la mortalidad por cáncer aparecen solo en niveles superiores a 150 ppb. El arsénico en las aguas subterráneas es de origen natural y se libera desde los sedimentos a las aguas subterráneas, debido a las condiciones anóxicas del subsuelo. Estas aguas subterráneas se utilizaron después de que las ONG locales y occidentales y el gobierno de Bangladesh emprendieran un programa masivo de agua potable a través de pozos tubulares poco profundos a fines del siglo XX. Este programa fue diseñado para prevenir el consumo de aguas superficiales contaminadas con bacterias, pero no realizó pruebas de arsénico en las aguas subterráneas. Muchos otros países y distritos del sudeste asiático, como Vietnam y Camboya , tienen entornos geológicos que producen aguas subterráneas con un alto contenido de arsénico. Se informó de arsenicosis en Nakhon Si Thammarat , Tailandia, en 1987, y el río Chao Phraya probablemente contiene altos niveles de arsénico disuelto de origen natural sin ser un problema de salud pública porque gran parte del público utiliza agua embotellada . [136] En Pakistán, más de 60 millones de personas están expuestas al agua potable contaminada con arsénico, según indicó un informe de 2017 en Science . El equipo de Podgorski investigó más de 1200 muestras y más del 66% excedía el nivel mínimo de contaminación de la OMS. [137]
Desde la década de 1980, los residentes de la región de Ba Men en Mongolia Interior, China, han estado expuestos crónicamente al arsénico a través del agua potable de pozos contaminados. [138] Un estudio de investigación de 2009 observó una elevada presencia de lesiones cutáneas entre los residentes con concentraciones de arsénico en el agua de pozo entre 5 y 10 μg/L, lo que sugiere que la toxicidad inducida por arsénico puede ocurrir en concentraciones relativamente bajas con exposición crónica. [138] En general, 20 de las 34 provincias de China tienen altas concentraciones de arsénico en el suministro de agua subterránea, lo que potencialmente expone a 19 millones de personas a agua potable peligrosa. [139]
Un estudio del IIT Kharagpur encontró altos niveles de arsénico en las aguas subterráneas del 20% de las tierras de la India, lo que expone a más de 250 millones de personas. Estados como Punjab , Bihar, Bengala Occidental , Assam, Haryana , Uttar Pradesh y Gujarat tienen la mayor superficie terrestre expuesta al arsénico. [140]
En los Estados Unidos, el arsénico se encuentra más comúnmente en las aguas subterráneas del suroeste. [141] También se sabe que partes de Nueva Inglaterra , Michigan , Wisconsin , Minnesota y las Dakotas tienen concentraciones significativas de arsénico en el agua subterránea. [142] Se han asociado niveles elevados de cáncer de piel con la exposición al arsénico en Wisconsin, incluso a niveles inferiores al estándar de agua potable de 10 ppb. [143] Según una película reciente financiada por el Superfondo de EE. UU ., millones de pozos privados tienen niveles desconocidos de arsénico y, en algunas áreas de EE. UU., más del 20% de los pozos pueden contener niveles que exceden los límites establecidos. [144]
Según los científicos que cuentan con el apoyo del NIEHS, la exposición a niveles bajos de arsénico en concentraciones de 100 ppb (es decir, superiores a las 10 ppb que se exigen en el agua potable) compromete la respuesta inmunitaria inicial a la infección por H1N1 o gripe porcina . El estudio, realizado en ratones de laboratorio, sugiere que las personas expuestas al arsénico en el agua potable pueden correr un mayor riesgo de sufrir enfermedades más graves o de morir a causa del virus. [145]
Algunos canadienses beben agua que contiene arsénico inorgánico. Las aguas de pozos privados son las que tienen mayor riesgo de contener arsénico inorgánico. Los análisis preliminares del agua de pozos normalmente no detectan el arsénico. Los investigadores del Servicio Geológico de Canadá han modelado la variación relativa del potencial de riesgo natural del arsénico para la provincia de Nuevo Brunswick. Este estudio tiene importantes implicaciones para el agua potable y las preocupaciones sanitarias relacionadas con el arsénico inorgánico. [146]
La evidencia epidemiológica de Chile muestra una relación dosis-dependiente entre la exposición crónica al arsénico y diversas formas de cáncer, en particular cuando están presentes otros factores de riesgo, como el tabaquismo. Estos efectos se han demostrado en contaminaciones inferiores a 50 ppb. [147] El arsénico es en sí mismo un componente del humo del tabaco . [148]
El análisis de múltiples estudios epidemiológicos sobre la exposición al arsénico inorgánico sugiere un aumento pequeño pero mensurable del riesgo de cáncer de vejiga con 10 ppb. [149] Según Peter Ravenscroft, del Departamento de Geografía de la Universidad de Cambridge, [150] aproximadamente 80 millones de personas en todo el mundo consumen entre 10 y 50 ppb de arsénico en el agua potable. Si todas consumieran exactamente 10 ppb de arsénico en el agua potable, el análisis de múltiples estudios epidemiológicos citado anteriormente predeciría 2.000 casos adicionales de cáncer de vejiga solamente. Esto representa una clara subestimación del impacto general, ya que no incluye el cáncer de pulmón o de piel, y subestima explícitamente la exposición. Las personas expuestas a niveles de arsénico superiores a la norma actual de la OMS deberían sopesar los costos y beneficios de la remediación del arsénico.
Las primeras evaluaciones (1973) de los procesos para eliminar el arsénico disuelto del agua potable demostraron la eficacia de la coprecipitación con óxidos de hierro o aluminio. En particular, se descubrió que el hierro como coagulante eliminaba el arsénico con una eficacia superior al 90%. [151] [152] Se han aprobado varios sistemas de medios de adsorción para su uso en el punto de servicio en un estudio financiado por la Agencia de Protección Ambiental de los Estados Unidos (US EPA) y la Fundación Nacional de Ciencias (NSF). Un equipo de científicos e ingenieros europeos e indios ha instalado seis plantas de tratamiento de arsénico en Bengala Occidental basadas en el método de remediación in situ (Tecnología SAR). Esta tecnología no utiliza ningún producto químico y el arsénico se deja en forma insoluble (estado +5) en la zona subterránea mediante la recarga de agua aireada en el acuífero y el desarrollo de una zona de oxidación que sustenta los microorganismos oxidantes del arsénico. Este proceso no produce ningún flujo de desechos ni lodos y es relativamente barato. [153]
Otro método eficaz y económico para evitar la contaminación por arsénico es perforar pozos de 500 pies o más de profundidad para llegar a aguas más puras. Un estudio reciente de 2011 financiado por el Programa de Investigación Superfund del Instituto Nacional de Ciencias de la Salud Ambiental de los Estados Unidos muestra que los sedimentos profundos pueden eliminar el arsénico y sacarlo de circulación. En este proceso, llamado adsorción , el arsénico se adhiere a las superficies de las partículas de sedimentos profundos y se elimina naturalmente del agua subterránea. [154]
Se han demostrado separaciones magnéticas de arsénico en gradientes de campo magnético muy bajos con nanocristales de magnetita (Fe 3 O 4 ) monodispersos y de gran área de superficie en la purificación de agua en el punto de uso. Utilizando la gran área de superficie específica de los nanocristales de Fe 3 O 4 , se ha reducido drásticamente la masa de desechos asociada con la eliminación de arsénico del agua. [155]
Los estudios epidemiológicos han sugerido una correlación entre el consumo crónico de agua potable contaminada con arsénico y la incidencia de todas las principales causas de mortalidad. [156] La literatura indica que la exposición al arsénico es causal de la patogénesis de la diabetes. [157]
Recientemente se ha demostrado que los filtros a base de granza reducen el contenido de arsénico del agua a 3 μg/L. Esto puede tener aplicaciones en áreas donde el agua potable se extrae de acuíferos subterráneos . [158]
Durante varios siglos, los habitantes de San Pedro de Atacama en Chile han estado bebiendo agua contaminada con arsénico, y algunas evidencias sugieren que han desarrollado cierta inmunidad. [159] [160] [161]
Alrededor de un tercio de la población mundial bebe agua de fuentes subterráneas. De esta población, alrededor del 10 por ciento, unos 300 millones de personas, obtienen agua de fuentes subterráneas que están contaminadas con niveles nocivos de arsénico o flúor. [162] Estos oligoelementos se derivan principalmente de minerales e iones del suelo. [163] [164]
El arsénico es único entre los metaloides traza y los metales traza formadores de oxianiones (p. ej., As, Se, Sb, Mo, V, Cr, U, Re). Es sensible a la movilización a valores de pH típicos de aguas naturales (pH 6,5-8,5) tanto en condiciones oxidantes como reductoras. El arsénico puede presentarse en el medio ambiente en varios estados de oxidación (−3, 0, +3 y +5), pero en aguas naturales se encuentra principalmente en formas inorgánicas como oxianiones de arsenito trivalente [As(III)] o arsenato pentavalente [As(V)]. Las formas orgánicas de arsénico se producen por actividad biológica, principalmente en aguas superficiales, pero rara vez son cuantitativamente importantes. Sin embargo, los compuestos orgánicos de arsénico pueden presentarse donde las aguas se ven significativamente afectadas por la contaminación industrial. [165]
El arsénico puede solubilizarse mediante diversos procesos. Cuando el pH es alto, el arsénico puede liberarse de los sitios de unión de la superficie que pierden su carga positiva. Cuando el nivel del agua baja y los minerales de sulfuro se exponen al aire, el arsénico atrapado en los minerales de sulfuro puede liberarse al agua. Cuando hay carbono orgánico presente en el agua, las bacterias se alimentan reduciendo directamente As(V) a As(III) o reduciendo el elemento en el sitio de unión, liberando arsénico inorgánico. [166]
Las transformaciones acuáticas del arsénico se ven afectadas por el pH, el potencial de reducción-oxidación, la concentración de materia orgánica y las concentraciones y formas de otros elementos, especialmente hierro y manganeso. Los principales factores son el pH y el potencial redox. En general, las principales formas del arsénico en condiciones óxicas son H 3 AsO 4 , H 2 AsO−4, HAsO2−4, y AsO3−4a pH 2, 2–7, 7–11 y 11, respectivamente. En condiciones reductoras, el H 3 AsO 4 predomina a pH 2–9.
La oxidación y la reducción afectan la migración del arsénico en ambientes subterráneos. El arsenito es la forma soluble más estable del arsénico en ambientes reductores y el arsenato, que es menos móvil que el arsenito, es dominante en ambientes oxidantes a pH neutro . Por lo tanto, el arsénico puede ser más móvil en condiciones reductoras. El ambiente reductor también es rico en materia orgánica que puede mejorar la solubilidad de los compuestos de arsénico. Como resultado, la adsorción de arsénico se reduce y el arsénico disuelto se acumula en las aguas subterráneas. Es por eso que el contenido de arsénico es mayor en ambientes reductores que en ambientes oxidantes. [167]
La presencia de azufre es otro factor que afecta la transformación del arsénico en el agua natural. El arsénico puede precipitar cuando se forman sulfuros metálicos. De esta manera, el arsénico se elimina del agua y su movilidad disminuye. Cuando hay oxígeno presente, las bacterias oxidan el azufre reducido para generar energía, liberando potencialmente el arsénico ligado.
Las reacciones redox que involucran Fe también parecen ser factores esenciales en el destino del arsénico en los sistemas acuáticos. La reducción de los oxihidróxidos de hierro juega un papel clave en la liberación de arsénico al agua. Por lo tanto, el arsénico puede enriquecerse en agua con concentraciones elevadas de Fe. [168] En condiciones oxidantes, el arsénico puede movilizarse a partir de pirita u óxidos de hierro, especialmente a pH elevado. En condiciones reductoras, el arsénico puede movilizarse por desorción reductora o disolución cuando se asocia con óxidos de hierro. La desorción reductora ocurre en dos circunstancias. Una es cuando el arsenato se reduce a arsenito que se adsorbe a óxidos de hierro con menor fuerza. La otra es el resultado de un cambio en la carga en la superficie mineral que conduce a la desorción del arsénico unido. [169]
Algunas especies de bacterias catalizan las transformaciones redox del arsénico. Los procariotas que respiran arseniato desasimiladores (DARP) aceleran la reducción de As(V) a As(III). Los DARP utilizan As(V) como aceptor de electrones de la respiración anaeróbica y obtienen energía para sobrevivir. Otras sustancias orgánicas e inorgánicas pueden oxidarse en este proceso. Los oxidadores de arseniato quimioautotróficos (CAO) y los oxidadores de arseniato heterotróficos (HAO) convierten As(III) en As(V). Los CAO combinan la oxidación de As(III) con la reducción de oxígeno o nitrato. Utilizan la energía obtenida para fijar y producir carbono orgánico a partir de CO2 . Los HAO no pueden obtener energía de la oxidación de As(III). Este proceso puede ser un mecanismo de desintoxicación de arsénico para las bacterias. [170]
Los cálculos termodinámicos de equilibrio predicen que las concentraciones de As(V) deberían ser mayores que las concentraciones de As(III) en todas las condiciones excepto en condiciones fuertemente reductoras, es decir, donde se está produciendo la reducción de sulfato . Sin embargo, las reacciones redox abióticas del arsénico son lentas. La oxidación de As(III) por O2 disuelto es una reacción particularmente lenta. Por ejemplo, Johnson y Pilson (1975) dieron vidas medias para la oxigenación de As(III) en agua de mar que van desde varios meses a un año. [171] En otros estudios, las proporciones As(V)/As(III) fueron estables durante períodos de días o semanas durante el muestreo de agua cuando no se tomó ningún cuidado particular para prevenir la oxidación, lo que nuevamente sugiere tasas de oxidación relativamente lentas. Cherry encontró a partir de estudios experimentales que las proporciones As(V)/As(III) fueron estables en soluciones anóxicas hasta por 3 semanas, pero que ocurrieron cambios graduales en escalas de tiempo más largas. [172] Se ha observado que las muestras de agua estéril son menos susceptibles a los cambios de especiación que las muestras no estériles. [173] Oremland descubrió que la reducción de As(V) a As(III) en el lago Mono fue catalizada rápidamente por bacterias con constantes de velocidad que oscilaban entre 0,02 y 0,3 días −1 . [174]
En 2002, las industrias con sede en Estados Unidos consumían 19.600 toneladas métricas de arsénico. El noventa por ciento de esta cantidad se utilizaba para el tratamiento de la madera con arseniato de cobre cromado (CCA). En 2007, el 50% de las 5.280 toneladas métricas de consumo todavía se utilizaban para este fin. [52] [175] En Estados Unidos, la eliminación voluntaria del arsénico en la producción de productos de consumo y productos de construcción residenciales y de consumo general comenzó el 31 de diciembre de 2003, y ahora se utilizan productos químicos alternativos, como el cobre cuaternario alcalino , los boratos , el azol de cobre , el ciproconazol y el propiconazol . [176]
Aunque se ha descontinuado, esta aplicación también es una de las más preocupantes para el público en general. La gran mayoría de la madera antigua tratada a presión se trataba con CCA. La madera CCA todavía se usa ampliamente en muchos países y se usó mucho durante la segunda mitad del siglo XX como material de construcción estructural y para exteriores . Aunque el uso de madera CCA se prohibió en muchas áreas después de que los estudios demostraran que el arsénico podía filtrarse de la madera al suelo circundante (de los equipos de juegos, por ejemplo), también existe un riesgo por la quema de madera CCA más antigua. La ingestión directa o indirecta de ceniza de madera de madera CCA quemada ha causado muertes en animales e intoxicaciones graves en humanos; la dosis letal humana es de aproximadamente 20 gramos de ceniza. [177] La madera CCA de desecho de los sitios de construcción y demolición puede usarse inadvertidamente en incendios comerciales y domésticos. Los protocolos para la eliminación segura de la madera CCA no son uniformes en todo el mundo. La eliminación generalizada de esa madera en vertederos genera cierta preocupación, [178] pero otros estudios no han demostrado contaminación por arsénico en las aguas subterráneas. [179] [180]
Una herramienta que mapea la ubicación (y otra información) de liberaciones de arsénico en los Estados Unidos es TOXMAP . [181] TOXMAP es un Sistema de Información Geográfica (GIS) de la División de Servicios de Información Especializada de la Biblioteca Nacional de Medicina de los Estados Unidos (NLM) financiado por el Gobierno Federal de los Estados Unidos. Con mapas marcados de los Estados Unidos, TOXMAP permite a los usuarios explorar visualmente datos del Inventario de Liberaciones Tóxicas y los Programas de Investigación Básica del Superfondo de la Agencia de Protección Ambiental de los Estados Unidos (EPA) . La información de salud ambiental y química de TOXMAP se toma de la Red de Datos Toxicológicos (TOXNET) de la NLM, [182] PubMed y de otras fuentes autorizadas.
Se han utilizado métodos físicos, químicos y biológicos para remediar el agua contaminada con arsénico. [183] Se dice que la biorremediación es rentable y respetuosa con el medio ambiente. [184] La biorremediación de aguas subterráneas contaminadas con arsénico tiene como objetivo convertir el arsenito, la forma tóxica del arsénico para los humanos, en arsenato. El arsenato (estado de oxidación +5) es la forma dominante de arsénico en aguas superficiales, mientras que el arsenito (estado de oxidación +3) es la forma dominante en entornos hipóxicos a anóxicos. El arsenito es más soluble y móvil que el arsenato. Muchas especies de bacterias pueden transformar el arsenito en arsenato en condiciones anóxicas utilizando el arsenito como donante de electrones. [185] Este es un método útil en la remediación de aguas subterráneas. Otra estrategia de biorremediación es utilizar plantas que acumulen arsénico en sus tejidos a través de la fitorremediación, pero debe considerarse la eliminación del material vegetal contaminado.
La biorremediación requiere una evaluación y un diseño cuidadosos de acuerdo con las condiciones existentes. Algunos sitios pueden requerir la adición de un aceptor de electrones, mientras que otros requieren la suplementación con microbios ( bioaumentación ). Independientemente del método utilizado, solo un monitoreo constante puede prevenir la contaminación futura.
La coagulación y la floculación son procesos estrechamente relacionados que son comunes en la eliminación de arseniato del agua. Debido a la carga negativa neta que llevan los iones de arseniato, estos sedimentan lentamente o no sedimentan en absoluto debido a la repulsión de carga. En la coagulación, un coagulante cargado positivamente como el hierro y el aluminio (sales comúnmente utilizadas: FeCl 3 , [186] Fe 2 (SO 4 ) 3 , [187] Al 2 (SO 4 ) 3 [188] ) neutralizan el arseniato cargado negativamente y le permiten sedimentar. Luego sigue la floculación, donde un floculante une partículas más pequeñas y permite que el agregado se precipite del agua. Sin embargo, estos métodos pueden no ser eficientes en el arsenito, ya que el As(III) existe en el ácido arsenioso sin carga, H 3 AsO 3 , a un pH casi neutro. [189]
Las principales desventajas de la coagulación y la floculación son la costosa eliminación de lodos con concentración de arseniato y la posible contaminación secundaria del medio ambiente. Además, los coagulantes como el hierro pueden producir contaminación iónica que excede los niveles de seguridad. [186]
El arsénico y muchos de sus compuestos son venenos especialmente potentes (por ejemplo, la arsina ). Se pueden detectar pequeñas cantidades de arsénico mediante métodos farmacológicos que incluyen la reducción del arsénico a arsénico con la ayuda de zinc y se pueden confirmar con papel de cloruro de mercurio. [191]
El arsénico elemental y los compuestos de sulfato y trióxido de arsénico están clasificados como " tóxicos " y "peligrosos para el medio ambiente" en la Unión Europea según la directiva 67/548/EEC . La Agencia Internacional para la Investigación sobre el Cáncer (IARC) reconoce el arsénico y los compuestos de arsénico inorgánico como carcinógenos del grupo 1 , y la UE clasifica el trióxido de arsénico, el pentóxido de arsénico y las sales de arseniato como carcinógenos de categoría 1 .
Se sabe que el arsénico causa arsenicosis cuando está presente en el agua potable, "siendo la especie más común el arsenato [ HAsO2−4;As(V)] y arsenito [ H 3 AsO 3 ;As(III)]".
En los Estados Unidos desde 2006, la concentración máxima en el agua potable permitida por la Agencia de Protección Ambiental (EPA) es de 10 ppb [192] y la FDA estableció el mismo estándar en 2005 para el agua embotellada. [193] El Departamento de Protección Ambiental de Nueva Jersey estableció un límite de agua potable de 5 ppb en 2006. [194] El valor IDLH (inmediatamente peligroso para la vida y la salud) para el metal arsénico y los compuestos inorgánicos de arsénico es de 5 mg/m3 ( 5 ppb). La Administración de Seguridad y Salud Ocupacional ha establecido el límite de exposición permisible (PEL) en un promedio ponderado en el tiempo (TWA) de 0,01 mg/m3 ( 0,01 ppb), y el Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH) ha establecido el límite de exposición recomendado (REL) en una exposición constante de 15 minutos de 0,002 mg/m3 ( 0,002 ppb). [195] El PEL para los compuestos orgánicos de arsénico es un TWA de 0,5 mg/m 3 . [196] (0,5 ppb).
En 2008, basándose en sus pruebas en curso de una amplia variedad de alimentos estadounidenses para detectar sustancias químicas tóxicas, [197] la Administración de Alimentos y Medicamentos de Estados Unidos estableció el "nivel de preocupación" para el arsénico inorgánico en los jugos de manzana y pera en 23 ppb, basándose en efectos no cancerígenos, y comenzó a bloquear la importación de productos que superaran este nivel; también exigió que se retiraran del mercado productos nacionales que no cumplieran con las normas. [193] En 2011, el programa de televisión nacional Dr. Oz transmitió un programa que destacaba las pruebas realizadas por un laboratorio independiente contratado por los productores. Aunque la metodología fue cuestionada (no distinguía entre arsénico orgánico e inorgánico), las pruebas mostraron niveles de arsénico de hasta 36 ppb. [198] En respuesta, la FDA analizó la peor marca del programa Dr. Oz y encontró niveles mucho más bajos. Las pruebas en curso encontraron que el 95% de las muestras de jugo de manzana estaban por debajo del nivel de preocupación. Pruebas posteriores realizadas por Consumer Reports mostraron niveles de arsénico inorgánico ligeramente superiores a 10 ppb, y la organización instó a los padres a reducir el consumo. [199] En julio de 2013, teniendo en cuenta el consumo por parte de los niños, la exposición crónica y el efecto cancerígeno, la FDA estableció un "nivel de acción" de 10 ppb para el jugo de manzana, el mismo que el estándar para el agua potable. [193]
En 2002 se expresó preocupación por el arsénico en el arroz de Bangladesh, pero en ese momento sólo Australia tenía un límite legal para los alimentos (un miligramo por kilogramo, o 1000 ppb). [200] [201] En 2005 se expresó preocupación por las personas que consumían arroz estadounidense que excedía los estándares de la OMS para la ingesta personal de arsénico. [202] En 2011, la República Popular China estableció un estándar alimentario de 150 ppb para el arsénico. [203]
En Estados Unidos, en 2012, las pruebas realizadas por grupos separados de investigadores en el Centro de Investigación de Prevención de Enfermedades y Salud Ambiental Infantil del Dartmouth College (a principios de año, centrándose en los niveles urinarios en niños) [204] y Consumer Reports (en noviembre) [205] [206] encontraron niveles de arsénico en el arroz que dieron lugar a peticiones para que la FDA estableciera límites. [207] La FDA publicó algunos resultados de las pruebas en septiembre de 2012, [208] [209] y, a julio de 2013, todavía está recopilando datos en apoyo de una nueva regulación potencial. No ha recomendado ningún cambio en el comportamiento del consumidor. [210]
Consumer Reports recomendó:
Se programó una conferencia consultiva de la Organización Mundial de la Salud en 2014 para considerar límites de 200 a 300 ppb para el arroz. [206]

En 2020, los científicos evaluaron múltiples procedimientos de preparación del arroz por su capacidad para reducir el contenido de arsénico y preservar los nutrientes, y recomendaron un procedimiento que implicaba hervirlo y absorber agua. [213] [212] [214]
El arsénico es bioacumulable en muchos organismos, en particular en las especies marinas, pero no parece biomagnificarse significativamente en las redes alimentarias. [217] En áreas contaminadas, el crecimiento de las plantas puede verse afectado por la absorción de arseniato por las raíces, que es un análogo del fosfato y, por lo tanto, se transporta fácilmente en los tejidos y células de las plantas. En áreas contaminadas, la absorción del ion arsenito, más tóxico (que se encuentra más particularmente en condiciones reductoras), es probable en suelos mal drenados.
La toxicidad del arsénico se debe a la afinidad de los óxidos de arsénico(III) por los tioles . Los tioles, en forma de residuos de cisteína y cofactores como el ácido lipoico y la coenzima A , se encuentran en los sitios activos de muchas enzimas importantes . [12]
El arsénico altera la producción de ATP a través de varios mecanismos. A nivel del ciclo del ácido cítrico , el arsénico inhibe el ácido lipoico , que es un cofactor de la piruvato deshidrogenasa . Al competir con el fosfato, el arsenato desacopla la fosforilación oxidativa , inhibiendo así la reducción vinculada a la energía de NAD+ , la respiración mitocondrial y la síntesis de ATP. También aumenta la producción de peróxido de hidrógeno, que, se especula, tiene potencial para formar especies reactivas de oxígeno y estrés oxidativo. Estas interferencias metabólicas conducen a la muerte por insuficiencia orgánica multisistémica . Se presume que la insuficiencia orgánica se debe a la muerte celular necrótica , no a la apoptosis , ya que las reservas de energía se han agotado demasiado para que se produzca la apoptosis. [218]
La exposición ocupacional y el envenenamiento por arsénico pueden ocurrir en personas que trabajan en industrias que involucran el uso de arsénico inorgánico y sus compuestos, como la conservación de la madera, la producción de vidrio, las aleaciones de metales no ferrosos y la fabricación de semiconductores electrónicos. El arsénico inorgánico también se encuentra en las emisiones de hornos de coque asociados con la industria de fundición. [219]
La conversión entre As(III) y As(V) es un factor importante en la contaminación ambiental por arsénico. Según Croal, Gralnick, Malasarn y Newman, "la comprensión de lo que estimula la oxidación de As(III) y/o limita la reducción de As(V) es relevante para la biorremediación de sitios contaminados (Croal). El estudio de los oxidantes quimiolitoautotróficos de As(III) y los reductores heterótrofos de As(V) puede ayudar a comprender la oxidación y/o reducción del arsénico". [220]
El tratamiento de la intoxicación crónica por arsénico es posible. El anti-lewisita británico ( dimercaprol ) se prescribe en dosis de 5 mg/kg hasta 300 mg cada 4 horas durante el primer día, luego cada 6 horas durante el segundo día y finalmente cada 8 horas durante 8 días adicionales. [221] Sin embargo, la Agencia para Sustancias Tóxicas y Registro de Enfermedades (ATSDR) de los EE. UU. afirma que no se pueden predecir los efectos a largo plazo de la exposición al arsénico. [130] Se pueden realizar pruebas de arsénico en sangre, orina, cabello y uñas; sin embargo, estas pruebas no pueden prever los posibles resultados para la salud de la exposición. [130] La exposición a largo plazo y la consiguiente excreción a través de la orina se han relacionado con el cáncer de vejiga y riñón , además del cáncer de hígado, próstata, piel, pulmones y cavidad nasal . [222]
El arsénico era conocido como "el polvo de la herencia", ya que se utilizaba habitualmente para envenenar a los miembros de la familia y conseguir una fortuna en la época del Renacimiento.
Al principio, los papeles verdes se coloreaban con el pigmento mineral tradicional cardenillo o se compraban mezclando azules y amarillos de origen vegetal. Pero una vez que el verde de Scheele comenzó a producirse en grandes cantidades, se adoptó como una mejora de los colores antiguos y se convirtió en un componente común del papel pintado en 1800.
El papel pintado como fuente de veneno de arsénico fue noticia en 1982 [...] cuando el análisis de una muestra de papel pintado de la sala de estar de Longwood, la residencia de Napoleón en Santa Elena, reveló concentraciones de arsénico de aproximadamente 0,12 g/m 2 .