La corteza cerebral , también conocida como manto cerebral , [1] es la capa externa de tejido neural del cerebro del cerebro en humanos y otros mamíferos . Es el sitio más grande de integración neuronal en el sistema nervioso central , [2] y juega un papel clave en la atención , la percepción , la conciencia , el pensamiento , la memoria , el lenguaje y la conciencia . La corteza cerebral es la parte del cerebro responsable de la cognición .
El neocórtex de seis capas constituye aproximadamente el 90% de la corteza , y el alocórtex constituye el resto. [3] La corteza está dividida en partes izquierda y derecha por la fisura longitudinal , que separa los dos hemisferios cerebrales que están unidos debajo de la corteza por el cuerpo calloso . En la mayoría de los mamíferos, aparte de los mamíferos pequeños que tienen cerebros pequeños, la corteza cerebral está plegada, lo que proporciona una mayor área de superficie en el volumen confinado del cráneo . Además de minimizar el volumen cerebral y craneal, el plegamiento cortical es crucial para los circuitos cerebrales y su organización funcional. [4] En los mamíferos con cerebros pequeños, no hay plegamiento y la corteza es lisa. [5] [6]
Un pliegue o cresta en la corteza se denomina circunvolución (en plural, circunvoluciones) y un surco se denomina surco (en plural, surcos). Estas circunvoluciones superficiales aparecen durante el desarrollo fetal y continúan madurando después del nacimiento a través del proceso de girificación . En el cerebro humano , la mayor parte de la corteza cerebral no es visible desde el exterior, sino que está enterrada en los surcos. [7] Los surcos y circunvoluciones principales marcan las divisiones del cerebro en los lóbulos del cerebro . Los cuatro lóbulos principales son los lóbulos frontal , parietal , occipital y temporal . Otros lóbulos son el lóbulo límbico y la corteza insular , a menudo denominada lóbulo insular .
Existen entre 14 y 16 mil millones de neuronas en la corteza cerebral humana. [2] Estas están organizadas en capas corticales horizontales y radialmente en columnas y minicolumnas corticales . Las áreas corticales tienen funciones específicas, como el movimiento en la corteza motora y la vista en la corteza visual . La corteza motora se encuentra principalmente en el giro precentral y la corteza visual se encuentra en el lóbulo occipital.

La corteza cerebral es la cubierta externa de las superficies de los hemisferios cerebrales y está plegada en picos llamados giros y surcos llamados surcos . En el cerebro humano , tiene entre 2 y 3-4 mm de espesor, [8] y constituye el 40% de la masa del cerebro. [2] El 90% de la corteza cerebral es el neocórtex de seis capas , mientras que el otro 10% está formado por el alocórtex de tres o cuatro capas . [2] Hay entre 14 y 16 mil millones de neuronas en la corteza. [2] Estas neuronas corticales están organizadas radialmente en columnas corticales y minicolumnas , en las capas organizadas horizontalmente de la corteza. [9] [10]
El neocórtex se puede dividir en diferentes regiones de la corteza, conocidas en plural como cortezas, e incluyen la corteza motora y la corteza visual . Aproximadamente dos tercios de la superficie cortical están enterrados en los surcos y la corteza insular está completamente oculta. La corteza es más gruesa en la parte superior de un giro y más delgada en la parte inferior de un surco. [11]
La corteza cerebral está plegada de tal manera que permite que una gran superficie de tejido neural encaje dentro de los confines del neurocráneo . Cuando está desplegada en el ser humano, cada corteza hemisférica tiene una superficie total de aproximadamente 0,12 metros cuadrados (1,3 pies cuadrados). [12] El pliegue se produce hacia adentro, alejándose de la superficie del cerebro, y también está presente en la superficie medial de cada hemisferio dentro de la fisura longitudinal . La mayoría de los mamíferos tienen una corteza cerebral contorneada con los picos conocidos como giros y los valles o surcos conocidos como surcos. Algunos mamíferos pequeños, incluidos algunos roedores pequeños, tienen superficies cerebrales lisas sin girificación . [6]
Los surcos y circunvoluciones más grandes marcan las divisiones de la corteza cerebral en los lóbulos del cerebro . [8] Hay cuatro lóbulos principales: el lóbulo frontal , el lóbulo parietal , el lóbulo temporal y el lóbulo occipital . La corteza insular a menudo se incluye como el lóbulo insular. [13] El lóbulo límbico es un borde de corteza en el lado medial de cada hemisferio y también se incluye a menudo. [14] También se describen tres lóbulos del cerebro: el lóbulo paracentral , el lóbulo parietal superior y el lóbulo parietal inferior .
En las especies de mamíferos, los cerebros más grandes (en términos absolutos, no solo en relación con el tamaño corporal) tienden a tener cortezas más gruesas. [15] Los mamíferos más pequeños, como las musarañas , tienen un grosor neocortical de aproximadamente 0,5 mm; los que tienen los cerebros más grandes, como los humanos y las ballenas de aleta, tienen grosores de 2 a 4 mm. [2] [8] Existe una relación aproximadamente logarítmica entre el peso del cerebro y el grosor cortical. [15] La resonancia magnética del cerebro (MRI) permite obtener una medida del grosor de la corteza cerebral humana y relacionarla con otras medidas. El grosor de las diferentes áreas corticales varía, pero en general, la corteza sensorial es más delgada que la corteza motora. [16] Un estudio ha encontrado cierta asociación positiva entre el grosor cortical y la inteligencia . [17] Otro estudio ha descubierto que la corteza somatosensorial es más gruesa en pacientes con migraña , aunque no se sabe si esto es el resultado de los ataques de migraña, la causa de ellos o si ambos son el resultado de una causa compartida. [18] [19] Un estudio posterior que utilizó una población de pacientes más grande no informa cambios en el grosor cortical en pacientes con migraña. [20] Un trastorno genético de la corteza cerebral, por el cual la disminución del plegamiento en ciertas áreas da como resultado un microgiro , donde hay cuatro capas en lugar de seis, en algunos casos se ve relacionado con la dislexia . [21]

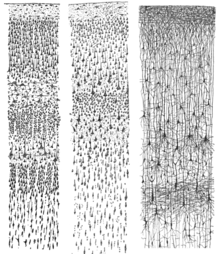

El neocórtex está formado por seis capas, numeradas de I a VI, desde la capa más externa I, cerca de la piamadre , hasta la capa más interna VI, cerca de la sustancia blanca subyacente . Cada capa cortical tiene una distribución característica de diferentes neuronas y sus conexiones con otras regiones corticales y subcorticales. Existen conexiones directas entre diferentes áreas corticales y conexiones indirectas a través del tálamo.
Uno de los ejemplos más claros de estratificación cortical es la línea de Gennari en la corteza visual primaria . Se trata de una banda de tejido más blanco que se puede observar a simple vista en el surco calcarino del lóbulo occipital. La línea de Gennari está compuesta por axones que llevan la información visual desde el tálamo hasta la capa IV de la corteza visual .
La tinción de secciones transversales de la corteza para revelar la posición de los cuerpos celulares neuronales y los tractos axónicos intracorticales permitió a los neuroanatomistas de principios del siglo XX producir una descripción detallada de la estructura laminar de la corteza en diferentes especies. El trabajo de Korbinian Brodmann (1909) estableció que la neocorteza de los mamíferos se divide sistemáticamente en seis capas.
La capa I es la capa molecular y contiene pocas neuronas dispersas, incluidas las neuronas GABAérgicas de la rosa mosqueta . [22] La capa I consiste principalmente en extensiones de penachos dendríticos apicales de neuronas piramidales y axones orientados horizontalmente, así como células gliales . [4] Durante el desarrollo, las células de Cajal-Retzius [23] y las células de la capa granular subpial [24] están presentes en esta capa. También, se pueden encontrar aquí algunas células estrelladas espinosas . Se cree que las entradas a los penachos apicales son cruciales para las interacciones de retroalimentación en la corteza cerebral involucradas en el aprendizaje asociativo y la atención. [25]
Si bien antes se creía que la entrada a la capa I provenía de la propia corteza, [26] ahora se sabe que la capa I a lo largo de la corteza cerebral recibe una entrada sustancial de las células de la matriz o del tálamo de tipo M, [27] a diferencia del núcleo o de tipo C que van a la capa IV. [28]
Se cree que la capa I sirve como centro neurálgico para recopilar y procesar información generalizada. Integra las entradas sensoriales ascendentes con las expectativas descendentes, regulando la forma en que las percepciones sensoriales se alinean con los resultados previstos. Además, la capa I clasifica, dirige y combina las entradas excitatorias, integrándolas con señales neuromoduladoras. Las interneuronas inhibidoras, tanto dentro de la capa I como de otras capas corticales, regulan estas señales. Juntas, estas interacciones calibran dinámicamente el flujo de información a lo largo del neocórtex, dando forma a las percepciones y experiencias. [29]
La capa II, la capa granular externa , contiene pequeñas neuronas piramidales y numerosas neuronas estrelladas.
La capa III, la capa piramidal externa , contiene predominantemente neuronas piramidales de tamaño pequeño y mediano, así como neuronas no piramidales con axones intracorticales orientados verticalmente; las capas I a III son el objetivo principal de las aferencias corticocorticales comisurales , y la capa III es la fuente principal de las eferencias corticocorticales .
La capa IV, la capa granular interna , contiene diferentes tipos de células estrelladas y piramidales, y es el objetivo principal de las aferencias talamocorticales de las neuronas de tipo C del tálamo (tipo central) [28] , así como de las aferencias corticocorticales intrahemisféricas. Las capas por encima de la capa IV también se denominan capas supragranulares (capas I-III), mientras que las capas inferiores se denominan capas infragranulares (capas V y VI). Los elefantes africanos , los cetáceos y los hipopótamos no tienen una capa IV con axones que terminarían allí y se dirigirían en su lugar a la parte interna de la capa III. [30]
La capa V, la capa piramidal interna , contiene neuronas piramidales de gran tamaño. Los axones de estas neuronas salen de la corteza y se conectan con estructuras subcorticales, incluidos los ganglios basales . En la corteza motora primaria del lóbulo frontal, la capa V contiene células piramidales gigantes llamadas células de Betz , cuyos axones viajan a través de la cápsula interna , el tronco encefálico y la médula espinal formando el tracto corticoespinal , que es la vía principal para el control motor voluntario.
La capa VI, la capa polimórfica o capa multiforme , contiene pocas neuronas piramidales grandes y muchas neuronas piramidales y multiformes pequeñas con forma de huso; la capa VI envía fibras eferentes al tálamo, estableciendo una interconexión recíproca muy precisa entre la corteza y el tálamo. [31] Es decir, las neuronas de la capa VI de una columna cortical se conectan con las neuronas del tálamo que proporcionan información a la misma columna cortical. Estas conexiones son tanto excitatorias como inhibidoras. Las neuronas envían fibras excitatorias a las neuronas del tálamo y también envían colaterales al núcleo reticular talámico que inhiben estas mismas neuronas del tálamo o las adyacentes a ellas. [32] Una teoría es que debido a que la salida inhibidora se reduce por la entrada colinérgica a la corteza cerebral, esto proporciona al tronco encefálico un "control de ganancia ajustable para el relé de entradas lemniscales ". [32]
Las capas corticales no están simplemente apiladas una sobre otra; existen conexiones características entre diferentes capas y tipos neuronales, que abarcan todo el espesor de la corteza. Estos microcircuitos corticales se agrupan en columnas corticales y minicolumnas . [33] Se ha propuesto que las minicolumnas son las unidades funcionales básicas de la corteza. [34] En 1957, Vernon Mountcastle demostró que las propiedades funcionales de la corteza cambian abruptamente entre puntos adyacentes lateralmente; sin embargo, son continuas en la dirección perpendicular a la superficie. Trabajos posteriores han proporcionado evidencia de la presencia de columnas corticales funcionalmente distintas en la corteza visual (Hubel y Wiesel , 1959), [35] la corteza auditiva y la corteza asociativa.
Las áreas corticales que carecen de una capa IV se denominan agranulares . Las áreas corticales que solo tienen una capa IV rudimentaria se denominan disgranulares. [36] El procesamiento de la información dentro de cada capa está determinado por diferentes dinámicas temporales: en las capas II/III, la oscilación es lenta, de 2 Hz, mientras que en la capa V, la oscilación es rápida, de 10 a 15 Hz. [37]
En función de las diferencias en la organización laminar, la corteza cerebral se puede clasificar en dos tipos: la gran área de neocórtex que tiene seis capas de células, y el área mucho más pequeña de alocorteza que tiene tres o cuatro capas: [3]
Existe una zona de transición entre el neocórtex y el alocórtex llamada corteza paralímbica , donde se fusionan las capas 2, 3 y 4. Esta zona incorpora el proisocórtex del neocórtex y el periallocórtex del alocórtex. Además, la corteza cerebral puede clasificarse en cuatro lóbulos : el lóbulo frontal , el lóbulo temporal , el lóbulo parietal y el lóbulo occipital , llamados así por los huesos superpuestos del cráneo.

El suministro de sangre a la corteza cerebral forma parte de la circulación cerebral . Las arterias cerebrales suministran la sangre que irriga el cerebro. Esta sangre arterial transporta oxígeno, glucosa y otros nutrientes a la corteza. Las venas cerebrales drenan la sangre desoxigenada y los desechos metabólicos, incluido el dióxido de carbono, de regreso al corazón.
Las principales arterias que irrigan la corteza son la arteria cerebral anterior , la arteria cerebral media y la arteria cerebral posterior . La arteria cerebral anterior irriga las porciones anteriores del cerebro, incluida la mayor parte del lóbulo frontal. La arteria cerebral media irriga los lóbulos parietales, los lóbulos temporales y partes de los lóbulos occipitales. La arteria cerebral media se divide en dos ramas para irrigar el hemisferio izquierdo y derecho, donde se ramifican aún más. La arteria cerebral posterior irriga los lóbulos occipitales.
El polígono de Willis es el principal sistema sanguíneo que se ocupa del suministro de sangre al cerebro y la corteza cerebral.

El desarrollo prenatal de la corteza cerebral es un proceso complejo y finamente ajustado llamado corticogénesis , influenciado por la interacción entre los genes y el medio ambiente. [38]
La corteza cerebral se desarrolla a partir de la parte más anterior, la región prosencéfalo, del tubo neural . [39] [40] La placa neural se pliega y se cierra para formar el tubo neural . A partir de la cavidad en el interior del tubo neural se desarrolla el sistema ventricular , y, a partir de las células neuroepiteliales de sus paredes, las neuronas y la glía del sistema nervioso. La parte más anterior (frontal o craneal) de la placa neural, el prosencéfalo , que es evidente antes de que comience la neurulación , da lugar a los hemisferios cerebrales y posteriormente a la corteza. [41]
Las neuronas corticales se generan en la zona ventricular , junto a los ventrículos . En un principio, esta zona contiene células madre neuronales , que luego se transforman en células gliales radiales –células progenitoras–, que se dividen para producir células gliales y neuronas. [42]

La corteza cerebral está compuesta por una población heterogénea de células que dan lugar a diferentes tipos celulares. La mayoría de estas células derivan de la migración radial de la glía que forma los diferentes tipos celulares del neocórtex y es un período asociado a un aumento de la neurogénesis . De manera similar, el proceso de neurogénesis regula la laminación para formar las diferentes capas de la corteza. Durante este proceso hay un aumento en la restricción del destino celular que comienza con progenitores tempranos que dan lugar a cualquier tipo celular en la corteza y progenitores posteriores que dan lugar solo a neuronas de capas superficiales. Este destino celular diferencial crea una topografía de adentro hacia afuera en la corteza con neuronas más jóvenes en capas superficiales y neuronas más viejas en capas más profundas. Además, las neuronas laminares se detienen en la fase S o G2 para dar una distinción fina entre las diferentes capas corticales. La diferenciación laminar no está completamente completa hasta después del nacimiento ya que durante el desarrollo las neuronas laminares aún son sensibles a señales extrínsecas y señales ambientales. [43]
Aunque la mayoría de las células que componen la corteza se derivan localmente de la glía radial, existe un subconjunto de la población de neuronas que migran desde otras regiones. La glía radial da lugar a neuronas que tienen forma piramidal y utilizan glutamato como neurotransmisor , sin embargo, estas células migratorias aportan neuronas que tienen forma estrellada y utilizan GABA como su principal neurotransmisor. Estas neuronas GABAérgicas son generadas por células progenitoras en la eminencia ganglionar medial (EMG) que migran tangencialmente a la corteza a través de la zona subventricular . Esta migración de neuronas GABAérgicas es particularmente importante ya que los receptores GABA son excitatorios durante el desarrollo. Esta excitación es impulsada principalmente por el flujo de iones de cloruro a través del receptor GABA, sin embargo, en los adultos las concentraciones de cloruro cambian provocando un flujo hacia el interior de cloruro que hiperpolariza las neuronas postsinápticas . [44] Las fibras gliales producidas en las primeras divisiones de las células progenitoras están orientadas radialmente, abarcando el espesor de la corteza desde la zona ventricular hasta la superficie pial externa , y proporcionan un andamiaje para la migración de neuronas hacia afuera desde la zona ventricular . [45] [46]
Al nacer, el cuerpo celular de la neurona cortical tiene muy pocas dendritas y el axón no está desarrollado. Durante el primer año de vida, el número de dendritas aumenta drásticamente, de modo que pueden albergar hasta cien mil conexiones sinápticas con otras neuronas. El axón puede desarrollarse hasta extenderse mucho más allá del cuerpo celular. [47]
Las primeras divisiones de las células progenitoras son simétricas, lo que duplica el número total de células progenitoras en cada ciclo mitótico . Luego, algunas células progenitoras comienzan a dividirse asimétricamente, produciendo una célula postmitótica que migra a lo largo de las fibras gliales radiales, abandonando la zona ventricular , y una célula progenitora, que continúa dividiéndose hasta el final del desarrollo, cuando se diferencia en una célula glial o una célula ependimaria . A medida que se alarga la fase G1 de la mitosis , en lo que se considera un alargamiento selectivo del ciclo celular, las neuronas recién nacidas migran a capas más superficiales de la corteza. [48] Las células hijas migratorias se convierten en las células piramidales de la corteza cerebral. [49] El proceso de desarrollo está ordenado en el tiempo y regulado por cientos de genes y mecanismos reguladores epigenéticos . [50]
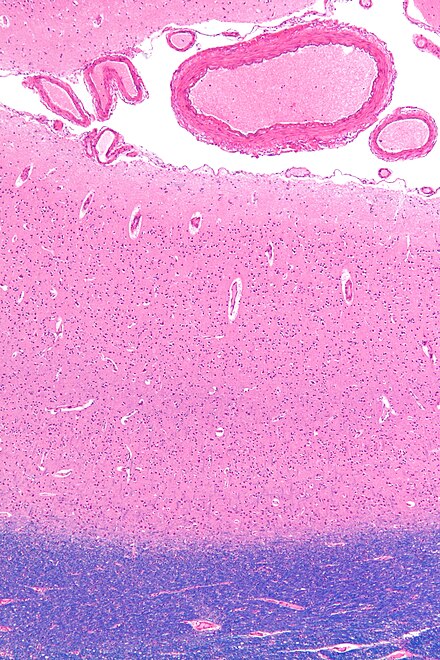
La estructura en capas de la corteza cerebral madura se forma durante el desarrollo. Las primeras neuronas piramidales generadas migran fuera de la zona ventricular y la zona subventricular , junto con las neuronas de Cajal-Retzius productoras de reelina , desde la preplaca . A continuación, una cohorte de neuronas que migran hacia el medio de la preplaca divide esta capa transitoria en la zona marginal superficial , que se convertirá en la capa I del neocórtex maduro, y la subplaca , [51] formando una capa intermedia llamada placa cortical . Estas células formarán las capas profundas de la corteza madura, las capas cinco y seis. Las neuronas nacidas más tarde migran radialmente hacia la placa cortical pasando las neuronas de la capa profunda, y se convierten en las capas superiores (dos a cuatro). Por lo tanto, las capas de la corteza se crean en un orden de adentro hacia afuera. [52] La única excepción a esta secuencia de adentro hacia afuera de la neurogénesis ocurre en la capa I de los primates , en la que, a diferencia de los roedores , la neurogénesis continúa durante todo el período de corticogénesis . [53]
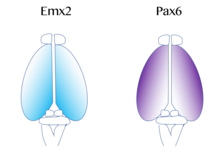
El mapa de áreas corticales funcionales, que incluyen la corteza motora primaria y visual, se origina a partir de un ' protomapa ', [54] que está regulado por señales moleculares como el factor de crecimiento de fibroblastos FGF8 temprano en el desarrollo embrionario. [55] [56] Estas señales regulan el tamaño, la forma y la posición de las áreas corticales en la superficie del primordio cortical, en parte regulando los gradientes de expresión del factor de transcripción , a través de un proceso llamado patrón cortical . Ejemplos de tales factores de transcripción incluyen los genes EMX2 y PAX6 . [57] Juntos, ambos factores de transcripción forman un gradiente opuesto de expresión. Pax6 se expresa altamente en el polo lateral rostral , mientras que Emx2 se expresa altamente en el polo caudomedial . El establecimiento de este gradiente es importante para el desarrollo adecuado. Por ejemplo, las mutaciones en Pax6 pueden hacer que los niveles de expresión de Emx2 se expandan fuera de su dominio de expresión normal, lo que en última instancia conduciría a una expansión de las áreas normalmente derivadas de la corteza medial caudal, como la corteza visual . Por el contrario, si se producen mutaciones en Emx2, puede provocar que el dominio que expresa Pax6 se expanda y dé como resultado el agrandamiento de las regiones corticales frontal y motora . Por lo tanto, los investigadores creen que gradientes similares y centros de señalización junto a la corteza podrían contribuir a la expresión regional de estos factores de transcripción. [44] Dos señales de patrones muy bien estudiadas para la corteza incluyen FGF y ácido retinoico . Si los FGF se expresan incorrectamente en diferentes áreas de la corteza en desarrollo, se altera el patrón cortical . Específicamente, cuando Fgf8 aumenta en el polo anterior , Emx2 se regula a la baja y se produce un desplazamiento caudal en la región cortical. Esto, en última instancia, provoca una expansión de las regiones rostrales. Por lo tanto, Fgf8 y otros FGF desempeñan un papel en la regulación de la expresión de Emx2 y Pax6 y representan cómo la corteza cerebral puede especializarse para diferentes funciones. [44]
La rápida expansión de la superficie cortical está regulada por la cantidad de autorrenovación de las células gliales radiales y está regulada en parte por los genes FGF y Notch . [58] Durante el período de neurogénesis cortical y formación de capas, muchos mamíferos superiores comienzan el proceso de girificación , que genera los pliegues característicos de la corteza cerebral. [59] [60] La girificación está regulada por una proteína asociada al ADN Trnp1 [61] y por la señalización FGF y SHH [62] [63]
De todas las diferentes regiones del cerebro, la corteza cerebral es la que muestra la mayor variación evolutiva y la que ha evolucionado más recientemente. [6] A diferencia de los circuitos altamente conservados del bulbo raquídeo , por ejemplo, que cumplen funciones críticas como la regulación de las frecuencias cardíaca y respiratoria, muchas áreas de la corteza cerebral no son estrictamente necesarias para la supervivencia. Por lo tanto, la evolución de la corteza cerebral ha visto el advenimiento y la modificación de nuevas áreas funcionales, en particular áreas de asociación que no reciben información directamente desde fuera de la corteza. [6]
Una teoría clave de la evolución cortical está incorporada en la hipótesis de la unidad radial y la hipótesis relacionada del protomapa , propuesta por primera vez por Rakic. [64] Esta teoría afirma que las nuevas áreas corticales se forman mediante la adición de nuevas unidades radiales, lo que se logra a nivel de células madre . La hipótesis del protomapa afirma que la identidad celular y molecular y las características de las neuronas en cada área cortical están especificadas por las células madre corticales , conocidas como células gliales radiales , en un mapa primordial. Este mapa está controlado por proteínas de señalización secretadas y factores de transcripción posteriores . [65] [66] [67]
La corteza cerebral está conectada a varias estructuras subcorticales como el tálamo y los ganglios basales , enviándoles información a través de conexiones eferentes y recibiendo información de ellos a través de conexiones aferentes . La mayor parte de la información sensorial se envía a la corteza cerebral a través del tálamo. La información olfativa, sin embargo, pasa a través del bulbo olfatorio a la corteza olfatoria ( corteza piriforme ). La mayoría de las conexiones son de un área de la corteza a otra, en lugar de áreas subcorticales; Braitenberg y Schüz (1998) afirman que en las áreas sensoriales primarias, a nivel cortical donde terminan las fibras de entrada, hasta el 20% de las sinapsis son suministradas por aferentes extracorticales pero que en otras áreas y otras capas es probable que el porcentaje sea mucho menor. [68]
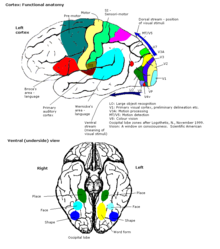
En una presentación temprana de Korbinian Brodmann, la corteza cerebral en su totalidad se dividió en 52 áreas diferentes . Estas áreas, conocidas como áreas de Brodmann , se basan en su citoarquitectura , pero también se relacionan con diversas funciones. Un ejemplo es el área 17 de Brodmann, que es la corteza visual primaria .
En términos más generales, la corteza suele describirse como compuesta por tres partes: áreas sensoriales, motoras y de asociación.

Las áreas sensoriales son las áreas corticales que reciben y procesan información de los sentidos . Las partes de la corteza que reciben información sensorial del tálamo se denominan áreas sensoriales primarias. Los sentidos de la vista, la audición y el tacto son atendidos por la corteza visual primaria, la corteza auditiva primaria y la corteza somatosensorial primaria respectivamente. En general, los dos hemisferios reciben información del lado opuesto (contralateral) del cuerpo . Por ejemplo, la corteza somatosensorial primaria derecha recibe información de las extremidades izquierdas y la corteza visual derecha recibe información del campo visual izquierdo .
La organización de los mapas sensoriales en la corteza refleja la del órgano sensorial correspondiente, en lo que se conoce como un mapa topográfico . Los puntos vecinos en la corteza visual primaria , por ejemplo, corresponden a puntos vecinos en la retina . Este mapa topográfico se llama mapa retinotópico . De la misma manera, existe un mapa tonotópico en la corteza auditiva primaria y un mapa somatotópico en la corteza sensorial primaria. Este último mapa topográfico del cuerpo sobre el giro central posterior se ha ilustrado como una representación humana deformada, el homúnculo somatosensorial , donde el tamaño de las diferentes partes del cuerpo refleja la densidad relativa de su inervación. Las áreas con mucha inervación sensorial, como las yemas de los dedos y los labios, requieren más área cortical para procesar sensaciones más finas.
Las áreas motoras se encuentran en ambos hemisferios de la corteza cerebral. Las áreas motoras están muy relacionadas con el control de los movimientos voluntarios, especialmente los movimientos finos y fragmentados realizados con la mano. La mitad derecha del área motora controla el lado izquierdo del cuerpo y viceversa.
Hay dos áreas de la corteza que comúnmente se denominan motoras:
Además, se han descrito funciones motoras para:
Justo debajo de la corteza cerebral hay masas subcorticales interconectadas de materia gris llamadas ganglios basales (o núcleos). Los ganglios basales reciben información de la sustancia negra del mesencéfalo y las áreas motoras de la corteza cerebral, y envían señales de vuelta a ambas ubicaciones. Están involucrados en el control motor. Se encuentran laterales al tálamo. Los componentes principales de los ganglios basales son el núcleo caudado , el putamen , el globo pálido , la sustancia negra , el núcleo accumbens y el núcleo subtalámico . El putamen y el globo pálido también se conocen colectivamente como el núcleo lenticular , porque juntos forman un cuerpo con forma de lente. El putamen y el núcleo caudado también se denominan colectivamente cuerpo estriado por su apariencia rayada. [71] [72]

Las áreas de asociación son las partes de la corteza cerebral que no pertenecen a las regiones primarias. Su función es producir una experiencia perceptiva significativa del mundo, permitirnos interactuar de manera efectiva y apoyar el pensamiento abstracto y el lenguaje. Los lóbulos parietal , temporal y occipital , todos ubicados en la parte posterior de la corteza, integran la información sensorial y la información almacenada en la memoria. El lóbulo frontal o complejo de asociación prefrontal está involucrado en la planificación de acciones y movimientos, así como en el pensamiento abstracto. Globalmente, las áreas de asociación están organizadas como redes distribuidas. [73] Cada red conecta áreas distribuidas en regiones ampliamente espaciadas de la corteza. Las distintas redes se ubican adyacentes entre sí, lo que produce una serie compleja de redes entrelazadas. La organización específica de las redes de asociación se debate con evidencia de interacciones, relaciones jerárquicas y competencia entre redes.
En los seres humanos, las redes de asociación son particularmente importantes para la función del lenguaje. En el pasado se teorizó que las habilidades del lenguaje se localizan en el área de Broca en áreas del giro frontal inferior izquierdo , BA44 y BA45 , para la expresión del lenguaje y en el área de Wernicke BA22 , para la recepción del lenguaje. Sin embargo, se ha demostrado que los procesos de expresión y recepción del lenguaje ocurren en áreas distintas a las estructuras alrededor del surco lateral , incluido el lóbulo frontal, los ganglios basales , el cerebelo y la protuberancia . [74]
Las enfermedades neurodegenerativas como la enfermedad de Alzheimer , muestran como marcador una atrofia de la materia gris de la corteza cerebral. [76]
Otras enfermedades del sistema nervioso central incluyen trastornos neurológicos como la epilepsia , trastornos del movimiento y diferentes tipos de afasia (dificultades en la expresión o comprensión del habla).
El daño cerebral causado por una enfermedad o un traumatismo puede afectar a un lóbulo específico, como en el caso de un trastorno del lóbulo frontal , y las funciones asociadas se verán afectadas. La barrera hematoencefálica que sirve para proteger al cerebro de las infecciones puede verse comprometida, lo que permite la entrada de patógenos .
El feto en desarrollo es susceptible a una variedad de factores ambientales que pueden causar defectos de nacimiento y problemas en el desarrollo posterior. El consumo materno de alcohol, por ejemplo, puede causar un trastorno del espectro alcohólico fetal . [77] Otros factores que pueden causar trastornos del desarrollo neurológico son los tóxicos como las drogas y la exposición a la radiación , como los rayos X. Las infecciones también pueden afectar el desarrollo de la corteza. Una infección viral es una de las causas de la lisencefalia , que da como resultado una corteza lisa sin girificación .
Un tipo de electrocorticografía denominada mapeo de estimulación cortical es un procedimiento invasivo que implica colocar electrodos directamente sobre el cerebro expuesto para localizar las funciones de áreas específicas de la corteza. Se utiliza en aplicaciones clínicas y terapéuticas, incluido el mapeo prequirúrgico. [78]
Hay una serie de mutaciones genéticas que pueden causar una amplia gama de trastornos genéticos de la corteza cerebral, incluyendo microcefalia , esquizencefalia y tipos de lisencefalia . [79] Las anomalías cromosómicas también pueden causar una serie de trastornos del desarrollo neurológico como el síndrome del cromosoma X frágil y el síndrome de Rett .
El gen MCPH1 codifica la microcefalina , y los trastornos en esta y en la ASPM están asociados con la microcefalia. [79] Las mutaciones en el gen NBS1 que codifica la nibrina pueden causar el síndrome de rotura de Nijmegen , caracterizado por microcefalia. [79]
Las mutaciones en EMX2 , [80] y COL4A1 están asociadas con la esquizencefalia , [81] una condición caracterizada por la ausencia de grandes partes de los hemisferios cerebrales.
En 1909, Korbinian Brodmann distinguió 52 regiones diferentes de la corteza cerebral en función de su citoarquitectura, conocidas como áreas de Brodmann . [82]
Rafael Lorente de Nó , alumno de Santiago Ramón y Cajal , identificó más de 40 tipos diferentes de neuronas corticales basándose en la distribución de sus dendritas y axones. [82]
La corteza cerebral se deriva del palio , una estructura en capas que se encuentra en el prosencéfalo de todos los vertebrados . La forma básica del palio es una capa cilíndrica que encierra ventrículos llenos de líquido. Alrededor de la circunferencia del cilindro hay cuatro zonas, el palio dorsal, el palio medial, el palio ventral y el palio lateral, que se cree que son homólogos del neocórtex , el hipocampo , la amígdala y la corteza olfativa , respectivamente.
En los cerebros de las aves , la evidencia sugiere que la neuroarquitectura del palio aviar recuerda a la corteza cerebral de los mamíferos. [83] También se ha sugerido que el palio aviar es una base neuronal equivalente para la conciencia . [84] [85]
Hasta hace poco no se había reconocido ningún homólogo de la corteza cerebral en los invertebrados. Sin embargo, un estudio publicado en la revista Cell en 2010, basado en perfiles de expresión genética, informó fuertes afinidades entre la corteza cerebral y los cuerpos de hongo del gusano de trapo Platynereis dumerilii . [86] Los cuerpos de hongo son estructuras en los cerebros de muchos tipos de gusanos y artrópodos que se sabe que desempeñan papeles importantes en el aprendizaje y la memoria; la evidencia genética indica un origen evolutivo común y, por lo tanto, indica que los orígenes de los primeros precursores de la corteza cerebral se remontan a la era Precámbrica .
, quien propuso la hipótesis columnar, que afirma que la corteza está compuesta de columnas discretas y modulares de neuronas, caracterizadas por un perfil de conectividad consistente.